En febrero de 2009 la Agencia Europea de Evaluación de Medicamentos (EMEA) suspendió la comercialización de efalizumab por la notificación de tres casos confirmados de leucoencefalopatía multifocal progresiva (LMP). Nos planteamos realizar un estudio prospectivo de seguimiento de los pacientes tratados en nuestro Servicio con efalizumab en el momento de la suspensión y comparar la evolución con las perspectivas publicadas en la literatura.
Pacientes y métodosSe incluyeron 32 pacientes (28 con psoriasis en placas y 4 con psoriasis palmoplantar) entre febrero y marzo de 2009. Se recogió el Psoriasis Area and Severity Index (PASI) previo al comienzo del tratamiento con efalizumab, en el momento de la suspensión, a las 6 semanas y posteriormente cada tres meses. En el caso de los pacientes que presentaron brotes generalizados se recogió el tiempo transcurrido desde la suspensión y el manejo terapéutico que se realizó.
ResultadosA pesar de que el 92,8% de los pacientes correspondían a buenos respondedores (mejoría PASI >75), presentaron rebote un 25% de los sujetos (8/32) y recaídas un 15,7% (5/32). Con respecto a la terapia de transición presentaron rebote un 18% de los pacientes (2/11) con ciclosporina, un 50% (1/2) con metotrexato, un 50% (1/2) con adalimumab, un 50% (1/2) con etanercept y un 27% (3/11) de los que recibieron tratamiento tópico.
ConclusionesHemos encontrado un porcentaje muy alto de rebote y formas generalizadas inflamatorias en pacientes que habían conseguido un buen control de la psoriasis durante varios años.
In February 2009, the European Medicines Agency suspended the marketing authorization for efalizumab after 3 confirmed cases of progressive multifocal leukoencephalopathy were reported. To assess the consequences of this decision, we performed a prospective follow-up study of patients in our department who were being treated with efalizumab at the time and compared clinical outcomes with data from the literature.
Patients and methodsThirty-two patients (28 with plaque psoriasis and 4 with palmoplantar psoriasis) were enrolled between February and March 2009. We recorded psoriasis area and severity index (PASI) scores at the moment of efalizumab discontinuation, at 6 weeks post-discontinuation, and at 3-monthly intervals thereafter. PASI scores prior to treatment with efalizumab were also noted. For patients who experienced rebounds with generalized psoriasis, we noted the time that had elapsed since efalizumab discontinuation and the treatment they were receiving.
ResultsEven though 92.8% of the patients were considered good responders (>75% reduction in PASI score), 25% of the group (8/32) experienced rebound and 15.7% (5/32) experienced relapse. The percentage of patients in whom rebound was observed on transition therapy was 18% (2/11) for cyclosporin, 50% (1/2) for methotrexate, 50% (1/2) for adalimumab, 50% (1/2) for etanercept, and 27% (3/11) for topical treatment.
ConclusionsWe observed a very high rate of rebound and generalized inflammation in patients whose disease had previously been well controlled for several years.
Efalizumab es un anticuerpo monoclonal humanizado que se une a la molécula CD 11 a, inhibiendo la activación, la adhesión y la migración de la célula T. En octubre de 2004 la Agencia Europea de Evaluación de Medicamentos (EMEA) aprobó el tratamiento con efalizumab para pacientes con psoriasis moderada o grave que no hubieran respondido, tuvieran contraindicaciones o no toleraran otras terapias sistémicas. En múltiples ensayos clínicos a corto plazo (6 meses) se comprobó que efalizumab era un fármaco bien tolerado1–4; posteriormente se publicaron estudios de extensión de hasta tres años de seguimiento, que avalaban su seguridad a largo plazo manteniendo el fármaco de forma continua5,6. Este escenario cambió bruscamente cuando en febrero de 2009 la EMEA suspendió la comercialización del fármaco tras la notificación de tres casos confirmados de leucoencefalopatía multifocal progresiva (LMP) en pacientes bajo tratamiento de más de tres años con efalizumab. La LMP es una enfermedad desmielinizante progresiva causada por la reactivación del virus JC, que suele desarrollarse en pacientes en estado de inmunosupresión grave, y habitualmente lleva a la incapacidad grave o muerte del paciente sin que haya disponible un tratamiento eficaz. Suele desarrollarse en sujetos con linfopenia grave secundaria a la infección por el virus de la inmunodeficiencia humana, a quimioterapia o a tratamiento inmunosupresor. El mecanismo por el que algunos anticuerpos monoclonales moduladores de la respuesta inmunitaria se han relacionado de forma inesperada con la LMP es controvertido. En el caso de natalizumab y efalizumab, ambos inhibidores selectivos de moléculas de adhesión, parece que producen una alteración del tráfico de los linfocitos T al sistema nervioso central7.
El hecho de que la suspensión brusca de efalizumab pudiera llevar a un rebote de la psoriasis era bien conocido. Su incidencia se calculaba en los ensayos clínicos entre un 5 y 14%8; sin embargo, en otras series de menor tamaño, se encontraba una incidencia mayor (22,5% de 31 pacientes, 17,8% de 49)9,10. El riesgo de presentar un rebote se consideraba inversamente proporcional a la respuesta obtenida con el fármaco, siendo mucho más frecuente en los no respondedores que en los buenos respondedores, en los que se estimaba una incidencia mucho menor (1,3% en 1.316 pacientes, 0% en 130 pacientes)11,12.
Tras la suspensión de la comercialización de efalizumab nos planteamos seguir la evolución de los pacientes con psoriasis que estaban bajo este tratamiento.
Pacientes y métodosLos datos clínicos que recogimos de los pacientes que estaban en tratamiento con efalizumab en el Servicio de Dermatología del Hospital General Universitario Gregorio Marañón se resumen en la tabla 1.
Datos recogidos en la muestra
| Edad |
| Tipo de psoriasis |
| Tratamientos previos |
| Artritis psoriásica |
| Episodios de psoriasis pustulosa o eritrodermia |
| Ingresos |
| PASI basal |
| PASI en el momento de la suspensión de efalizumab |
| PASI a las 6 semanas de la retirada de efalizumab |
| PASI a los 3 meses de la retirada de efalizumab |
| Pauta de transición |
| Rebote (tiempo transcurrido) |
PASI: Psoriasis Area and Severity Index.
Entre febrero y marzo de 2009 todos los pacientes fueron citados para retirarles el fármaco; en ese momento se valoró la gravedad de la psoriasis de cada paciente en función del Psoriasis Area and Severity Index (PASI) y de forma prospectiva se obtuvo el PASI a las 6 semanas de la retirada y después a los tres meses, avisando a los pacientes que acudieran sin cita si presentaban un brote generalizado. Se recogieron las diferentes pautas de transición realizadas en nuestros pacientes y, en el caso de que presentaran brotes generalizados, las semanas transcurridas desde la suspensión y el manejo terapéutico realizado con ellos. En función de la reducción del PASI con efalizumab en el momento de su suspensión los pacientes se clasificaron según hubieran alcanzado una mejoría de su PASI basal de al menos 90%, el 75%, el 50% o menor. Para valorar la respuesta de los pacientes con psoriasis palmo-plantar se utilizó la clasificación de la Static Physician's Global Assessment.
Como terapias de transición en los pacientes con psoriasis en placas nos planteamos principalmente pautar ciclosporina por su eficacia y rapidez de acción. Otras alternativas también fueron metotrexato, adalimumab, etanercept, UVB-BE o únicamente tratamiento tópico. En el caso de los tratamientos sistémicos clásicos solapamos la retirada de efalizumab con el inicio del otro fármaco durante 4 semanas. Para decidir el tratamiento de transición nos basamos de forma individualizada en la gravedad de la psoriasis pretratamiento, en la eficacia de los tratamientos previos, el grado de respuesta con efalizumab y la patología concomitante de cada paciente. En el caso de los pacientes con psoriasis palmoplantar, tras la retirada de efalizumab sólo se pautó tratamiento tópico (corticoides, derivados de la vitamina D y emolientes).
Se definió «rebote» como un empeoramiento de un 125% respecto a la situación pretratamiento, o el desarrollo de una forma más inflamatoria, eritrodérmica o pustulosa durante los tres meses siguientes a la suspensión del fármaco según se describió en la US National Psoriasis Foundation13. Consideramos «recaída» como la pérdida de la mejoría del 50% del PASI alcanzada con el tratamiento, en este caso con efalizumab.
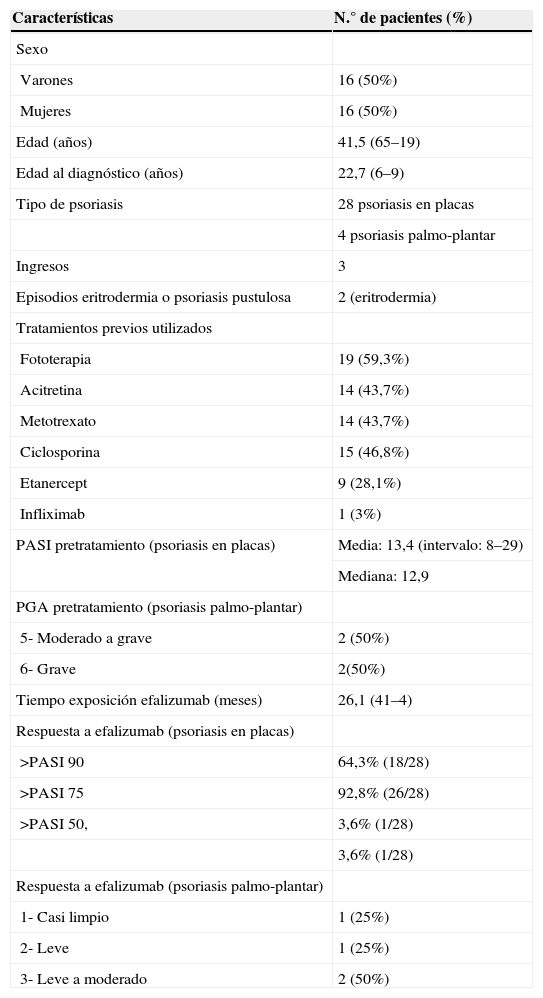
ResultadosEn el momento de la retirada estaban en tratamiento con efalizumab 33 pacientes con psoriasis, de los cuales pudimos seguir la evolución de 32; de ellos 28 tenían diagnóstico de psoriasis en placas y 4 psoriasis palmoplantar. En la tabla 2 se recogen las características de los pacientes estudiados.
Características clínicas de los 32 pacientes
| Características | N.° de pacientes (%) |
| Sexo | |
| Varones | 16 (50%) |
| Mujeres | 16 (50%) |
| Edad (años) | 41,5 (65–19) |
| Edad al diagnóstico (años) | 22,7 (6–9) |
| Tipo de psoriasis | 28 psoriasis en placas |
| 4 psoriasis palmo-plantar | |
| Ingresos | 3 |
| Episodios eritrodermia o psoriasis pustulosa | 2 (eritrodermia) |
| Tratamientos previos utilizados | |
| Fototerapia | 19 (59,3%) |
| Acitretina | 14 (43,7%) |
| Metotrexato | 14 (43,7%) |
| Ciclosporina | 15 (46,8%) |
| Etanercept | 9 (28,1%) |
| Infliximab | 1 (3%) |
| PASI pretratamiento (psoriasis en placas) | Media: 13,4 (intervalo: 8–29) |
| Mediana: 12,9 | |
| PGA pretratamiento (psoriasis palmo-plantar) | |
| 5- Moderado a grave | 2 (50%) |
| 6- Grave | 2(50%) |
| Tiempo exposición efalizumab (meses) | 26,1 (41–4) |
| Respuesta a efalizumab (psoriasis en placas) | |
| >PASI 90 | 64,3% (18/28) |
| >PASI 75 | 92,8% (26/28) |
| >PASI 50, | 3,6% (1/28) |
| 3,6% (1/28) | |
| Respuesta a efalizumab (psoriasis palmo-plantar) | |
| 1- Casi limpio | 1 (25%) |
| 2- Leve | 1 (25%) |
| 3- Leve a moderado | 2 (50%) |
PASI: Psoriasis Area and Severity Index; PGA: Physician's Global Assessment.
Los pacientes tenían una media de evolución de la psoriasis de 19 años, todos habían sido tratados previamente con tratamientos sistémicos o fototerapia, 9 de ellos habían requerido también tratamiento con etanercept y uno con infliximab antes de pautarles efalizumab. Tres sujetos habían requerido ingreso hospitalario por su psoriasis, y dos habían presentado episodios de eritrodermia psoriásica. En el momento de la suspensión el porcentaje de pacientes que había alcanzado una mejoría del PASI 75 fue del 92,8%, de los cuales un 64,3% había alcanzado incluso una mejoría del PASI 90. Sólo un 3,6% (1 de 32) presentaba una mejoría entre un 75 y 50% (respondedor parcial) y también un 3,6% (1 de 32) presentaba una mejoría menor de un 50% (no respondedor). El tiempo medio de exposición de forma continuada con efalizumab fue de 26,1 meses (entre 41 y 4 meses).
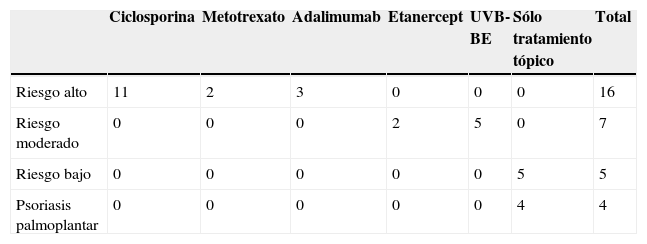
Con respecto a la terapia de transición (tabla 3) consideramos que tenían mayor riesgo de rebote aquellos pacientes que bien habían presentado episodios de psoriasis inestable, caracterizada por recaídas muy rápidas tras suspender tratamientos sistémicos o biológicos o lesiones muy eritematosas, en gotas o incluso episodios de eritrodermia e ingresos hospitalarios, o bien no habían alcanzado una mejoría del PASI 75. En estos pacientes de mayor riesgo se pautó principalmente ciclosporina en dosis de 3–5mg/kg (en total en 11 pacientes, un 39,3% de los sujetos con psoriasis en placas). En aquellos que tuvieran contraindicaciones o no hubieran respondido a ciclosporina se pautó adalimumab (en 3 pacientes: 10,7%) o metotrexato en dosis de 15 y 20mg/semana (en 2 pacientes: 7,1%). En pacientes con riesgo moderado pautamos etanercept a 50mg dos veces por semana (2 pacientes: 7,1%) o UVB-BE (5 pacientes: 17,8%). En los sujetos con psoriasis palmoplantar (4 pacientes) o en aquellos que habían tenido una psoriasis en placas con lesiones muy estables y con poca extensión, decidimos no instaurar tratamientos sistémicos ni biológicos y realizar un control únicamente con tratamiento tópico (5 pacientes: 17,8%). Dos pacientes (uno en tratamiento con adalimumab y otro con UVB-BE) abandonaron el tratamiento por cuenta propia. En el caso de pautar tratamiento sistémico clásico lo solapamos durante 4 semanas con efalizumab; los tratamientos biológicos los instauramos inmediatamente después de suspender efalizumab.
Tratamientos de transición según riesgo de rebote
| Ciclosporina | Metotrexato | Adalimumab | Etanercept | UVB-BE | Sólo tratamiento tópico | Total | |
| Riesgo alto | 11 | 2 | 3 | 0 | 0 | 0 | 16 |
| Riesgo moderado | 0 | 0 | 0 | 2 | 5 | 0 | 7 |
| Riesgo bajo | 0 | 0 | 0 | 0 | 0 | 5 | 5 |
| Psoriasis palmoplantar | 0 | 0 | 0 | 0 | 0 | 4 | 4 |
UVB-BE: radiación ultravioleta de longitud de onda B de banda estrecha.
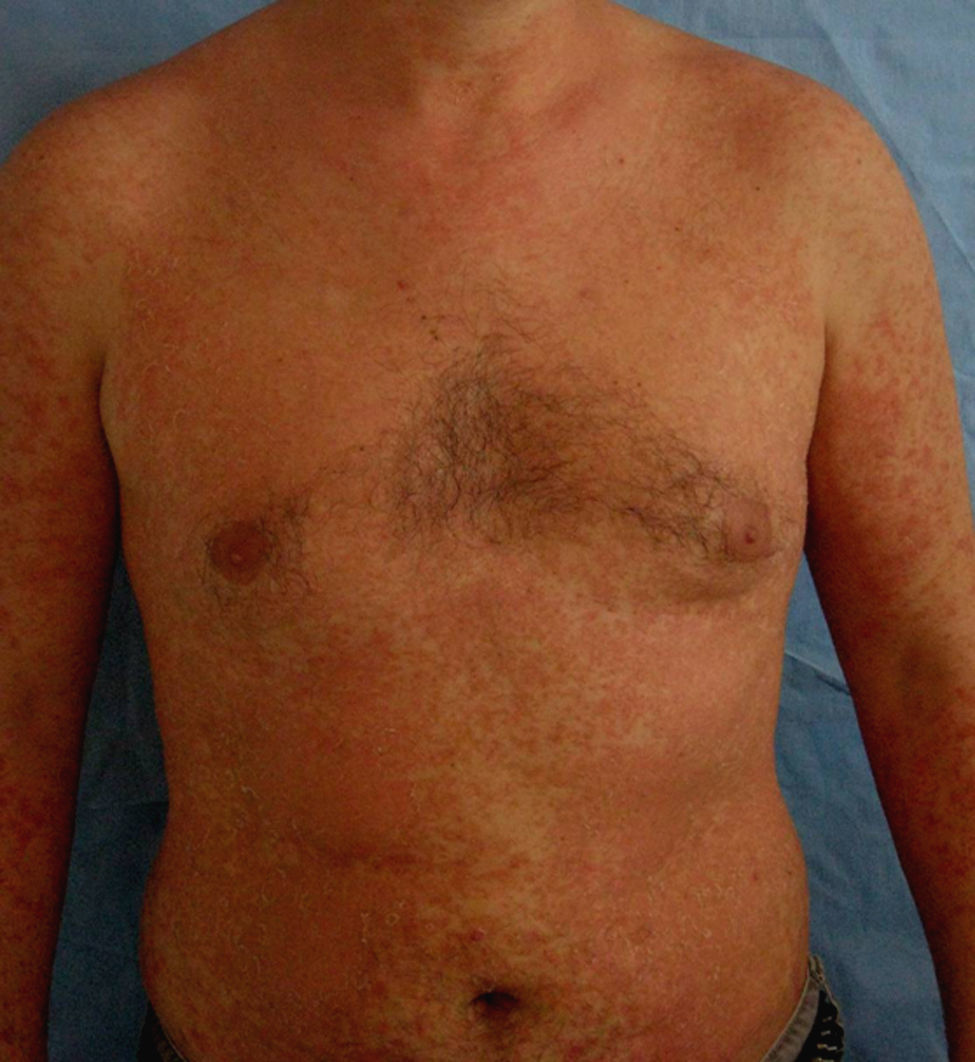
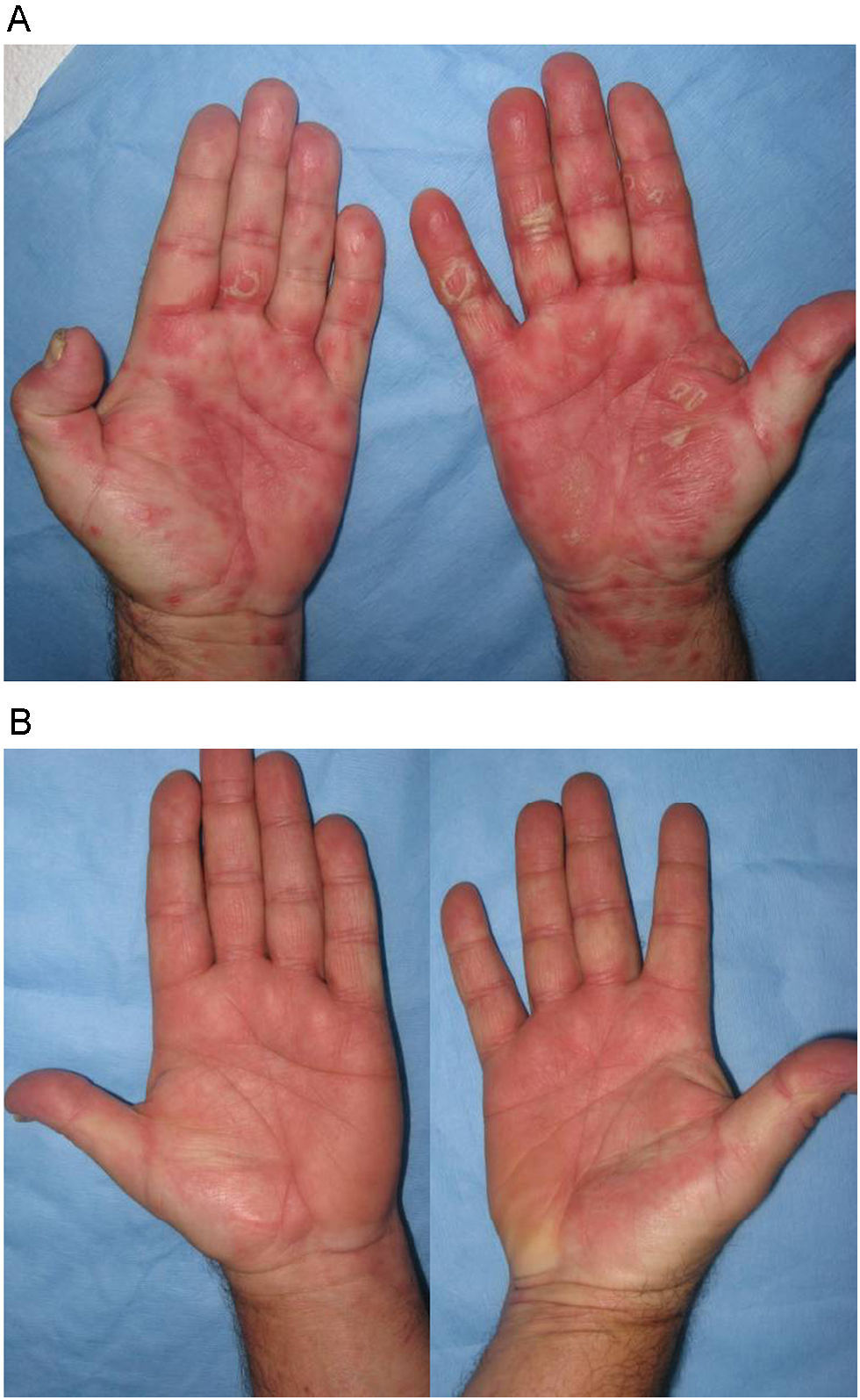
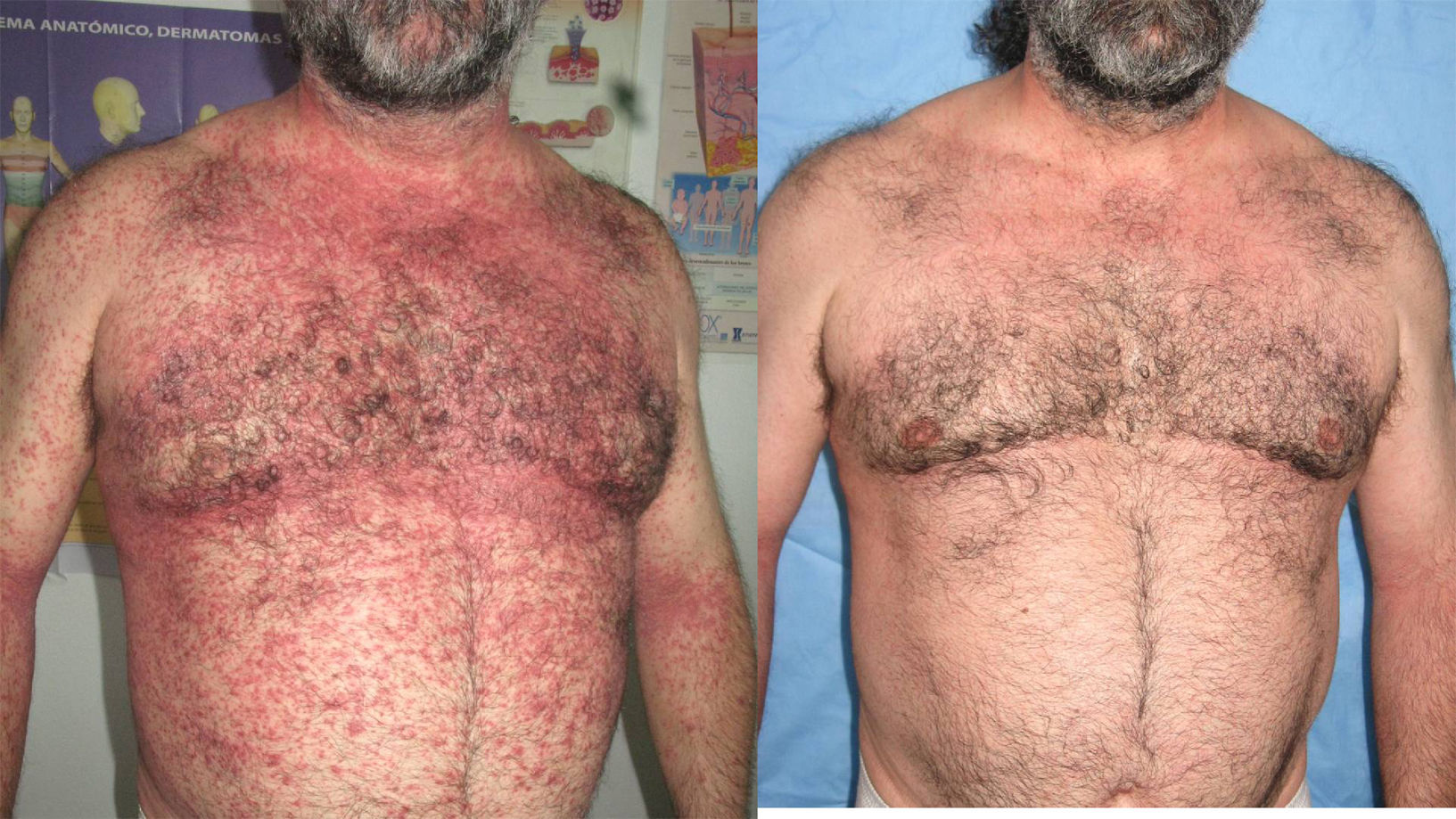
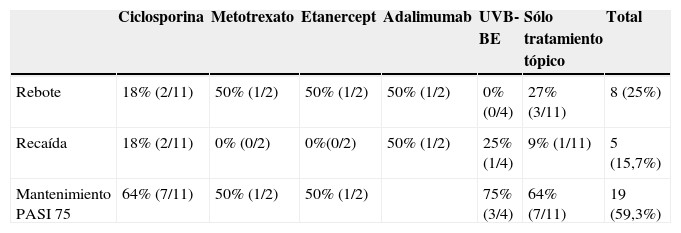
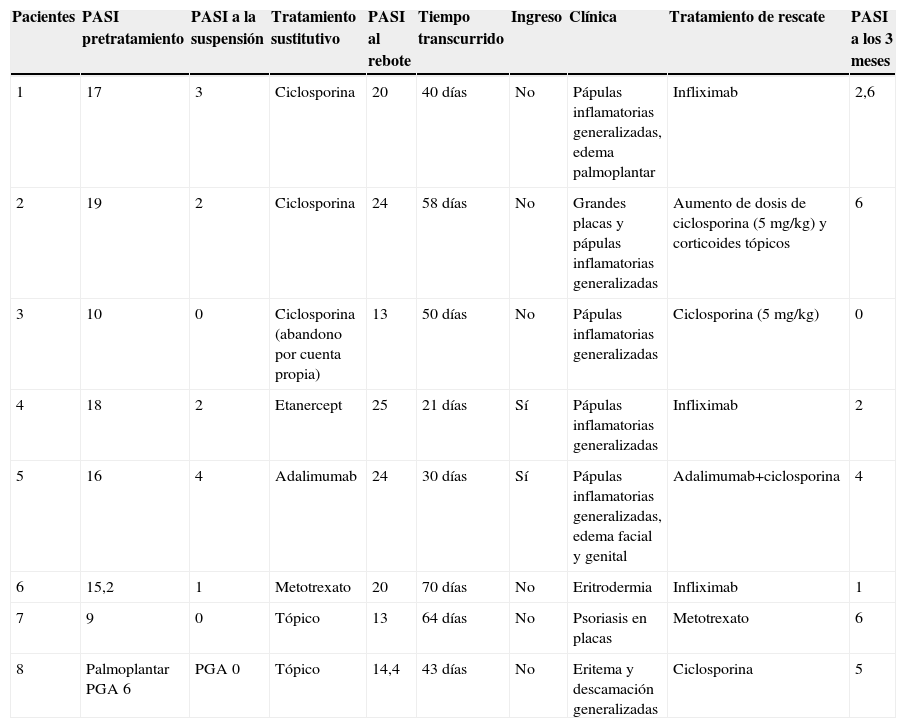
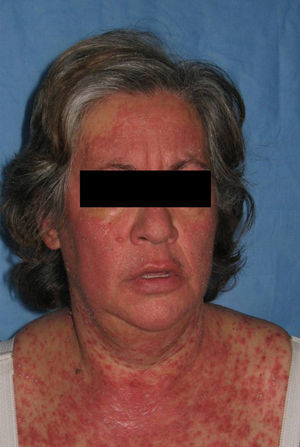
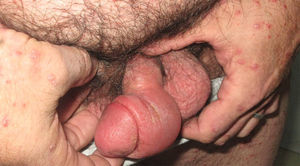
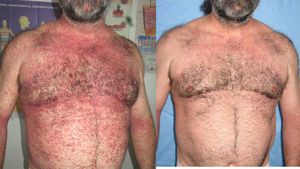
En la tabla 4 se describe el porcentaje de pacientes que presentaron rebotes y recaídas frente a los que mantuvieron un buen control de su enfermedad en relación con el tratamiento de transición prescrito. En total un 25% (8 de 32) de los pacientes presentó rebotes y un 15,7% (5 de 32) una recaída, frente a un 59,3% (19 de 32) que mantuvo un buen control de su enfermedad. El fenómeno de rebote fue más frecuente en los pacientes que tenían metotrexato, etanercept o adalimumab como terapia de transición (un 50%: 1 de 2 pacientes), aunque también lo observamos en los que estaban en tratamiento con ciclosporina (un 18%: 2 de 11). Únicamente tres pacientes (27%) con tratamiento tópico presentaron rebote; entre ellos se incluye la paciente que abandonó el tratamiento con ciclosporina por cuenta propia, un sujeto con psoriasis palmoplantar (fig. 1) y otro con lesiones muy estables, que presentaba un blanqueamiento total de las mismas en el momento en el que se le suspendió efalizumab. Cabe destacar que los dos pacientes que no clasificamos como buenos respondedores (un respondedor parcial y un no respondedor) no presentaron rebote, mejorando su PASI al pautarles ciclosporina en solapamiento con la retirada de efalizumab durante un mes. En la tabla 5 describimos el curso clínico de los 8 pacientes que sufrieron rebote; la media del tiempo transcurrido entre la suspensión de efalizumab y el rebote fue de 47 días. En tres de estos pacientes pautamos infliximab como medida de rescate ante la intensa inflamación y extensión de las lesiones, con un control muy rápido tras la segunda infusión (fig. 2). El resto de los sujetos también se ha controlado adecuadamente a los tres meses, aunque la mejoría con ciclosporina y metotrexato fue más gradual.
Evolución clínica durante el periodo de transición
| Ciclosporina | Metotrexato | Etanercept | Adalimumab | UVB-BE | Sólo tratamiento tópico | Total | |
| Rebote | 18% (2/11) | 50% (1/2) | 50% (1/2) | 50% (1/2) | 0% (0/4) | 27% (3/11) | 8 (25%) |
| Recaída | 18% (2/11) | 0% (0/2) | 0%(0/2) | 50% (1/2) | 25% (1/4) | 9% (1/11) | 5 (15,7%) |
| Mantenimiento PASI 75 | 64% (7/11) | 50% (1/2) | 50% (1/2) | 75% (3/4) | 64% (7/11) | 19 (59,3%) |
PASI: Psoriasis Area and Severity Index; UVB-BE: radiación ultravioleta de longitud de onda B de banda estrecha.
Pacientes que presentaron rebote
| Pacientes | PASI pretratamiento | PASI a la suspensión | Tratamiento sustitutivo | PASI al rebote | Tiempo transcurrido | Ingreso | Clínica | Tratamiento de rescate | PASI a los 3 meses |
| 1 | 17 | 3 | Ciclosporina | 20 | 40 días | No | Pápulas inflamatorias generalizadas, edema palmoplantar | Infliximab | 2,6 |
| 2 | 19 | 2 | Ciclosporina | 24 | 58 días | No | Grandes placas y pápulas inflamatorias generalizadas | Aumento de dosis de ciclosporina (5mg/kg) y corticoides tópicos | 6 |
| 3 | 10 | 0 | Ciclosporina (abandono por cuenta propia) | 13 | 50 días | No | Pápulas inflamatorias generalizadas | Ciclosporina (5mg/kg) | 0 |
| 4 | 18 | 2 | Etanercept | 25 | 21 días | Sí | Pápulas inflamatorias generalizadas | Infliximab | 2 |
| 5 | 16 | 4 | Adalimumab | 24 | 30 días | Sí | Pápulas inflamatorias generalizadas, edema facial y genital | Adalimumab+ciclosporina | 4 |
| 6 | 15,2 | 1 | Metotrexato | 20 | 70 días | No | Eritrodermia | Infliximab | 1 |
| 7 | 9 | 0 | Tópico | 13 | 64 días | No | Psoriasis en placas | Metotrexato | 6 |
| 8 | Palmoplantar PGA 6 | PGA 0 | Tópico | 14,4 | 43 días | No | Eritema y descamación generalizadas | Ciclosporina | 5 |
PASI: Psoriasis Area and Severity Index; PGA: Physician's Global Assessment.
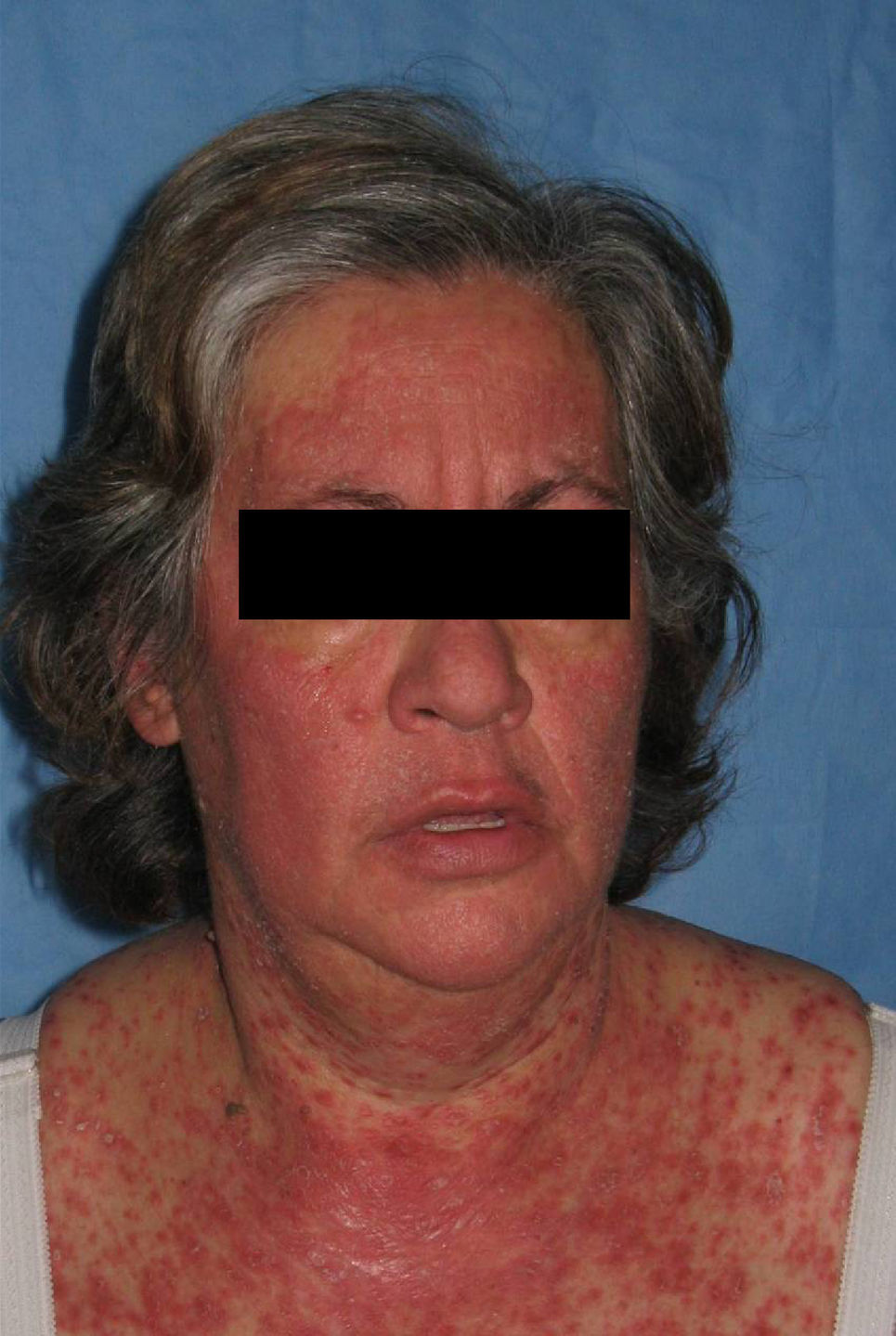
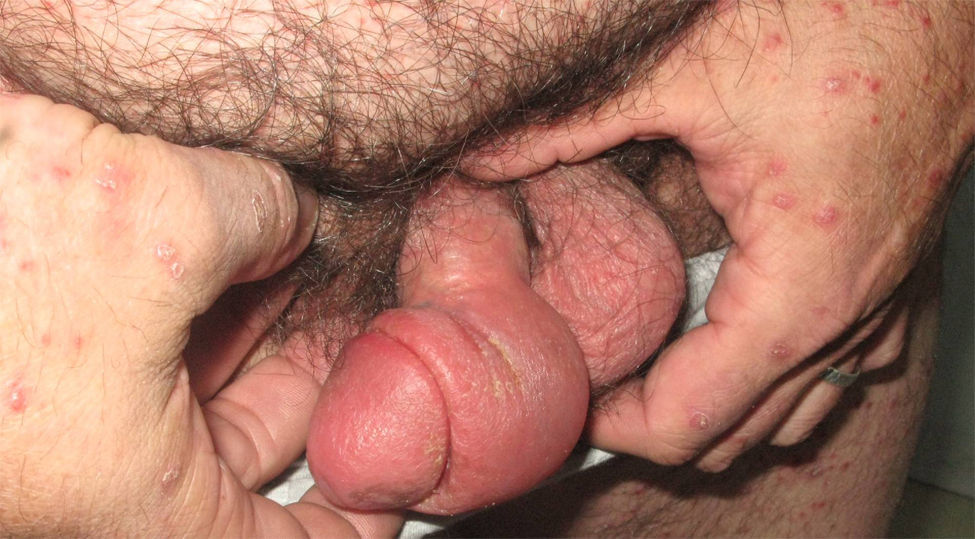
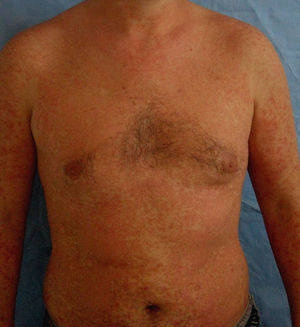
Los pacientes recogidos en esta muestra corresponden a una selección de pacientes «buenos respondedores» que mantenían en general una excelente respuesta tras un tratamiento de mantenimiento medio de 26,1 meses (entre 4 – 41 meses). Presentaban una psoriasis en placas de muchos años de evolución (media de 19 años) con pocos episodios de inestabilidad (tres pacientes habían requerido ingreso hospitalario y dos habían presentado episodios de eritrodermia). A pesar de tratarse de pacientes con poco riesgo de rebote y pautar en la mayoría de ellos un tratamiento de transición (sobre todo ciclosporina), un 25% presentó este fenómeno y un 15,6% una recaída. Estas cifras son claramente superiores a las publicadas en la literatura en pacientes «buenos respondedores»; también a diferencia de lo descrito previamente, la mayoría de los sujetos que sufrió rebote presentó además de un empeoramiento de un 125% del PASI, un cambio de morfología de las lesiones (7 de 8) que consistió en una erupción brusca generalizada muy pruriginosa caracterizada por pápulas confluyentes de características inflamatorias y lesiones edematosas, que se extendían por áreas previamente no afectadas como la cara, las palmas o los genitales (figs. 2–4); en un caso el cuadro derivó a una eritrodermia y dos pacientes requirieron ingreso hospitalario por la intensidad de las lesiones. El tiempo medio transcurrido entre la suspensión de efalizumab y el rebote se estima en la literatura en alrededor de 6 semanas (entre 4–9 semanas), cifra que se aproxima a la de este estudio (media de 47 días, con un intervalo entre 4 – 10 semanas).
En nuestro estudio la ciclosporina consiguió controlar a un 64% de los pacientes que pensábamos que presentaban mayor riesgo para un rebote; dada su potencia y rapidez de acción se consideraba por diferentes autores el fármaco de elección como terapia de transición11,12,14,15. Otros tratamientos recomendados como metotrexato, adalimumab o etanercept, sin embargo, resultaron menos eficaces para evitar el rebote, pero debido al escaso número de casos que fueron tratados con cada uno de estos fármacos, a la heterogeneidad de la historia clínica y la gravedad de la dermatosis en cada uno de los pacientes no es posible llegar a una conclusión. Seguimos la recomendación16 de solapar la retirada de efalizumab con otros fármacos sistémicos clásicos durante 4 semanas, a pesar de que algunos autores no encuentran beneficio en esta medida para prevenir los rebotes14.
Con respecto al tratamiento de rescate en los pacientes que presentaban una exacerbación inflamatoria generalizada, infliximab fue la medida que controló más rápidamente el rebote intenso que presentaron estos pacientes. Esta medida se había descrito ya previamente como muy eficaz en algunos casos clínicos aislados de pacientes que, tras la supresión de efalizumab, habían desarrollado formas eritrodérmicas9 o pustulosas17, y que no se habían controlado con otras medidas como UVB18 o etanercept19. Otros tratamientos como ciclosporina en monoterapia o asociada con adalimumab (fig. 5) también fueron eficaces para controlar los rebotes en este estudio, pero la mejoría se produjo de forma más progresiva.
Previamente ya se habían publicado episodios muy agudos de psoriasis eritrodérmica, pustulosa o formas generalizadas inflamatorias durante el tratamiento o tras la suspensión de efalizumab20–22; este comportamiento nos puede recordar al riesgo de desarrollo de psoriasis pustulosa tras la suspensión brusca de los corticoides orales. Las causas por las que este fármaco lleva a una modificación de la naturaleza de la psoriasis no están bien establecidas. Lowes et al estudiaron mediante inmunohistoquímica las lesiones de pacientes que habían desarrollado pápulas inflamatorias en zonas previamente no afectadas, cuadro que se denominó erupción papulosa localizada; encontraron un aumento de las células CD11b+, CD11c+ e iNOS+. Dichos autores sugerían que esta reacción inflamatoria sólo era observable ante el bloqueo de la molécula CD11a por efalizumab, y no durante el curso natural de la psoriasis. También se plantearon que la erupción papulosa localizada y las formas inflamatorias generalizadas tras la suspensión del fármaco formaban parte del espectro del mismo fenómeno23.
El hecho de que la incidencia de rebote en nuestra muestra haya sido superior a la descrita quizás se deba a que nuestros pacientes llevaban varios años de tratamiento continuo con efalizumab, al contrario que las series previamente descritas, que llevaban pocos meses bajo tratamiento14. Se evidencia que la experiencia obtenida en los ensayos clínicos resulta insuficiente para prever el comportamiento del fármaco a más largo plazo, circunstancia que sólo se obtiene con el beneficio de la experiencia.
En conclusión, a pesar de que actualmente está suspendida la comercialización de efalizumab, nos parece de interés describir el porcentaje tan alto de rebotes y formas generalizadas inflamatorias que hemos encontrado en los pacientes que habían conseguido una mejoría mantenida de sus lesiones durante varios años.
Conflicto de interesesLa Dra. Baniandrés declara haber participado como asesora en reuniones organizadas por Shering-Plough. El resto de los autores declara no tener ningún conflicto de intereses.