Existe un pequeño número de casos de dermatitis atópica (DA) infantil donde la terapia tópica es insuficiente para el control de la enfermedad y es necesario el uso prolongado de agentes inmunosupresores sistémicos. En los últimos años el mejor conocimiento de las vías metabólicas implicadas en la catabolización de la azatioprina (AZT) parece ofrecernos un uso más seguro de este fármaco. Hemos evaluado la toxicidad de la AZT según los niveles de tiopurina metiltransferasa (TPMT) en niños con DA grave.
Material y métodosEstudio retrospectivo de los efectos secundarios de la AZT ajustada a los niveles de TPMT en menores de 14 años con DA que han sido tratados en el Servicio de Dermatología del Hospital Universitario Insular de Gran Canaria. La evaluación de los efectos secundarios se realizó mediante controles analíticos con recuento leucocitario y de transaminasemia en la visita basal, al mes y cada tres meses durante el tratamiento.
ResultadosEn los últimos 4 años, 7 niños (media de 10 años) con DA grave han recibido AZT en nuestro Servicio. La duración media del tratamiento fue de 12 meses (rango 1–38); sólo dos pacientes presentaron una leucopenia leve transitoria que no requirió la suspensión del tratamiento.
DiscusiónSegún nuestra experiencia la AZT, ajustada a los niveles de TPMT, se muestra como un fármaco seguro en el tratamiento de niños con DA grave, aunque son precisos ensayos clínicos que comparen la relación riesgo/beneficio entre los inmunosupresores empleados en estos pacientes.
In a small number of cases of childhood atopic dermatitis, topical therapy is ineffective, necessitating prolonged use of systemic immunosuppressants. Over the last few years, a better understanding of the metabolic pathways involved in azathioprine breakdown has enabled us to use this drug more safely. In this study, we evaluated the toxicity of azathioprine treatment adjusted to thiopurine methyltransferase activity in children with severe atopic dermatitis.
Material and methodsWe performed a retrospective study of the side effects of azathioprine therapy adjusted to thiopurine methyltransferase activity in children aged under 14 years with atopic dermatitis who were treated in the dermatology department of Hospital Universitario Insular de Gran Canaria in Gran Canaria, Spain. Side effects were evaluated by analysis of leukocyte count and transaminase levels at baseline, after 1 month of treatment, and every 3 months thereafter.
ResultsDuring the last 4 years, 7 children (mean age, 10 years) with severe atopic dermatitis received azathioprine in our department. Mean duration of treatment was 12 months (range, 1 to 38 months). Only 2 patients presented mild transient leukopenia that did not require treatment to be suspended.
DiscussionOur experience shows that, when adjusted to thiopurine methyltransferase activity, azathioprine is a safe drug for the treatment of children with severe atopic dermatitis. However, clinical trials should be performed to compare the risk-benefit ratios of the different immunosuppressants used to treat these patients.
La dermatitis atópica (DA) es una enfermedad inflamatoria crónica de la piel, cuyo manejo se basa en el uso regular de hidratación y en el tratamiento de las exacerbaciones agudas con corticoides o los inhibidores tópicos de la calcineurina principalmente1. Existe, sin embargo, un menor número de casos donde el tratamiento tópico es insuficiente para el control de la enfermedad y es necesario el uso de tratamiento sistémico. Los corticoides sistémicos, aunque de frecuente utilización en la práctica clínica, no han sido adecuadamente evaluados, y su uso a largo plazo se encuentra limitado por los efectos adversos, siendo necesario el empleo de otros agentes inmunosupresores para evitar su uso prolongado o recurrente.
La azatioprina (AZT), un análogo sintético de las purinas con un efecto inmunosupresor y antiinflamatorio, se ha convertido en los últimos 10 años en una opción terapéutica clara en el control de la DA grave de los adultos2; sin embargo, su uso en niños está menos estudiado3. El empleo más seguro de este fármaco se debe al mejor conocimiento de una enzima clave en su catabolización, la tiopurina metiltransferasa (TPMT), que se encuentra sujeta a un polimorfismo genético4. El conocimiento del grado de actividad de esta enzima en cada sujeto parece ofrecer un uso más seguro de este fármaco de empleo limitado por el riesgo de mielosupresión.
Presentamos 7 niños con DA grave, en los que el tratamiento con AZT se ajustó a los niveles de TPMT.
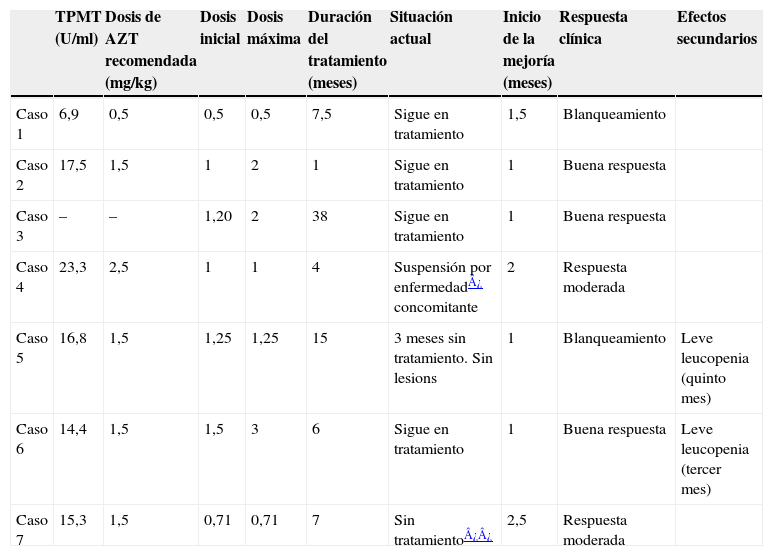
Material y métodosHemos realizado un estudio retrospectivo de 7 niños con DA que han recibido AZT en los últimos 4 años en el Servicio de Dermatología del Hospital Insular de Gran Canaria, con una media de 12 meses de tratamiento (rango 1–38 meses) (tabla 1).
Pautas, duración del tratamiento, respuesta clínica y efectos secundarios durante el uso de azatioprina
| TPMT (U/ml) | Dosis de AZT recomendada (mg/kg) | Dosis inicial | Dosis máxima | Duración del tratamiento (meses) | Situación actual | Inicio de la mejoría (meses) | Respuesta clínica | Efectos secundarios | |
| Caso 1 | 6,9 | 0,5 | 0,5 | 0,5 | 7,5 | Sigue en tratamiento | 1,5 | Blanqueamiento | |
| Caso 2 | 17,5 | 1,5 | 1 | 2 | 1 | Sigue en tratamiento | 1 | Buena respuesta | |
| Caso 3 | – | – | 1,20 | 2 | 38 | Sigue en tratamiento | 1 | Buena respuesta | |
| Caso 4 | 23,3 | 2,5 | 1 | 1 | 4 | Suspensión por enfermedad¿ concomitante | 2 | Respuesta moderada | |
| Caso 5 | 16,8 | 1,5 | 1,25 | 1,25 | 15 | 3 meses sin tratamiento. Sin lesions | 1 | Blanqueamiento | Leve leucopenia (quinto mes) |
| Caso 6 | 14,4 | 1,5 | 1,5 | 3 | 6 | Sigue en tratamiento | 1 | Buena respuesta | Leve leucopenia (tercer mes) |
| Caso 7 | 15,3 | 1,5 | 0,71 | 0,71 | 7 | Sin tratamiento¿¿ | 2,5 | Respuesta moderada |
Los niños presentaban edades comprendidas entre los 7 y 14 años al inicio del tratamiento, con una media de 10 años (tabla 2). Todos presentaban una DA de años de evolución, que no había respondido a tratamientos tópicos y a pautas cortas de corticoides sistémicos en exacerbaciones agudas de la enfermedad. En uno de los casos la ciclosporina fue también ineficaz (tabla 2).
Características demográficas y tratamientos previos utilizados
| Caso | Sexo/edad | Inicio de la dermatitis atópica | Otros tratamientos |
| 1 | ♂7 | Lactancia | Corticoides tópicos. Tacrolimus tópico y pimecrolimus. Corticoides orales |
| 2 | ♀ 7 | 4 años | Corticoides tópicos. Corticoides orales |
| 3 | ♂ 9 | 2 años | Corticoides tópicos. Tacrolimus. Corticoides orales. Ciclosporina |
| 4 | ♀ 10 | 5 años | Corticoides tópicos. Corticoides orales |
| 5 | ♂ 10 | Lactancia | Corticoides tópicos. Tacrolimus |
| 6 | ♀ 12 | Lactancia | Corticoides tópicos. Tacrolimus y pimecrolimus. Corticoides orales |
| 7 | ♂ 14 | 4 años | Corticoides tópicos. Tacrolimus y pimecrolimus |
Previo al uso de AZT se calcularon los niveles de TPMT en sangre periférica en todos los pacientes excepto en uno (caso 3, tabla 1), cuyo tratamiento comenzó hace más de tres años, momento en el que no se encontraba protocolizado el cálculo de la actividad de esta enzima. Las mediciones de la actividad enzimática se realizaron mediante cromatografía líquida de alta resolución, ajustándose la dosis de AZT según la actividad de la TPMT (tablas 1 y 3).
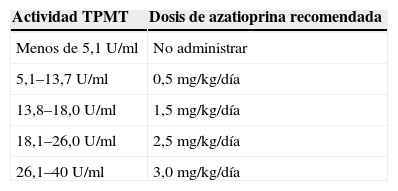
Dosis de azatioprina recomendada según los niveles de tiopurina metiltransferasa
| Actividad TPMT | Dosis de azatioprina recomendada |
| Menos de 5,1U/ml | No administrar |
| 5,1–13,7U/ml | 0,5mg/kg/día |
| 13,8–18,0U/ml | 1,5mg/kg/día |
| 18,1–26,0U/ml | 2,5mg/kg/día |
| 26,1–40U/ml | 3,0mg/kg/día |
TPMT: tiopurina metiltransferasa
La evaluación de la respuesta clínica se valoró al final del estudio, según la necesidad de tratamiento concomitante para el control de la enfermedad. De esta manera se clasificó como: aclaramiento los que sólo requirieran hidratación; buena respuesta si precisaban menos de 30g de corticoides tópicos de moderada potencia al mes; respuesta moderada si necesitaban más de 30g/mes y falta de respuesta.
La evaluación de la toxicidad se realizó mediante analíticas seriadas (hemograma y bioquímica) al inicio, al mes y cada tres meses durante el tratamiento.
ResultadosNinguno de los pacientes estudiados mostró un déficit de actividad de la TPMT que contraindicara el uso del fármaco (tabla 1). El establecimiento de la dosis se realizó según los niveles de TPMT, aunque de manera general la dosis inicial administrada fue inferior a la recomendada según estos niveles por cautela, debido a la falta de experiencia en el uso de este fármaco en niños (tabla 1).
En todos los pacientes estudiados el inicio de la respuesta clínica se observó entre el mes y los dos meses y medio de tratamiento. En este periodo inicial se requirió en todos los pacientes el uso concomitante de medicación tópica, y sólo en dos, aisladamente, el uso de pautas cortas de corticoides sistémicos para el control de exacerbaciones agudas. Ninguno de los pacientes requirió corticoides sistémicos después de los dos meses del inicio del tratamiento.
En el transcurso de tratamiento dos de los pacientes recibieron puntualmente, por una mala comprensión de la prescripción, una dosis de AZT superior a la recomendada (casos 2 y 6, tabla 1) y en uno se suspendió la medicación por diarrea asociada a enfermedad inflamatoria intestinal (caso 4, tabla 1).
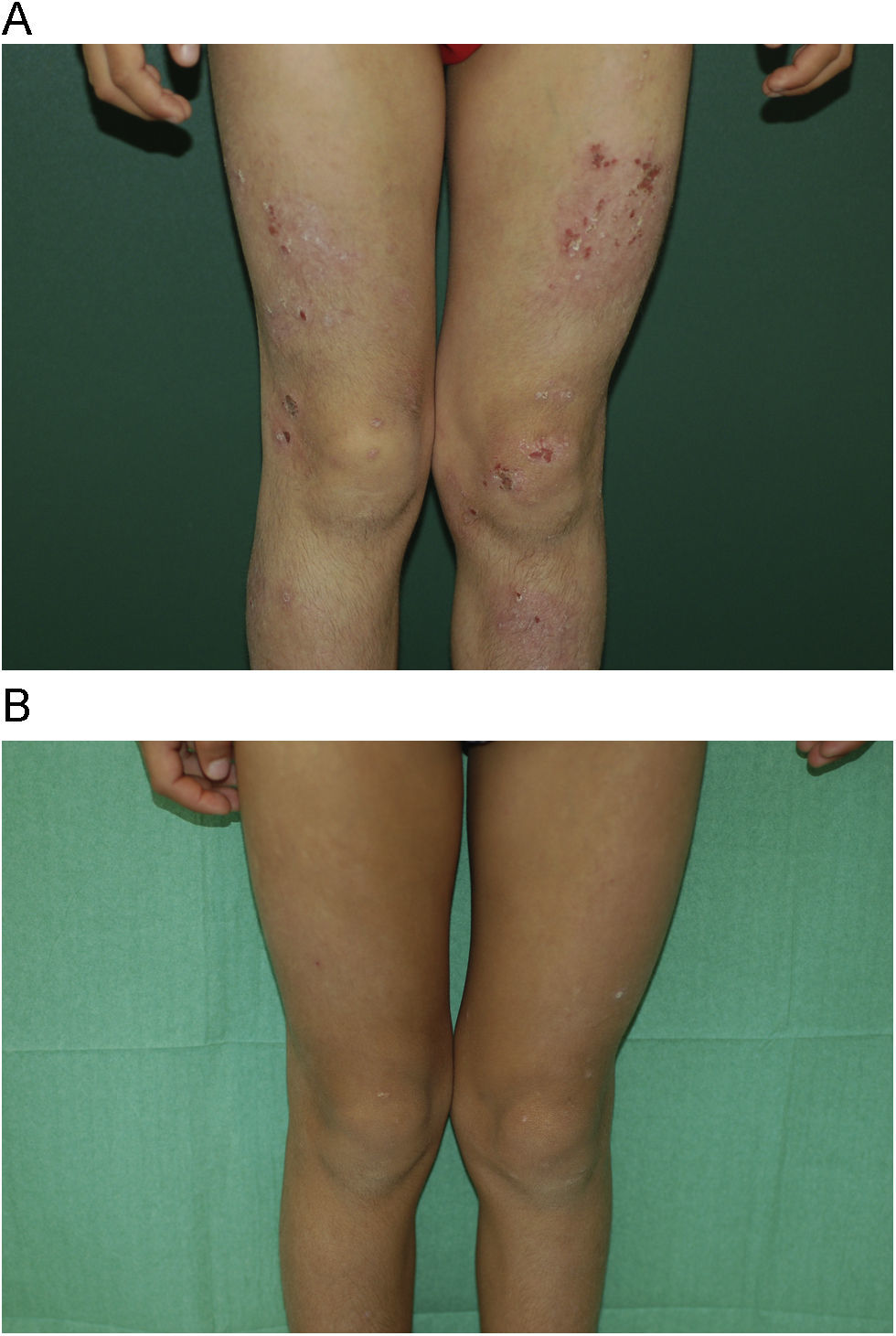
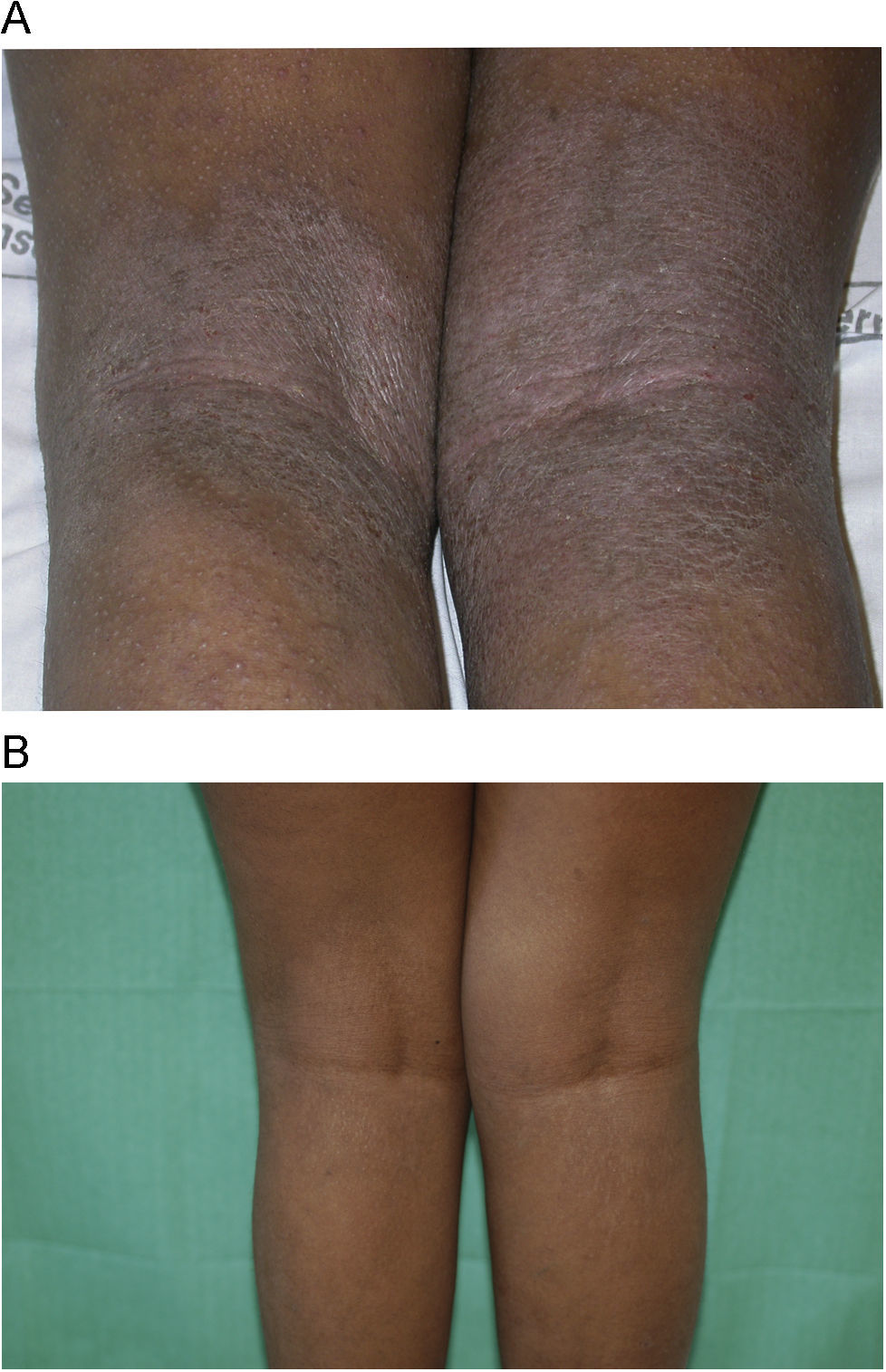
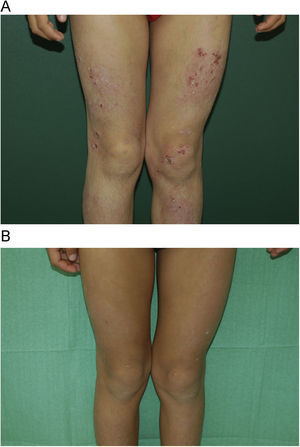
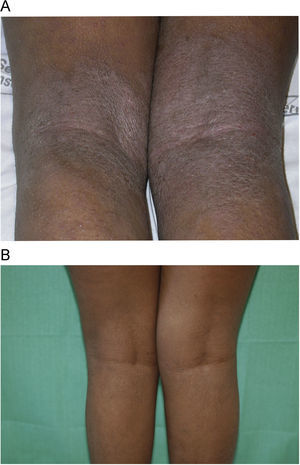
Con respecto a la respuesta clínica, dos de los pacientes mostraron un blanqueamiento total de sus lesiones (figs. 1A y B, caso 1), tres una buena respuesta (figs. 2A y B, caso 6) y dos una respuesta moderada. En uno de los casos con respuesta moderada hubo que suspender el tratamiento por mala adherencia al seguimiento médico (caso 7, tabla 1).
Ningún paciente mostró efectos adversos que requirieran la suspensión del tratamiento, y sólo dos mostraron una leucopenia leve transitoria que no requirió la disminución de la dosis (casos 5 y 6, tabla 1). Uno de estos pacientes corresponde al que superó la dosis de AZT recomendada según los niveles de TPMT (caso 6, tabla 1).
Cuatro pacientes siguen en tratamiento con AZT en el momento actual (tabla 1).
DiscusiónEl uso de fármacos inmunosupresores en la edad pediátrica se encuentra limitado por la toxicidad que presenta este tipo de tratamientos. Su utilización en la DA grave infantil, aunque de uso difundido1, no se encuentra protocolizada por la falta de estudios controlados que comparen diferentes opciones terapéuticas.
Son varios los tratamientos inmunosupresores que se han utilizado en el manejo de la DA infantil grave, de los cuales sólo la ciclosporina5,6 ha demostrado su efectividad mediante estudios controlados. Sin embargo, su uso se encuentra limitado por los efectos adversos a largo plazo, como la toxicidad renal.
Otros tratamientos en la DA infantil nombrados en la literatura en series de casos son la azatioprina3,7, el micofenolato de mofetilo8, la fototerapia9–11, la inmunoglobulina intravenosa12,13 y el omalizumab14.
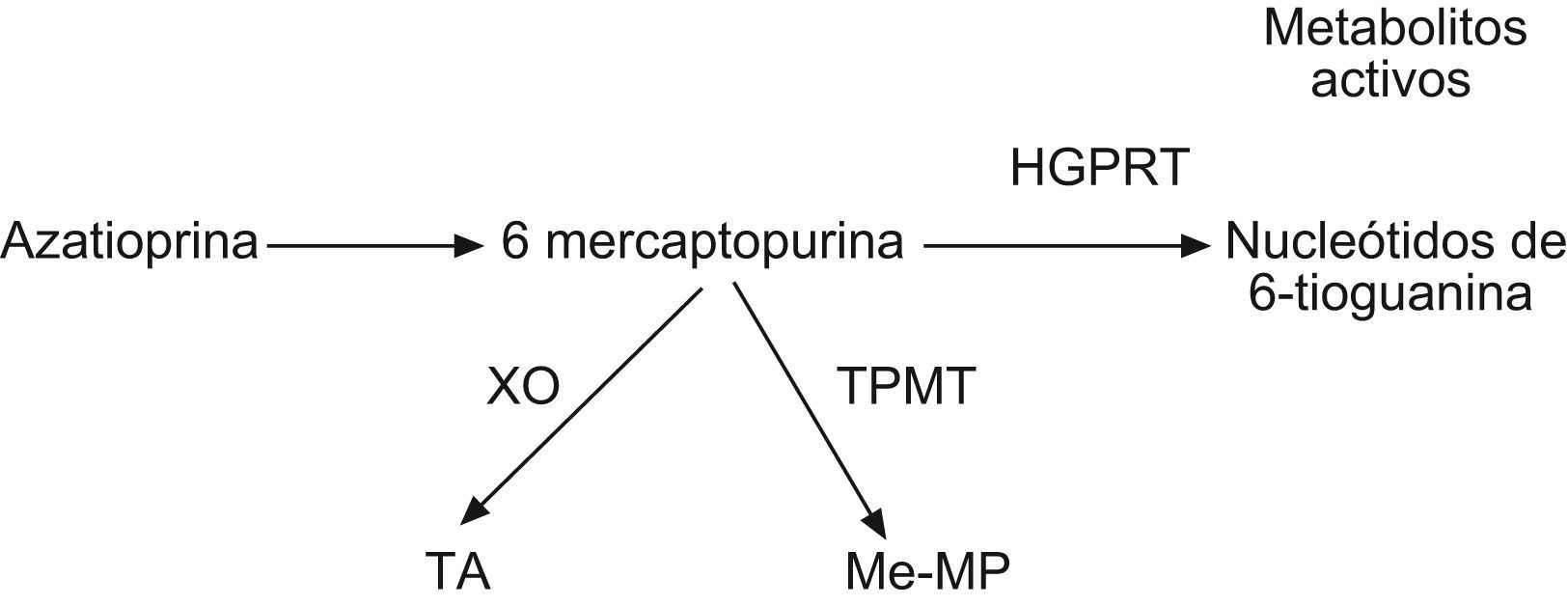
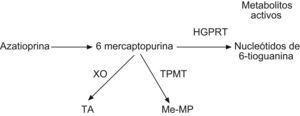
La AZT es un derivado de la 6-mercaptopurina (6-MP) sintetizado en 1956, que aunque posee un efecto terapéutico similar a su precursor administrado parenteralmente, presenta una biodisponibilidad por vía oral muy superior15. Una vez en el interior del organismo este fármaco puede seguir tres vías metabólicas (fig. 3): una vía anabólica por la que se convierte en metabolito activo y dos vías catabólicas que lo degradan a metabolitos inactivos. Las enzimas implicadas en las vías catabólicas son (fig. 3): la xantina oxidasa, cuya actividad puede reducirse por el uso de algunos fármacos como el alopurinol y la TPMT, cuya actividad está sujeta a un polimorfismo genético. La medición de la actividad de esta última enzima en los glóbulos rojos muestra una buena correlación con su actividad sistémica, y mediante su medición en la población de raza blanca se han llegado a identificar tres grandes grupos: un 89% de la población muestra una alta expresión TPMT, un 11% presenta una expresión intermedia y 1 de cada 200 o 300 pacientes presenta una actividad enzimática deficiente16.
Los efectos adversos de la AZT se basan fundamentalmente en la hepatotoxicidad a largo plazo y la mielosupresión, este último relacionado con los niveles de TPMT, que obligan a la monitorización de los pacientes durante el tratamiento. Otros efectos adversos encontrados durante el uso de AZT se muestran en la tabla 4, siendo los más frecuentes los gastrointestinales (náuseas, vómitos, diarreas, etc.)16.
Efectos secundarios de la azatioprina
| Tumores |
| Carcinoma escamoso |
| Linfomas |
| Mielosupresión (correlacionado con baja actividad de TPMT) |
| Neutropenia |
| Agranulocitosis y pancitopenia |
| Infecciones |
| VPH, VHS, escabiosis |
| Las infecciones oportunistas son poco comunes con la AZT de uso dermatológico |
| Teratogenicidad |
| Síndrome de hipersensibilidad |
| Efectos gastrointestinales |
| Hepatotoxicidad |
| Elevación de transaminasas |
| Toxicidad hepatocelular grave (raros) |
AZT: azatioprina; TPMT: tiopurina metiltransferasa; VHS: virus del herpes simple; VPH: virus del papiloma humano.
Con el fin de evitar esta toxicidad, históricamente la dosificación de la AZT se ha basado en el uso de dosis iniciales bajas con estrecha monitorización analítica, para ir aumentándola hasta dosis terapéuticas. Muchos autores defendían que las dosis necesarias de AZT se encontraban entre 1–3mg/kg/día con una dosis máxima diaria de 100mg17, mientras que otros creían que la dosis máxima debía situarse en 2,5mg/kg/día16. Hoy en día la medición previa de los niveles de TPMT nos permite conocer la dosis de AZT recomendada y evitar su uso en pacientes con alto riesgo de toxicidad, así como el empleo de dosis infraterapéuticas en sujetos con alta actividad enzimática4. Es decir, los pacientes con baja actividad de la TPMT presentarán una acumulación de metabolitos activos con un riesgo incrementado de mielosupresión, y en ellos el uso de AZT debería limitarse, mientras que aquellos con alta actividad enzimática pueden encontrarse infratratados a la dosis de tratamiento habitualmente utilizada por la elevada catabolización del fármaco (tabla 3). Nos permite, por tanto, la posibilidad de optimizar el efecto terapéutico de la AZT reduciendo al mínimo el riesgo de toxicidad.
Son pocos los estudios que evalúan retrospectivmente la toxicidad y eficacia de la AZT en niños con DA grave. Murphy y Atherton3 estudiaron retrospectivamente 48 niños que habían recibido AZT y a los que previamente se les había calculado los niveles de TPMT para excluir pacientes con alto riesgo de mielosupresión. De todos los pacientes sólo dos requirieron la suspensión del tratamiento por una reacción de hipersensibilidad y un eccema herpético, y 15 de ellos sufrieron una linfopenia transitoria que no requirió el abandono de la medicación. Por otro lado, los autores Hon KLE, et al7 evaluaron la respuesta de 17 niños con DA que habían recibido AZT y a los que no se les calculó los niveles de TPMT. Para evitar toxicidad los niños fueron sometidos a analíticas semanales hasta dosis terapéuticas y no encontraron efectos secundarios por los que se requiriera la suspensión del tratamiento.
Nuestra experiencia clínica, al igual que los escasos estudios en la literatura sobre el uso de AZT en niños3,7,18, confirma la seguridad del tratamiento. Ninguno de nuestros pacientes mostró efectos secundarios que requirieran la suspensión del tratamiento, lo que puede sugerir que el cálculo previo de los niveles de TPMT permite evitar su uso en aquellos pacientes con baja actividad enzimática y, por tanto, mayor riesgo de mielosupresión.
Con respecto a la eficacia del tratamiento, y aun no siendo el objetivo de nuestro estudio, la medición de este parámetro, por las limitaciones que presenta, muestra concordancia con lo ya publicado3,7,18. Todos nuestros pacientes mostraron algún grado de respuesta clínica que comenzó tras un mes de tratamiento continuado. Por ello algunos pacientes, al igual que en el estudio de Murphy3, requirieron el uso concomitante de pautas cortas de corticoides sistémicos al inicio del tratamiento.
De manera general a nuestros pacientes, por tratarse de niños y ante la falta de experiencia del uso de AZT en este grupo de edad, se les administró una dosis inicial inferior a la recomendada según sus niveles de TPMT (tabla 1). En dos de ellos (casos 4 y 7, tabla 1), sin poder realizar asociación causal, se tardó más en encontrar un efecto terapéutico. Este fenómeno de dosis infraterapéuticas en pacientes con alta actividad de la TPMT se plantea en varios estudios3,4,19.
La suspensión del tratamiento se basó en la respuesta clínica medida según la necesidad de tratamiento concomitante para el control de la dermatitis, de esta manera los pacientes que sólo requerían hidratación para el control sintomático fueron catalogados como «blanqueamiento» y se les retiró la medicación. En el caso número 5, con una duración del tratamiento superior al año y un blanqueamiento objetivado durante más de un mes, se decidió la suspensión del tratamiento tras una pauta descendente. Sin embargo, en el caso número 1, con blanqueamiento total de las lesiones de menos de un mes de evolución (objetivadas por primera vez durante la última revisión) se decidió disminuir la dosis pautándola a días alternos antes de retirarla totalmente.
Al ser escasa la literatura sobre el uso de este fármaco en la DA infantil, no existen recomendaciones sobre la duración del tratamiento. Murphy y Atherton decidieron, basándose en la posible persistencia del beneficio terapéutico una vez que se retira el fármaco19, mantener el tratamiento durante aproximadamente dos años en aquellos pacientes que presentaran una buena respuesta al tratamiento, con retirada progresiva del mismo. En nuestros casos la duración del tratamiento no se encuentra protocolizada. La decisión de retirar la medicación se ha basado en: la presentación de un blanqueamiento de las lesiones que se haya objetivado durante más de un mes (caso 5), la presencia de algún efecto secundario o estado médico que contraindicara su continuación (caso 4) y la mala adherencia al seguimiento médico que no permitiera un buen seguimiento analítico del paciente (caso 7).
La revisión de la literatura nos muestra, por tanto, que son escasos los estudios sobre el uso de la AZT en niños, aun existiendo estudios que sugieren que este tratamiento puede ser muy efectivo en adultos2,20. En comparación con otras opciones terapéuticas disponibles, como ahorrador de corticoides en la DA infantil grave, la AZT muestra un mejor rango de seguridad y de manejo que la ciclosporina, aunque se puede tardar más tiempo en encontrar un efecto terapéutico.
Nuestra experiencia en el uso de AZT, ajustada a los niveles de la TPMT en niños con DA grave, es muy positiva en términos de seguridad y eficacia, aunque faltan estudios de mayor potencia que confirmen y establezcan una monitorización adecuada en el manejo de este fármaco en niños.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.