La dermatomiositis juvenil es una conectivopatía sistémica infrecuente de aparición en la edad pediátrica. Clínicamente se caracteriza por la presencia de debilidad muscular proximal con afectación cutánea característica. El diagnóstico de la enfermedad se realiza mediante los criterios de Bohan y Peter, si bien recientemente numerosos autores están sustituyendo la realización de biopsia muscular por la resonancia magnética muscular (RMM) para el diagnóstico y seguimiento de la enfermedad.
En fases crónicas de la enfermedad, y sin un tratamiento precoz intensivo, pueden aparecer complicaciones como la calcinosis cutánea o la lipoatrofia, por lo que el reconocimiento temprano de la enfermedad es clave en el manejo.
Presentamos una serie de 5 pacientes diagnosticados de dermatomiositis juvenil mediante RMM sin realizarse biopsia muscular y tratados de forma temprana. Resaltamos la utilidad de la RMM en el diagnóstico de la enfermedad muscular y la importancia de instaurar el tratamiento de forma precoz e intensiva para prevenir las complicaciones.
Juvenile dermatomyositis is a rare systemic connective tissue disease with onset during childhood. It presents clinically with proximal muscle weakness and characteristic skin involvement. Diagnosis is based on the Bohan and Peter criteria, though many authors are now substituting biopsy with muscle magnetic resonance imaging (MRI) for both diagnosis and follow-up. Without intensive early treatment, complications such as calcinosis cutis and lipodystrophy can develop in the chronic phases of the disease. Early recognition is therefore key to management. We present a series of 5 patients who were diagnosed with Juvenile dermatomyositis on muscle MRI without undergoing muscle biopsy and who received early treatment. We draw attention to the usefulness of muscle MRI for the diagnosis of muscle involvement and to the importance of early initiation of intensive treatment to prevent complications.
La dermatomiositis juvenil (DMJ) es una conectivopatía sistémica de origen autoinmune poco frecuente. A pesar de ello, representa el 85% de los casos de miopatía inflamatoria idiopática en la edad pediátrica, encontrándose en algunas series incidencias de 2-4/1.000.000 de niños-año1. Clínicamente se caracteriza por la presencia de debilidad muscular y afectación cutánea característica, que suele ser el síntoma de presentación de la enfermedad, pudiendo afectar en algunos casos a otros órganos como el tracto gastrointestinal, el corazón, el pulmón, el riñón y los ojos2. En fases tardías de la enfermedad pueden aparecer otras complicaciones como la lipoatrofia o la calcinosis cutánea, cuya prevalencia ha ido disminuyendo con el tratamiento intensivo precoz. El diagnóstico se realiza clásicamente con los criterios de Bohan y Peter (1975), aunque en los últimos años la resonancia magnética muscular (RMM) ha ido desplazando el uso de la biopsia muscular como método diagnóstico, pues se trata de una técnica no invasiva, con buena sensibilidad y que no presenta los falsos negativos de la biopsia muscular, ocasionados por la afectación parcheada de la enfermedad3–5. Por todo ello, algunos grupos han propuesto su inclusión en los criterios diagnósticos y de seguimiento1,5,6.
ObjetivosPresentamos una revisión retrospectiva de los pacientes diagnosticados de DMJ en nuestro centro entre enero de 1999 y diciembre de 2015. Nuestros objetivos fueron valorar la presencia de complicaciones y la evolución de los pacientes con el uso de tratamiento intensivo precoz y evaluar la utilidad de la RMM en el diagnóstico de la afectación muscular, en sustitución de la biopsia muscular.
ResultadosSe incluyeron un total de 5 pacientes, con una edad media al diagnóstico de 10,4 años (8-12 años) y una ratio varón/mujer (V/M) de 4/1. El tiempo hasta el diagnóstico fue entre 2 meses y 3 años. En todos los casos las manifestaciones cutáneas precedieron entre 2 semanas y 3 años a la afectación muscular. En los 2 pacientes en los que la afectación cutánea fue el motivo de consulta, el diagnóstico se estableció más precozmente, encontrándose en la exploración del primero pápulas de Gottron y rash malar (tabla 1, paciente 2), y en el segundo pápulas de Gottron, eritema heliotropo y placas de aspecto psoriasiforme en el cuero cabelludo (tabla 1, paciente 4). En los 3 pacientes restantes el síntoma de consulta fue la debilidad muscular. Todos los pacientes presentaron afectación cutánea, siendo los hallazgos más frecuentes las pápulas/signo de Gottron en 5/5, el eritema heliotropo en 4/5 pacientes, el rash malar en 4/5 y las telangiectasias periungueales en 3/5 (tabla 1).
Características clínicas de los pacientes
| Caso | Sex | ED | T. Dx. | Primer síntoma | S. consulta | Clínica cutánea | Debilidad muscular | ACa | Biopsia | Resonancia magnética |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | V | 8 | 24m | Piel | Debilidad | EH, PG, TP, RM, | Esc. y pelv. | Neg | HiperQ, paraQ, infiltrado linfocitario perivascular, mucina, IFD negativa | Edema muscular paraespinal y EESS y EEII |
| 2 | V | 12 | 3sem | Piel | Lesión piel | PG, RM, | Esc. | ANA | HiperQ, infiltrado perivascular, Q necróticos, mucina, IFD fibrinógeno | Edema muscular escapular |
| 3 | V | 12 | – | Piel | Debilidad | EH, PG, TP, RM, FS | Pelv. | ANA | Ulceración, paraQ, infiltrado perivascular linfocitario, dilatación vascular | Edema muscular cintura pelviana |
| 4 | M | 8 | 1,5m | Piel | Lesión piel | EH, PG, TP, PP | Esc. | Neg | HiperQ, edema dermis papilar, infiltrado linfocítico perivascular, dilatación vascular | Edema deltoides derecho |
| 5 | V | 12 | 24m | Piel | Debilidad | EH, PG, RM, CC, | Esc. y pelv. | – | Realizada en otro centro (no disponible) | Atrofia muscular proximal EESS y EEII |
AC: anticuerpos; ANA: anticuerpos antinucleares; CC: calcinosis cutis, ED: edad al diagnóstico; EH: eritema heliotropo; EEII: extremidades inferiores; Esc: escapular; EESS: extremidades superiores; FS: fotosensibilidad; HiperQ: hiperqueratosis; IFD: inmunofluorescencia directa; Q: queratinocitos; M: mujer; m: meses; Neg: negativo; paraQ: paraqueratosis; Pelv: pelviana; PG: pápulas de Gottron; PP: placas psoriasiformes; RM: rash malar; sem: semanas; Sex: sexo; S. consulta: síntoma de consulta; T. Dx: tiempo hasta diagnóstico; TP: telangiectasias periungueales; V: varón.
Los 5 casos presentaron debilidad muscular proximal, con elevación de una o más de las enzimas musculares (GOT, GPT, CK y aldolasa) y RMM en las extremidades superiores e inferiores con signos de miositis (fig. 1). En el electromiograma realizado en 4 pacientes se observó patrón miogénico en el bíceps y/o el cuádriceps. Dos pacientes mostraron ANA positivos a títulos bajos (1/160). En ningún caso se realizó biopsia muscular y en todos se realizó biopsia cutánea (tabla 1).
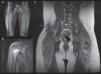
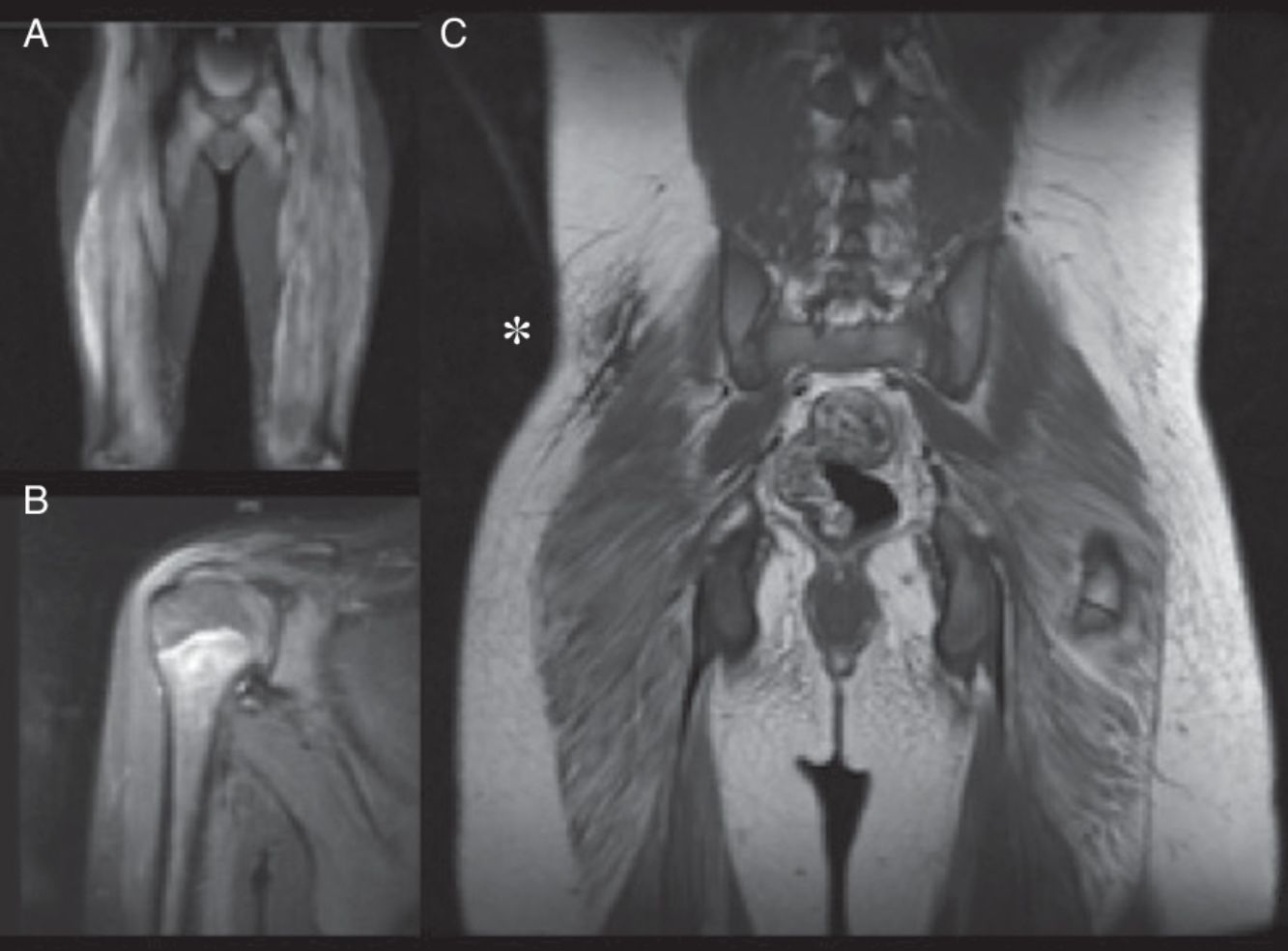
RMM de nuestros pacientes. A. Paciente 1. RMM-CE. Aumento de intensidad en secuencia STIR en región glútea y vasto lateral, indicativo de edema muscular, signo de inflamación muscular, que en el contexto del paciente confirma la miopatía. B. Paciente 4. RMM-hombro. Aumento de intensidad de la señal de deltoides derecho y fascia muscular, asociada a mínima cantidad de líquido en bursa subacromial. C. Paciente 5. RMM-CE tras instauración de tratamiento. Nótese la placa de calcinosis cutis en la región lumbar baja derecha (*) visualizada como una placa hipointensa.
En cuanto al tratamiento inicial 3 pacientes recibieron corticoides sistémicos orales a dosis de 1mg/kg/día o endovenosos en 2 pulsos de 500mg, asociado a metotrexato oral 15mg semanales e hidroxicloroquina 200mg/día. Un paciente recibió tratamiento con prednisona oral 1mg/kg/día asociada a ciclosporina y 6 bolus de inmunoglobulinas endovenosas (IGEV), mientras otro con afectación muscular leve fue tratado con 15mg de metotrexato oral y 200mg de hidroxicloroquina asociado con corticoides y tacrolimus tópicos sin corticoides sistémicos. Cuatro pacientes han recidivado a lo largo del periodo de seguimiento, recibiendo diferentes pautas terapéuticas (tabla 2). Actualmente 4 pacientes se encuentran asintomáticos, 2 de ellos sin tratamiento, uno con metotrexato subcutáneo 15mg/semana e hidroxicloroquina 200mg/día y otro con 200mg de hidroxicloroquina/día en monoterapia (tabla 3). Ningún caso ha presentado complicaciones graves ni afectación visceral, y solo uno ha desarrollado calcinosis cutánea en forma de placa única en la región lumbar a los 3 años del diagnóstico.
Tratamiento inicial
| Caso | CORTI | MTX | HCLQ | TAC | IGEV | CYA | N.° REC/TTO | TS (años) |
|---|---|---|---|---|---|---|---|---|
| 1 | 2 pulsos mPDN | 15mg | 200mg | – | – | – | 1/PDN, IGEV, MTX | 3 |
| 2 | PDN oral | − | − | – | 6 bolus | sí | 2/deflazacort | 9 |
| 3 | PDN oral | 15mg | 200mg | – | – | – | 1/tacrolimus | 11 |
| 4 | Tópico | 15mg | 200mg | Tópico | – | – | 0 | 5 |
| 5 | PDN oral | 15mg | 200mg | – | 1 bolus | – | 1/PDN, MTX, HCLQ, IGEV | 6 |
CORTI: corticoides; CYA: ciclosporina; HCLQ: hidroxicloroquina; IGEV: inmunoglobulinas endovenosas; mPDN: metilprednisona; MTX: metotrexato; N.° REC/TTO: número de recaídas/tratamiento; PDN: prednisona; TAC: tacrolimus; TS: tiempo de seguimiento.
Tratamiento de mantenimiento
| Caso | CORTI | MTX | HCLQ | TAC | IGEV | CYA | Situación actual |
|---|---|---|---|---|---|---|---|
| 1 | PDN 30mg 5 meses | 15mg | 200mg | – | 6 bolus | – | En tratamiento |
| 2 | – | − | − | Oral | – | Sí | Sin tratamiento |
| 3 | – | P. Desc | 200mg | – | – | – | Estable con tratamiento |
| 4 | – | P. Desc | 200mg | Tópico | – | – | Sin tratamiento |
| 5 | – | 20mg | 200mg | – | 7 bolus | – | Estable con tratamiento |
CORTI: corticoides; CYA: ciclosporina; HCLQ: hidroxicloroquina; IGEV: inmunoglobulinas endovenosas; MTX: metotrexato, P. Desc: pauta descendente; PDN: prednisona; TAC: tacrolimus.
Se presentan 5 pacientes afectos de DMJ con afectación cutánea y muscular sin afectación visceral. Observamos una mayor prevalencia de la enfermedad en niños que en niñas (4/1), a diferencia de otras series más largas con mayor proporción en niñas1,2,7,8. La edad media al diagnóstico fue de 10,4 años y el tiempo medio hasta el diagnóstico de 11,25 meses, hallazgos similares a los descritos en la literatura2,7,8, evidenciando que el retraso diagnóstico es frecuente en esta enfermedad.
El diagnóstico de dermatomiositis se realizó en nuestros 5 pacientes por una clínica muscular y/o cutánea sugestiva, una elevación de una o varias enzimas musculares, un electromiograma con patrón miógeno y una RMM patológica, sin precisar la biopsia muscular en ningún caso. La presencia de edema, objetivado por la RMM en las secuencias T1 y STIR ha sido descrito como un hallazgo no patognomónico, pero específico para la valoración de las miopatías inflamatorias idiopáticas y la DMJ. Barsotti et al. definen el edema muscular como un signo sensible y específico del 92,3% y el 83,3% respectivamente para el diagnóstico de las miopatías inflamatorias9. Además, el grado de edema medido a través de la RMM se correlaciona con el grado de actividad de la enfermedad3,5,9, siendo la región anatómica más rentable a estudiar la pelvis, seguida por los glúteos, el vasto medial y lateral del cuádriceps y por último los hombros, el tórax y el cuello5. Estas localizaciones pueden afectarse más precozmente pasando desapercibidas clínicamente. Por ello, varios autores3,9 defienden el uso de la RMM de cuerpo entero como la prueba de imagen de elección. Así, la presencia de edema en estos y otros territorios objetivada mediante la RMM de cuerpo entero permite la detección precoz de áreas musculares afectadas, clínicamente asintomáticas, incluso en pacientes sin elevación de las enzimas musculares y/o con biopsia muscular negativa3,5.
Más allá, la biopsia muscular puede presentar falsos negativos debido a la afectación parcheada del músculo, mientras que la RMM permite la valoración de todo el territorio muscular afecto, aumentando la sensibilidad y guiando, en caso necesario, a la biopsia muscular3,9. Además, está técnica de imagen presenta una elevada sensibilidad para la detección de recidivas en pacientes bajo seguimiento clínico, mostrando signos de actividad en pacientes con enzimas musculares normales mediante determinación analítica4.
Por todo ello, consideramos, como otros autores1,3,9,10–12, que el uso de la RMM es una técnica segura, sensible y no invasiva que puede sustituir en la mayoría de los pacientes a la biopsia muscular, estableciéndose como técnica de valor diagnóstico y de seguimiento. De hecho, se ha propuesto esta técnica de imagen como criterio diagnóstico adicional, y ha sido aceptada por diferentes grupos de trabajo para la valoración y seguimiento de miopatías inflamatorias1,3,4,9,12.
Destacamos la excelente evolución de 4 de 5 pacientes que se encuentran asintomáticos y sin secuelas tras un periodo de seguimiento de 4 a 12 años. El quinto paciente fue diagnosticado y tratado inicialmente en otro centro en Ecuador, siendo remitido a nuestro hospital tras 3 años de evolución con una pequeña placa de calcinosis, probablemente como consecuencia de un tratamiento poco intensivo inicial. La calcinosis se ha relacionado con la presencia de una actividad inflamatoria persistente, y muchos autores han confirmado que el tratamiento intensivo y precoz permitiría prevenir las complicaciones de la enfermedad en fases avanzadas7,8,13.
Aunque el pronóstico de la DMJ ha mejorado, sigue siendo una enfermedad que requiere un tratamiento intensivo precoz y un seguimiento a largo plazo, porque presenta un curso impredecible.
ConclusionesHemos presentado 5 pacientes afectos de DMJ con una excelente evolución en 4 de ellos, probablemente debido al tratamiento intensivo precoz, tal y como refieren la mayoría de autores en la literatura1,6,8,11,14. La presencia de calcinosis en un paciente fue debida posiblemente al tratamiento poco intensivo y tardío.
Finalmente, queremos destacar el papel del dermatólogo en el diagnóstico de esta enfermedad15 y el uso de la RMM como técnica complementaria segura, sensible y no invasiva para la detección y seguimiento de la afectación muscular.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.