INTRODUCCION
La fotobiología es el estudio de los efectos que la radiación solar tiene sobre los organismos. El sol es la fuente más importante de radiación electromagnética que se distribuye desde longitudes de onda muy cortas, como los rayos X, a otras largas como la radioondas. Las partes del espectro que más interesan en los estudios de fotobiología son la radiación ultravioleta y la radiación visible. En dermatología, la radiación ultravioleta es la que más importancia tiene.
Es indudable que la fuente óptima para los estudios de fotobiología sería el sol1 pero, como instrumento de trabajo, está sujeta a numerosos condicionantes que dificultan su utilización. En los estudios de fotobiología se han empleado muy diversas fuentes de radiación. Algunas lámparas emiten radiación ultravioleta C (UVC); otras emiten, con diversos espectros, radiación ultravioleta B (UVB) y radiación ultravioleta A (UVA). Por ello, últimamente, se ha llamado la atención sobre la necesidad de utilizar fuentes de luz que representen lo mejor posible la radiación ultravioleta solar o que, al menos, no emitan en longitudes de onda que no existen en la superficie terrestre y que den como resultado trabajos con poco significado desde el punto de vista de la fotobiología humana terrestre1,2.
En cultivo de queratinocitos se ha evaluado el efecto biológico de dos formas de filtrar la luz ultravioleta para producir espectros de luz similares al sol, y hemos encontrado grandes diferencias con pequeñas variaciones en el espectro de irradiación.
MATERIAL Y MÉTODOS
Cultivo de queratinocitos
Los queratinocitos se cultivaron, con pequeñas modificaciones, tal como se ha descrito previamente3,4. La piel, obtenida de cirugía cosmética o reductora, se incubó en una solución de dispasa (Boehringer Mannheim) a 1,2 U/ml durante 16 h a 4 °C. La epidermis se separó mecánicamente de la dermis y se introdujo en tripsina al 0,05 % con ácido etilendiaminotetraacético (EDTA) 0,02 % (BioWittaker) durante 25 min. La suspensión obtenida se filtró y centrifugó. El sedimento se resuspendió en 75 % Dulbeccos Modified Eagles Medium (DMEM, GIBCO Invitrogen Corporation) 25 % HAM'S F12 (GIBCO Invitrogen Corporation) complementado con 10 % de suero bovino fetal, factor de crecimiento epidérmico a 10 ng/ml (Promega), hidrocortisona soluble a 0,5 mg/ml (Sigma), apotransferrina humana a 5 mg/ml (Sigma), insulina bovina a 5 mg/ml (GIBCO Invitrogen Corporation) y toxina colérica a 10 ng/ml (Sigma) y se repartió en placas de Petri de plástico de 100 mm (Costar) en una cantidad entre 40.000-50.000 cél./ml, donde previamente se distribuyen fibroblastos 3T3NIH irradiados para eliminar su capacidad proliferativa. En este medio, que se reemplazaba 3 días a la semana, las células permanecían hasta alcanzar la confluencia; después eran despegadas de la placa con tripsina al 0,05 % con EDTA al 0,02 % y se repartían en placas sin 3T3 y medio Defined Keratinocyte Serum Free Medium (DKSFM, GIBCO Invitrogen Corporation), que era reemplazado 3 días por semana. Todos los experimentos se realizaron con células entre 2 y 5 pases.
Fuente de luz
Se utilizó una lámpara de Xenon de 1.000 W con filtros dicroicos UVA/UVB, que reflejan longitudes de onda de 280 a 400 nm y, por lo tanto, eliminan la mayor parte de las longitudes de onda de radiación visible e infrarroja (Simulador Solar Ultravioleta 81290, Oriel).
Filtros
Se utilizaron dos tipos de filtros que, según los fabricantes, imitan el espectro solar:
Filtros atmosféricos AM0 y AM1D (Oriel). Cumplen el estándar de la American Society of Testing and Materials (ASTM) E927 para el AM0 y el de la Commission Electrotechnique Internationale (CIE) (publicación 85, tabla 2) para el AM1D. Este conjunto de filtros simula la radiación solar en todo el espectro, desde ultravioleta hasta infrarrojo cuando nos situamos a nivel de la superficie del mar y el sol está situado en el cenit. No tiene en cuenta la luz dispersa.
Filtro 81017 (Oriel). Cumple el estándar de la Deutsches Institut für Normung e.V. (DIN) 67501. Simula la radiación solar sólo en el espectro ultravioleta, sin modificar la emisión de luz visible o longitudes de onda más largas.
Espectrorradiómetro
Para evaluar el espectro y la dosis de irradiación se utilizó un espectrorradiómetro Sola-Scope que permite medir en el intervalo de 230 a 470 nm (Solatell). Tiene una resolución espectral de 0,5 nm y una sensibilidad del orden de 10-9 W/(cm2 · nm). Éste se ha calibrado con un patrón estándar del UKL (United Kingdom Laboratory) que está aceptado como patrón de emisión por la Asociación Europea de Entidades de Normalización, a la que pertenece AENOR. La calibración se llevó a cabo cumpliendo las normas de calidad ISO 9002.
Radiómetro
Las medidas puntuales de dosis en cada experimento se realizaron con un radiómetro calibrable IL-1700 (International Light), en el que se introdujeron los factores de corrección obtenidos en la espectrorradiometría. Se utilizaron los fotodetectores, SED240/UVB-1/TD para UVB y el SED033/UVA/TD para UVA.
Condiciones de irradiación
Las células cultivadas en placas de 35 mm de diámetro se extrajeron del incubador. Se eliminó el medio para evitar la presencia de sustancias que pudieran absorber la radiación y se sustituyó por una mínima cantidad de amortiguador (buffer) fosfato salino (PBS) a 4 °C. Se dispusieron sobre una placa de hielo a 7 cm de la fuente de irradiación. La tapa que cubría la zona de cultivo se retiró antes de la irradiación. Después de la radiación, el PBS fue retirado y sustituido, de nuevo, por medio DKSFM.
Ciclo celular
Se realizó como se ha descrito previamente5, utilizando yoduro de propidio. El yoduro de propidio es una molécula con fluorescencia roja que se une al ADN celular. Esta actividad permite identificar las células en fases SubG0, G0/G1, S y G2/M según la intensidad de fluorescencia (mayor en G2 y menor en SubG0). Para realizarlo se utilizaron queratinocitos cultivados en medio sin suero. Tras irradiar las células con distintas dosis de ultravioleta se mantuvieron durante 24 o 48 h en el incubador. El sobrenadante se recogió para asegurarse de que se contaban todas las células apoptóticas, incluidas las que ya se habían despegado y estaban en suspensión en el medio; el resto se despegaron con tripsina/EDTA y se lavaron con PBS y se fijaron con etanol al 70 % diluido en 10 % PBS 4 h a 4 °C. Para eliminar totalmente el etanol se lavaron en PBS a 4 °C y se centrifugaron 2 veces. Las células se resuspendieron en 300 μl de PBS, yoduro de propidio (20 μg/ml), tritón X-100 al 0,1 % y RNAsa (0,2 mg/ml). Tras incubar 15 min a temperatura ambiente en esta solución se analizaban las células. El etanol, además de fijar las células, las permeabiliza junto con el tritón X-100, lo que permite el paso del yoduro de propidio al interior celular. La fluorescencia se cuantificó pasando las células por un citómetro de flujo FACScan© (Becton Dickinson Labware) con el programa CellQuest.
Visualización
Se realizaron fotografías de los cultivos a las 6, 24 y 48 h después de la irradiación. Se utilizó una cámara Nikon Coolpix 950 sobre un microscopio invertido Nikon Eclipse TS100 y objetivo ×20. Las imágenes se procesaron en Photoshop.
RESULTADOS
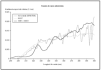
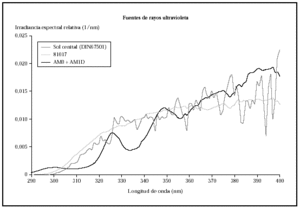
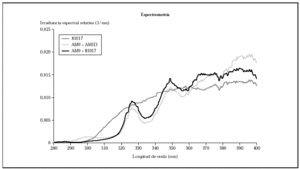
Los análisis de espectrorradiometría mostraron perfiles similares, pero que se diferenciaban claramente en el espectro de emisión y en la distribución de la energía (fig. 1). La lámpara, con los filtros AM0 + AM1D emitía un 4,1 % de la energía en el rango UVB (280-320 nm), mientras que con el filtro 81017 la lámpara emitía un 7,5 % de la energía en este rango.
Fig. 1.--Comparación de la irradiancia espectral relativa de sol cenital, la radiación obtenida con el conjunto de filtros AM0 + AM1D y la obtenida con el 81017.
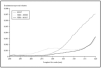
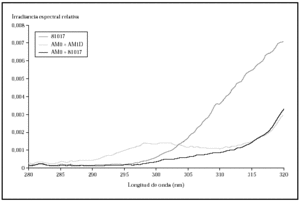
Al comparar las curvas espectrales de ambos filtros con la de la luz solar según el DIN 67501 se observaron diferencias tanto en la zona de ultravioleta A como B (fig. 1), aunque ambas curvas seguían el patrón de luz solar cenital. En la gráfica destaca la mayor energía en la zona de UVB corta que emitía la lámpara equipada con los filtros AM0 + AM1D. En concreto, en el rango 280-300 nm, con el conjunto de filtros AM0 + AM1D, se disponía de un 1,3 % de la energía de la lámpara, mientras que con el 81017 sólo había un 0,4 % de la energía (fig. 2).
Fig. 2.--Comparación de la irradiancia espectral relativa en el área de ultravioleta B de las radiaciones obtenidas con los filtros AM0 + AM1D, 81017 y AM0 + 81017.
Para evaluar el efecto biológico de cada una de estas condiciones experimentales se irradiaron queratinocitos a distintas dosis con los dos tipos de filtros. Se realizaron estudios de ciclo celular y se tomaron fotografías de los cultivos.
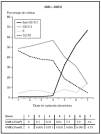
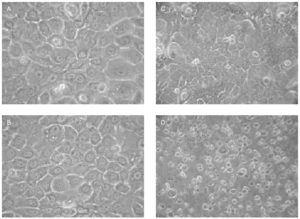
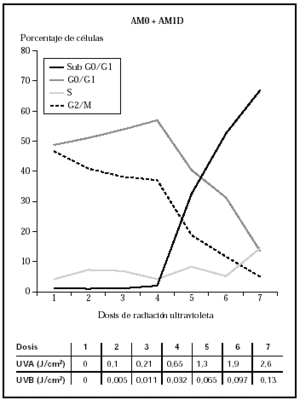
Cuando se irradiaron los queratinocitos con AM0 + AM1D, se obtuvieron mortalidades significativas con dosis conjuntas de 0,065 J/cm2 de UVB y 1,3 J/cm2 de UVA (fig. 3). Estos datos visuales se correlacionan con la presencia de daño celular medidas con el estudio de ciclo celular (fig. 4). En él se observa cómo al aumentar la dosis de radiación ultravioleta hasta 0,032 J/cm2 de UVB y 0,65 J/cm2 de UVA disminuía el número de células en G2/M (células en división) y cómo estas células se unían al grupo de células en fase G0/G1 (células en reposo), que aumentaban en número. Sin embargo, al seguir incrementando la dosis, las células disminuyeron en todos los grupos y aumentaron las células en grupo Sub G0/G1, que podrían identificarse como células apoptóticas y necróticas.
Fig. 3.--Fotografías de queratinocitos en cultivo 48 h después de irradiarse con distintas dosis de radiación ultravioleta usando el conjunto de filtros AM0 + AM1D. A: no irradiadas. B: UVA 0,21 J/cm2 + UVB 0,011 J/cm2. C: UVA 0,65 J/cm2 + UVB 0,032 J/cm2. D: UVA 1,3 J/cm2 + UVB 0,065 J/cm2.
Fig. 4.--Influencia sobre el ciclo celular de distintas dosis de radiación ultravioleta usando los filtros AM0 + AM1D.
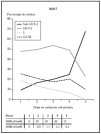
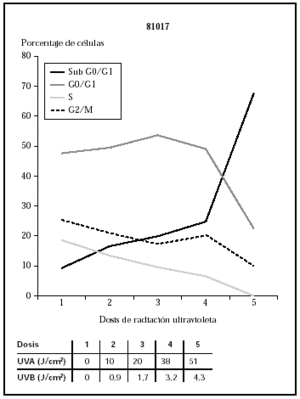
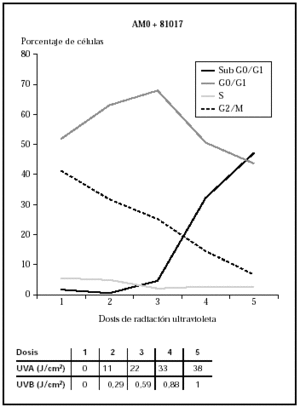
Cuando se utilizó el filtro 81017, se observa cómo las células morían con dosis de 3,2 J/cm2 de UVB y 38 J/cm2 de UVA (datos no mostrados) que se correlacionaban con los datos de ciclo celular (fig. 5).
Fig. 5.--Influencia sobre el ciclo celular de distintas dosis de radiación ultravioleta usando el filtro 81017.
Ante estos resultados, y para evaluar la influencia de la radiación UVB, se diseñó un experimento utilizando los filtros AM0 + 81017. Esta combinación obtuvo un perfil de espectrorradiometría en el que se perdía la banda de 280 a 300 nm que se producía con el AM0 + AM1D, gracias al uso del 81017 (fig. 2) y daba un perfil en UVA similar a la combinación AM0 + AM1D (fig. 6). La cantidad de energía en el rango 280-300 nm era del 0,5 % y la energía total en el rango UVB era del 2,5 %. Al realizar el ciclo celular, se observó que las células sufrían daño con dosis de 0,88 J/cm2 de UVB y 33 J/cm2 de UVA (datos no mostrados) que se correlacionaban con el ciclo celular (fig. 7).
Fig. 6.--Comparación de la irradiancia espectral relativa de las radiaciones obtenidas con el conjunto de filtros AM0 + AM1D, 81017 y AM0 + 81017.
Fig. 7.--Influencia sobre el ciclo celular de distintas dosis de radiación ultravioleta usando los filtros AM0 + 81017.
DISCUSION
A la hora de realizar estudios de fotobiología es importante utilizar fuentes de iluminación que imiten en lo posible la radiación solar. Es evidente que un estudio que demuestre un efecto biológico de la radiación UVC, aunque sea científicamente interesante, no tendría relevancia fisiológica puesto que esta radiación nunca alcanza la superficie terrestre6,7. En este sentido, utilizar en los estudios de fotobiología radiaciones no fisiológicas, tiene poco sentido si se busca determinar efectos biológicos relevantes1. En dermatología, y en concreto en fotobiología clínica, se utilizan fuentes de luz diversas para estudiar fotosensibilizaciones o erupciones fotoinducidas8. En investigación básica en dermatología, cada vez se utiliza más a menudo la radiación ultravioleta como reactivo1. Es habitual que sobre la fuente de luz sólo existan unas pequeñas líneas describiendo el nombre de la fuente y si emite UVA o UVB. En pocas ocasiones se describe, además, la longitud de onda en la que se encuentra el pico máximo de emisión. Sin embargo, resulta excepcional la presencia de trabajos que describan claramente la fuente de luz utilizada y su espectro.
Nosotros hemos decidido evaluar una fuente de luz «solar», que se consigue usando un arco de xenón y diversos filtros que logran imitar el espectro de la radiación solar. Nuestro estudio ha mostrado cómo distintos sistemas de simulación solar tienen distintos efectos biológicos. El uso de los filtros AM0 + AM1D logra mayor daño celular con menores dosis que el 81017 o que el conjunto de AM0 + 81017. En concreto, los queratinocitos soportan dosis de radiación ultravioleta 30 veces mayores en los experimentos con el filtro 81017 frente al conjunto AM0 + AM1D. Sin embargo, las dosis totales son similares utilizando el 81017 o el conjunto AM0 + 81017.
Estos resultados sugieren que el efecto biológico tan intenso observado se deba a la franja de 280 a 300 nm que deja pasar el conjunto de filtros AM0 + AM1D. Es de destacar que esta franja representa sólo un 1,3 % de la energía que emite la lámpara cuando está filtrada con AM0 + AM1D, y también es llamativo que, en cambio, es el filtro 81017 el que deja pasar proporcionalmente más energía en el rango de UVB.
Aunque en una primera aproximación la radiación UVB pueda considerarse homogénea en cuanto al daño celular, el estudio de los espectros de acción de las distintas moléculas implicadas en la actividad celular muestra que cada longitud de onda tiene una eficacia distinta para producir un daño en ellas. Así, el ADN tiene su máximo en 260 nm, los aminoácidos aromáticos en 280-290 nm, el ácido urocánico en 280 nm y el 7-deshidrocolesterol en 285 nm9. Estos distintos espectros de acción determinan que pequeñas variaciones en la cantidad de energía emitida en el espectro de UVB de banda corta pueden tener un efecto biológico muy distinto. Se asume que la radiación ultravioleta que llega a la superficie terrestre nunca tiene longitudes de onda menores a 290 nm. Esto ha llevado a muchos autores a considerar UVB a la parte del espectro comprendida entre 290 y 3209, aunque clásicamente se considera UVB de 280 a 320 nm.
La comparación entre el 81017 y el conjunto AM0 + 81017 es sugeridor de que el efecto observado se debe más a la radiación UVA que al daño por UVB. Los queratinocitos sufren un daño similar con dosis similares de UVA; sin embargo, las dosis de UVB que recibieron los queratinocitos eran tres veces mayores con el 81017. Estos resultados apoyan la idea de que la radiación UVA también es suficientemente dañina para las células y tiene un papel importante en la inducción de patología cutánea10.
Adicionalmente, hemos podido comprobar un efecto conocido de la luz ultravioleta. El ciclo celular se detiene cuando las células se irradian (disminución del porcentaje de células en el grupo G2/M) y las células entran en reposo (aumento del porcentaje de células en el grupo G0/G1). Esta parada del ciclo celular es debida al aumento de los niveles de p5311.
CONCLUSIONES
Hemos encontrado que es necesario realizar una espectrometría de la fuente de luz y los filtros utilizados en los estudios de fotobiología. Las publicaciones en las que se utilice radiación ultravioleta deben describir claramente estos aspectos y proporcionar un espectro de la radiación utilizada. Pequeñas diferencias en el espectro de radiación o en las curvas de energía pueden suponer grandes diferencias en los efectos biológicos observados.
AGRADECIMIENTOS
Agradecemos a David Baeza y Miguel Ángel García de FUTEC S.L. su colaboración en la espectrorradiometría del simulador solar y a los Dres. Amaro García Díez y Juan Pablo Pivel Ranieri sus críticas al manuscrito. Este trabajo ha sido financiado por Industrial Farmacéutica Cantabria (IFC), dentro del proyecto TQS/2001-0044 adscrito al Departamento de Tecnologías Químicas y Sanitarias del Centro para el Desarrollo Tecnológico Industrial (CDTI) y el Fondo de Investigación Sanitaria (FIS) 01/1304.