Aunque la eficacia del omalizumab en el tratamiento de la urticaria crónica espontánea está demostrada en ensayos clínicos de fase iii, la información disponible sobre la efectividad en la vida real utilizando la puntuación de actividad urticarial semanal (UAS7) es escasa. El objetivo del estudio fue evaluar la respuesta clínica (UAS7≤6) y la respuesta completa (UAS7=0) en las semanas 12 y 24 en una cohorte de la vida real e identificar posibles predictores de respuesta al omalizumab.
MétodosSe llevó a cabo una revisión retrospectiva de los registros clínicos de pacientes consecutivos con urticaria crónica espontánea de moderada a grave (UAS≥16) tratados con omalizumab en el Servicio de Dermatología de un hospital universitario en Barcelona, España, desde febrero de 2014 a septiembre de 2017. Se evaluaron los valores de UAS7 y la evolución siguiendo un protocolo predefinido. El análisis estadístico de los datos se realizó utilizando el paquete estadístico SPSS 18 (SPSS 18 Inc., Chicago, IL, EE. UU.).
ResultadosSe incluyeron en el estudio 48 pacientes, que completaron 24 semanas de seguimiento. Las tasas de respuesta clínica (UAS7<6) y completa (UAS7=0) fueron del 70,8% y del 47,9% a la semana 12 y del 64,6% y del 52,1% a la semana 24.
Los pacientes con urticaria de larga duración (≥18 meses) tuvieron menor probabilidad de lograr una respuesta clínica en la semana 12 (odds ratio: 0,25; intervalo de confianza del 95%: 0,06-0,96). El tratamiento inmunosupresor previo tendía a asociarse con una menor probabilidad de respuesta completa en la semana 12 (odds ratio: 0,27; intervalo de confianza del 95%: 0,07-1,02). El tratamiento con antihistamínicos H1 se asoció con una menor probabilidad de respuesta a la semana 24 (odds ratio: 0,1; intervalo de confianza del 95%: 0,01-0,88).
ConclusionesLa eficiencia y la seguridad del omalizumab en la vida real son similares a la eficacia y la seguridad en los ensayos clínicos. La duración de la enfermedad, la terapia inmunosupresora previa y el requerimiento de tratamiento concomitante con antihistamínicos H1 pueden ayudar a predecir la respuesta al tratamiento con omalizumab.
The efficacy of omalizumab in the treatment of chronic spontaneous urticaria has been demonstrated in phase iii clinical trials, but limited information is available regarding real-life effectiveness using the weekly Urticarial Activity Score (UAS7). The aim of the study was to assess clinical response (UAS7≤6) and complete response (UAS7=0) rates at weeks 12 and 24 in a real-life cohort and to identify possible predictors of response to omalizumab.
MethodsClinical records of consecutive patients with moderate-to-severe chronic spontaneous urticaria (UAS≥16) treated with omalizumab at a university-affiliated reference dermatology department in Barcelona, Spain, from February 2014 to September 2017 were retrospectively reviewed. UAS7 values and patients’ evolution were assessed according to a predefined protocol. Statistical analysis of data was done using SPSS 18 statistical package (SPSS 18 Inc., Chicago, IL, USA) software.
ResultsForty-eight patients were included in the study. All of them completed at least 24-weeks of treatment and follow-up. At week 12, clinical response rates (UAS7<6) were 70.8% and complete response rates (UAS7=0) were 47.9%. At week 24, clinical response rates were 64.6% and complete response rates were 52.1%.
Patientswith long-term urticaria (≥18 months’ duration) were less likely to achieve a clinical response at week 12 (odds ratio: 0.25; 95% confidence interval 0.06-0.96). Previous immunosuppressive treatment tended to be associated with a lower probability of complete response at week 12 (odds ratio: 0.27 95% confidence interval: 0.07-1.02). H1-antihistamine treatment was associated with lower probability of response at week 24 (odds ratio: 0.1 95% 95% confidence interval: 0.01-0.88)
ConclusionsThe effectiveness and safety of omalizumab in real life are similar to efficacy and safety in clinical trials. Duration of disease, previous immunosuppressive therapy and requirement for concomitant H1-antihistamine treatment may be helpful in predicting response to omalizumab treatment.
La urticaria crónica espontánea (UCE) es una enfermedad prevalente caracterizada por la aparición espontánea de habones pruriginosos, angioedema o ambos, que persisten durante un período de tiempo superior a 6 semanas. Este proceso se suele extender durante aproximadamente un año en el 70% de los pacientes, aunque puede persistir más de 5 años en hasta un 15%1, acompañándose del deterioro de la calidad de vida del paciente.
En la actualidad disponemos de 2 fármacos cuyo uso está aprobado en Europa y Estados Unidos para el tratamiento de la UCE: los antihistamínicos H1 no sedantes (anti-H1) y el anticuerpo monoclonal omalizumab. Los anti-H1 son seguros y baratos y en las directrices actuales de Europa y Estados Unidos aparecen recomendados como tratamiento inicial de los pacientes con UCE2,3. Sin embargo, en más del 50% de los pacientes1 no se alcanza un buen control de la enfermedad con las dosis estándar.
El omalizumab, anticuerpo monoclonal humanizado recombinante, ha mostrado tener un nivel de eficacia alto en ensayos clínicos en fase iii, y su uso está aprobado para el tratamiento de UCE moderada-grave resistente a los anti-H1. Sin embargo, la información disponible sobre el uso del omalizumab en la vida real es reducida (a dosis iguales y con los mismos parámetros y criterios de evaluación de la respuesta a los manejados en los ensayos clínicos en fase iii)2,4,5.
La actividad de la enfermedad en el caso de la UCE puede ser evaluada en la práctica real y en los ensayos clínicos mediante la puntuación de actividad urticarial semanal (UAS7), un sencillo sistema de puntuación propuesto en la versión 20176 de las directrices de la EAACI/GA2LEN/ EDF/WAO. A través de él, el paciente cuenta el número diario de habones (rango: 0-ninguno a 3-grave) y cuantifica diariamente la intensidad del picor (rango: 0-ninguno a 3-grave) durante 7 días consecutivos, con una puntuación total máxima de 42. UAS7 nos permite comparar los resultados obtenidos en diferentes estudios y centros, además de ser una herramienta útil tanto en ensayos clínicos como en la práctica clínica diaria7.
Son escasos los estudios que evalúan la respuesta en la vida real del UAS7 con omalizumab a dosis de 300mg/4 semanas, en las semanas 12 y 247–18. Los estudios en el mundo real y los ensayos clínicos aleatorizados han de ser comparados ya que puede haber diferencias entre ambas poblaciones de pacientes; por ejemplo, se excluyeron de los ensayos clínicos los pacientes que presentaban urticaria inducible o pacientes que teniendo UCE se les diagnosticaron comorbilidades graves (historial de cáncer, infestación parasitaria, historial de anafilaxia, embarazo, tratamiento 30 días antes con ciclosporina, etc.)2,4,5.
El objetivo de este estudio fue evaluar la eficacia y seguridad del omalizumab en la vida real y compararlas con la eficacia y seguridad referidas en los ensayos clínicos. También quisimos identificar posibles predictores de respuesta al omalizumab.
MétodosLlevamos a cabo una revisión retrospectiva de todos los pacientes con UCE moderada-grave (UAS≥16) tratados con omalizumab desde febrero del 2014 hasta septiembre del 2017 en el Departamento de Dermatología del Hospital de la Santa Creu i Sant Pau, hospital universitario de referencia (Barcelona, España). La recogida de datos se hizo a partir de los registros médicos y del registro prospectivo iniciado en el 2009, con la aprobación del Comité Ético local (16/049 [OBS]). En el estudio se incluyeron, previa obtención del consentimiento informado, todos aquellos pacientes que empezaron a tomar omalizumab para el tratamiento de la UCE en nuestro centro.
De acuerdo con la ficha técnica del producto, y las directrices Europeas6, en este estudio solo se han incluido aquellos pacientes con UCE que no habían respondido a dosis altas de anti-H1 (hasta 4 veces la dosis autorizada) y que habían recibido la dosis autorizada de omalizumab (300mg/4 semanas) durante al menos 12 semanas. La administración del omalizumab tuvo lugar en las instalaciones del hospital de día y fue llevada a cabo por personal médico y de enfermería experimentado.
Los datos recopilados incluyen: datos demográficos (edad, peso, altura, e índice de masa corporal); duración del la UCE previa al inicio del tratamiento con omalizumab; valores basales, en la semana 12 y en la 24 del UAS7; administración previa o simultánea de inmunosupresores (ciclosporina A, azatioprina, micofenolato mofetil y/o metotrexato) y otros tratamientos (montelukast); efectos adversos (EA); angioedema concomitante; urticaria inducible concomitante; y uso de corticosteroides. Los parámetros analíticos estudiados incluyeron recuentos sanguíneos y de leucocitos, determinaciones estándar de bioquímica sérica, proteína C reactiva sérica, niveles de inmunoglobulina E total y del complemento (C3 y C4), niveles plasmáticos del dímero D, títulos de los anticuerpos antinucleares, y títulos de anticuerpos antitiroideos. La urticaria de larga duración se fijó en los 18 meses tras el análisis estadístico y fue consistente con la mediana de la duración de la enfermedad en una cohorte de Barcelona publicada recientemente19.
Los valores UAS7 de cada paciente se registraron 2 veces al día durante una semana al inicio del estudio, antes de empezar el tratamiento, y previamente a las visitas de las semanas 12 y 24 del tratamiento. De acuerdo con lo publicado en los ensayos clínicos2,4,5, el resultado del tratamiento se definió conforme a los valores UAS7 como «respuesta clínica» (UAS7≤6) y «respuesta completa» (UAS7=0).
Se registraron todos los EA y se clasificaron en leves, moderados y graves. Todas las reacciones cutáneas que tuvieron lugar en el lugar de la administración sin acompañamiento de sintomatología sistémica se consideraron como EA leves; las reacciones anafilácticas o la muerte se valoraron como EA graves, y los restantes EA relacionados con la administración del omalizumab se calificaron como de intensidad moderada.
Análisis estadísticoPara el análisis estadístico de los datos se empleó el paquete estadístico SPSS 18 (SPSS Inc., Chicago, IL, EE. UU.). Para la comparación de las proporciones se utilizó la prueba del Chi-cuadrado con la corrección de Yates. La prueba de Mann-Whitney fue usada para la comparación de las variables paramétricas. El modelo de regresión lineal se empleó para correlacionar los valores de la UAS7 en las semanas 12 y 24 con el índice de masa corporal y la edad. Todas las pruebas fueron de 2 colas y la significación estadística se estableció en un valor p<0,05
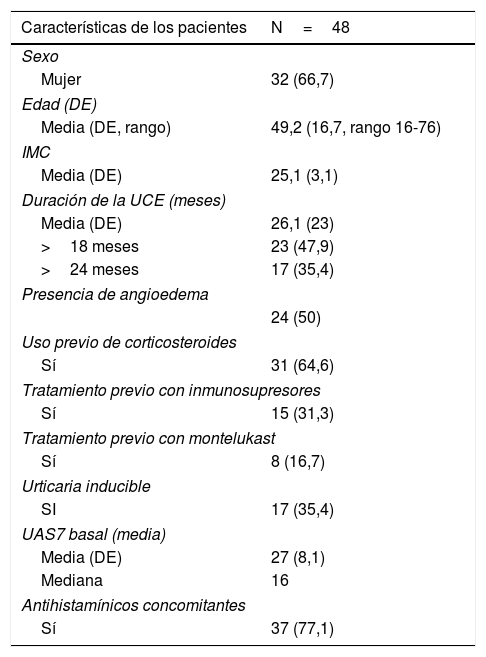
ResultadosPacientes y tratamientosSe incluyeron en el estudio 48 pacientes. Se resumen las características basales de los pacientes en la tabla 1. La duración media de la UCE antes de comenzar el tratamiento con omalizumab fue de 26,1 meses (desviación estándar 23,0; mediana 16, rango 2–84). Veinticuatro pacientes (50%) presentaron angioedema, y 17 (35,4%) urticaria crónica inducible (10 pacientes urticaria por presión retardada, 6 urticaria colinérgica, 4 dermografismo y una urticaria física no filiada).
Características basales de los pacientes
| Características de los pacientes | N=48 |
|---|---|
| Sexo | |
| Mujer | 32 (66,7) |
| Edad (DE) | |
| Media (DE, rango) | 49,2 (16,7, rango 16-76) |
| IMC | |
| Media (DE) | 25,1 (3,1) |
| Duración de la UCE (meses) | |
| Media (DE) | 26,1 (23) |
| >18 meses | 23 (47,9) |
| >24 meses | 17 (35,4) |
| Presencia de angioedema | |
| 24 (50) | |
| Uso previo de corticosteroides | |
| Sí | 31 (64,6) |
| Tratamiento previo con inmunosupresores | |
| Sí | 15 (31,3) |
| Tratamiento previo con montelukast | |
| Sí | 8 (16,7) |
| Urticaria inducible | |
| SI | 17 (35,4) |
| UAS7 basal (media) | |
| Media (DE) | 27 (8,1) |
| Mediana | 16 |
| Antihistamínicos concomitantes | |
| Sí | 37 (77,1) |
DE: desviación estándar; IMC: índice de masa corporal; UAS7: puntuación de actividad urticarial semanal; UCE: urticaria crónica espontánea.
Antes de comenzar la terapia con omalizumab, 31 pacientes (64,6%) fueron tratados con corticosteroides orales, 8 (16,7%) con montelukast y 15 (31,3%) con inmunosupresores. El empleo concomitante de corticosteroides y/o tratamiento inmunosupresor no fue dependiente de la duración de la enfermedad. Los tratamientos inmunosupresores previos incluyeron ciclosporina sola en 9 pacientes, metotrexato solo en un paciente, tratamiento concomitante ciclosporina-metotrexato en 2 pacientes, azatioprina en un paciente y micofenolato mofetilo y ciclosporina no concomitante en un paciente. Todos los tratamientos inmunosupresores se interrumpieron al menos 2 semanas antes de iniciar el tratamiento con omalizumab.
Durante el tratamiento con omalizumab se solicitó a los pacientes que continuaran el tratamiento con anti-H1 si era necesario. Sin embargo, en 11 (22,9%) pacientes este se suspendió debido al buen control de la enfermedad, sin evidencia de recaída tras la suspensión.
EficaciaEn la semana 12, el 70,8% (34/48) de los pacientes mostraron respuesta clínica (UAS7≤6) y el 47,9% (23/48) respuesta completa (UAS7=0). Debido al éxito terapéutico (respuesta completa), 5 pacientes interrumpieron el tratamiento en la semana 12, manteniéndose el estatus de respuesta completa en la semana 24. Dos pacientes dejaron el tratamiento por la falta de respuesta en la semana 12. En 15 pacientes que lograron una respuesta completa en la semana 12 esta se mantuvo en la semana 24, 6 perdieron la respuesta y 2 mantuvieron la respuesta clínica. De 11 pacientes que tuvieron «respuesta clínica» pero no «respuesta completa» en la semana 12, 6 se convirtieron en respondedores completos en la semana 24, 4 perdieron la respuesta y uno mantuvo la respuesta clínica. En 5 pacientes que no alcanzaron respuesta clínica en la semana 12, se aumentó la dosis de omalizumab a 450mg/mes, comenzando en la semana 12, y 3 de ellos alcanzaron la respuesta clínica en la semana 24. De los restantes 9 pacientes sin respuesta en la semana 12, 4 alcanzaron respuesta completa, 2 respuesta clínica y los otros 3 se mantuvieron en el grupo no-respondedor. En la semana 24, el 64,6% de los pacientes (31/48) obtuvieron respuesta clínica (58,3% si excluimos los pacientes a los que se les aumentó la dosis), y el 52,1 (25/48) respuesta completa.
No se asoció ninguna de las variables clínicas ni de los parámetros de laboratorio incluidos en el análisis con la consecución de la respuesta clínica o la respuesta completa en la semana 12 o 24, excepto la duración de la enfermedad, la presencia de angioedema, el tratamiento inmunosupresor previo y el tratamiento anti-H1 concomitante, como se detalla en la tabla 2.
Resultados
| Respuesta clínica (UAS7<6) | Respuesta completa (UAS7=0) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| S12 | S24 | S12 | S24 | |||||||||
| Sí | No | p | Sí | No | p | Sí | No | p | Sí | No | p | |
| Duración | 20,0/13,5/17,9 | 40,9/42/27,7 | 0,015 | |||||||||
| >18 meses | 13(34) | 10(14) | 0,036 | |||||||||
| Angioedema | 13 (65) | 7 (33,3) | 0,063 | |||||||||
| Corticosteroides | ||||||||||||
| Inmunosupresores | 4 (23) | 11 (25) | 0,065 | |||||||||
| Antihistaminas-H1 | 15(30) | 15(18) | 0,028 | 12(20) | 18(21) | 0,065 | ||||||
S12/24: semana 12 y 24; UAS7: puntuación de actividad urticarial semanal; UCE: urticaria crónica espontánea.
La duración media de la enfermedad fue menor en pacientes con respuesta clínica (UAS7≤6) en la semana 12 (13,5 meses vs. 42; p<0,015). Los pacientes con urticaria de larga duración (≥18 meses de duración) fueron menos propensos a lograr la respuesta clínica (UAS7≤6) en la semana 12 (odds ratio [OR]: 0,25; intervalo de confianza del 95% [IC 95%]: 0,06-0,96 para pacientes con una duración del cuadro≥18 meses), pero la duración de la enfermedad no fue un parámetro predictivo de respuesta clínica en el mes 24, ni de respuesta completa ni en la semana 12 o 24.
Un historial de angioedema se asoció con una mayor probabilidad de respuesta completa únicamente en la semana 24 (OR: 3,33; IC 95%: 1,02-10,90). Un tratamiento inmunosupresor previo (ciclosporina en 13 de 15 pacientes) se asoció con una menor probabilidad de lograr una respuesta completa en la semana 12 (OR: 0,27; IC 95%: 0,07-1,02). La proporción de pacientes que siguieron usando anti-H1 fue menor entre aquellos pacientes que alcanzaron respuesta clínica (OR: 0,1; IC 95%: 0,01-0,88) o respuesta completa (OR: 0,25; IC 95%: 0,06-1,14) en la semana 24, si bien no se observó dicha asociación en la semana 12.
Perfil de seguridadNo se registraron EA, y no hubo que interrumpir ningún tratamiento a causa de estos. Se registraron EA leves (eritema en el lugar de administración) en 2 casos y EA moderado (dolor de cabeza y astenia) en un paciente.
DiscusiónEl omalizumab es un anticuerpo monoclonal aprobado para el tratamiento de la UCE moderada-grave. La dosis autorizada conforme a la aprobación de la Agencia Europea de Medicamentos (ficha técnica del producto) es de 300mg/4 semanas y de 150-300mg/4 semanas según el etiquetado de la Administración de Alimentos y Medicamentos (FDA). Los pacientes tratados con 300mg muestran mejores respuestas si los comparamos con los que reciben dosis de 75-150mg, y las dosificaciones más altas se asocian con un mejor control del angioedema5.
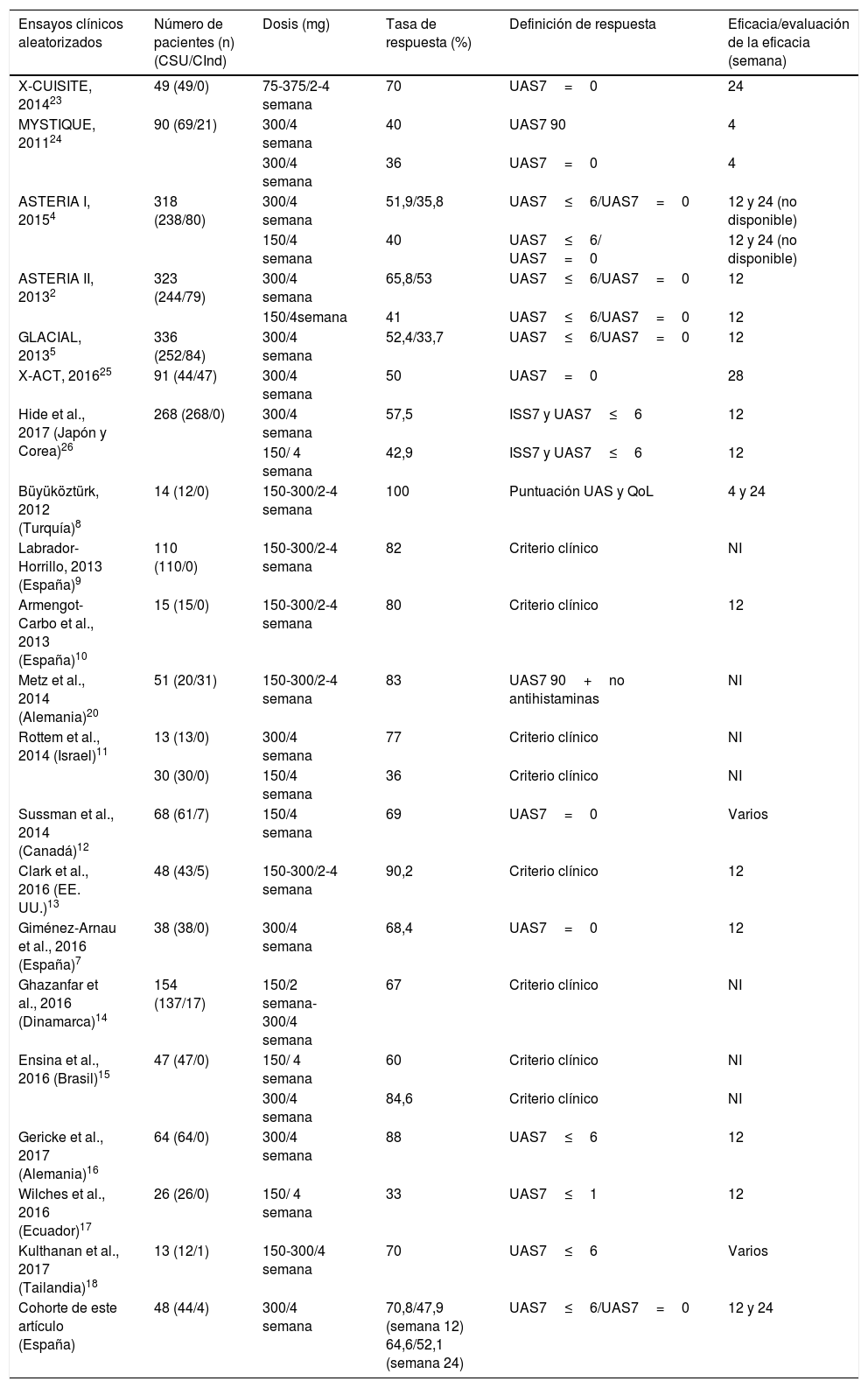
Los estudios en la vida real publicados previamente muestran una heterogeneidad muy marcada cuando se compara con el porcentaje de respondedores al omalizumab. En los ensayos clínicos se observan diferencias en la dosificación, definición de respuesta y punto temporal de evaluación de resultados, como se muestra en la tabla 3. En muchos estudios en la vida real se define respuesta al tratamiento como mejoría clínica, criterio subjetivo que hace difíciles las comparaciones. Metz et al.20 fueron los primeros en utilizar UAS7 en la práctica clínica en la vida real, siendo empleado a continuación por otros autores8–11,13–15,17,20 con clasificación UAS7=0 (respuesta completa) o UAS7≤6 (respuesta). Estamos de acuerdo con la recomendación de las directrices EAACI/GA2LEN/EDF/WAO para la urticaria de que el UAS7 debe ser el método estándar de medida y la segmentación UAS7=0/UAS7≤6 el criterio de eficacia, tal y como sucede en los ensayos clínicos.
Ensayos clínicos y estudios en la vida real con omalizumab
| Ensayos clínicos aleatorizados | Número de pacientes (n) (CSU/CInd) | Dosis (mg) | Tasa de respuesta (%) | Definición de respuesta | Eficacia/evaluación de la eficacia (semana) |
|---|---|---|---|---|---|
| X-CUISITE, 201423 | 49 (49/0) | 75-375/2-4 semana | 70 | UAS7=0 | 24 |
| MYSTIQUE, 201124 | 90 (69/21) | 300/4 semana | 40 | UAS7 90 | 4 |
| 300/4 semana | 36 | UAS7=0 | 4 | ||
| ASTERIA I, 20154 | 318 (238/80) | 300/4 semana | 51,9/35,8 | UAS7≤6/UAS7=0 | 12 y 24 (no disponible) |
| 150/4 semana | 40 | UAS7≤6/ UAS7=0 | 12 y 24 (no disponible) | ||
| ASTERIA II, 20132 | 323 (244/79) | 300/4 semana | 65,8/53 | UAS7≤6/UAS7=0 | 12 |
| 150/4semana | 41 | UAS7≤6/UAS7=0 | 12 | ||
| GLACIAL, 20135 | 336 (252/84) | 300/4 semana | 52,4/33,7 | UAS7≤6/UAS7=0 | 12 |
| X-ACT, 201625 | 91 (44/47) | 300/4 semana | 50 | UAS7=0 | 28 |
| Hide et al., 2017 (Japón y Corea)26 | 268 (268/0) | 300/4 semana | 57,5 | ISS7 y UAS7≤6 | 12 |
| 150/ 4 semana | 42,9 | ISS7 y UAS7≤6 | 12 | ||
| Büyüköztürk, 2012 (Turquía)8 | 14 (12/0) | 150-300/2-4 semana | 100 | Puntuación UAS y QoL | 4 y 24 |
| Labrador-Horrillo, 2013 (España)9 | 110 (110/0) | 150-300/2-4 semana | 82 | Criterio clínico | NI |
| Armengot-Carbo et al., 2013 (España)10 | 15 (15/0) | 150-300/2-4 semana | 80 | Criterio clínico | 12 |
| Metz et al., 2014 (Alemania)20 | 51 (20/31) | 150-300/2-4 semana | 83 | UAS7 90+no antihistaminas | NI |
| Rottem et al., 2014 (Israel)11 | 13 (13/0) | 300/4 semana | 77 | Criterio clínico | NI |
| 30 (30/0) | 150/4 semana | 36 | Criterio clínico | NI | |
| Sussman et al., 2014 (Canadá)12 | 68 (61/7) | 150/4 semana | 69 | UAS7=0 | Varios |
| Clark et al., 2016 (EE. UU.)13 | 48 (43/5) | 150-300/2-4 semana | 90,2 | Criterio clínico | 12 |
| Giménez-Arnau et al., 2016 (España)7 | 38 (38/0) | 300/4 semana | 68,4 | UAS7=0 | 12 |
| Ghazanfar et al., 2016 (Dinamarca)14 | 154 (137/17) | 150/2 semana-300/4 semana | 67 | Criterio clínico | NI |
| Ensina et al., 2016 (Brasil)15 | 47 (47/0) | 150/ 4 semana | 60 | Criterio clínico | NI |
| 300/4 semana | 84,6 | Criterio clínico | NI | ||
| Gericke et al., 2017 (Alemania)16 | 64 (64/0) | 300/4 semana | 88 | UAS7≤6 | 12 |
| Wilches et al., 2016 (Ecuador)17 | 26 (26/0) | 150/ 4 semana | 33 | UAS7≤1 | 12 |
| Kulthanan et al., 2017 (Tailandia)18 | 13 (12/1) | 150-300/4 semana | 70 | UAS7≤6 | Varios |
| Cohorte de este artículo (España) | 48 (44/4) | 300/4 semana | 70,8/47,9 (semana 12) 64,6/52,1 (semana 24) | UAS7≤6/UAS7=0 | 12 y 24 |
mg: miligramos; NI: no se indica; UAS7 90: ≥90% reducción del UAS7 con respecto al valor basal; UCE/UCind: urticaria crónica espontánea/urticaria crónica inducida.
Más aún, los puntos temporales de evaluación en los estudios en la vida real no han sido especificados8,9,11,12,14,15,18,20 o han discrepado (i.e. semana 4)8 con respecto a aquellos empleados en los principales ensayos clínicos2,4,5, a saber, semana 12 y semana 24. La respuesta tardía solo puede ser evaluada por los resultados registrados en la semana 24, como sucede en los ensayos clínicos ASTERIA I y GLACIAL4,5,8, y en el estudio en la vida real de Büyüköztürk et al.8. No obstante, en ninguno de dichos estudios se aportó información alguna en términos de respuesta completa o clínica, y Büyüköztürk et al. solo especificaron la reducción absoluta en el UAS7.
Se ha demostrado que la respuesta al tratamiento con omalizumab en los estudios en la vida real son mejores que los ensayos clínicos2,4,5,7–18,20, tal y como se detalla en la tabla 3. En nuestra cohorte, las tasas de respuesta clínica (UAS7≤6) y de respuesta completa (UAS7=0) en la semana 12 también fueron más numerosas que en los ensayos clínicos ASTERIA I y II y el GLACIAL, si bien en los estudios anteriores en la vida real las tasas de «respuesta» fueron más altas que en nuestra cohorte, probablemente debido a la elección del criterio clínico como medida de resultado en vez de la UAS78–10,13,15. No se puede comparar la tasa de respuesta en la semana 24, ya que tanto en GLACIAL como en ASTERIA I solo se incluyen los datos de seguridad y de la Escala de intensidad del picor (Cuestionario Itch Severity, ISS), y en el ASTERIA II no se incorpora una evaluación en la semana 24.
La duración media de la UCE fue mucho mayor en los estudios pivotales, aproximadamente 7 años (rango 6,1-7,4), frente a los aproximadamente 2 años de nuestra serie, lo que podría proporcionar una explicación de las diferencias en la respuesta¸ como lo indican las tasas de respuesta más bajas en la semana 12 observadas en aquellos pacientes de nuestra serie en los que la duración de la sintomatología fue mayor.
No se observan diferencias entre nuestra cohorte y los estudios pivotales, en relación con la edad media, el UAS7 basal, la presencia de angioedema, y el uso previo de corticosteroides. La media del índice de masa corporal de los pacientes de nuestra cohorte fue 25,1 (IC 95%; 24; 2-26), mientras que en GLACIAL y ASTERIA I y II fueron de 29,4 y 29,3, respectivamente. Curto-Barredo et al. 21 identificaron recientemente el índice de masa corporal como un predictor de respuesta parcial a la dosis de 300mg, y de mejor respuesta con dosis más altas. Sin embargo, no encontramos ninguna asociación estadísticamente significativa en nuestra serie.
De acuerdo con Maurer et al.1, la urticaria inducible es un predictor negativo de respuesta, y fue un criterio de exclusión en los ensayos pivotales. Aunque 17 (35,4%) de nuestros pacientes presentaron urticaria inducible en algún momento del curso de su enfermedad, este no fue un factor pronóstico en relación con la respuesta al omalizumab en ningún momento en nuestra cohorte de estudio. A diferencia de los hallazgos realizados por Maurer et al.1, los altos valores basales para el UAS7 no resultaron ser un factor pronóstico negativo con relación a la respuesta al omalizumab.
En nuestra población de estudio, las tasas de respuesta completa aumentaron con el tiempo mientras que las tasas de respuesta clínica descendieron desde la semana 12 a la semana 24. Pacientes con respuesta clínica en la semana 12 perdieron este estatus en la semana 24. Por otro lado, el estatus de respuesta completa tendía a ser constante a lo largo del tiempo; 25 de los 48 pacientes mantuvieron la respuesta completa desde la semana 12 a la 24, incluidos 5 pacientes que interrumpieron tratamiento en la semana 12 por presentar respuesta completa.
La presencia de angioedema se ha asociado también con un descenso en la respuesta terapéutica al omalizaumab1. En nuestra cohorte en la vida real, un historial de angioedema se relacionó con una mayor probabilidad de respuesta completa en la semana 24; no se hallaron asociaciones significativas en otros momentos y con la respuesta clínica. Sin embargo, las limitaciones del UAS7 para evaluar el angioedema pueden estar influyendo en este resultado. Por el contrario, nuestros datos son consistentes con los de Tonacci et al.22, que encontraron que la respuesta clínica al tratamiento con omalizumab en pacientes con UCE es independiente de la gravedad de la enfermedad o de los niveles de inmunoglobulina E al inicio del estudio.
En cuanto al tratamiento previo de la UCE, en los estudios ASTERIA solo se incluyeron como terapia de base las dosis aprobadas de anti-H1, mientras que en el GLACIAL se admitió el empleo de dosis de anti-H1 más altas así como de otros tipos de terapias de base. En un análisis post-hoc no se encontró relación entre la intensidad del tratamiento previo y la respuesta a omalizumab22, lo que coincide con los datos de nuestra cohorte. Por otro lado, la OR para respuesta completa a la semana 12 se aproximó a 4:1 en aquellos pacientes que no habían sido tratados previamente con agentes inmunosupresores. En nuestra población de estudio fue común el tratamiento previo con inmunosupresores (31,3 vs. 9,5% en el estudio GLACIAL). Se ha descrito que pacientes no pretratados con inmunosupresores presentan una mejor respuesta al omalizumab14, lo que es consistente con nuestros resultados.
Las limitaciones de este estudio, si lo comparamos con los estudios pivotales, son la naturaleza observacional del mismo, la falta de un grupo control, las limitaciones de la escala de medición y el pequeño tamaño de la muestra.
En conclusión, esta revisión retrospectiva de una cohorte de 48 pacientes consecutivos tratados en la práctica clínica real con omalizumab 300mg/4 semanas durante al menos 12 semanas muestra, en la semana 12, unas tasas de respuesta numéricamente mejores que los ensayos clínicos aleatorizados2,4,5. En la semana 24, más del 50% de los pacientes tenían una respuesta completa como se define en el UAS7. La UCE de larga duración (≥18 meses) se asoció con una menor probabilidad de responder al omalizumab en diferentes momentos. Se observó una tendencia semejante para los tratamientos inmunosupresores previos. En nuestra cohorte, la seguridad del perfil del omalizumab fue congruente con la de los ensayos clínicos, con unos efectos secundarios mínimos, tolerables e infrecuentes.
Serán necesarios más estudios para confirmar nuestros resultados y su aplicabilidad a otras poblaciones de pacientes.
Conflicto de interesesX. Cubiró y E. Rozas-Muñoz declaran no tener conflictos de intereses. L. Puig, E. Serra-Baldrich y J. Spertino han sido retribuidos como ponentes y han participado en ensayos clínicos patrocinados por Novartis.
Los autores agradecen al Dr. Ignasi Gich Saladich, Departamento de Epidemiología Clínica, Hospital de la Santa Creu i Sant Pau, Barcelona, España, su ayuda en el análisis estadístico, y al Dr. Oriol Yélamos su colaboración en la revisión del manuscrito.