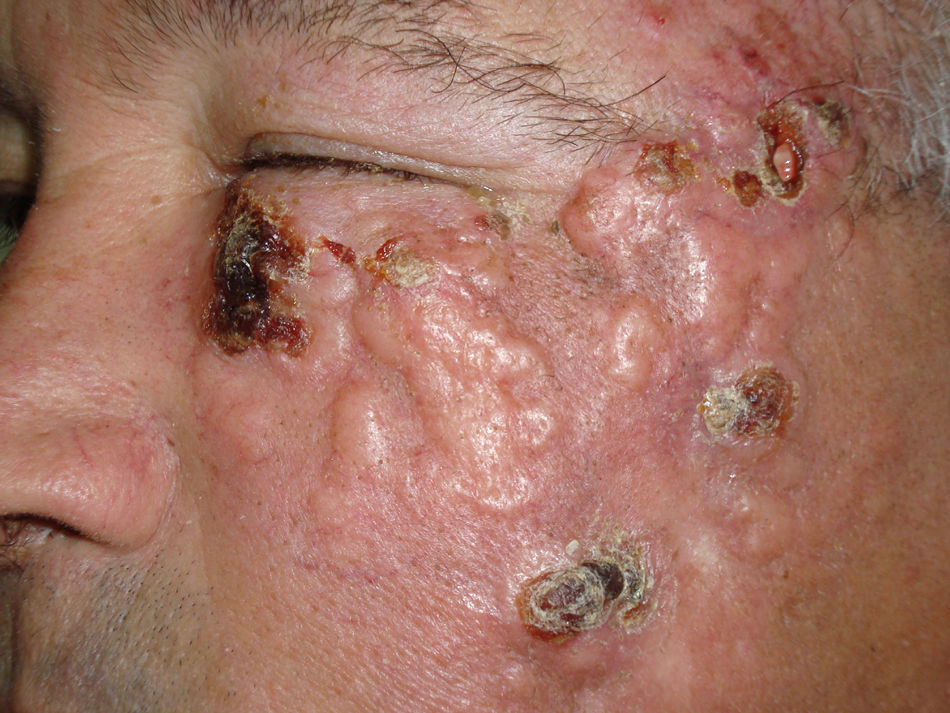
Presentamos el caso de un varón de 66 años que consultó por la aparición en la mejilla izquierda de una lesión de tres semanas de evolución, de curso asintomático y con un crecimiento rápidamente progresivo que impedía la apertura ocular desde la última semana (fig. 1).
El paciente había sido diagnosticado dos años antes en otro centro de un LACG (linfoma anaplásico de célula grande) CD30+ primario sistémico, con lesiones cutáneas en la misma localización que las actuales y afectación ganglionar cervical homolateral en el momento del diagnóstico. Había recibido tratamiento quimioterápico (CHOP: ciclofosfamida,doxorrubicina, vincristina, prednisona) y radioterapia externa, consiguiendo la remisión completa cutánea y ganglionar de la enfermedad.
A la exploración se observaba una placa de 15 x 12cm que afectaba a la hemicara izquierda en las áreas malar, infraocular y preauricular hasta el ángulo mandibular. La lesión tenía bordes mal definidos y estaba formada por la confluencia de múltiples tumores (fig. 1).
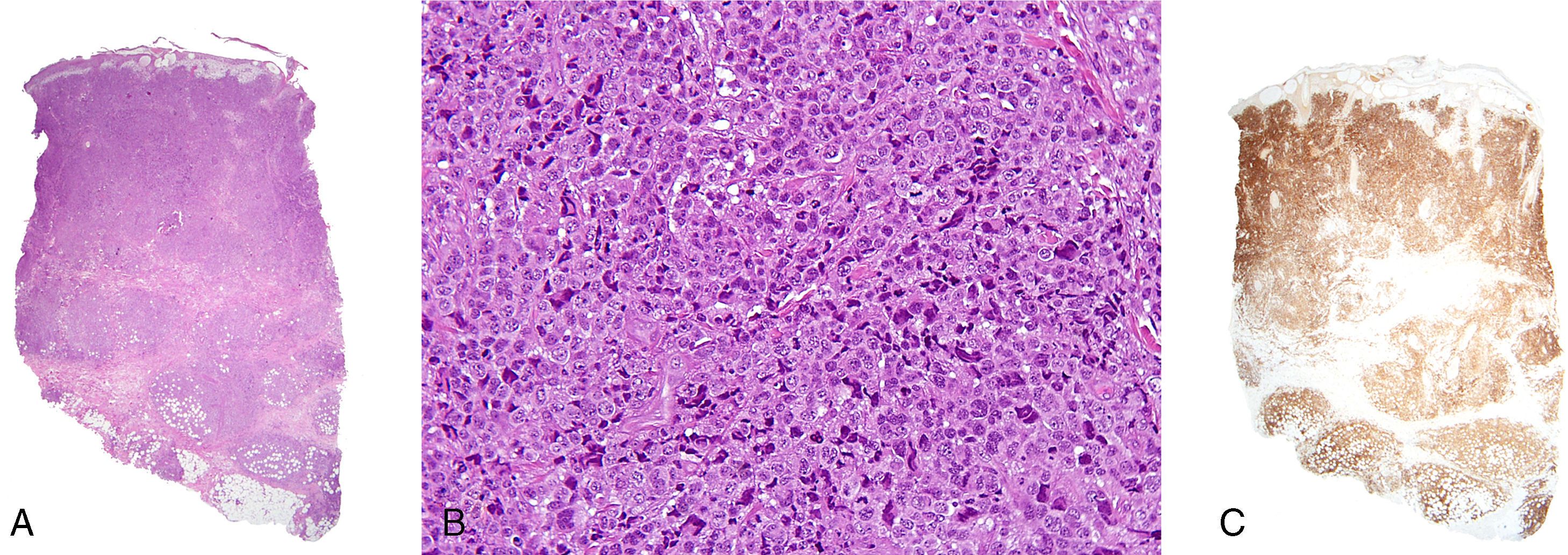
El estudio histológico mostraba una marcada espongiosis epidérmica que en algunos puntos daba lugar a vesículas intraepidérmicas, y un importante edema de la dermis papilar (fig. 2A). El resto de la dermis estaba ocupada por una proliferación linfocitaria densa que alcanzaba el tejido celular subcutáneo (fig. 2A). El infiltrado neoplásico estaba formado por células de gran tamaño, pleomórficas, de citoplasma amplio y claro. Los núcleos eran arriñonados u ovalados, con cromatina irregularmente distribuída y nucleolos prominentes (fig. 2B).
A. Denso infiltrado linfocitario que ocupa totalmente el espesor de la dermis hasta el tejido celular subcutáneo (hematoxilina-eosina, x20). B. Células linfoides de citoplasma amplio con importante pleomorfismo, actividad mitótica y atipia (hematoxilina-eosina, x200). C. Positividad intensa con el marcador CD30 en casi toda la muestra (x20).
El estudio inmunohistoquímico mostraba positividad para CD3 y CD30 (fig. 2C) en un 95% de las células neoplásicas. La expresión de CD5 y CD15 era focal y marcaba un 30 y un 20% de las células respectivamente. El antígeno Ki-67 fue positivo entre un 80 y 90% del infiltrado neoplásico. Asimismo, se encontró un 30% de células CD4+ y un 15% de células CD8+ mientras que el ALK-1 (anaplastic lymphoma kinasa), el CD56 y el EMA (antígeno epitelial de membrana) fueron negativos. El estudio genético del receptor de células T mostró reordenamiento monoclonal.
Se realizó un estudio analítico que incluyó poblaciones linfocitarias y niveles de inmunoglobulinas, una tomografía axial cérvico-toracoabdominopélvica y una biopsia de médula ósea. Todos los resultados fueron normales o negativos.
Con estos datos se estableció el diagnóstico de recidiva cutánea por LACG CD30+ ALK negativo, y se instauró tratamiento quimioterápico. El paciente mostró una remisión parcial después de dos ciclos completos de CHOP. Un mes después presentó una nueva recaída y se inició tratamiento con ESHAP (citarabina, metilprednisolona, cisplatino, etopósido) obteniendo una marcada reducción del tamaño lesional al finalizar el primer ciclo.
Los LACG pueden dividirse en dos grandes grupos1. El primero lo constituyen los LACG primarios cutáneos que, junto a la papulosis linfomatoide, forman parte de los procesos linfo-proliferativos cutáneos primarios CD30 positivos2. El segundo grupo integra a los LACG sistémicos (nodales) que a su vez pueden dividirse en ALK (anaplastic lymphoma kinasa) positivos y ALK negativos.
El diagnóstico diferencial entre las distintas formas de LACG CD30+ es complicado, y resulta fundamental dado su distinto pronóstico y manejo terapéutico. La expresión de la proteína ALK, positiva en el 80% de los LACG sistémicos y negativa en casi el 100% de los LACG cutáneos primarios, puede ser útil para diferenciar el origen cutáneo o nodal3–5. Dicha expresión se debe a translocaciones cromosómicas, habitualmente t(2;5) (p23;q35).
Recientemente se ha descrito en los LACG primarios cutáneos la presencia de translocaciones que afectan al gen MUM1/IRF4. Está pendiente de establecer la especificidad de estas translocaciones y su utilidad como marcador diferencial entre las distintas proliferaciones linfoides CD30 positivas6.
El curso evolutivo también puede servir para orientar el diagnóstico. La supervivencia a los 5 años de los LACG primarios cutáneos es de un 95%, mientras que los LACG primarios sistémicos tienen un peor pronóstico, con supervivencias a los 5 años del 80% en el subgrupo ALK+ y del 30% en los casos ALK negativos3,4,7. Existen series de LACG ALK negativos con afectación simultánea cutánea y ganglionar en el momento del diagnóstico, como sucedía en nuestro caso, cuya supervivencia fue similar a la de los LACG primarios cutáneos3,8. Dado que la frecuencia de afectación cutánea por los LACG sistémicos ALK negativos es rara, se ha sugerido el origen cutáneo con extensión ganglionar precoz como explicación del curso indolente de estos casos7,8.
El tratamiento de elección de los LACG primarios sistémicos, tanto en los casos ALK positivos como negativos, es la poliquimioterapia9, mientras que el tratamiento de los LACG primarios cutáneos incluye opciones menos agresivas como la abstención terapéutica inicial esperando su autoinvolución, el metotrexato a dosis bajas, la radioterapia local o la resección quirúrgica10. En nuestro caso, dado el diagnóstico inicial de LACG primario nodal, se optó por la quimioterapia como tratamiento de su recidiva.
En conclusión, se describe un caso inusual de LACG ALK negativo con afectación simultánea cutánea y ganglionar locorregional en el momento del diagnóstico. Serán necesarios futuros estudios genéticos e inmunohistoquímicos que permitan esclarecer si casos como el presentado, diagnosticados actualmente como LACG sistémicos, son en realidad primarios cutáneos.