Este artículo fue premiado con el premio «Juan de Azúa» de la AEDV.
INTRODUCCION
El melanoma es el tumor cutáneo más importante debido a dos factores: su elevada mortalidad y el aumento de su incidencia. Su frecuencia dentro de las neoplasias cutáneas oscila entre el 1,5 y el 7 %, pero representa el 65 % de las muertes por cáncer de piel, lo que indica su alto potencial de agresividad y capacidad metastásica. Los mecanismos biológicos que subyacen al desarrollo del melanoma están en pleno estudio en la actualidad. Encontrar terapias que puedan modificar la evolución natural del tumor o impedir su diseminación modificarían dramáticamente su pronóstico. Se han utilizado diversas estrategias durante los últimos años. Una herramienta de nueva generación que se está utilizando con gran éxito en investigación y que se quiere aplicar en terapéutica es el ARN de interferencia (ARNi).
Se sabe que hasta un 45 % del genoma humano es remanente de infecciones por retrovirus y transposones. El estudio de los mecanismos que utiliza el genoma para evitar la síntesis de proteínas a partir de estos genes descubrió un nuevo mecanismo: el silenciamiento genómico postranscripcional o silenciamiento del ARN1. Este mecanismo parece muy extendido (hongos, plantas y animales) y muy conservado en la evolución, por lo que ha recibido el nombre de «sistema inmunológico» del genoma.
La técnica se ha revisado recientemente1-3 y brevemente implica la presencia intracelular de ARN pequeño de doble cadena (ARNdc). Este ARNdc es capaz de iniciar la degradación de ARN mensajeros (ARNm) con los que guarda homología. El mecanismo es muy específico y efectivo y no afecta a los sistemas generales de transcripción y traducción del ARN.
Esta técnica, usada por las células para defenderse de la síntesis de genes virales, se ha utilizado para estudiar la función de diversos genes. La síntesis de pequeñas cadenas de ARNdc (ARN de interferencia pequeños, ARNip) y su transfección dentro de las células permiten bloquear de manera específica la síntesis proteica de diversos genes en células eucariotas con una gran especificidad4.
En la patogenia del melanoma están implicadas diversas proteínas celulares. Entre ellas, las tetraspaninas y, sobre todo, CD9, se han implicado con frecuencia en la regulación de la motilidad del melanoma5. Estas proteínas, que tienen cuatro dominios transmembrana, se han implicado en la regulación del desarrollo, proliferación, activación y motilidad celulares y se ha visto que se acoplan a diversas vías de transducción de señales (revisado por Yáñez-Mo et al6 y Tarrant et al7). Las tetraspaninas coprecipitan con diversas proteínas transmembrana y, en particular, con integrinas β18, una de las principales moléculas de adhesión de las células a matriz extracelular con efectos funcionales tanto en adhesión como en motilidad celular.
En este trabajo se ha explorado el efecto de ARNip de tetraspaninas CD9 y CD151 en la motilidad de células de melanoma.
MATERIAL Y MÉTODOS
Células de melanoma
Hemos utilizado la línea A375 de melanoma, proporcionada por Paloma Sánchez Mateos (Hospital Universitario Gregorio Marañón, Madrid) que se ha utilizado previamente9. Las células crecieron en medio RPMI-1640 (Gibco BRL) suplementado con el 10 % de suero fetal bovino y 10 mM HEPES.
Anticuerpos
Los anticuerpos monoclonales utilizados en este estudio se han descrito previamente: el anticuerpo activador de integrinas β1 TS2/1610, el inhibidor de integrinas β1 VJ1/1411 y el anti-CD15112. El anticuerpo anti-CD9 VJ1/10 fue obtenido en nuestro laboratorio13. El anticuerpo monoclonal Ig (IgG1, k) de la línea celular de mieloma P3X63 fue utilizado como control negativo.
Inmunofluorescencia
Se cultivan las células A375 en cubreobjetos de cristal hasta alcanzar confluencia. Se fijan con paraformaldehído al 3,7 % en buffer de fosfato salino (PBS). Se bloquean los sitios de unión inespecíficos con una incubación en TNB (0,1 M Tris-HCl, 0,15 M NaCl, 0,5 % agente bloqueante; Boehringer Mannheim GmbH). Se incuban los cubreobjetos con el anticuerpo primario durante 30 min a 37 °C. Tras lavar con PBS, realizamos una segunda incubación con el anticuerpo secundario anti-ratón marcado con Alexa Fluor® 488 (Molecular Probes). Se evaluaron las muestras con un microscopio Leica con objetivos de inmersión de 60 aumentos. Se fotografiaron las muestras con una cámara CCD de alta capacidad COHU (COHU, Japón) acoplada al microscopio y conectada a una estación de trabajo Leica Q550CW. Se procesaron las imágenes usando el programa Leica Qfish versión 1.01 (Leica Imaging Systems. Ltd., Reino Unido).
Citometría de flujo
Se desprendieron las células con tripsina al 0,05 % con 0,02 % ácido etilendiaminotetraacético (EDTA). Tras lavarlas se resuspendieron en PBS. Se incubaron las células con los anticuerpos correspondientes durante 30 min a 4 °C. Después de lavarlas en PBS se incubaron durante 20 min a 4 °C con el anticuerpo secundario marcado con isotiocianato de fluoresceína (FITC) contra inmunoglobulinas de ratón (DAKOPATTS). Se lavaron las células con PBS y se resuspendieron en PBS con yoduro de propidio a 10 mg/ml y se analizaron en un citómetro de flujo FACScan (Becton Dickinson Labware). Analizamos las células según su tamaño y complejidad, excluyendo las células muertas que presentaban fluorescencia de ioduro de propidio.
Síntesis ARNi
Para reducir de manera selectiva la expresión de las tetraspaninas CD9 y CD151 se realizó un rastreo de diferentes secuencias diana exclusivas de cada una de estas proteínas usando casetes de expresión de ARNi (Ambion). Una vez determinadas las secuencias funcionales, se generaron dúplex de ARN correspondientes a dichas secuencias diana (Eurogentec).
Transfección celular
Los dúplex de ARN de interferencia se transfectaron en la línea celular A375 usando un reactivo especializado denominado oligofectamina (Invitrogen). Brevemente, se dividieron las células el día anterior a la transfección para realizarla a una confluencia celular del 30-50 % y se dejaron crecer en ausencia de antibióticos. Para transfectar, se resuspendió la oligofectamina en medio optimen sin suero ni antibióticos, incubándola a temperatura ambiente 10 min. A continuación, se diluyó el ARNi en este mismo medio y se mezcló con la oligofectamina resuspendida, dejando el ARNi a una concentración final de 200 nM. Se incubó la preparación 20 min a temperatura ambiente y se añadió al cultivo celular. La transfección se realizó durante 4 h a 37 °C y se paró añadiendo suero al medio.
Selección de células transfectadas
Se realizó una selección negativa de las células transfectadas. Para ello, se incubaron bolas magnéticas (Dynabeads) recubiertas con anticuerpos anti-CD9 y/o anti-CD151 con las células que habían sido transfectadas con los ARNi de CD9 y/o CD151, respectivamente. La incubación se realizó en rotación a 4 °C durante 5 min. Se seleccionaron las células que no se unieron a las bolas magnéticas, que correspondían con la población que expresaba menores niveles de tetraspaninas. Estas células fueron plaqueadas para realizar los experimentos funcionales de motilidad.
Modelo de migración celular
Los ensayos de migración se realizaron como se ha descrito previamente14. Brevemente, se cultivaron las células hasta confluencia en placas de 24 pocillos (Costar, EE.UU.). Se cambiaron las células a medio basal con o sin los anticuerpos purificados a 20 mg/ml 30 min antes de provocar la rotura de la monocapa de células. Se arañó la monocapa con un rascador celular y se fotografió la herida en varios tiempos con una cámara Nikon Coolpix 995 (Nikon, EE.UU.) en un microscopio con objetivos invertidos. El área de la herida fue calculado utilizando el programa de análisis Adobe Photoshop 7.0 (Adobe Systems).
RESULTADOS
Expresión de tetraspaninas CD9, CD151 y CD81 en células de melanoma
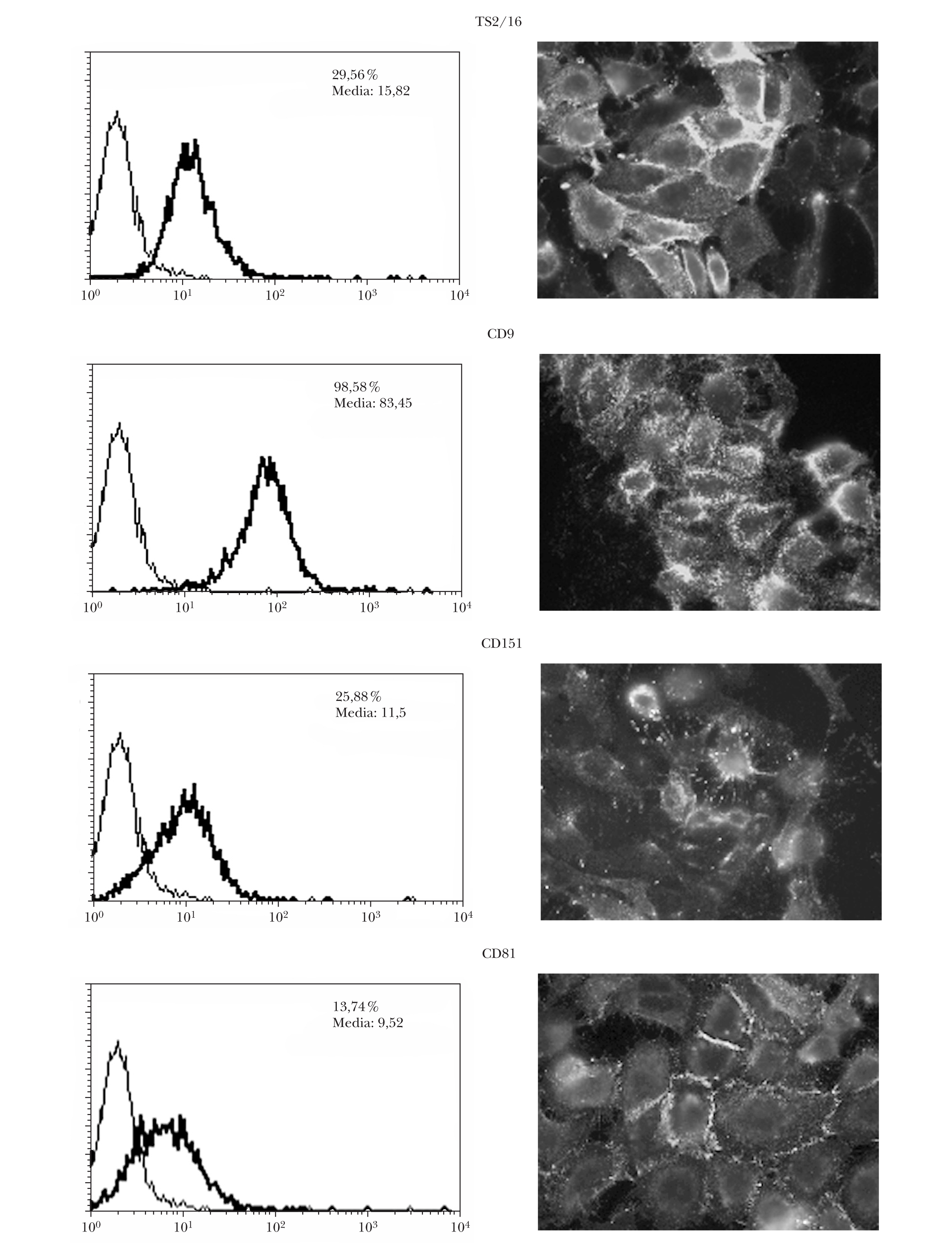
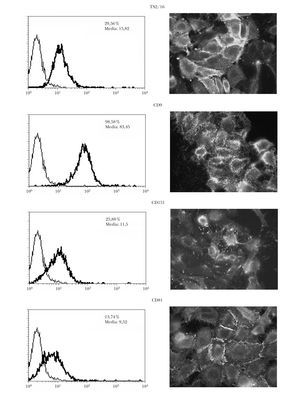
Se comprobó que las células A375 presentaban expresión en membrana de las tetraspaninas CD9, CD151 y CD81 por citometría y por inmunofluorescencia indirecta (fig. 1). La expresión resultó ser predominante en las zonas de interacción intercelular.
Fig. 1.--Expresión basal en membrana de tetraspaninas e integrinas b1 en células de melanoma. La expresión era mayor con integrinas b1 (TS2/16) y con CD9 medida por citometría. El número indica el porcentaje de células positivas y la media de la intensidad de fluorescencia.
Inhibición de CD9 y CD151 con ARNi
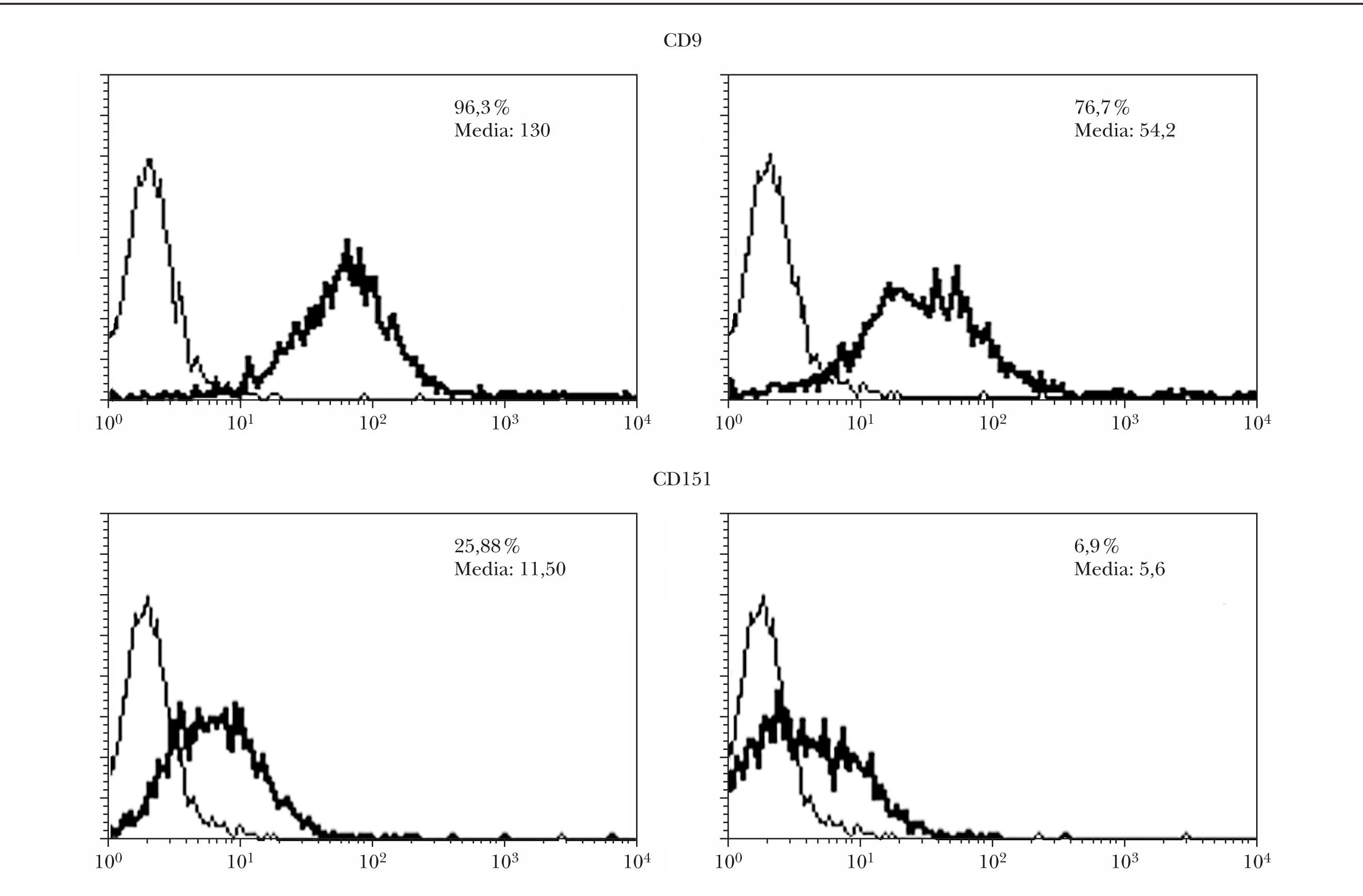
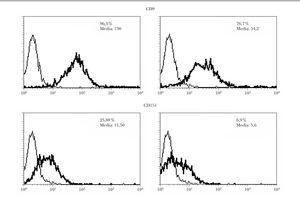
Tras la transfección con ARNi de células de melanoma, se realizó una selección negativa de las células que seguían presentando CD9 en la membrana. El estudio de citometría de flujo demostró una disminución de los niveles de CD9 y CD151 tanto en el porcentaje de células positivas como en la intensidad de la fluorescencia (fig. 2). El descenso fue más llamativo con CD151 que con CD9.
Fig. 2.--Inhibición en la expresión de CD9 y CD151 por ARNip. Se observa una disminución tanto en la intensidad de fluorescencia como en el porcentaje de células positivas evaluado por citometría. Se muestran los perfiles de citometría normales a la izquierda y los de las células transfectadas a la derecha con ARNip de CD9 y de CD151, respectivamente.
Inhibición de la migración de células de melanoma con ARNi
Se evaluó la migración de las células A375 en el modelo de curación de heridas. Tras realizar la herida en la monocapa se fotografió en varios tiempos la migración de las células para reparar la herida. Se utilizaron los tiempos de 0 y 24 h para el análisis.
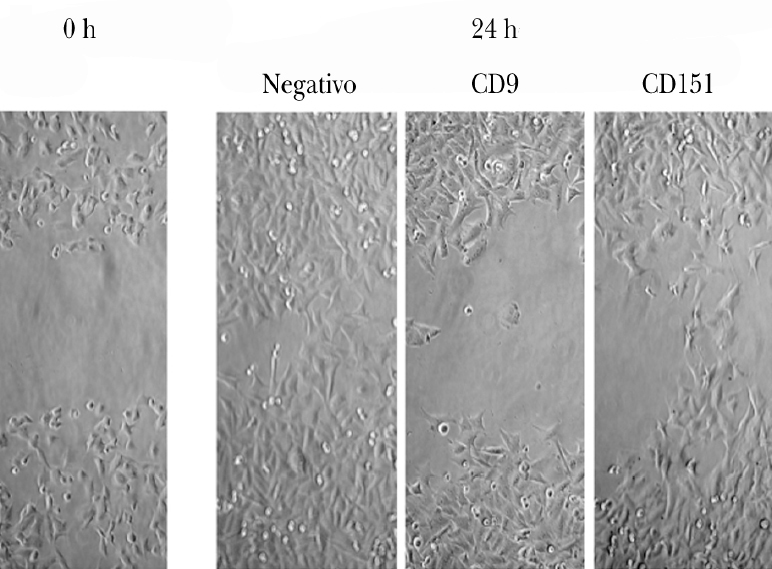
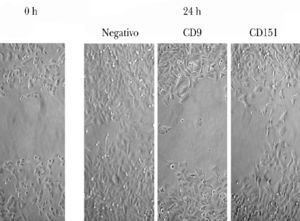
Pudimos observar que las células A375 son capaces de cubrir casi en su totalidad la herida producida en la monocapa celular a las 24 h de la misma (fig. 3). Las células tratadas con ARNip de CD9 mostraron una menor migración que las células tratadas con ARNip de CD151.
Fig. 3.--Inhibición de la migración de células de melanoma tratadas con ARNip. Se observa a la izquierda un ejemplo de herida en la monocapa de células de melanoma. A la derecha se muestra la situación de la monocapa a las 24 h en las células control (sin transfectar), en las células tratadas con ARNip de CD9 y de CD151.
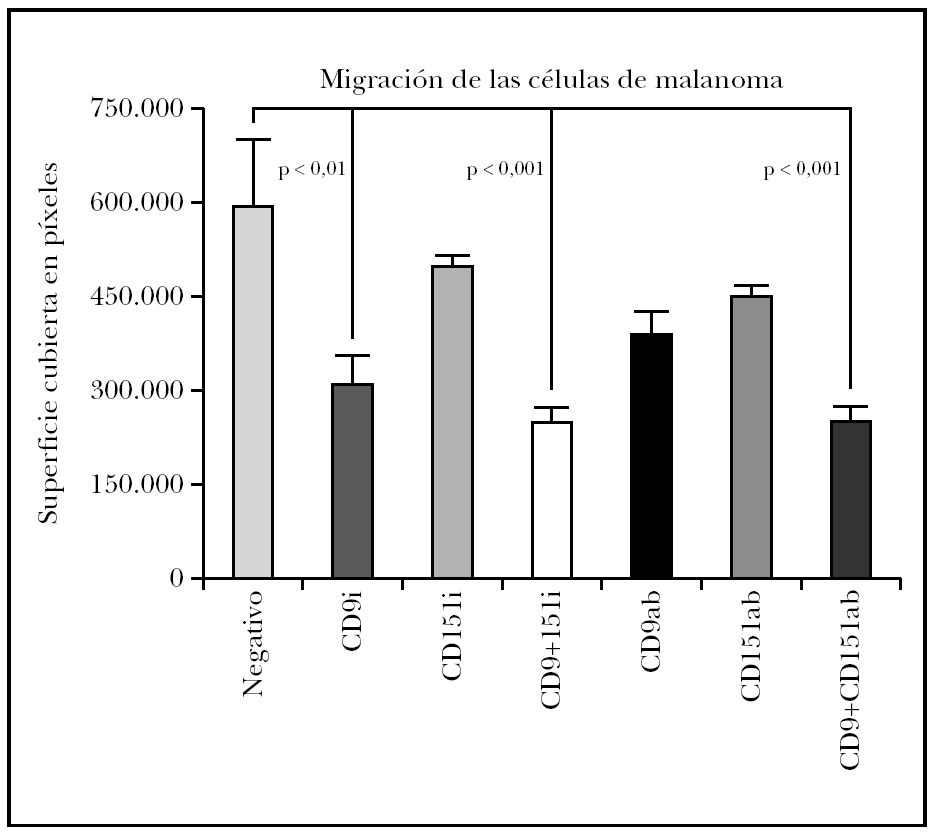
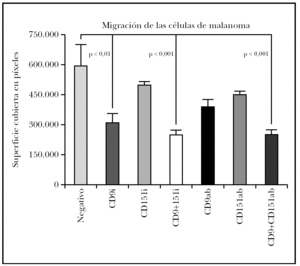
El estudio estadístico mostró diferencias significativas entre el control negativo (sin transfectar) y las células transfectadas con ARNi de CD9 pero no si se transfectaba sólo con ARNi de CD151 (fig. 4). Para determinar si existía un efecto sinérgico de ambas tetraspaninas, se realizó una cotransfección con los ARNip de CD9 y de CD151. Estas células mostraron una inhibición algo mayor que con el uso de CD9 exclusivamente. El uso de anticuerpos monoclonales para modificar la migración mostró una disminución con CD9 y con CD151 que no fueron significativas y que sí alcanzó significación estadística cuando se combinaron ambas.
Fig. 4.--Efecto sobre la migración de células de melanoma tratadas con ARNip. Se muestra el efecto del tratamiento con ARNip de CD9, CD151 o de la transfección con ambos ARNip. También realizamos experimentos comprobando el efecto del uso de anticuerpos anti-CD9, anti-CD151 o el de ambos anticuerpos. Se muestra un experimento realizado por triplicado. La superficie de la herida cubierta por las células se midió en píxeles de fotografía cubierta.
Modulación de la expresión de tetraspaninas e integrinas tras tratamiento con ARNi
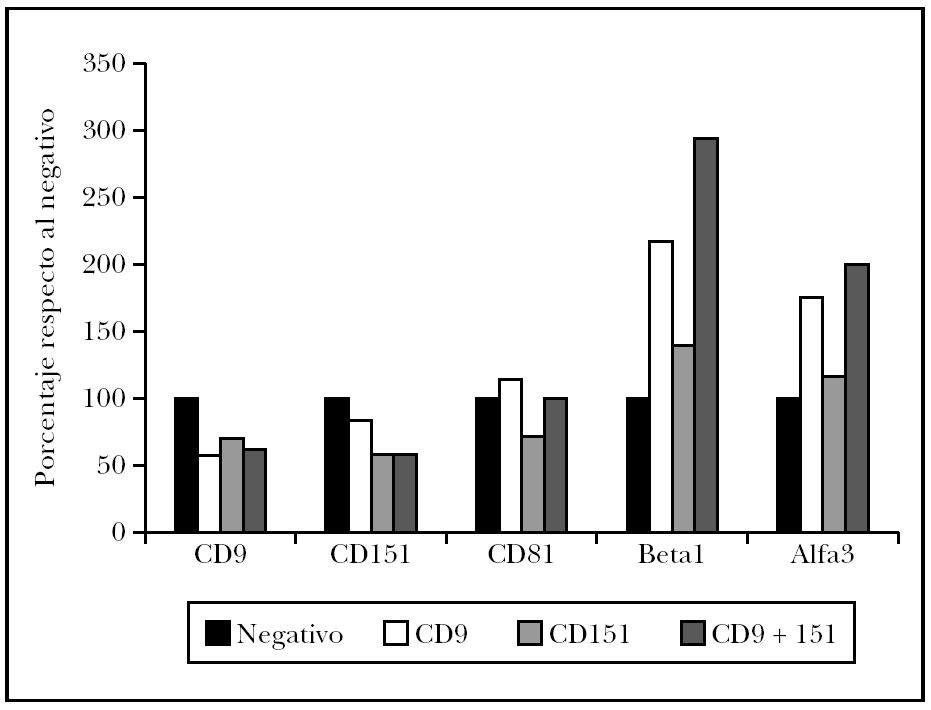
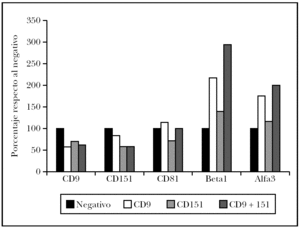
Como es conocida la interrelación de las diversas tetraspaninas entre sí y con integrinas b1, se decidió evaluar su expresión tras el tratamiento con el ARNip (fig. 5). Así se observó que las células tratadas con ARNip de CD9 mostraban una fuerte inhibición de CD9, pero un discreta modulación de CD151 y CD81. Sin embargo, el efecto más llamativo fue un aumento en la expresión de la integrina a3b1. Las células transfectadas con ARNip de CD151 mostraban una modulación más intensa de CD9 y CD81 con descenso de ambas tetraspaninas. Sin embargo, su efecto sobre la integrina a3b1 fue más leve. Finalmente, la doble transfección con ARNip de CD9 y CD151 resultó en datos que confirmaban el doble efecto debido a la bajada de expresión de ambas transfecciones, una gran inhibición de CD9, CD151 y aumento de la integrina a3b1. La expresión de CD81 no se vio afectada.
Fig. 5.--Efecto de la transfección de células de melanoma con ARNi de CD9 y CD151 o una cotransfección con ambos ARNi. Media de la intensidad de fluorescencia de la tinción con cada monoclonal medida mediante citometría de flujo de células A375. Normalizado respecto al control sin transfección en cada anticuerpo monoclonal ensayado. Se muestra la media de dos experimentos.
DISCUSION
Las tetraspaninas se han implicado en la regulación del desarrollo, proliferación, activación y motilidad celulares6 y se ha visto que se acoplan a diversas vías de transducción de señales7.
La utilización de ARNi en el estudio de la actividad funcional de las proteínas celulares es muy reciente. Hasta ahora, se había intentado usar ARN antisentido, pero su aplicación era difícil y daba lugar a resultados confusos. En 1998 se utilizó por primera vez ARNdc15 con un efecto más claro y llamativo. Desde entonces se han multiplicado los trabajos en los que se usa ARNi tanto para estudio de la funcionalidad de diversas proteínas como de su posible papel en terapéutica.
En este trabajo se ha conseguido transfectar células de melanoma con ARNip de las tetraspaninas CD9 y CD151. Además se ha conseguido una inhibición importante de la expresión de membrana de ambas tetraspaninas, lo que no ha sido publicado hasta ahora. El efecto fue más intenso con CD151, cuya expresión basal era más pequeña, y menos intenso con CD9, probablemente por la altísima expresión basal de esta molécula. En este aspecto, aunque se utilizó una selección negativa de células que expresaban tanto CD9 como CD151, la eficacia fue menor con CD9.
El efecto de CD9 en las células de melanoma se ha estudiado en distintas ocasiones y con distintos abordajes5,9.
Parece que el melanoma5, como casi todos los carcinomas, tiene una disminución de CD9, a veces una ausencia de expresión, que podría colaborar en su capacidad metastatizante. Sin embargo, en los diversos trabajos publicados la expresión de CD9 en melanoma ha sido variable5,9, y las células utilizadas en nuestro estudio mostraban una expresión basal alta de CD9.
En una línea de células de melanoma de ratón con gran capacidad metastatizante (BL6) se observó que, aunque expresaban CD9 en la membrana, la transfección con CD9 para producir su sobreexpresión provocaba una disminución en la motilidad16.
Un estudio posterior precisó más el posible papel de CD9 en la migración de las células de melanoma. En células A375, el uso de anticuerpos anti-CD9 (VJ1/10) solo logró una ligera inhibición en la migración de las misma a través de filtros transwell. Sin embargo, si se utilizaba el mismo anticuerpo para interferir la migración a través de endotelio, el efecto conseguido fue de una inhibición importante9. Estos datos sugerían que el papel de esta tetraspanina estaría en las uniones intercelulares heterotípicas (entre A375 y células endoteliales) y que su papel en las uniones a matriz extracelular sería poco importante.
Nuestro trabajo sugiere que, además de un papel directo de la expresión de CD9 en algunas situaciones como la migración transendotelial, su mayor o menor expresión puede estar ligada a modificaciones de otras tetraspaninas y de la integrina a3b1 y que estas otras modificaciones tengan un relevancia alta en la capacidad de migración de las células. La inhibición de la expresión de CD9 con ARNip provoca un aumento de la integrina a3b1 lo que probablemente condicione una menor migración celular al existir mayor adhesión a la matriz extracelular. Es interesante que, aunque la transfección con ARNip de CD151 producía un disminución de la expresión de CD9, no se producía el aumento de integrina a3b1 y tampoco una inhibición significativa de la migración de las células de melanoma.
Para poder explicar estos efectos a priori discordantes, podemos basarnos en distintos niveles de regulación de la expresión proteica. El ARNip de CD9 impide la síntesis de la proteína CD9 al destruir el ARNm de CD9. Sin embargo, la modulación en la expresión de CD9 provocada por la transfección con ARNip de CD151 puede ser a nivel postraduccional, o sea, una vez la proteína está sintetizada, impidiendo que la proteína alcance la membrana o que ésta sea funcional. El distinto mecanismo de regulación provocaría efectos diferentes. Nuestro grupo está actualmente implicado en la aclaración de esta diferencia.
En nuestros experimentos se ha demostrado que las células de melanoma pueden ser tratadas para disminuir su motilidad con ARNi. La utilización de este tipo de tratamientos, eficaces y altamente específicos, pueden ser una herramienta muy importante en el control clínico del melanoma.
AGRADECIMIENTOS
Este trabajo ha sido financiado por el Fondo de Investigación Sanitaria (FIS) 01/1304 y por Industrial Farmacéutica Cantabria (IFC) dentro del proyecto TQS/2001-0044 adscrito al Departamento de Tecnologías Químicas y Sanitarias del Centro para el Desarrollo Tecnológico Industrial (CDTI). OBR tiene una beca de la Red de Cardiovascular del FIS y una beca EU LSHG-CT-2003-502935.