Entre las funciones de la piel está la de constituir una barrera física, química y biológica contra los patógenos. Esta función barrera está englobada dentro del sistema inmunológico. El sistema inmune posee una rama innata, de respuesta rápida y estereotipada, y una rama adaptativa, de mayor latencia y de actuación dirigida.
En la piel, los integrantes del sistema inmune innato son las células hematopoyéticas, como las células pertenecientes al sistema mononuclear-fagocítico o las células NK, los factores solubles como el complemento, las citoquinas, las metaloproteasas o los péptidos antimicrobianos, y por último, las propias células cutáneas1.
El sistema innato no es inespecífico, sus células poseen receptores que reconocen patrones moleculares de patógenos y productos metabólicos resultantes del estrés celular altamente conservados a nivel evolutivo. Estos receptores son los Toll-like receptors (TLR)2, presentes en las membranas celulares, y los Nod-like receptors (NLR) citosólicos3.
Una pieza fundamental de la inmunidad innata, de interés creciente, es el inflamasoma. Se localiza a nivel intracelular de células efectoras del sistema inmune innato como los neutrófilos y los macrófagos. El inflamasoma es un complejo proteico intracelular, constituido por proteínas de la familia NALP, que supone el nexo entre los TLR y NLR con la liberación de citoquinas pro-inflamatorias, como la interleucina1β, por estas células4.
Es el responsable de emitir una respuesta inflamatoria ante diversos estímulos de índole muy diversa: desde ARN bacteriano hasta cristales de ácido úrico, pasando por radiación ultravioleta UVB5-7. Existen varios inflamasomas, siendo probablemente el mejor caracterizado el inflamasoma NRLP3.
Relación entre acné vulgar e inflamaciónEl acné es la dermopatía juvenil y del adulto joven más prevalente8: hasta un 80% de la población se verá afectada en algún momento de su vida9. Su fisiopatología es compleja y clásicamente se han descrito 4 actores implicados: la hiperqueratinización folicular, el aumento de producción de sebo, el Propionibacterium acnes y la inflamación secundaria. El microcomedón, consecuencia de la obstrucción del folículo con sebo y queratina, ha sido tradicionalmente descrito como la lesión precursora del acné. Sin embargo, la secuencia de eventos que resulta en la formación de lesiones acneicas no está completamente dilucidada.
Existen publicaciones de hace más de 2 décadas en las que se relaciona estrechamente el acné vulgar con una inflamación subyacente10,11, pero no ha sido hasta recientemente cuando se ha producido un cambio en el entendimiento de esta patología12.
Jeremy et al.13 ya constataron la existencia de células y moléculas inflamatorias como la IL-1 en la piel «aparentemente sana» de pacientes con acné de forma previa a la formación del comedón. Este hallazgo subrayó el papel fundamental de la inflamación en las fases iniciales de la comedogénesis.
Además, Do et al.14 demostraron que las lesiones inflamatorias del acné provenían en más de la mitad de las ocasiones de microcomedones, y en hasta un tercio de los casos de piel aparentemente sana.
Por otra parte, tanto en microcomedones como en comedones se han hallado niveles elevados de moléculas inflamatorias. Por último, se ha encontrado un aumento de la expresión de genes implicados en la inflamación y el remodelamiento de la matriz extracelular en pacientes afectos de acné15.
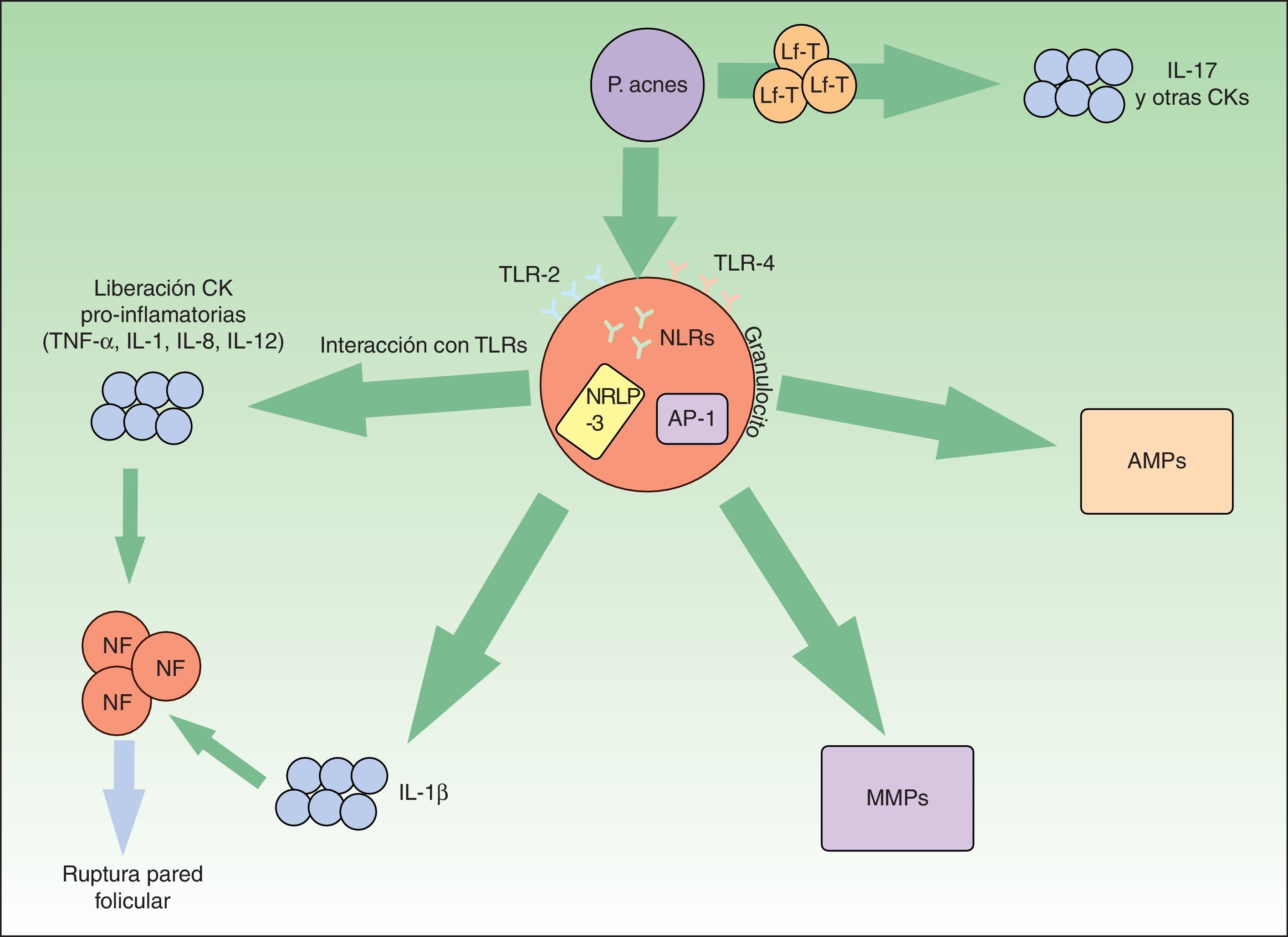
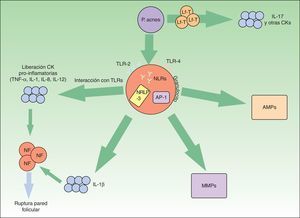
P.acnes es una bacteria saprofita anaerobia grampositiva con especial apetencia por el complejo pilosebáceo. Tiene un rol principal en la aparición y la cronificación de la inflamación en el acné (fig. 1).
Vías inflamatorias implicadas en la patogénesis del acné vulgar. Propionibacterium acnes puede interactuar directamente con los linfocitos T (Lf-T) y favorecer la liberación de citoquinas inflamatorias como la interleucina17. Asimismo, a través de los receptores TLR-2 y 4 de las células inflamatorias perifoliculares se favorece la síntesis de otras citoquinas inflamatorias. El inflamasoma NRLP-3 juega también un papel relevante en la producción de la IL-1β. La liberación de todas estas citoquinas proinflamatorias al medio extracelular conduce a la rotura de la pared folicular mediada por células inflamatorias.
P.acnes también induce un incremento de varias metaloproteasas (MMPs) a través del factor de transcripción «proteína activadora-1» (AP1). Estas enzimas intervienen activamente en la destrucción tisular y cicatrización. Por último, la bacteria es capaz de producir una activación inveterada de péptidos antimicrobianos (AMPs) que perpetúan el microambiente inflamatorio.
El TLR-2, presente en los macrófagos perifoliculares, presenta afinidad contra P.acnes y desencadena la liberación de citoquinas proinflamatorias como la IL-8 o la IL-1216,17. Estas interleucinas favorecen la quimiotaxis neutrofílica y la liberación de enzimas lisosomales que intervienen en la rotura de la pared folicular. Aparentemente, la expresión de TLR-2 por las células inmunes está además directamente relacionada con la gravedad del acné16. Esto podría explicar la razón por la cual los retinoides tópicos, y en concreto el adapaleno, que disminuye significativamente la expresión de TLR-2, son de utilidad en lesiones inflamatorias18.
Por otra parte, P.acnes es capaz de activar el inflamasoma-NRLP3 a través de diversos NLR. Este complejo multiproteico activaría enzimas proteolíticas, como la caspasa-1, que transformarían el precursor de la IL-1β en su forma funcionante19. Se ha demostrado la activación del inflamasoma en monocitos y sebocitos cutáneos humanos por esta bacteria20,21. El conocimiento de esta relación entre P.acnes y el inflamasoma abre una nueva perspectiva terapéutica.
Asimismo, P.acnes puede estimular los linfocitos T. En un reciente estudio in vitro se demostró que el P.acnes inducía los linfocitos T-helper1 y 17 a producir IL-17 y otras citoquinas proinflamatorias22. En el mismo estudio se constató que la vitaminaA (ácido transretinoico) y la vitaminaD (1,25-dihidroxivitaminaD3) inhibían esa estimulación inflamatoria. Esto podría abrir otra puerta para el tratamiento del acné.
Las metaloproteasas de la matriz extracelular (MMP) intervienen en el mantenimiento de la matriz extracelular dérmica de forma fisiológica. Además, son causantes de la destrucción de tejidos y formación de cicatrices en el acné. Varios estudios han constatado que P.acnes induce un aumento de actividad de varias MMP23–25. Asimismo, probablemente existe una susceptibilidad individual a una cicatrización aberrante en pacientes afectos de acné. Se sabe que determinados perfiles de expresión inflamatoria están ligados a mayor riesgo de cicatrización anómala26. De nuevo, conociendo estas dianas moleculares podrían diseñarse tratamientos específicos para modular la cicatrización cutánea.
En el sistema inmune innato la actuación de péptidos antimicrobianos (AMP) como las β-defensinas o las catelicidinas son relevantes para el control de la flora bacteriana residente y transitoria cutánea. Se sabe que la presencia de P.acnes en pacientes afectos de acné estimula de forma mantenida la acción de estos péptidos exacerbando el ambiente inflamatorio característico de esta entidad27.
En última instancia, el microbioma cutáneo tiene un efecto directo e indirecto sobre el sistema inmune y la respuesta inflamatoria frente a P.acnes. Se ha comprobado que esta inflamación varía según la cepa de P.acnes y la sensibilidad intrínseca de cada paciente28.
Por tanto, debemos deshabituarnos de la concepción del acné como una enfermedad trifásica, constituida por una etapa preinflamatoria (comedones), una etapa inflamatoria (pápulas, pústulas, nódulos y quistes) y una etapa postinflamatoria (cicatrices e hiperpigmentación residual). En realidad, es una patología en la que la inflamación juega un papel fundamental y la define: existe inflamación subclínica en piel sin lesiones visibles, interviene en el inicio de las lesiones (microcomedones y comedones) y en su perpetuación.
Repercusión en la práctica clínicaLos conocimientos de su etiopatogenia tienen una traducción clínica directa en forma de nuevas dianas terapéuticas y replanteamiento de las indicaciones de los tratamientos actuales29,30. Un ejemplo son los retinoides tópicos, que además de su conocido efecto regulador de la queratinización31 tienen un papel antiinflamatorio modulando la producción de moléculas inflamatorias18 y quimiotaxis de los neutrófilos y, por tanto, no solo tendrían utilidad en las tradicionalmente descritas lesiones preinflamatorias32.
De forma análoga, la utilidad de la isotretinoína oral en el acné no se debe únicamente a su efecto queratorregulador. Su eficacia terapéutica está también mediada por su acción antiinflamatoria. Recientes estudios han demostrado que disminuye la expresión de TLR-2 de los monocitos33. Este último efecto se mantiene durante meses tras la suspensión del fármaco. Por otra parte, inhibe varias MMP de la matriz extracelular34.
Respecto a la utilidad de los antibióticos en el acné vulgar, como los macrólidos o las tetracicilinas, además de su efecto bacteriostático sobre P.acnes, tienen un efecto antiinflamatorio35 incluso a dosis subantimicrobianas36. Este efecto además explica la mayor parte de su acción terapéutica37.
Por tanto, dado que el acné vulgar es una patología inflamatoria crónica, deberemos ajustar la dosis y la duración del tratamiento para prevenir el desarrollo de resistencias antibióticas.
El peróxido de benzoilo (POB) actúa contra el P.acnes debido a su efecto oxidativo y además tiene propiedades queratolíticas y antiinflamatorias. Es especialmente útil de forma combinada con retinoides o antibióticos tópicos dificultando la aparición de estas resistencias38.
De especial interés clínico es conocer la existencia de diversas entidades, actualmente englobadas bajo el término de enfermedades autoinflamatorias, en las que se ha involucrado en su etiopatogenia una actividad aberrante de la IL-1β y participación directa de neutrófilos. En estas patologías, la presencia de lesiones acneiformes o pustulosas es frecuente. Ejemplos de estos síndromes serían el síndrome SAPHO39 y las enfermedades autoinflamatorias relacionadas con el síndrome PAPA, como el PASH, el PAPASH o el PASS40. En estas patologías, el bloqueo de la vía de señalización de la IL-1 con fármacos biológicos como el anakinra o con anti-TNF mejora significativamente su sintomatología. Además, fármacos que actúan bloqueando esta vía a través de otras citoquinas (IL-12, IL-23 o IL-17), involucradas en la fisiopatología del acné vulgar y que además son dianas terapéuticas de la psoriasis, están resultando de utilidad en su tratamiento y, por tanto, constituyen otra alternativa a explorar en el tratamiento del acné.
Por último, se ha asociado la dieta occidental con alteraciones metabolómicas que empeoran la inflamación existente en el acné vulgar41. Si bien las guías actuales para el tratamiento del acné no sugieren modificaciones dietéticas específicas42, datos emergentes de estudios sugieren la utilidad de una dieta «paleolítica», compuesta por hidratos de carbono de bajo índice glucémico y ácidos grasos omega-3 antiinflamatorios41.
El futuro del tratamiento de esta patología se muestra prometedor gracias al mejor entendimiento de su fisiopatología. Además de nuevas formulaciones de combinaciones preexistentes (adapaleno 0,3%-peróxido de benzoilo 2,5%43, clindamicina fosfato 1,2%-peróxido de benzoilo 3,75%44 o dapsona 7,5% tópica45), nuevos fármacos eminentemente antiinflamatorios —como un inhibidor de la coenzima-A carboxilasa46, un jabón de minociclina47, óxido nítrico tópico48 e incluso una suspensión de micropartículas de sílice recubiertas en oro para su uso en terapia fotodinámica49— ampliarán nuestro armamento terapéutico.
En conclusión, el acné es una patología inflamatoria crónica de la unidad pilosebácea en la cual P.acnes participa de forma activa cronificando el proceso inflamatorio. Al entender cómo se relacionan el sistema inmune innato y P.acnes podemos dilucidar nuevas ventanas terapéuticas para enfrentarnos a esta patología y explorar regímenes de tratamiento óptimos que reduzcan la inflamación sin contribuir a la resistencia a los antibióticos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.