Las micosis profundas son infecciones poco frecuentes en nuestro medio. Se presentan principalmente en pacientes inmunodeprimidos o en regiones de climas tropicales, que abarcan las micosis subcutáneas y las micosis sistémicas. Las micosis subcutáneas o por implantación siempre producen signos de afectación cutánea. En la primera parte de esta revisión se realizará una revisión de las principales micosis subcutáneas: esporotricosis, cromoblastomicosis, micetomas, feohifomicosis, hialohifomicosis y lacaziosis. Reconocer y tratar estas micosis subcutáneas de forma precoz es importante, ya que a menudo están asociadas a una alta morbilidad.
The deep mycoses are uncommon in our setting. These fungal infections occur mainly in immunosuppressed patients or in tropical climates, and include subcutaneous infections and systemic infections. The skin is always involved in the former. In the first part of this review, we describe the main subcutaneous mycoses: sporotrichosis, chromoblastomycosis, mycetoma, phaeohyphomycosis, hyalohyphomycosis, and lacaziosis. Early recognition and treatment is important, as these infections are frequently associated with high morbidity.
La micosis profundas son infecciones poco frecuentes producidas por hongos, que abarcan las micosis subcutáneas y las micosis sistémicas1. Las micosis subcutáneas o por implantación producen signos de afectación cutánea, mientras que las micosis sistémicas solo presentan lesiones en la piel en algunas ocasiones, ya sea por afectación directa de ella como puerta de entrada o tras la diseminación de la infección a partir de un foco profundo. La mayoría de las micosis subcutáneas y sistémicas en España, con excepción de algunas excepciones (por ejemplo mucormicosis), corresponden a «micosis importadas», según Rezusta et al.2 No existen datos epidemiológicos en España para poder señalar la prevalencia ni la incidencia de estas enfermedades.
Micosis subcutáneasIncluyen diversas entidades clínicas caracterizadas por la invasión de la piel y el tejido subcutáneo por hongos saprofitos cuyo hábitat es el suelo y las plantas. Las personas que viven en las zonas rurales constantemente sufren lesiones o traumatismos, sin embargo, solo unos pocos de ellos desarrollan la enfermedad1.
Generalmente la puerta de entrada es la inoculación traumática de material contaminado: astillas, espinas u otros objetos punzantes, por lo que también se denominan micosis por implantación3.
Esta circunstancia permite agrupar un conjunto heterogéneo de infecciones causadas por hongos taxonómicamente muy diversos, y cuyo denominador común es la puerta de entrada en el hospedador. Cualquiera de estas infecciones puede presentarse como enfermedad del viajero en personas provenientes de áreas endémicas, aun en el lapso de varios años.
Las micosis subcutáneas más prevalentes son: esporotricosis, cromoblastomicosis y micetoma1. Otras entidades más raras comprenden: lacaziosis, feohifomicosis, hialohifomicosis y conidiobolomicosis.
EsporotricosisEs una infección subaguda o crónica causada por un complejo de hongos dimórficos, siendo el más frecuente Sporothrix schenckii4,5. Estos hongos presentan una distribución universal, siendo más frecuente en zonas tropicales y subtropicales. En América del Sur la incidencia anual se estima en 48 a 60 casos por 100.000 habitantes6,7. Los casos autóctonos en España y el resto de Europa son anecdóticos8, y la mayoría corresponde a casos importados en viajeros9.
Los agentes etiológicos pertenecen a un complejo llamado Sporothrix schenckii que incluye diferentes especies10,11: S. brasiliensis, S. mexicana, S. globosa, S. luriei, S. pallida (antes S. albicans) y S. schenckii sensu lato (sl.), en el que S. schenckii (sl.) corresponde al agente más frecuente12.
La inoculación traumática de Sporothrix spp. produce, tras un periodo de incubación de 15-30 días, una infección crónica caracterizada por lesiones nodulares en el tejido cutáneo y subcutáneo acompañada de linfangitis del área afectada.
Sporothrix spp. vive en la naturaleza asociado a la vegetación, plantas o restos vegetales en el suelo, por lo que la incidencia de la esporotricosis es mayor en trabajadores agrícolas y personas que operan en zonas abiertas. Se considera una enfermedad profesional de guardabosques, horticultores, jardineros y personal agrícola en general4,13. El alcoholismo y la diabetes también se han descrito como factores de riesgo. La inmunosupresión, independientemente de la causa, predispone a la enfermedad diseminada o sistémica1. También se puede adquirir en el laboratorio mediante la manipulación del hongo. Finalmente, llama también la atención que en una epidemia del sur de Brasil la infección fue transmitida en forma atípica por arañazos de gatos que padecían la infección, como si se tratase de una verdadera zoonosis. En estos casos se aisló en su mayoría S. brasilensis14.
Formas clínicas5- 1)
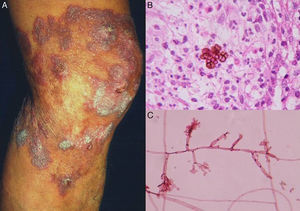
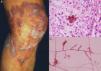
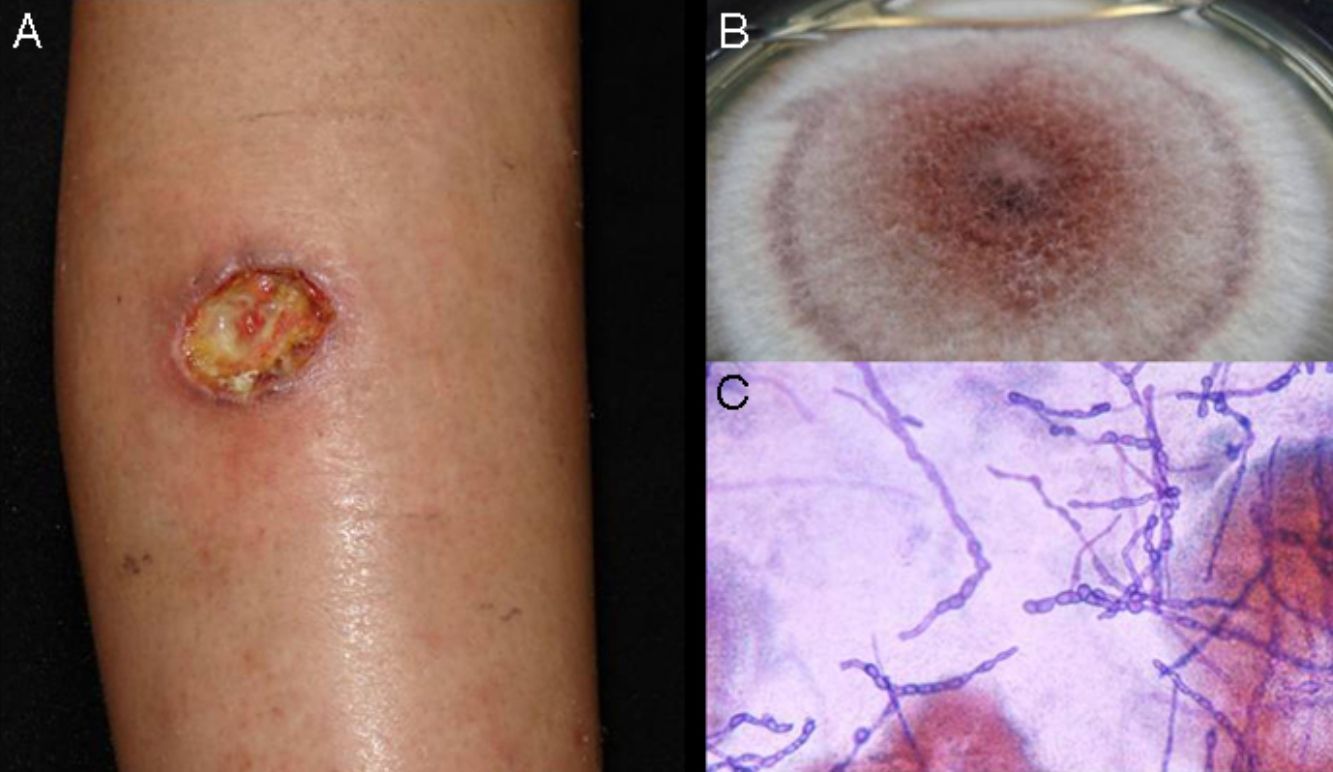
Esporotricosis linfocutánea o linfangítica: representa más del 75% de los casos15. Se desarrolla en piel expuesta, como manos, cara y pies. Comienza como un nódulo dérmico violáceo o negruzco, no doloroso, que se rompe formando una úlcera pequeña (chancro esporotricósico) con bordes engrosados, centro granulomatoso, doloroso y escasa supuración. Posteriormente se produce linfangitis con nódulos secundarios a lo largo del tracto linfático (patrón esporotricoide), los que también pueden romperse y ulcerarse (fig. 1)16. No hay afectación del estado general15. La evolución dependerá de la inmunorrespuesta del huésped, la virulencia de la cepa, el tamaño del inóculo y la profundidad de la lesión.
- 2)
Esporotricosis fija o dermoepidérmica: solo hay una lesión. La infección es limitada y se manifiesta por lo general como una placa verrugosa de lento crecimiento y menos progresiva. Los vasos linfáticos no suelen estar afectados y es más común en áreas endémicas16.
- 3)
Otras formas clínicas:
Osteoarticular: forma diseminada en huesos y articulaciones que constituye el sitio más común de compromiso sistémico17.
Pulmonar primaria: se observa de preferencia en pacientes inmunodeprimidos, se adquiere por inhalación; simula una tuberculosis cavitaria16.
Pulmonar metastásica: es infrecuente, solo descrita en casos aislados; ocurre en pacientes inmunodeprimidos, especialmente en aquellos con VIH etapa sida18.
Invasión generalizada: es rara, aunque se han descrito formas meníngeas y oculares en pacientes inmunodeprimidos, asociados a diabetes descontrolada y alcoholismo crónico.
En México, como en otros países de Latinoamérica (lugar con mayor experiencia y series de casos importantes), la esporotricosis linfangítica se observa en el 60-80% de los casos; la forma cutánea fija en el 10-30% y las otras formas clínicas en 1-2%16.
La esporotricosis debe diferenciarse de la tuberculosis, leishmaniasis, tularemia, nocardiosis cutánea, micobacteriosis no-tuberculosas, micetomas, cromoblastomicosis y lepra lepromatosa, muchas de las cuales pueden presentar un patrón esporotricoide (linfangítico) de diseminación y deben ser consideradas dentro del diagnóstico diferencial19.
- 1.
Pus (aspirado de nódulos): la microscopia directa no tiene utilidad, por la escasa cantidad de las levaduras presentes en las lesiones. Puede cultivarse en agar dextrosa Sabouraud y Sabouraud dextrosa con antibióticos (cloranfenicol y actidone), desarrollándose colonias blancas que luego se vuelven oscuras (fig. 1). El tiempo de crecimiento es característicamente rápido, de 3 a 5 días20, y se debe guardar hasta 14 días para identificar el hongo y confirmar el diagnóstico16. Se puede hacer identificación molecular por técnicas de reacción en cadena de la polimerasa (PCR)10,21.
- 2.
Histología: reacción granulomatosa mixta, inespecífica, con microabcesos neutrofílicos. El hongo se presenta como una pequeña levadura con forma de cigarro, ocasionalmente rodeado de un borde eosinofílico radiado formando el «cuerpo asteroide» característico, aunque no patognomónico16,20. Los cuerpos asteroides pueden encontrarse también en sarcoidosis, silicosis y lacaziosis (lobomicosis) de manera intracelular. Por el contrario, en la esporotricosis la ubicación extracelular es más característica. Pueden ser necesarios varios cortes para poder visualizar los microorganismos, sin embargo en los casos diseminados y viscerales se observan con frecuencia.
La curación espontánea puede ocurrir en algunos casos, como en el embarazo, aunque paradójicamente, en estas condiciones, también se ha informado de diseminación.
- 1.
Solución saturada de yoduro de potasio. Se inicia con 5 gotas en cada comida y se aumenta con la tolerancia hasta 20 o 30 gotas en cada comida. Continuar de 3 a 4 semanas tras la resolución del cuadro. El mecanismo de acción es desconocido, pero se cree que es inmunoestimulante. Los efectos colaterales son sabor metálico, coriza, expectoración, urticaria, petequias, erupciones ampollares y acneiformes, vasculitis, inducción de hipo e hipertiroidismo. Está contraindicado en el embarazo20,22.
- 2.
Itraconazol 200mg al día de 3 a 6 meses22: este es el tratamiento de elección en la mayoría de guías terapéuticas; suele ser un poco más costoso que el yoduro de potasio, pero con menos efectos colaterales.
- 3.
Otras alternativas terapéuticas incluyen: terbinafina 250 a 1.000mg al día de 3 a 6 meses23,24; fluconazol 400mg diarios por 3 a 6 meses22; anfotericina B en formas sistémicas de 0,5 a 1mg/kg/día (desoxicolato) o anfotericina B liposomal o lipídica a dosis de 3-5mg/kg/día22; calor local o termoterapia por 2 o 3 meses:22 y la combinación de los tratamientos antes descritos (yoduro de potasio e itraconazol o itraconazol y terbinafina o terbinafina y yoduro de potasio)25. La adición de la terapia fotodinámica con metilaminolevulinato, o mejor con azul de metileno 1% intralesional, añadida o no al tratamiento con itraconazol ha mostrado buena respuesta in vitro y en un paciente26.
En la enfermedad osteoarticular la cirugía puede desempeñar un papel importante22. Tradicionalmente, el aseo quirúrgico y la artrodesis se consideran de elección, pero el reemplazo por material articular protésico seguido de la terapia antifúngica a largo plazo ha sido descrita también como una opción viable.
Cromoblastomicosis o cromomicosisEs una infección fúngica, crónica, polimorfa, de la piel y del tejido subcutáneo, causada por varias especies de hongos melánicos o dematiáceos (que producen pigmento oscuro) cuyas formas parasitarias son denominadas células fumagoides o muriformes (cuerpos escleróticos)27–30.
Las especies causales más comunes son Fonsecaea pedrosoi, Fonsecaea monophora, Cladophialophora carrionii, Phialophora verrucosa y Rhinocladiella aquaspersa5,27,28. La mayoría de los pacientes tienen una historia de traumatismo por madera o vegetación, y más del 80% son trabajadores agrícolas que suelen ir descalzos (África, Asia, Sudamérica); más frecuente en países tropicales y subtropicales, aunque los hongos responsables han sido aislados en todas partes del mundo27.
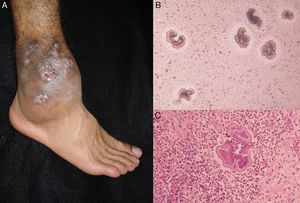
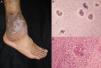
ClínicaLa penetración del hongo ocurre por traumatismo, siendo más frecuente en los miembros inferiores31. Uno o 2 meses después del traumatismo surge inicialmente una pápula, y posteriormente se hace nodular, luego va creciendo lentamente, tornándose a una superficie verrucosa (fig. 2). Permanece a nivel del tejido subcutáneo sin afectar el hueso o el músculo, excepto en inmunodeprimidos. Las lesiones individuales pueden ser muy gruesas como grandes vegetaciones, de ahí el nombre de «dermatitis coliflor», siendo habitual la sobreinfección bacteriana. Es posible que se produzca un linfedema secundario que puede llegar a elefantiasis y aparición de carcinoma espinocelular27.
Diagnóstico- 1.
Examen directo: hecho con costras y fragmentos de piel, en donde se revela la presencia de las formas parasitarias aisladas o agrupadas con su septación característica (fig. 2). Las estructuras que se observan en el examen directo son comunes a todas las especies27,28.
- 2.
Cultivo: los hongos causales crecen lentamente en medios de Sabouraud dextrosa agar con y sin antibióticos (cloranfenicol y actidiona) formando colonias oscuras verde oliva o negro con aspecto aterciopelado, superficie plana y centro elevado. La diferenciación entre las distintas especies de hongos es difícil y se hace conforme a las estructuras de reproducción, así como a la identificación molecular30. Se puede realizar además identificación de las especies por biología molecular (PCR), en particular dirigida a las regiones Internal transcribed spacer (ITS) del ADN ribosomal (rADN)32,33.
- 3.
Histología: la epidermis muestra hiperplasia pseudoepiteliomatosa característica; en la dermis se ve un infiltrado inflamatorio mixto granulomatoso con células gigantes, y dentro las estructuras fúngicas redondas características (fig. 2)27.
La cromoblastomicosis es extremadamente difícil de tratar, y a menudo refractaria a los diversos enfoques terapéuticos, que incluyen terapias no farmacológicas como el curetaje, la electrocoagulación y la criocirugía5. Los antifúngicos deben mantenerse durante al menos 6 meses y pueden resultar en una respuesta clínica favorable, pero las recaídas durante o después de la terapia son comunes. El término de tratamiento debe establecerse ante la desaparición total de las lesiones27.
Otras alternativas terapéuticas descritas incluyen la resección quirúrgica de lesiones pequeñas; la criocirugía local (se sugiere acompañada de antimicótico, para evitar la diseminación linfática); el itraconazol 200-400mg/día solo o asociado a 5-fluorocitosina 30mg/kg 4 veces al día por 6 meses; la terbinafina 250-500mg/día hasta 12 meses y en caso de afección sistémica la anfotericina B a dosis de 1mg/kg i.v. o anfotericina B liposomal o lipídica a dosis de 3-5mg/kg/día27.
MicetomasEl micetoma es una infección crónica localizada causada por varias especies de hongos y bacterias, denominándose actinomicetoma si es por bacterias filamentosas aerobias y eumicetoma si es por hongos34. Se caracteriza por la formación de agregados de los microorganismos causantes, conocidos como «granos», dentro de los abscesos. Estos pueden drenar a través de fístulas sobre la superficie de la piel, o comprometer los huesos adyacentes. La enfermedad avanza por diseminación directa y los sitios metastásicos distantes de la infección son muy raros. Los agentes causales generalmente están en el suelo y se introducen en la piel a través de una solución de continuidad. La mayoría de los casos ocurre en personas que trabajan en áreas rurales.
Etiología- 1)
Hongos: agentes causales de los micetomas eumicéticos o eumicetomas, productores de granos blancos y oscuros. Especialmente frecuentes en África, India y México. Entre los agentes productores de granos oscuros se encuentran: Madurella mycetomatis, Trematosphaeria grisea, Leptosphaeria senegalensis35. Los granos pálidos corresponden a Fusarium spp., Acremonium spp. y Aspergillus nidulans.
- 2)
Bacterias filamentosas o actinomicetos aerobios: granos rojos (Actinomadura pelletieri), blanco-amarillentos (Actinomadura madurae y Nocardia brasiliensis y Nocardia spp.) o amarillo-marrones (Streptomyces somaliensis). Es posible encontrarlos en todo el mundo, no solo en países tropicales36.
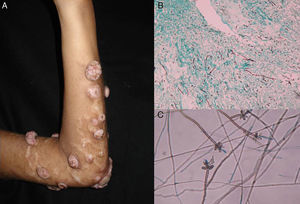
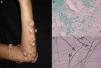
Las características clínicas de los micetomas micóticos y de los actinomicetos son muy similares. Son más comunes en pies, pantorrillas o manos. El estadio más temprano es un nódulo indoloro y duro que se disemina lentamente con el desarrollo de pápulas y fístulas secretantes en su superficie35,36. El edema del tejido local, la formación de fístulas crónicas y el compromiso óseo tardío distorsionan y deforman el sitio original de la infección (fig. 3). Las lesiones raramente son dolorosas, excepto en la fase tardía.
DiagnósticoEncontrar los granos de micetoma (fig. 3) es la clave para establecer el diagnóstico; en general aparecen en la secreción de las fístulas o al extraer una costra y comprimir. La microscopia nos dirá si están compuestos de actinomicetos pequeños o filamentos micóticos más anchos. La identificación definitiva exige el aislamiento del agente causal en un cultivo, generalmente se hace en Sabouraud dextrosa agar con y sin antibióticos (cloranfenicol y actidione); en los casos de hongos hialinos solo se prefiere el primero. Los agentes se pueden identificar por pruebas de biología molecular, en especial por PCR con diversos marcadores37 dependiendo del agente, como son ITS rADN, β-tubulina38 o D1/D2. Por el contrario, para los actinomicetos como Nocardia y Actinomadura se usa secuenciación parcial de ARN ribosomal (rARN) 16S36. La histología es similar en todos los micetomas, representada por un área central de inflamación rica en polimorfonucleares (verdaderos abscesos), células epiteloides, células gigantes y fibrosis; los granos se encuentran en el centro de la inflamación35,39. Las imágenes ayudan en el diagnóstico, pero son técnicas complementarias en las que puede visualizarse un aumento de tejido blando, lesiones osteolíticas y espesamiento cortical.
El diagnóstico diferencial incluye osteomielitis bacterianas, osteomielitis tuberculosa, hidradenitis supurativa, sarcoma de Kaposi y tuberculosis cutánea, entre otras35,39.
TratamientoActinomicetoma: para los casos por Nocardia sp., en general, el esquema de tratamiento con más evidencia es trimetoprim-sulfametoxazol más diamino-difefenil sulfona (dapsona) durante 6 meses a 2 años. Si hay resistencia o falta de respuesta se puede usar amoxicilina-ácido clavulánico durante 6 meses40–42; para los casos extensos y/o con compromiso visceral el tratamiento de elección es amikacina combinado con trimetoprim-sulfametoxazol39 o meropenem43,44. Si no hay respuesta existen tratamientos efectivos anecdóticos con otros agentes36,39,45.
Eumicetoma: contrariamente a los resultados terapéuticos observados en actinomicetomas, donde el tratamiento médico farmacológico es una buena alternativa, el tratamiento estándar del eumicetoma es la combinación del tratamiento médico y quirúrgico. Entre los antifúngicos utilizados se han descrito resultados aceptables con triazoles de última generación, como itraconazol o fluconazol, solos o asociados a terbinafina durante largo tiempo, siempre tras agotar las opciones quirúrgicas35,45.
FeohifomicosisSe refiere al conjunto heterogéneo de micosis causadas por hongos de paredes oscuras (hongos dematiáceos)46,47. Puede aparecer en cualquier clima, pero es más frecuente en los trópicos. En los últimos años han aumentado estos casos con la inmunosupresión en pacientes VIH-sida, trasplantados o diabéticos, entre otros46,48.
Los agentes más frecuentes son Exophiala spp., Bipolaris spp., Curvularia spp., Pleurophomopsis spp. Phaeoacremonium spp. y Alternaria spp. Estos hongos son aislados fundamentalmente de detritos orgánicos.
Clínica- 1)
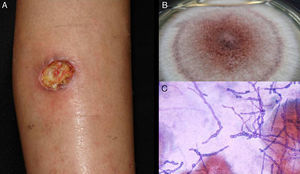
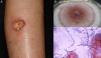
Forma subcutánea: antecedente de traumatismo local o inoculación de material extraño. Posteriormente aparece una lesión única como quiste o nódulo habitualmente, en otros casos placa o absceso de localización preferencial en las extremidades y de crecimiento lento (fig. 4)48,49. El diagnóstico diferencial se hace con lipomas, quistes epidérmicos o sinoviales, fibromas, granuloma a cuerpo extraño y abscesos bacterianos.
- 2)
Forma sistémica o diseminada: es muy poco frecuente, pero muy grave en pacientes inmunosuprimidos50.
El examen en fresco muestra hifas de color oscuro, tabicadas, ramificadas o en cadenas y es diagnóstico (fig. 4). En los cultivos en Sabouraud el crecimiento de las colonias es lento, en 3 o 4 semanas, y adquieren el color verde oliva o marrón oscuro. Su identificación molecular se hace por PCR con marcadores como β-tubulina y regiones ITS51,52. La biopsia revela una pared quística formada por empalizada de macrófagos con hifas micóticas49.
TratamientoEl tratamiento para las infecciones por el género Exophiala spp. es controvertido. Una alternativa es la resección quirúrgica de la lesión48. Tampoco existe un protocolo estándar para el tratamiento de las infecciones causadas por Alternaria53. Parece ser que, en general, para las feohifomicosis la mejor alternativa es utilizar la combinación de un antifúngico (itraconazol, ketoconazol o terbinafina) asociado al tratamiento quirúrgico. Las cepas de Exophiala spp. suelen ser resistentes al fluconazol. Las formas diseminadas se tratan con anfotericina B48,49.
HialohifomicosisSon las micosis causadas por hongos hialinos (hifomicetos) que presentan hifas septadas en los tejidos47. Esta clasificación, sin embargo, puede resultar artificial, ya que hay una gran variedad de hifomicetos en el suelo y en el medio acuático en la Tierra. En ciertas ocasiones unos pocos organismos pueden producir enfermedad en la especie humana, particularmente infecciones de tipo oportunista54,55. La mayoría de los géneros involucrados en estas infecciones presentan la misma morfología en los tejidos y producen la misma respuesta patológica. Si un hongo causa infecciones con regularidad, o si tiene algún otro aspecto particularmente distintivo, se le asigna una categoría diferente (por ejemplo aspergilosis).
Los agentes más frecuentes son Aspergilius (fumigatus, niger, flavus), Scopulariosis spp., Fusarium spp., Acremonimun recifei, Paecilomyces spp., Purporeocillum spp. y Neoscytalidium spp.55. Todos ellos están distribuidos ampliamente en la naturaleza, encontrándose en cualquier tipo de suelo, madera, vegetales en descomposición56. Compromete a pacientes de ambos sexos de cualquier edad y para su contagio no se requiere ser inmunodeprimido.
ClínicaLas hialohifomicosis pueden ser clasificadas de diferentes formas:
- 1)
Superficial: dermatomicosis y onicomicosis. Son más habituales en trabajadores rurales, pescadores, grandes quemados y prematuros57,58.
- 2)
Forma subcutánea: la inoculación por traumatismo desencadena abscesos, quistes y tumores similares al micetoma (fig. 5)56.
- 3)
Forma sistémica: es poco frecuente y muy grave, ocurre en pacientes inmunodeprimidos y puede ser fatal. Compromete el pulmón y el SNC por diseminación hematógena y linfática55,57.
Se realiza a través del examen directo, de las escamas de la piel, uñas, secreciones o fragmentos que revelan hifas hialinas septadas. El cultivo confirma el diagnóstico (fig. 5). La mayoría crecen en medios de Sabouraud dextrosa agar y no se utilizan medios con antibióticos o inhibidores47,59. Al igual que en las enfermedades previas, puede diagnosticarse mediante identificación molecular60.
El diagnóstico diferencial debe plantearse con otras dermatomicosis, quistes epidérmicos, actinomicetomas y eumicetomas, histoplasmosis y criptococosis.
TratamientoEn individuos inmunocompetentes el tratamiento se realiza con triazólicos, terbinafina o cirugía61. En inmunodeprimidos la elección es la anfotericina B asociada a un triazólico (itraconazol 200mg diarios durante 6 meses o fluconazol 150mg 2 veces por semana durante 6 meses).
Lacaziosis (lobomicosis)La lacaziosis, anteriormente llamada lobomicosis, es una infección micótica granulomatosa crónica de la piel y los tejidos subcutáneos que fue descrita por primera vez en 1930 por Jorge Lobo, en Recife, Brasil, denominándose entonces blastomicosis queloidea62. Es una infección rara que se observa en América central y del Sur causada por Lacazia loboi62,63, la cual es una levadura no cultivable. Se piensa que la fuente de infección se encuentra en el suelo y los vegetales. El agente se introduce probablemente en la piel a través de una traumatismo penetrante como un pinchazo de espina o una picadura de insecto.
Se caracteriza por la aparición de lesiones tipo queloide en sitios expuestos, frecuentemente en la cara, los brazos o las piernas, con típicos márgenes lobulados bien definidos. Las lesiones crecen por contigüidad, pero también se pueden extender a otros sitios por autoinoculación.
DiagnósticoLa presencia de abundantes estructuras fúngicas en el examen directo y en la biopsia formando cadenas de células redondas unidas por un túbulo pequeño facilitan el diagnóstico de esta enfermedad62. Se pueden identificar en el tejido por técnicas de PCR, en especial dirigida al fragmento 18S del rADN64.
El diagnóstico diferencial incluye queloides, lepra lepromatosa y leishmaniosis anérgica.
TratamientoLos fármacos antifúngicos no son efectivos, siendo la extirpación quirúrgica el tratamiento definitivo62,63.
ZigomicosisGrupo heterogéneo de infecciones fúngicas causadas por oportunistas llamados zigomicetos: orden Mucorales (Rhizopus, Lichtheimia, Mucor y Rhizomucor) y orden Entomopthorales (Basidiobolus y Conidiobolus)65. Se discutirá solo acerca de estos últimos en esta sección, ya que los primeros se desarrollarán en la segunda parte de esta revisión por ser causantes de Micosis sistémicas.
Las entomoftoromicosis se caracterizan por el desarrollo y diseminación de una tumoración dura crónica que afecta a los tejidos subcutáneos, de la cual existen 2 variedades. La primera es causada por Basidiobolus ranarum y es una entidad más común en niños66. Las lesiones aparecen generalmente en las cinturas escapular y pelviana, presentándose como una celulitis de consistencia leñosa que se expande lentamente. La segunda forma es causada por Conidiobolus coronatus y se observa en adultos. La infección primaria comienza en los cornetes inferiores de la nariz, diseminándose hacia la parte central de la cara, con edema duro y doloroso, causando una grave deformación de nariz, labios y mejillas65–68.
ConclusiónHemos revisado las principales características de las micosis subcutáneas, así como sus principales métodos de diagnóstico y tratamiento (tabla 1).
Resumen de las características de las micosis subcutáneas
| Micosis | Agente etiológico principal | Diagnóstico | Tratamiento |
|---|---|---|---|
| Esporotricosis | Sporothrix schenckii | Cultivo aspirado pus de nódulos-histología -PCR | Solución saturada de KI por 3 semanas-itraconazol 200mg día 3 a 6 meses-combinaciones |
| Cromoblastomicosis | Fonsecaea pedrosoi | Examen directo-cultivo-histología | Muy difícil-itraconazol 200mg día durante 6 meses–terbinafina por 12 meses-anfotericina B-combinaciones |
| Micetomas | Actinomicetos filamentosos y hongos filamentosos | Hallazgo de granos de micetoma-cultivo-histología-PCR | Actinomicetomas-antibióticos/eumicetomas-antifúngicos+cirugía |
| Feohifomicosis | Exophiala jeanselmei Alternaria spp. | Examen directo y cultivo-histología-PCR | Controvertido. Cirugía+combinación de antifúngicos |
| Hialohifomicosis | Oportunistas Aspergillus (fumigatus, niger, flavus), Fusarium spp., Paecilomyces, etc. | Examen directo y cultivo-PCR | Inmunocompetentes: triazólicos-terbinafina -ciclopiroxolamina-cirugía Inmunodeprimidos: anfotericina B asociado a triazólico durante 6 meses |
| Lacaziosis (lobomicosis) | Lacazia loboi | Examen directo-histología-PCR | Cirugía |
| Entomoftoromicosis | Conidiobolus coronatus Basidiobolus ranarum | Examen directo y cultivo | Cirugía y antifúngicos sistémicos |
Los autores declaran no tener ningún conflicto de intereses.



![Esporotricosis linfangítica (A), cultivo de Sporothrix schenckii (B) y microscopia del cultivo ([C] medio Sabouraud dextrosa agar. Tinción eritrosina 2%, ×40). Esporotricosis linfangítica (A), cultivo de Sporothrix schenckii (B) y microscopia del cultivo ([C] medio Sabouraud dextrosa agar. Tinción eritrosina 2%, ×40).](https://static.elsevier.es/multimedia/00017310/0000010700000010/v1_201611260105/S000173101630182X/v1_201611260105/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w9/t1/zx4Q/XH5Tma1a/6fSs=)