Determinar el uso de los recursos y los costes de la dermatitis atópica (DA) en adultos según su gravedad y las comorbilidades asociadas en situación de práctica clínica habitual.
Pacientes y métodosSe efectuó un diseño observacional retrospectivo realizado a partir de la revisión de registros de pacientes ≥18años que demandaron asistencia durante 2013-2014 en un área geográfica de Cataluña con una población de 215.634 personas. Se constituyeron 3 grupos de gravedad en función del tratamiento prescrito. Las variables evaluadas fueron el conjunto de comorbilidades, la medicación concomitante/específica; y los costes sanitarios directos/indirectos. El análisis estadístico se elaboró mediante modelos de regresión múltiple, p<0,05.
ResultadosSe reclutaron 6.186 sujetos con diagnóstico de DA (edad-media: 47,1años; mujeres, 61,6%). En función de la gravedad de la DA se consideraron 3 grupos; el 55,7% leve (n=3.445), el 38,2% moderada (n=2.361) y el 6,1% grave (n=380). La DA grave se asoció a la probabilidad de presentar comorbilidades (β=0,192); específicamente: asma (β=0,138), depresión (β=0,099), eventos cardiovasculares (β=0,087), obesidad (β=0,085) y hábito tabáquico (β=0,025), p<0,001. El coste ascendió a 9,3 millones de euros (costes sanitarios: 75,5%; pérdidas de productividad: 24,5%), con un promedio/unitario de 1.504euros/año. Los promedios/unitarios corregidos (ANCOVA) fueron mayores en la DA grave en comparación con la moderada y la leve (3.397 vs. 2.111 y 885 euros, respectivamente; p<0,001).
ConclusionesLa DA grave se asocia a una elevada utilización de recursos sanitarios y costes para el Sistema Nacional de Salud proporcional a la gravedad de la dermatosis. La comorbilidad general y el asma fueron los factores con mayor impacto asociado al coste sanitario.
To determine resource usage and costs associated with atopic dermatitis in adults according to severity and comorbid conditions in daily clinical practice.
Patients and methodsWe performed an observational, retrospective study based on a review of registries of patients aged ≥18 years who sought health care in 2013 and 2014 in an area of Catalonia, Spain, with a population of 215,634 persons. We established 3 classes of severity depending on the treatment prescribed. The variables evaluated were total comorbid conditions, concomitant/specific medication, and direct/indirect health care costs. The statistical analysis was based on multiple regression models. Statistical significance was set at P<.05.
ResultsWe included 6,186 patients with a diagnosis of atopic dermatitis (mean age, 47.1 years; women, 61.6%). We established 3 groups based on severity, as follows: mild (n=3,445 [55.7%]); moderate (n=2,361 [38.2%]); and severe (n=380 [6.1%]). Severe atopic dermatitis was associated with risk of presenting comorbid conditions (β=0.192), namely, asthma (β=0.138), depression (β=0.099), cardiovascular events (β=0.087), obesity (β=0.085), and smoking (β=0.025); P<.001. Costs reached €9.3 million (health care costs, 75.5%; loss of productivity, 24.5%), with an average unit cost of €1,504 per year. The corrected average unit cost (ANCOVA) was greater in severe atopic dermatitis compared with moderate and mild disease (€3,397 vs. €2,111 vs. €885; P<.001), respectively.
ConclusionsSevere atopic dermatitis generates considerable usage of health care resources and high costs for the National Health System. These are in proportion with the severity of the disease. General comorbid conditions and asthma were the factors with the greatest impact on health care costs.
La dermatitis atópica (DA) es una enfermedad inflamatoria crónica recidivante de la piel1 con una expresión morfológica que varía con la edad del paciente, pero con un predominio de formas recurrentes, y cuyo síntoma más frecuente es el prurito2. Su etiología es compleja, y en ella se encuentran implicados factores genéticos y una combinación de factores alérgicos (el 80% de los pacientes pueden presentar niveles elevados de IgE) y no alérgicos (disfunción de la barrera epidérmica, biológicos y factores ambientales)1-4.
La DA afecta a alrededor del 10-15% de los niños, y entre el 2-7% de los adultos, sobre todo en las sociedades occidentales desarrolladas2,5,6. El 50% se resuelve en la adolescencia, y en los adultos puede persistir hasta en el 20% de los casos1. La incidencia es mayor en mujeres, aunque en la infancia predomina en los varones. Las formas moderadas/graves representan alrededor del 10-20% del total de pacientes con DA1,2.
En general es una enfermedad que ocasiona una elevada carga psicosocial para los pacientes y sus familiares7. Tienen peor pronóstico los pacientes con historia familiar de DA, edad de inicio tardía, enfermedad diseminada en la infancia, sexo femenino y cuando se asocia a otras enfermedades alérgicas (asma y rinitis)1-4. Los corticoides tópicos se consideran actualmente la piedra angular del tratamiento farmacológico en los casos moderados de DA, mientras que para los casos graves se emplean fototerapia e inmunomoduladores sistémicos como ciclosporinaA, metotrexato, micofenolato mofetilo o azatioprina2,4. No obstante, en los casos moderados/graves están en marcha ensayos clínicos en faseIII con fármacos biológicos dirigidos frente a puntos concretos del proceso patogénico8,9.
La DA tiene un elevado impacto económico en los pacientes y familiares10. Sin embargo, la mayoría de los estudios revisados evalúan solamente el coste del tratamiento farmacológico, por lo que las evidencias disponibles hasta el momento, incluyendo el uso de recursos y los costes asociados a este colectivo de pacientes en nuestro país, son escasas11,12. Además, existe una necesidad creciente de llevar a cabo estudios naturalísticos, representativos de las condiciones clínicas reales de las intervenciones sanitarias que reflejen de forma adecuada el flujo de los pacientes, el consumo de recursos sanitarios y sociales y el impacto en sus comorbilidades. El objetivo del estudio fue determinar el uso de los recursos y los costes de la DA en adultos según su grado de gravedad (leve, moderada, grave) en situación de práctica clínica habitual.
Pacientes y métodoDiseño y población de estudioSe efectuó un estudio observacional, multicéntrico y longitudinal (de carácter retrospectivo), realizado a partir de la revisión de los registros médicos (bases de datos informatizadas, con datos disociados). La población de estudio se obtuvo a partir de los registros informatizados de proveedores de salud de diversos centros de atención primaria (AP) de Cataluña y varios hospitales, concretamente en el área de Badalona, que representa un área geográfica con una población de 215.634 habitantes. Estos datos están unificados en la base de datos disociada de la Fundación RedISS (Red de Investigación en Servicios Sanitarios). Los datos procedieron de la historia clínica informatizada OMIAP y de otras bases de datos complementarias. Todos los centros fueron entidades proveedoras concertadas con el CatSalut (Servicio Catalán de la Salud), con financiación pública y provisión privada de servicios.
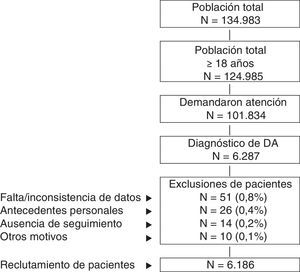
Criterios de inclusión y exclusiónSe incluyeron en el estudio los pacientes que demandaron atención durante los años 2013-2014 (periodo de reclutamiento, fecha índice), y que reunieran las siguientes características: a) edad ≥18años; b) pacientes con diagnóstico de DA (registro) un mínimo de 12meses previos a la fecha índice; c) estar en el programa de prescripciones para la obtención de las recetas médicas (con registro constatado de la dosis, el intervalo de tiempo y la duración de cada tratamiento administrado; ≥2 recetas durante el periodo de seguimiento), y d) que se pueda garantizar el seguimiento regular de los pacientes (≥2 registros sanitarios en el sistema informático). Fueron excluidos: a) los sujetos trasladados a otros centros, los desplazados o fuera de zona; b) los pacientes institucionalizados permanentemente, y c) los sujetos con antecedentes de dermatitis seborreica, dermatitis de contacto y/o eccema micótico. En la figura 1 se muestra el diagrama de flujo de pacientes incluidos en el estudio a partir de los criterios de inclusión y exclusión.
Esquema general del estudio. Se efectuó un estudio observacional de carácter retrospectivo, realizado a partir de la revisión de los registros médicos (anonimizados y disociados) de pacientes diagnosticados de dermatitis atópica. El seguimiento de los pacientes fue de un año.
DA: dermatitis atópica.
Los registros de los pacientes con DA se obtuvieron de la Clasificación Internacional de la AP (CIAP-2)13, códigos S87, S88, S99; y/o de la Clasificación Internacional de Enfermedades (novena edición) Modificación Clínica (CIE-9-MC; códigos específicos), que incluyen: DA, dermatitis alérgica, eccema alérgico, eccema atópico, piel seca o xerosis. El diagnóstico de la DA fue a criterio del clínico (médico de AP y/o dermatólogo de referencia) de acuerdo con los criterios de Hanifin y Rajka14 (DA de más de un año de evolución). La clasificación según gravedad de la DA fue a partir del algoritmo de tratamiento de Garnacho et al.15. En la tabla 1 se recoge la clasificación de la gravedad según los tratamientos prescritos. El periodo de seguimiento (a partir de la fecha de inclusión del paciente) fue de un año.
Clasificación de gravedad según los tratamientos prescritos
| Leve | Moderada | Grave |
|---|---|---|
| Emolientes | Inhibidores de la calcineurina (inmunomoduladores tópicos) | Inmunosupresor |
| Corticoides tópicos de baja/intermedia potencia (hidrocortisona, clobetasona, dexametasona, betametasona, flucinolona y triamcinolona) | Corticoides tópicos de alta potencia | Tratamiento biológico |
| Radiaciones UV monoterapia | Hospitalización por dermatitis atópica | |
| Corticoides orales |
Las variables sociodemográficas y de comorbilidad que se recogieron en el estudio se refieren en la tabla 2. Como variable resumen de la comorbilidad general, para cada paciente atendido, se utilizó: a) el número de diagnósticos crónicos, b) el índice de comorbilidad de Charlson16 como una aproximación a la gravedad del paciente, y c) el índice de casuística individual, obtenido a partir de los Adjusted Clinical Groups (ACG), que es un sistema de clasificación de pacientes por iso-consumo de recursos17. El aplicativo ACG proporciona las bandas de utilización de recursos (BUR), con lo que cada paciente en función de su morbilidad general quedó agrupado en una de las 5 categorías mutuamente excluyentes (1: usuarios sanos o de morbilidad muy baja; 2: morbilidad baja; 3: morbilidad moderada; 4: morbilidad elevada, y 5: morbilidad muy elevada).
Variables sociodemográficas y de comorbilidad recogidas
| Edad (continua y por rangos) | ||
| Sexo | ||
| Antecedentes personales (CIAP-2) | ||
| Hipertensión arterial (K86, K87) | Dislipidemia (T93) | Tabaquismo (P17) |
| Diabetes mellitus (T89,T90), | Obesidad (T82) | Alcoholismo (P15, P16) |
| Fallos orgánicos (cardiaco, hepático y renal) | Cardiopatía isquémica (K74, K76, K75) | Accidente cerebrovascular (K90, K91, K93) |
| Enfermedad pulmonar obstructiva crónica (R96) | Asma (R96) | Rinitis alérgica (R97) |
| Poliposis nasal (R99) | Demencias o trastornos de memoria (P70, P20) | Enfermedad de Parkinson (N87) |
| Epilepsia (N88) | Esclerosis múltiple (N86) | Síndrome depresivo (P76) |
| Trastorno de ansiedad general (P82) | Neoplasias malignas (A79, B72-75, D74-78, F75, H75, K72, L71, L97, N74-76, R84-86, T71-73, U75-79, W72-73, X75-81, Y77-79) | Otras enfermedades neurológicas (N99) |
CIAP-2: The International Classification of Primary Care in the European Community13.
Se obtuvieron todos los medicamentos (principios activos y fármacos biológicos) indicados para el tratamiento de la DA (general y específica) según la clasificación ATC (Anatomical Therapeutic Chemical Classification System)18. La información se obtuvo de los registros procedentes de la dispensación farmacológica de medicamentos emitida por la aplicación RCMPS del CatSalut. La elección del medicamento a un paciente en concreto fue a criterio del médico (práctica clínica). Se obtuvieron los medicamentos prescritos durante el periodo de seguimiento (un año). Durante el reclutamiento de los pacientes también se obtuvieron algunos parámetros bioquímicos y antropométricos (presión arterial, índice de masa corporal, glucosa, colesterol total y creatinina sérica).
Uso de recursos y costes asociadosSe consideraron costes directos sanitarios (costes directos) los relacionados con la actividad asistencial (visitas médicas, días de hospitalización, urgencias, solicitudes diagnósticas o terapéuticas, medicación) efectuada por los profesionales; y como costes no sanitarios o indirectos, los relativos a las pérdidas de productividad laboral (días de incapacidad laboral). El diseño del sistema de costes se definió teniendo en cuenta las características de las organizaciones y el grado de desarrollo de los sistemas de información disponibles. El coste fue expresado en coste medio por paciente/año (coste/unitario anual), obtenido durante el seguimiento de los pacientes (un año a partir de la fecha índice). Los diferentes conceptos de estudio y su valoración económica se detallan en la tabla 3 (correspondientes al año 2015). Las tarifas se obtuvieron a partir de la contabilidad analítica del hospital del ámbito del estudio, excepto la medicación y los días de baja laboral. Las prescripciones se cuantificaron según el precio de venta al público por envase en el momento de la prescripción. Los días de incapacidad laboral o pérdidas de productividad se cuantificaron según el salario mínimo interprofesional (fuente: INE)19. En este estudio no se contemplaron los costes directos no sanitarios, es decir, los que se consideran «costes de bolsillo» o pagados por el propio paciente/familia, al no estar registrados en la base de datos y no tener acceso, por diseño del estudio, al propio paciente.
Detalle de los costes/unitarios y de las pérdidas de productividad laboral (año 2015)
| Recursos sanitarios y no sanitarios | Costes unitarios (€) |
|---|---|
| Visitas médicas | |
| Visita médica de atención primaria | 23,19 |
| Visita médica de urgencias | 117,53 |
| Hospitalización (un día) | 320,90 |
| Visita médica de atención especializadaa | 67,50 |
| Pruebas complementarias | |
| Pruebas de laboratorio | 22,30 |
| Radiología convencional | 18,50 |
| Pruebas diagnósticas/terapéuticasb | 37,12 |
| Espirometría/test cutáneos | 15,00 |
| Tomografía axial computarizada | 92,00 |
| Resonancia nuclear magnética | 154,00 |
| Pruebas broncodilatadoras | 56,00 |
| Otras | 37,12 |
| Prescripción farmacéutica | PVPiva |
| Productividad laboral-costes indirectos | |
| Coste por día no trabajado | 101,21 |
PVP: precio de venta al público.
Valores expresados en euros.
El estudio fue clasificado por la Agencia Española del Medicamento y Productos Sanitarios (EPA-OD) y posteriormente fue aprobado por el Comité de Ética de Investigación Clínica de la Universidad Internacional de Cataluña (UIC, Barcelona).
Análisis estadísticoSe realizó una validación de los datos para asegurar la calidad de los resultados. Se efectuó un análisis descriptivo univariante para las variables de interés. Para los datos cualitativos se utilizaron frecuencias absolutas y relativas. Las proporciones e intervalos de confianza (IC) del 95% para los parámetros de interés se basaron en el número total de sujetos con valores no perdidos. Para los datos cuantitativos se emplearon: media, desviación estándar, mediana y percentiles 25 y 75 de la distribución (amplitud intercuartil). Se comprobó la normalidad de la distribución con la prueba de Kolmogorov-Smirnov. En el análisis bivariante se utilizaron las pruebas de ANOVA, ji al cuadrado y correlación lineal de Pearson. Se efectuó un análisis de regresión múltiple para obtener las variables asociadas a la DA y al coste sanitario (procedimiento: pasos consecutivos). La comparación del coste se realizó, según las recomendaciones de Thompson y Barber20, mediante el análisis de la covarianza (ANCOVA), con el sexo, la edad, el índice de Charlson, las BUR y el tiempo desde el diagnóstico como covariables (procedimiento: estimación de medias marginales, ajuste de Bonferroni). Se utilizó el programa SPSSWIN versión 19, estableciéndose una significación estadística para valores de p<0,05.
Análisis de sensibilidadDebido a que la clasificación de la DA grave según los criterios descritos en el estudio podría estar infraestimada (solo se consideraron los pacientes en tratamiento inmunosupresor o biológico, y/o los pacientes hospitalizados), se realizó un análisis de sensibilidad. Este consistió en incluir a los pacientes que se les dispensaron corticoides orales dentro del grupo de la DA grave, para la obtención de los costes sanitarios y las pérdidas de productividad laboral (modelo corregido por covariables).
ResultadosDe una selección inicial de 101.834 sujetos ≥18años asignados a los centros de estudio, 6.287 tenían diagnóstico de DA. Considerando los criterios de exclusión, finalmente se reclutaron para el estudio 6.186 pacientes. En la figura 1 se muestra el diagrama de flujo de pacientes incluidos en el estudio a partir de los criterios de inclusión y exclusión mencionados en el apartado de Pacientes y método. En función de la gravedad de la DA se consideraron 3 grupos; el 55,7% leve (n=3.445), el 38,2% moderada (n=2.361) y el 6,1% grave (n=380).
En la tabla 4 se describen las características generales de la población estudiada según los 3 grupos de estudio. La media de edad de todos los pacientes fue de 47,1años y el 61,6% eran mujeres. La morbilidad asociada a la DA, medida por la BUR, fue de 2,3puntos. En pacientes con DA grave destaca una mayor asociación al asma, al síndrome depresivo y a la dislipidemia, con unos valores del 33,7, 36,3 y 53,7%, respectivamente. Se describen las comorbilidades asociadas también en la tabla 4.
Características basales de la serie estudiada por grupos de estudio
| Grupos de estudio | Leve | Moderada | Grave | Total | p |
|---|---|---|---|---|---|
| Número de pacientes, % | n=3.445 (55,7%) | n=2.361 (38,2%) | n=380 (6,1%) | n=6.186 (100%) | |
| Características sociodemográficas | |||||
| Promedio de edad, años | 44,2 (16,0) | 49,7 (16) | 58,1 (12,7) | 47,1 (16,3) | <0,001 |
| Rangos: | |||||
| 18-44 años | 52,3% | 35,2% | 13,2% | 43,4% | |
| 45-64 años | 35,3% | 43,5% | 50,0% | 39,3% | |
| 65-74 años | 10,4% | 18,0% | 34,2% | 14,8% | |
| ≥75años | 2,0% | 3,2% | 2,6% | 2,5% | <0,001 |
| Sexo (mujeres) | 60,3% | 62,9% | 65,8% | 61,6% | 0,036 |
| Régimen SS (pensionista) | 33,9% | 37,2% | 82,0% | 41,4% | <0,001 |
| Comorbilidad general | |||||
| Promedio de diagnósticos | 1,9 (1,5) | 3,2 (2,0) | 4,3 (1,8) | 2,6 (1,9) | <0,001 |
| Índice de Charlson | 0,2 (0,5) | 0,3 (0,6) | 0,6 (0,8) | 0,3 (0,6) | <0,001 |
| Promedio de BUR | 2,1 (0,8) | 2,5 (0,9) | 2,9 (0,7) | 2,3 (0,9) | <0,001 |
| 1 (comorbilidad muy baja) | 26,0% | 21,0% | 7,9% | 23,0% | |
| 2 (comorbilidad baja) | 34,7% | 19,0% | 4,7% | 26,9% | |
| 3 (comorbilidad moderada) | 39,2% | 53,7% | 75,0% | 47,0% | |
| 4 (comorbilidad elevada) | 0,0% | 6,1% | 11,1% | 3,0% | |
| 5 (comorbilidad muy elevada) | 0,1% | 0,2% | 1,3% | 0,2% | <0,001 |
| Comorbilidades asociadas | |||||
| Hipertensión arterial | 19,6% | 29,2% | 48,7% | 25,1% | <0,001 |
| Diabetes mellitus | 7,0% | 11,7% | 22,9% | 9,8% | <0,001 |
| Dislipidemia | 28,6% | 39,1% | 53,7% | 34,2% | <0,001 |
| Obesidad | 13,6% | 19,3% | 32,9% | 17,0% | <0,001 |
| Fumadores activos | 22,4% | 19,6% | 18,4% | 21,1% | 0,013 |
| Alcoholismo | 3,5% | 5,1% | 5,5% | 4,2% | 0,003 |
| Cardiopatía isquémica | 2,5% | 5,2% | 10,0% | 4,0% | <0,001 |
| Accidente cerebrovascular | 4,5% | 7,6% | 16,6% | 6,4% | <0,001 |
| Evento cardiovascular | 6,6% | 10,9% | 22,9% | 9,2% | <0,001 |
| Insuficiencias orgánicas | 7,2% | 10,1% | 20,5% | 9,1% | <0,001 |
| Asma | 12,1% | 20,3% | 33,7% | 16,6% | <0,001 |
| Rinitis alérgica | 14,4% | 20,2% | 24,7% | 17,2% | <0,001 |
| Poliposis nasal | 7,5% | 10,9% | 13,4% | 9,2% | <0,001 |
| EPOC | 2,0% | 5,0% | 10,3% | 3,7% | <0,001 |
| Neuropatías | 0,5% | 1,4% | 2,6% | 1,0% | <0,001 |
| Demencias (todos los tipos) | 1,2% | 2,5% | 5,0% | 1,9% | <0,001 |
| Psicosis orgánica | 1,1% | 2,3% | 5,2% | 1,9% | <0,001 |
| Síndrome depresivo | 14,4% | 25,1% | 36,3% | 19,9% | <0,001 |
| Neoplasias malignas | 6,1% | 10,5% | 13,7% | 8,2% | <0,001 |
BUR: bandas de utilización de recursos; EPOC: enfermedad pulmonar obstructiva crónica; SS: seguridad social.
p: significación estadística (los resultados significativos también lo son en las comparaciones por pares).
Valores expresados en porcentaje o media (desviación estándar).
En el modelo multivariante, la DA grave se asoció a la edad del paciente (β=0,159), al sexo femenino (β=0,024) y a la comorbilidad general (BUR, β=0,192); específicamente al asma (β=0,138), depresión (β=0,099), eventos cardiovasculares (β=0,087), obesidad (β=0,085) y tabaquismo (β=0,025). El coeficiente de determinación del modelo (R2) fue del 31,9%.
La distribución de las variables clínicas y la medicación concomitante y específica prescrita durante el periodo de seguimiento de los pacientes por grupos de estudio se muestran en la tabla 5. La media de tiempo desde el diagnóstico fue de 32,0años y la medicación concomitante de 1,4 (DE: 1,0) por paciente/año, siendo los antihistamínicos (74,0%), los ansiolíticos (26,1%) y los antidepresivos (22,7%) los fármacos administrados con mayor frecuencia. En cuanto a la medicación específica prescrita para el tratamiento de la DA, los emolientes (87,2%), corticoides tópicos de potencia baja o intermedia (37,0%), los corticoides tópicos potentes (22,8%) y los inhibidores de la calcineurina (19,6%) fueron los más utilizados. Los pacientes con DA grave en comparación con la moderada y la leve recibieron un mayor número de medicamentos concomitantes (2,2 vs. 1,6 y 1,2; p<0,001); especialmente antihistamínicos (88,1% vs. 74,3% y 70,0%; p<0,001), ansiolíticos (50,5% vs. 32,7% y 18,9%; p<0,001) y antidepresivos (43,9% vs. 28,8% y 16,2%; p<0,001), respectivamente. En los pacientes con DA grave, metotrexato (23,0%) y ciclosporina (65,2%) fueron los fármacos prescritos para el tratamiento de la DA más utilizados.
Distribución de las variables clínicas y de la medicación concomitante y específica prescrita durante el periodo de seguimiento de los pacientes por grupos de estudio
| Grupos de estudio | Leve | Moderada | Grave | Total | p |
|---|---|---|---|---|---|
| Número de pacientes, % | n=3.445 (55,7%) | n=2.361 (38,2%) | n=380 (6,1%) | n=6.186 (100%) | |
| Tiempo desde el diagnóstico, años | |||||
| Media (DE) | 37,1 (3,8) | 27,5 (9,0) | 24,5 (5,5) | 32,0 (9,1) | <0,001 |
| Mediana (P25-P75) | 37,5 (34,6-39,8) | 28,5 (25,8-30,8) | 25,0 (22,7-29,1) | 34,5 (29,8-38,3) | <0,001 |
| Parámetros bioquímicos/antropométricos | |||||
| Presión arterial sistólica, mmHg | 123,9 (15,0) | 124,3 (15,7) | 129,7 (14,7) | 124,9 (15,3) | <0,001 |
| Presión arterial diastólica, mmHg | 73,6 (9,9) | 73,4 (9,9) | 73,1 (9,7) | 73,4 (9,8) | 0,524 |
| Índice de masa corporal, kg/m2 | 26,9 (5,1) | 28,1 (5,4) | 29,7 (5,5) | 27,7 (5,4) | <0,001 |
| Glucosa sérica, mg/dL | 96,2 (24,0) | 96,3 (26,3) | 108,0 (30,5) | 98,2 (26,2) | <0,001 |
| Colesterol total, mg/dL | 191,5 (37,1) | 188,8 (37,3) | 187,0 (39,1) | 190,0 (37,6) | <0,001 |
| Creatinina sérica, mg/dL | 1,2 (0,5) | 1,1 (0,2) | 1,2 (0,5) | 1,2 (0,5) | 0,384 |
| Medicación concomitante | |||||
| Media (DE) | 1,2 (0,9) | 1,6 (0,9) | 2,2 (1,2) | 1,4 (1,0) | <0,001 |
| Número de medicamentos | |||||
| 0 | 24,5% | 12,2% | 9,9% | 18,7% | |
| 1 | 41,5% | 44,2% | 20,3% | 39,0% | |
| 2 | 26,5% | 31,1% | 33,5% | 28,8% | |
| 3 | 6,2% | 9,1% | 25,8% | 10,5% | |
| 4 | 1,2% | 3,2% | 9,3% | 2,7% | |
| 5 | 0,1% | 0,2% | 1,2% | 0,3% | |
| Grupos terapéuticos | |||||
| Antihistamínicos | 70,0% | 74,3% | 88,1% | 74,0% | <0,001 |
| Antibióticos sistémicos | 15,2% | 26,4% | 46,6% | 21,4% | <0,001 |
| Antagonistas de los leucotrienos | 8,5% | 12,4% | 20,8% | 10,8% | <0,001 |
| Antidepresivos | 16,2% | 28,8% | 43,9% | 22,7% | <0,001 |
| Ansiolíticos | 18,9% | 32,7% | 50,5% | 26,1% | <0,001 |
| Antifúngicos | 4,6% | 8,7% | 10,5% | 6,5% | <0,001 |
| Medicación específica | |||||
| Emolientes | 95,4% | 78,4% | 70,0% | 87,2% | <0,001 |
| Corticoides tópicos potencia media-baja | 53,7% | 19,9% | 10,6% | 37,0% | <0,001 |
| Corticoides tópicos potentes | – | 66,0% | 35,2% | 22,8% | <0,001 |
| Inhibidores de la calcineurina | – | 61,5% | 25,8% | 19,6% | <0,001 |
| Fototerapia: UVBnb/UVB/UVA/PUVA | – | 26,6% | 20,8% | 9,7% | <0,001 |
| Corticoides sistémicos | – | 15,8% | 35,3% | 6,3% | <0,001 |
| Ciclosporina | – | – | 65,2% | 1,7% | <0,001 |
| Metotrexato | – | – | 23,0% | 2,6% | <0,001 |
| Azatioprina | – | – | 8,5% | 0,7% | <0,001 |
| Mofetilo micofenolato | – | – | 15,2% | 1,1% | <0,001 |
| Rituximab | – | – | 9,9% | 0,3% | <0,001 |
| Omalizumab | – | – | 12,9% | 1,1% | <0,001 |
DE: desviación estándar; P: percentil 25-75 de la distribución.
Valores expresados en porcentaje o media (DE).
p: significación estadística (los resultados significativos también lo son en las comparaciones por pares).
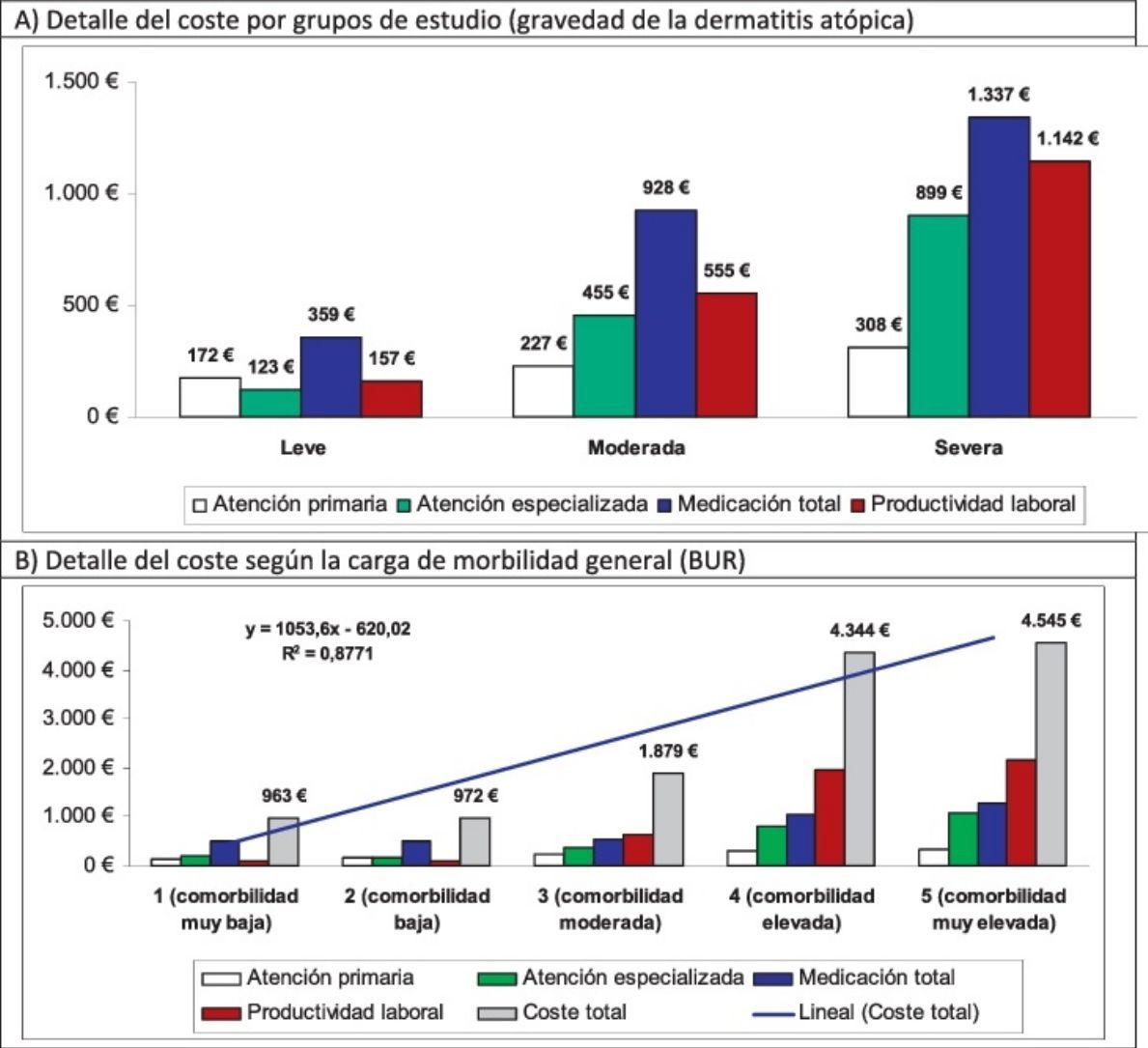
En la tabla 6 se describe el uso de los recursos y sus costes asociados (sanitarios y no sanitarios) según los grupos de estudio. Los pacientes con DA grave utilizaron más recursos sanitarios, especialmente en visitas médicas en AP (7,8 vs. 5,9 y 4,7; p<0,001), atención especializada (5,4 vs. 3,0 y 1,3; p<0,001) y días de incapacidad laboral (11,3 vs. 5,5 y 1,6; p<0,001), respectivamente. El promedio de días de hospitalización fue de 0,30 (n=18). La estancia media de los pacientes hospitalizados fue de 6,6días. Durante el periodo de seguimiento no hubo ningún fallecimiento.
Uso de recursos y costes sanitarios y no sanitarios (promedio unitario) por grupos de estudio
| Grupos de estudio | Leve | Moderada | Grave | Total | p |
|---|---|---|---|---|---|
| Número de pacientes, % | n=3.445 (55,7%) | n=2.361 (38,2%) | n=380 (6,1%) | n=6.186 (100%) | |
| Uso de recursos | |||||
| Visitas médicas, atención primaria | 4,7 (2,4) | 5,9 (3,1) | 7,8 (1,9) | 5,3 (2,8) | <0,001 |
| Pruebas de laboratorio | 1,7 (1,3) | 2,2 (1,7) | 2,8 (1,4) | 2,0 (1,5) | <0,001 |
| Radiología convencional | 0,9 (1,1) | 1,4 (1,5) | 2,2 (1,8) | 1,2 (1,3) | <0,001 |
| Pruebas complementarias | 0,1 (0,4) | 0,2 (0,6) | 0,4 (0,8) | 0,2 (0,5) | <0,001 |
| Días de hospitalización | – | – | 0,3 (2,3) | 0,0 (1,0) | <0,001 |
| Visitas médicas, hospitalarias | 1,3 (1,5) | 3,0 (2,5) | 5,4 (3,1) | 2,2 (2,3) | <0,001 |
| Urgencias, hospitalarias | 0,3 (0,9) | 2,1 (2,3) | 3,8 (3,5) | 1,2 (2,1) | <0,001 |
| Días de incapacidad laboral | 1,6 (5,8) | 5,5 (11,9) | 11,3 (15,1) | 3,7 (9,7) | <0,001 |
| Costes brutos | |||||
| Costes sanitarios | 654 (209) | 1.610 (970) | 2.544 (1.200) | 1.135 (899) | <0,001 |
| Costes en atención primaria | 531 (144) | 1155 (591) | 1.645 (537) | 838 (542) | <0,001 |
| Visitas médicas | 103 (52) | 129 (67) | 171 (42) | 117 (61) | <0,001 |
| Pruebas de laboratorio | 39 (29) | 52 (39) | 64 (33) | 46 (35) | <0,001 |
| Radiología convencional | 22 (25) | 33 (34) | 50 (42) | 28 (31) | <0,001 |
| Pruebas complementarias | 8 (23) | 13 (35) | 23 (45) | 11 (30) | <0,001 |
| Medicamentos | 359 (109) | 928 (552) | 1.337 (530) | 636 (495) | <0,001 |
| Costes en atención especializada | 123 (125) | 455 (656) | 899 (1.041) | 297 (537) | <0,001 |
| Días de hospitalización | – | – | 113 (928) | 17 (396) | <0,001 |
| Visitas médicas | 87 (94) | 192 (163) | 352 (200) | 143 (151) | <0,001 |
| Urgencias | 36 (98) | 237 (261) | 434 (404) | 137 (237) | <0,001 |
| Costes no sanitarios (productividad) | 157 (582) | 555 (1.199) | 1.142 (1.526) | 370 (977) | <0,001 |
| Costes totales | 811 (646) | 2.165 (1.774) | 3.686 (1.955) | 1.504 (1.548) | <0,001 |
| Modelo de costes corregidosa | |||||
| Costes sanitarios | 689 | 1.572 | 2.340 | – | <0,001 |
| IC del 95% | 665-712 | 1.544-1.600 | 2.268-2.412 | ||
| Costes en atención primaria | 551 | 1.132 | 1.532 | – | <0,001 |
| IC del 95% | 537-564 | 1.116-1.148 | 1.489-1.574 | ||
| Costes en atención especializada | 137 | 440 | 808 | – | <0,001 |
| IC del 95% | 120-154 | 419-460 | 755-861 | ||
| Costes no sanitarios (productividad) | 196 | 538 | 1.057 | – | <0,001 |
| IC del 95% | 164-228 | 500-576 | 958-1.155 | ||
| Costes totales | 885 | 2.111 | 3.397 | – | <0,001 |
| IC del 95% | 841-928 | 2.058-2.163 | 3.262-3.531 | ||
IC del 95%: intervalo de confianza del 95%; p: significación estadística (los resultados significativos también lo son en las comparaciones por pares).
Valores expresados en media (desviación estándar).
El coste total de los pacientes incluidos en el estudio ascendió a 9,3 millones de euros, de los cuales el 75,5% correspondieron a costes sanitarios y el 24,5% a costes no sanitarios (pérdidas de productividad). Del total de los costes sanitarios, el 55,7% se produjo en AP y el 19,7%, en atención especializada. La medicación concomitante/específica generó el mayor componente de los costes totales (42,3%), seguido de las visitas en atención especializada (9,5%) (tabla 6). En el estudio, el promedio unitario del coste total de la DA fue de 1.504euros/año. Los promedios unitarios del coste sanitario de los sujetos con DA grave, en comparación con la moderada y leve, fueron mayores (3.686 vs. 2.165 y 811euros, respectivamente, p<0,001). Todos los componentes de los costes sanitarios fueron superiores en los pacientes con DA grave. Los promedios unitarios corregidos por covariables (ANCOVA) del coste total fueron mayores en los pacientes con DA grave en comparación con los pacientes con DA moderada y DA leve (3.397 vs. 2.111 y 885euros, respectivamente, p<0,001). Estas diferencias se mantuvieron para los costes sanitarios (2.340 vs. 1.572 y 689euros; p<0,001) y los costes no sanitarios (pérdidas de productividad laboral: 1.057 vs. 538 y 196euros, p<0,001), respectivamente.
En el modelo de correlaciones binarias el coste sanitario tuvo una elevada correlación con la gravedad de la DA (r=0,715), con la comorbilidad (BUR; r=0,455), el número de medicamentos prescritos (r=0,400) y la edad (r=0,297), p<0,001.
En el modelo de regresión lineal múltiple (método: pasos consecutivos), el coste se asoció a la gravedad de la DA (β=0,398), a la comorbilidad (BUR; β=0,239), al asma (β=0,231) y al número de medicamentos administrados (β=0,187); p<0,01 en todos los casos. En la figura 2 se muestra la distribución de los principales componentes del coste total por los grupos de estudio y carga de morbilidad. La proporción del coste en atención especializada en relación con el coste total es mayor en la DA moderada/grave. Destaca el mayor coste sanitario de los pacientes con elevada comorbilidad (tendencia lineal: 4.545euros).
Distribución de los principales componentes del coste total por los grupos de estudio y carga de morbilidad.
Resultados estadísticamente significativos (p<0,05) en todas las comparaciones por pares.
BUR: bandas de utilización de recursos; R2: coeficiente de determinación del modelo lineal.
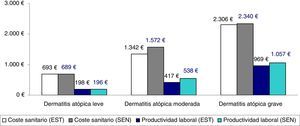
La comparación entre los costes sanitarios y las pérdidas de productividad en función de la clasificación de la gravedad según el tratamiento administrado (promedio/unitario corregido) se muestra en la figura 3 (análisis de sensibilidad). No se observan diferencias clínicamente relevantes en función de las dos clasificaciones de DA grave analizadas.
Análisis de sensibilidad. Comparación entre los costes sanitarios y las pérdidas de productividad en función de la clasificación de la gravedad según el tratamiento administrado (promedio/unitario).
EST: resultados del estudio realizado. Los pacientes con dermatitis atópica grave fueron aquellos en tratamiento inmunosupresor o biológico, y/o los pacientes hospitalizados (grupos: leve, n=3.445; moderada, n=2.361 y grave, n=380).
SEN: análisis de sensibilidad. Se incluyeron los pacientes con uso de corticoides orales en el grupo de la dermatitis atópica grave (grupos: leve, n=3.445; moderada, n=2.075 y grave, n=666).
La DA es una enfermedad que origina un alto consumo de recursos, e implica una carga económica importante para los sistemas de salud, los pacientes y sus familias, especialmente en la DA grave21. El presente estudio permitió comprobar cómo el impacto económico promedio en la DA del adulto se calculó en 1.504euros, con diferencias notables entre las formas graves, cuyo impacto económico (3.686euros) superó en más de 4 veces la asociada a las formas leves (811euros). Además, la DA grave se asoció a la edad, al sexo femenino y a la presencia de mayor comorbilidad general (asma, depresión, eventos cardiovasculares, obesidad y tabaco). El peso de estos factores en el pronóstico de la DA ha sido también contrastado por otros estudios, circunstancia que confiere coherencia a nuestro trabajo22,23. La mayor parte del gasto estuvo relacionado con costes sanitarios, un 75,5%, frente a un 24,5% atribuible a pérdidas de productividad. De los primeros, la mayor parte tuvo que ver con la prescripción farmacológica, seguida de la atención especializada. Sin embargo, debe tenerse en cuenta que no se incluyeron los gastos de bolsillo de los pacientes y sus familias tanto directos como indirectos que pueden tener que ver con complementos terapéuticos fuera de prescripción o relacionados con los costes asociados a las visitas, no identificables como pérdidas laborales. Las comparaciones con respecto a trabajos similares son complejas, teniendo en cuenta las diferencias en los ámbitos sanitarios y también en el propio diseño de los estudios. Kim et al.11, en un estudio realizado en Corea, encontraron un coste directo anual de alrededor de 2.102euros, con una imputación a costes sanitarios y a pérdidas de productividad similar a lo descrito en el presente estudio. Fowler et al.24, en un estudio retrospectivo (n=41.247), describieron un promedio de 991dólares estadounidenses por paciente/año, destacando que un 38% eran en días de incapacidad laboral. Suh et al.25 destacaron cómo el coste asociado a fármacos para la DA se incrementaba en los casos asociados a asma, tal y como también observamos en nuestro estudio, pasando de 482dólares estadounidenses a 973 el coste en medicamentos de la DA cuando está asociada al asma y/o rinitis. Whiteley et al.26 destacaron un 30% del coste en pérdidas de productividad anual y su impacto en la calidad de vida. Finalmente, Drucke et al.27, en una reciente revisión, mencionan el elevado impacto económico, social, ocupacional y en la calidad de vida de los pacientes con DA estimando el coste anual de la DA, desde una perspectiva conservadora, en unos 5.297millones de dólares –en una población aproximada de 322 millones de individuos– en el año 2016.
En el presente estudio destaca que, además de la gravedad de la DA, la presencia de comorbilidad y el asma bronquial se relacionaron con un mayor uso de recursos y costes sanitarios para el Sistema Nacional de Salud. De hecho, solo el coste sanitario de los pacientes con elevada comorbilidad fue de 4.545euros. Esta observación permite sugerir que el ámbito de la DA trasgrede el meramente cutáneo y que la optimización tanto de costes como de resultados podría beneficiarse de una aproximación multidisciplinaria.
Según los parámetros empleados en el estudio, la gravedad de la DA fue clasificada como leve en el 55,7% (n=3.445), moderada en el 38,2% (n=2.361) y grave en el 6,1% (n=380). Al tratarse de un estudio sobre una base poblacional, en la que tanto la descripción clínica por parte de los facultativos como su ámbito –atención primaria y especializada– fueron variados, se eligió el tratamiento administrado como parámetro para la clasificación de la gravedad de la enfermedad. Aunque existen escalas validadas para la gradación de la DA, tales como Scoring Atopic Dermatitis (SCORAD), Eczema Area and Severity Index (EASI), Six Area Six Sign Atopic Dermatitis Severity Index (SASSAD), todas ellas se emplean de forma restringida en los ensayos clínicos, pero no forman parte de la práctica clínica habitual. Existen diversos algoritmos que proponen un escalado terapéutico en función de la gravedad, por lo que la identificación de los fármacos prescritos, que sí pudieron registrarse de forma fidedigna, son un marcador de los recursos empleados por el facultativo para modular el curso de la enfermedad cutánea15,28. Sin embargo, teniendo en cuenta que el empleo de fármacos sistémicos inmunosupresores puede restringirse a menudo a ámbitos especializados, no puede descartarse que el sistema empleado se asocie a una infravaloración de los casos graves.
Aunque podría plantearse que las oscilaciones en el curso de la DA podrían condicionar el criterio de clasificación durante el periodo de reclutamiento, la frecuencia estimada de brotes, en particular en las formas moderadas y graves, lo hacen poco probable. En este sentido, en nuestro país, los resultados del estudio ACTIDA29 realizado sobre la base de 227 dermatólogos (n=1.441) detallaron una media de 3,6brotes/año. La mayoría de los pacientes (97,2%) indicaron que siempre o en ocasiones solicitaron una valoración médica.
Los resultados observados muestran una elevada heterogeneidad en el tratamiento de la DA, especialmente en su forma grave. Además de los tratamientos asociados a la DA, destaca el elevado uso como medicación concomitante de antihistamínicos, ansiolíticos o antidepresivos, aunque no puede cerciorarse en qué medida su prescripción tiene o no que ver con el manejo de la DA. Sin embargo, está bien reconocida la relación entre cuadros de ansiedad, depresión y DA22.
Entre la medicación prescrita para el tratamiento de la DA los fármacos más utilizados fueron los corticoides sistémicos, el metotrexato y la ciclosporina. La ciclosporinaA es el único fármaco aprobado para el tratamiento de la DA y el considerado de elección en diversas guías y recomendaciones23. Metotrexato, azatioprina y micofenolato mofetilo son considerados fármacos de segunda línea, con perspectivas moderadas de respuesta y un perfil de seguridad que a menudo condiciona la suspensión del tratamiento. No existe prioridad de uno u otro tratamiento, por lo que la elección puede venir condicionada por los hábitos de prescripción en los centros especializados de referencia en el estudio30.
Las pautas de corticoides sistémicos, por el contrario, sí que fueron un recurso terapéutico frecuente. Aunque en general la corticoterapia sistémica no se considera una estrategia terapéutica de primera línea y en general se desaconseja su empleo por la falta de evidencia científica y por el perfil de efectos secundarios, es un recurso habitual en el control clínico de las exacerbaciones31.
Teniendo en cuenta que no existe homogeneidad en los algoritmos terapéuticos propuestos entre el valor de los corticoides sistémicos como marcador de formas graves o moderadas de DA, se llevó a cabo un análisis de sensibilidad en el que se contemplaron ambas posibilidades. Los resultados, reflejados en la figura 3, ponen de manifiesto cómo el uso o no de estos fármacos, que puede tener relación con hábitos de prescripción en determinados centros o profesionales, tienen un escaso impacto en la clasificación final.
El presente estudio presenta algunas limitaciones. Las relacionadas con la clasificación de la enfermedad en los grupos de leve, moderada y grave fueron comentadas anteriormente. Sin embargo, la gravedad ponderada por el tratamiento refleja bien el impacto económico de su manejo. La medida operativa de los costes está relacionada con el ámbito geográfico estudiado, circunstancia que puede limitar su extensión a otros sistemas sanitarios de estructura diferente. El carácter retrospectivo podría favorecer el infrarregistro de la enfermedad o la posible variabilidad condicionada por los profesionales y pacientes, al ser un diseño observacional. En este aspecto, la posible inexactitud de la codificación diagnóstica en cuanto al diagnóstico de DA moderada/grave y otras comorbilidades, o bien la falta de alguna variable que pudiera influir en los resultados finales (nivel socioeconómico de los pacientes, exposición al trabajo, evolución de la dosis farmacológica prescrita, adherencia terapéutica, las causas de la DA, los fenotipos, etc.), deben considerarse como una limitación del estudio. Sin embargo, debe destacarse, por el contrario, el elevado número de individuos reclutados en un periodo de tiempo limitado y bien definido para todos ellos, circunstancia que difícilmente sería posible en un estudio retrospectivo multicéntrico o prospectivo realizado en el mismo ámbito a partir de la recogida de datos por parte de los clínicos. Tampoco se detallaron la superposición de medicamentos entre los periodos de brote o de mantenimiento debido a su dificultad en la medición. Además, la validez externa de los resultados (representatividad de la población regional y nacional), la evaluación de costes indirectos (únicamente por las pérdidas de productividad laboral) y la distinción entre DA moderada y grave deben considerarse como posibles limitaciones del estudio.
El tratamiento de la DA supone un elevado coste en consumo de recursos y en costes sociales. Sin embargo, el presente trabajo no estaba diseñado para recoger los resultados en salud asociados con dicho coste. Diversos trabajos concluyen que, a pesar de los tratamientos disponibles, existen necesidades terapéuticas no cubiertas, en particular para los pacientes con las formas más graves de DA3,15. Por este motivo, es factible, aunque especulativo, que este consumo de recursos se realizase además con escasa eficiencia, circunstancia que sería en particular exigible en el subgrupo de pacientes con formas graves y mayor consumo de recursos. La llegada de nuevos tratamientos biológicos, en estos momentos en fases avanzadas de desarrollo, permite avanzar mejoras en las perspectivas de respuesta en las formas graves de la enfermedad21.
Las mejoras proporcionadas por estos fármacos pueden, sin embargo, asociarse a un incremento en los costes directos de la enfermedad relacionados con el coste farmacológico, como se ha observado en el caso de la psoriasis u otras enfermedades inflamatorias crónicas, que deberán ser ponderados con las mejoras en los costes sanitarios globales –número de visitas, ingresos hospitalarios, exploraciones complementarias– y sociales32. En este sentido, resulta fundamental conocer cuál es el impacto basal de la enfermedad antes de este posible cambio de paradigma.
El presente trabajo pone de manifiesto un impacto notable de la DA del adulto en los costes sanitarios y sociales, mayor en las formas graves y en aquellas asociadas a comorbilidades. En sucesivos estudios deberá estudiarse cuáles son los resultados en salud de esta carga de la enfermedad, y profundizar en las necesidades no cubiertas de esta dermatosis crónica.
FinanciaciónEl estudio fue patrocinado por Sanofi.
Conflicto de interesesA. Sicras es un consultor independiente financiado por Sanofi en relación con el desarrollo de este manuscrito. José-Manuel Carrascosa ha participado como investigador en ensayos clínicos promovidos por Sanofi.