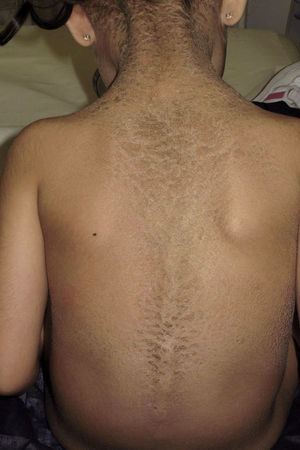
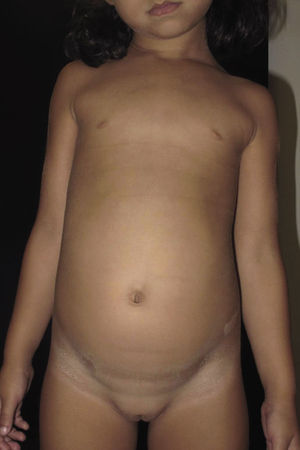
La ictiosis en bañador o ictiosis en traje de baño (ITB) es un tipo infrecuente de ictiosis clasificada dentro de las ictiosis congénitas autosómicas recesivas (ICAR), junto a la ictiosis lamelar (IL), la eritrodermia ictiosiforme congénita (EIC), la ictiosis arlequín y el bebé colodión autorresolutivo (BCA). Estas a su vez se encuentran dentro de las ictiosis no sindrómicas1,2 y su prevalencia estimada en España es de 7,2 casos por millón de habitantes, habiéndose reportado un total de 144 pacientes. De estos solo están documentados 2 casos de ITB, lo que supone un 1,4% del total de ICAR3. La ITB fue descrita como entidad propia en 20054 y se caracteriza por presentarse al nacimiento en forma de bebé colodión, adoptando generalmente a los pocos meses su distribución característica, en forma de escamas gruesas de color marronáceo respetando las extremidades y la cara, simulando un bañador de mujer2,5. Este cuadro se debe a mutaciones en el gen TGM-11,2,5–8, que provocan un fenotipo similar a la IL pero más leve y dependiente de la temperatura corporal, donde la función de la enzima transglutaminasa-1 se encuentra solo alterada en las zonas más calientes del cuerpo, generalmente las regiones centrales8.
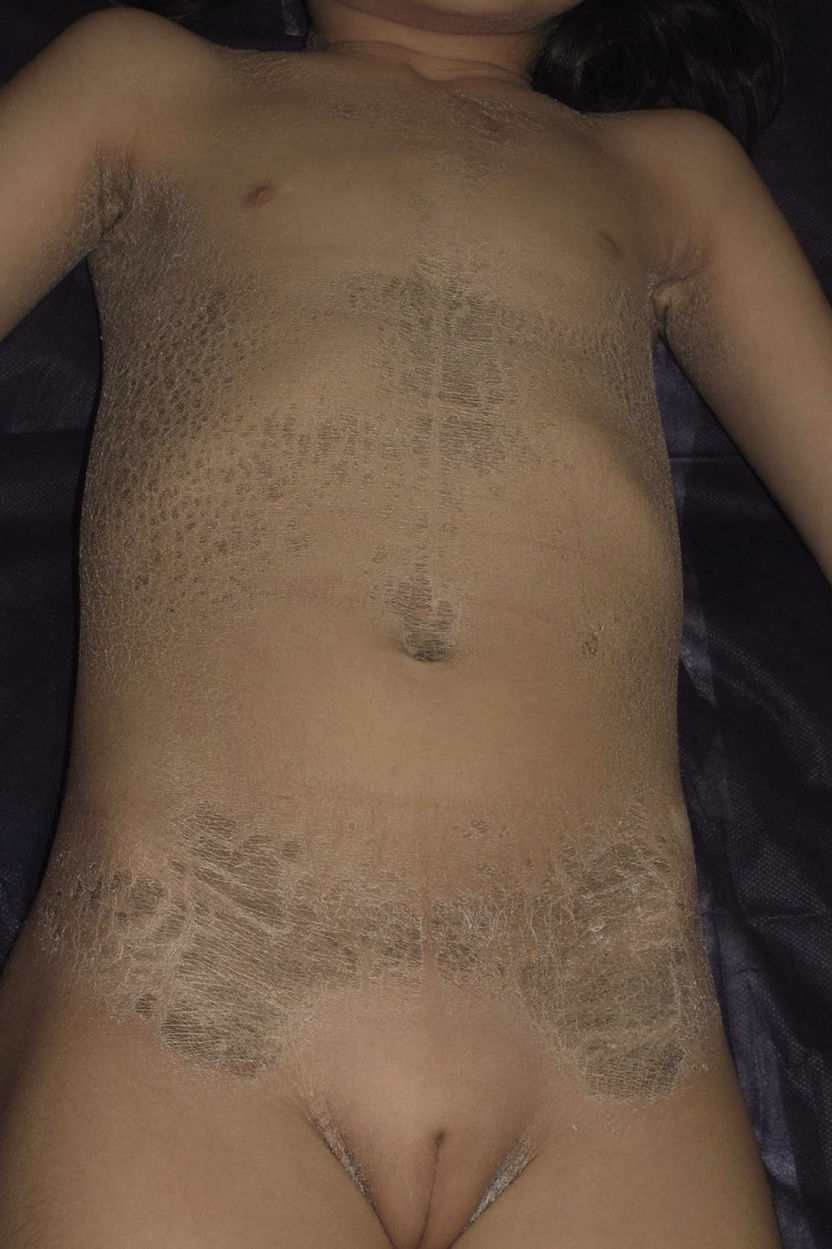
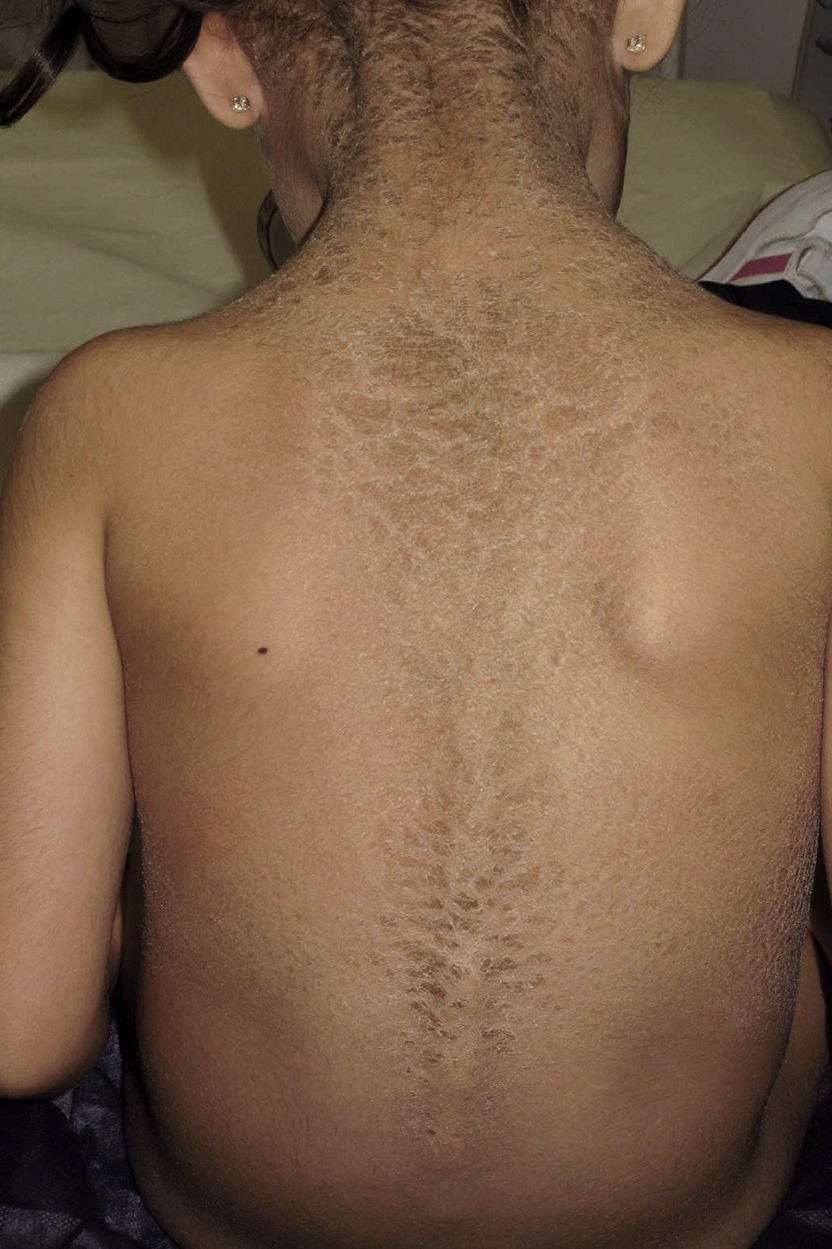
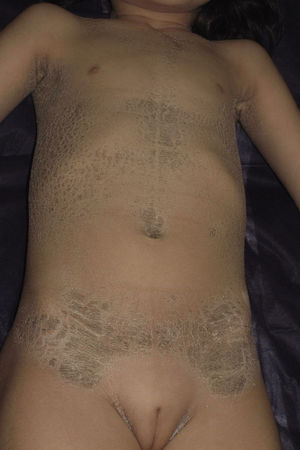
Presentamos a una niña de origen español de 6 años de edad,sin antecedentes familiares de interés ni consaguinidad conocida, fruto de una segunda gestación bien controlada, que presentó al nacimiento en forma de bebé colodión. Tras resolverse este cuadro, sin complicaciones, inicia a los 6 meses un cuadro cutáneo en forma de escamas gruesas de color marronáceo, con una distribución particular, afectando únicamente las regiones inguinales, axilares (figs. 1 y 2) y parte central del tronco con respeto total de la cara, las extremidades, las manos y los pies. Se observaba además descamación difusa y eritema en el cuero cabelludo. Destacaba la ausencia de afectación de las uñas o el pelo, alteraciones de la sudoración u otros signos de afectación sistémica. Tampoco se objetivaron déficits en su desarrollo psicomotor. Ante la sospecha de ITB decidimos realizar el estudio genético que confirmó dicha sospecha tras encontrar 2 mutaciones patogénicas conocidas en heterozigosis, en ambos alelos del gen TGM-1: c.424C>T; p.Arg142Cys descrita en ITB8 y c.919C>G; p.Arg307Gly descrita en IL9.
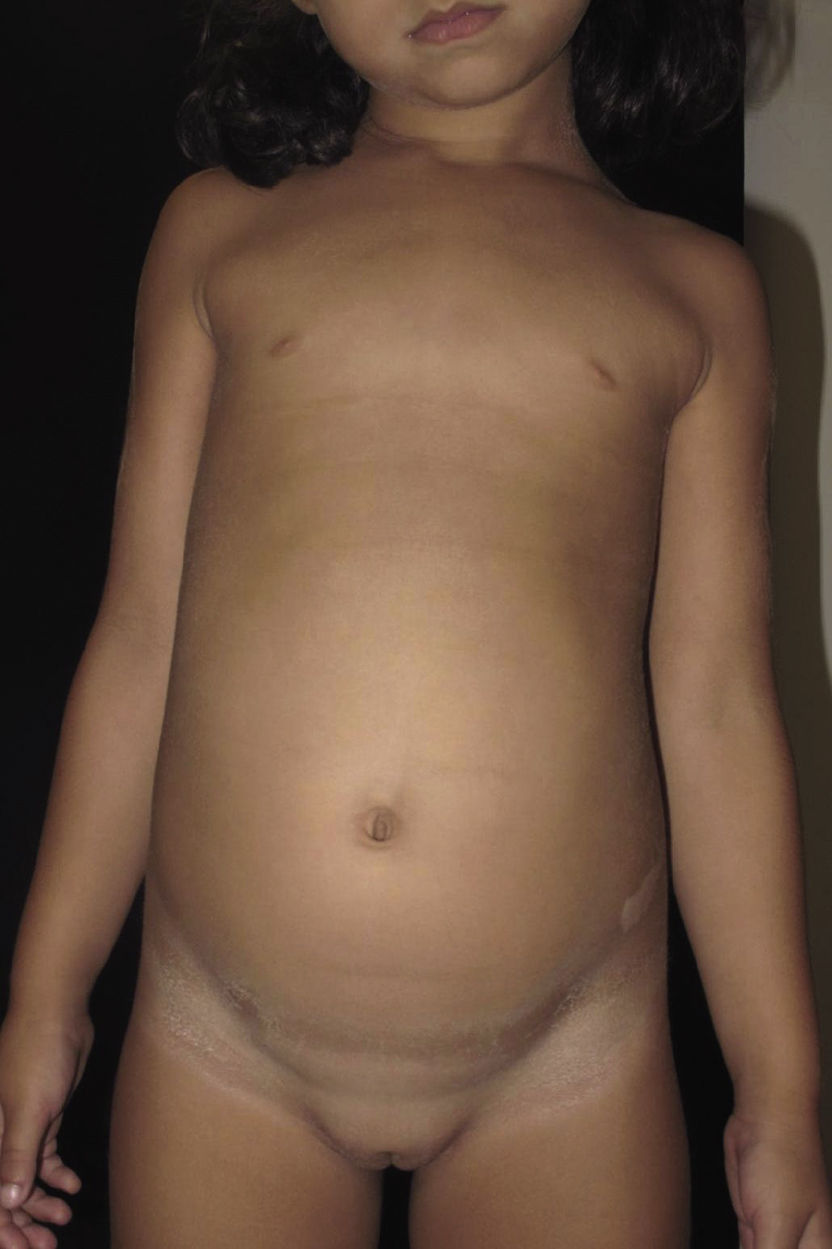
La evolución de la paciente ha seguido en todo momento el curso habitual de la enfermedad, siendo esta crónica y recurrente, controlándose con medidas humectantes y la aplicación de fórmulas de N-acetil-cisteína al 10% y urea al 5%10 (fig. 3). Sin embargo, el mal olor de las fórmulas con N-acetil-cisteína en algunos momentos ha condicionado la adherencia al tratamiento.
Tras 3 años de buen control la madre nos consultó por un nuevo embarazo y la posibilidad de gestar otro hijo afecto de ITB. Hoy en día se conocen 7 genes implicados en los diferentes tipos de ICAR. De ellos, sin duda el gen más frecuentemente implicado es el TGM-16,7. Sin embargo, este es el único gen conocido implicado en la ITB6. De esta entidad se han encontrado 20 mutaciones distintas, de las cuales 9 son exclusivas de la ITB, mientras que las otras 11 son mutaciones compartidas entre los diferentes tipos de ICAR5. Así, dos individuos con las mismas mutaciones se pueden presentar con fenotipos diferentes5,6. De hecho, están descritas familias donde hermanos con las mismas alteraciones genéticas presentan diferentes tipos de ICAR5. También están descritos algunos casos de forma aislada donde el fenotipo ha sido cambiante, evolucionando con la edad de ITB a formas generalizadas de IL/EIC o incluso a bebé colodión autorresolutivo5,6. Seguramente existen algunos factores ambientales que pueden influir a su vez en la expresión fenotípica de estos cuadros genéticamente idénticos. En nuestro caso, una de las mutaciones encontradas estaba ya descrita previamente en IL9. Dada esta posibilidad descrita en la literatura de IL en hermanos afectos de ITB con las mismas mutaciones5,6, decidimos conjuntamente con la madre realizar diagnóstico prenatal y se pudieron descartar mutaciones en el gen de TGM-1 en el feto. La gestación se desarrolló sin incidentes, dando fruto a un bebé sano.
En conclusión, la ITB es una genodermatosis poco frecuente, clasificada dentro de las ICAR, que tiene una serie de peculiaridades tanto clínicas como diagnósticas que es interesante conocer. Aunque el diagnóstico suele ser clínico, la única manera de confirmarlo es mediante el estudio genético del gen TGM-1. Este es el único gen implicado en esta entidad, pero también el más prevalente en el resto de ICAR, con las que comparte un gran número de mutaciones; así que individuos con la misma carga genética pueden desarrollar diferentes fenotipos, e incluso estos pueden ser dinámicos y cambiar durante la vida. Todos estos aspectos son importantes de cara a la información pronóstica de nuestros pacientes, así como a un correcto consejo genético.
Especial agradecimiento al doctor Rogelio González Sarmiento, de la Unidad de Medicina Molecular de la Universidad de Salamanca, por realizar el estudio genético.