La filagrina es una proteína estructural fundamental para el desarrollo y mantenimiento de la barrera cutánea. En los últimos años se ha llevado a cabo una extensa investigación sobre su función y su implicación en distintos trastornos cutáneos y extracutáneos. Se ha comprobado que las mutaciones en el gen que la codifica, el gen FLG, son la causa de la ictiosis vulgar y confieren un mayor riesgo de desarrollar dermatitis atópica y otras enfermedades atópicas, además de agravar algunas enfermedades. El presente artículo revisa la información existente en cuanto a su papel en la barrera cutánea, así como respecto a las mutaciones en el gen FLG y las consecuencias que conlleva el déficit de filagrina.
Filaggrin is a structural protein that is fundamental in the development and maintenance of the skin barrier. The function of filaggrin and its involvement in various cutaneous and extracutaneous disorders has been the subject of considerable research in recent years. Mutations in FLG, the gene that encodes filaggrin, have been shown to cause ichthyosis vulgaris, increase the risk of atopic dermatitis and other atopic diseases, and exacerbate certain conditions. The present article reviews the current knowledge on the role of filaggrin in the skin barrier, FLG mutations, and the consequences of filaggrin deficiency.
La principal función de la piel es actuar como una barrera que separa el medio interno del medio externo, protegiendo de agentes agresores exógenos y minimizando la pérdida de agua y otros componentes fundamentales del organismo hacia el exterior1. En el desarrollo de la barrera cutánea destaca la filagrina, tanto por su papel fundamental en la diferenciación epidérmica terminal como por su implicación en algunas de las enfermedades dermatológicas más frecuentes, como la dermatitis atópica (DA) o la ictiosis vulgar (IV)2. La filagrina es una importante proteína estructural que fue identificada por primera vez en 19773. Posteriormente, al observar que producía una agregación y compactación de los filamentos intermedios de queratina, se introdujo el término filagrina (filaggrin) para nombrarla, acrónimo de filament-aggregating protein4. Esta proteína se sintetiza en forma de un precursor proteico gigante denominado profilagrina, que es el principal componente de los gránulos de queratohialina del estrato granuloso de la epidermis.
Papel de la filagrina en la formación de la barrera epidérmicaEl elemento fundamental de la barrera cutánea es el estrato córneo. Este estrato es el producto final de la diferenciación de los queratinocitos, que son células nucleadas y viables desde la capa basal hasta la capa granulosa y que van expresando distintas proteínas estructurales según van madurando5. En los pasos finales de la diferenciación queratinocítica, estas células sufren cambios profundos en su estructura que provocan su transformación en células escamosas planas anucleadas: los corneocitos. Estos corneocitos, que permanecen firmemente unidos entre sí mediante corneodesmosomas, están recubiertos por una envoltura celular llamada envoltura cornificada (EC), que tiene una porción proteica y otra lipídica y que les provee de resistencia mecánica y química5. Entre ellos existe una matriz extracelular hidrófoba rica en lípidos dispuestos en bicapas laminares6. A esta organización del estrato córneo se la ha denominado «en ladrillos y cemento», donde los ladrillos son los corneocitos y el cemento, la matriz lipídica extracelular7.
En la epidermis existe un gradiente de calcio, de modo que se detecta una baja concentración en la capa basal, más baja en el estrato espinoso y alta en el estrato granuloso, siendo de nuevo muy baja en el estrato córneo8. Este gradiente es importante en la diferenciación terminal de los queratinocitos2,9. El aumento de la concentración de calcio en el estrato granuloso produce la liberación del contenido de los gránulos de queratohialina, de forma que la profilagrina queda expuesta y va a ser procesada y fragmentada en monómeros activos de filagrina10. Esta filagrina libre se une a los filamentos intermedios de queratina produciendo su agregación y compactación, lo cual provoca un colapso y aplanamiento de la célula. Coincidiendo con este proceso, la célula expresa una serie de proteínas estructurales que conforman la porción proteica de la EC11,12 a la cual se unen (por la acción de las transglutaminasas) los filamentos intermedios de queratina agregados por la filagrina6. Además, el aumento del calcio también provoca la liberación del contenido de los cuerpos laminares, gránulos ricos en lípidos y enzimas originados en el aparato de Golgi. A partir de estos lípidos y de la acción de las enzimas liberadas, se constituirá la porción lipídica de la EC y la matriz extracelular del estrato córneo6,11,13.
La filagrina va a seguir siendo procesada por distintas proteasas. Esta proteólisis produce la liberación de aminoácidos higroscópicos y sus derivados, que constituyen el factor humectante natural (FHN), responsable de retener el agua en el estrato córneo14. La degradación de algunos de estos aminoácidos da lugar a la formación de los ácidos orgánicos transurocánico (UCA, derivado de la histidina) y pirrolidona-5-carboxílico (PCA, derivado de la glutamina). Estos ácidos son uno de los principales factores responsables de mantener un pH ácido en el estrato córneo15, el cual es fundamental por su papel en el metabolismo y organización de los lípidos de la matriz extracelular16, por su acción antimicrobiana y por su papel regulador de la actividad enzimática y de la descamación fisiológica17. Además, el UCA tiene un efecto fotoprotector frente a la radiación ultravioleta (UV)18 y ha demostrado ser un mediador clave en la inmunosupresión inducida por los UVB19,20.
Consecuencias del déficit de filagrina en la barrera cutáneaEl déficit de filagrina va a tener una importante repercusión en la barrera epidérmica (tabla 1). Se va a producir una alteración en la organización de los filamentos de queratina del citoesqueleto y en la estructura de la EC. Habrá también una disminución de los gránulos de queratohialina, una disminución marcada del FHN (y por tanto de la hidratación del estrato córneo) y una alcalinización del pH5. A parte de estos cambios, estudios ultraestructurales recientes han revelado que su déficit también se asocia a una disminución global de la densidad de corneodesmosomas y de uniones estrechas intercelulares, así como a anomalías en la arquitectura de la matriz lipídica extracelular, hechos que contribuyen notablemente a la alteración de la función barrera16. Esto estaría provocado por las anomalías en la organización del citoesqueleto (que alteran la maduración y exocitosis de los cuerpos laminares, provocando una distribución no homogénea de los lípidos y enzimas secretados) y con el aumento del pH (que modula la actividad de dichas enzimas)16. Es más, el aumento de actividad de ciertas proteasas causado por la elevación persistente del pH promueve la liberación de mediadores proinflamatorios por parte de los queratinocitos, que inducen una respuesta inflamatoria Th2-mediada incluso en ausencia de alérgenos21. Por ejemplo, la alcalinización del pH aumenta la actividad de las proteasas responsables de la producción de las interleucinas IL-1α e IL-1β a partir de sus proproteínas inactivas generadas por los queratinocitos22.
Consecuencias del déficit de filagrina en la barrera epidérmica
| Repercusiones bioquímicas y estructurales | Consecuencias | |
|---|---|---|
| Superficie cutánea | Aumento del pH | Aumento de adhesión y proliferación de estafilococos |
| Incremento de la actividad de ciertas proteasas | Liberación de mediadores proinflamatorios epiteliales | |
| Capa córnea | Disminución del factor humectante natural | Xerosis |
| Disminución de la densidad de corneodesmosomas y de uniones intercelulares estrechas | Alteración de la función barreraAumento de la exposición a alérgenos | |
| Anomalías en la arquitectura de la matriz lipídica extracelular | ||
| Zona de transición granulosa-capa córnea | Alteración de la maduración y excreción de los cuerpos laminares | Alteración de la función barreraAumento de la exposición a alérgenos |
| Alteración de la agregación de filamentos intermedios de queratina | ||
| Capa granulosa | Disminución de los gránulos de queratohialina | - |
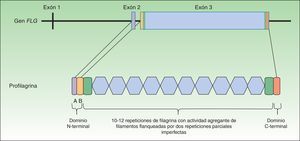
La profilagrina está codificada por el gen FLG, localizado en el complejo de diferenciación epidérmica del cromosoma 1 (locus 1q21), un clúster de genes que codifican proteínas implicadas en la diferenciación epidérmica23. El gen FLG consta de 3 exones y 2 intrones (fig. 1). La transcripción se inicia en el exón 2, pero es el exón 3 el que codifica la mayor parte de la proteína, constituyendo uno de los exones más grandes de todo el genoma24. La proteína codificada (profilagrina) es rica en aminoácidos histidina y contiene entre 10 y 12 repeticiones de filagrina flanqueadas por dominios N- y C- terminales (fig. 1).
Estos dominios también son funcionales. El dominio N-terminal está compuesto a su vez por 2 subdominios: A y B. El subdominio A contiene 2 lugares de unión al calcio25. De este modo, va a ser la unión del calcio a este subdominio lo que va a producir una serie de cambios conformacionales en la molécula de profilagrina que va a dar inicio a su procesamiento2. Por su parte, el subdominio B contiene una señal de localización nuclear que facilita la translocación del dominio N-terminal al núcleo celular cuando es escindido del resto de la proteína26. Se ha sugerido que este dominio N-terminal, una vez dentro, jugaría un papel importante en la pérdida del núcleo que sufre el queratinocito en su transformación a corneocito anucleado27 y se le ha atribuido también un papel en el ensamblaje de la EC28. El dominio C-terminal es imprescindible para un correcto procesamiento de la profilagrina, aunque su función exacta se desconoce2.
Mutaciones en el gen de la filagrina (FLG)Las primeras mutaciones identificadas en el gen FLG fueron la R501X y la 2282del4, en pacientes con IV29. Desde entonces se han descrito muchas más, pero todas ellas son mutaciones de pérdida de función (mutaciones de sustitución de aminoácidos o de alteración en el marco de lectura)21. Además se ha observado que muestran especificidad étnica/geográfica, de tal forma que las mutaciones detectadas en población europea son distintas de las detectadas en población asiática30. También varía la frecuencia de las mismas, ya que en Irlanda 2 mutaciones (R501X y 2282del4) suponen el 80% de todas las mutaciones de FLG, mientras que en Singapur ninguna mutación predomina tanto sobre las otras21. En cuanto a la prevalencia de mutaciones en la población general, sería globalmente de un 7,7% a nivel europeo, mientras que en asiáticos es de un 3%31. Centrándose en los estudios europeos, llama la atención una clara diferencia de prevalencia entre el norte y el sur del continente. La mayoría de publicaciones corresponden al norte, donde se sitúa en un 10% aproximadamente (7-14%)31. Existen solo 2 estudios de población mediterránea, uno de población francesa32 y otro de población italiana33, pero ambos revelan una prevalencia mucho menor, del 4%.
Este gradiente europeo, aparentemente dependiente de la latitud, hace sugerir a los autores italianos que quizás las mutaciones en FLG ofrezcan algún tipo de ventaja de supervivencia en el norte33. Se ha propuesto que esto podría guardar relación con el menor nivel de UCA que presentan estos pacientes, que determina una mayor sensibilidad a la radiación UV18,32,34. De hecho, estudios poblacionales recientes han revelado que los individuos portadores de mutación en FLG tienen unos niveles séricos de vitamina D un 10% superiores a los controles35. En conjunto, estos datos demuestran que en latitudes con menor incidencia de radiación UV los portadores de mutaciones en FLG podrían estar más protegidos de desarrollar enfermedades como el raquitismo31.
En la tabla 2 se enumeran los trastornos que se han relacionado con el déficit de filagrina causado por mutaciones en el gen FLG, que principalmente son la IV y los trastornos atópicos.
Trastornos que han sido asociados a mutaciones en FLG
| Cutáneos |
| Ictiosis vulgar29 |
| Dermatitis atópica45y sus complicaciones:Infección recurrente por Staphylococcus aureus80Eczema herpeticum71 |
| Dermatitis de contacto irritativa86,87 |
| Sensibilización al níquel y dermatitis de contacto alérgica al níquel de inicio más temprano88,89 |
| Eczema crónico de manos90 |
| Alopecia areata: curso más agresivo en pacientes con dermatitis atópica91 |
| Fenotipo más grave de ictiosis recesiva ligada a X92 |
| Fenotipo más grave de paquioniquia congénita93 |
| Extracutáneos |
| Asma55,70 |
| Rinitis alérgica55 |
| Alergia al cacahuete56 |
| Diabetes mellitus tipo 294 |
Fuente: Adaptado de Thyssen et al.51.
La IV es el trastorno de queratinización más frecuente, con una prevalencia estimada de entre 1/80 a 1/250 niños ingleses en edad escolar15, y es la enfermedad de herencia mendeliana causada por las mutaciones en el gen FLG31. Ya en los años ochenta se describió la ausencia (o marcada reducción) de los gránulos de queratohialina en biopsias de pacientes con IV, así como una disminución en la expresión de filagrina detectada por técnicas de inmunotinción36. Sin embargo, hasta 2006 no se identificaron las mutaciones de pérdida de función en el gen FLG como causantes del proceso29, una demora ocasionada por la gran longitud del gen y su secuencia altamente repetitiva, que hacía difícil su secuenciación mediante técnicas de PCR convencionales15. El descubrimiento de estas mutaciones permitió aclarar el patrón de herencia de la enfermedad, que es autosómica semidominante, lo cual explica a su vez la variabilidad fenotípica de la IV. Los pacientes heterocigotos sufren una haploinsuficiencia, es decir, una reducción del 50% en la expresión de filagrina, lo cual provoca una clínica menos marcada (o incluso ausencia de síntomas) siendo más modulable según factores externos como la aplicación de cremas hidratantes o la humedad ambiental. Sin embargo, los individuos homocigotos desarrollan de forma completa las manifestaciones de la enfermedad21,29.
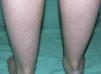
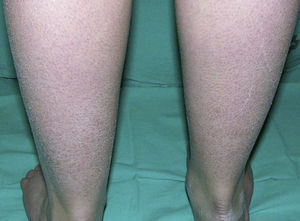
Clínicamente se caracteriza por la aparición posnatal (generalmente en el primer año de vida) de xerosis, queratosis pilar, hiperlinearidad palmar y atopia21. La xerosis se manifiesta en forma de descamación fina, a veces poligonal, que afecta principalmente a la superficie extensora de extremidades, cuero cabelludo, región centrofacial y tronco, mientras que los pliegues suelen estar respetados (fig. 2). El grado de humedad modifica el procesamiento de la filagrina14,37, lo cual explica esta tendencia a respetar los pliegues y también por qué la mayoría de estos pacientes empeoran en invierno, cuando la humedad ambiental es más baja31.
Es frecuente (hasta un 76% de los pacientes con IV) la aparición de fisuras dolorosas en manos, dedos o talones, lo cual está estrechamente relacionado con el grado de humedad ambiental31. Es más, las mutaciones en el gen FLG se han asociado al desarrollo de dermatitis fisurada en dorso de manos y dedos en los pacientes con DA e incluso en la población general31,38.
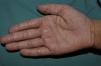
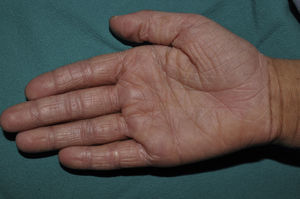
La hiperlinearidad palmar (fig. 3) y la queratosis pilar son hallazgos típicos, no solo en los pacientes con clínica de IV sino también en todos aquellos individuos portadores de mutaciones en FLG. De hecho, un estudio determinó que la hiperlinearidad palmar tiene un valor predictivo positivo del 71% y un valor predictivo negativo (VPN) del 90% para mutación en el gen FLG. Es decir, el 71% de los niños con hiperlinearidad palmar son portadores de mutación, mientras que resulta muy improbable que un paciente sin hiperlinearidad palmar lo sea. En el caso de la queratosis pilar, el valor predictivo positivo era del 53% y el valor predictivo negativo, del 90%39.
Finalmente, un 35-70% de los pacientes con IV van a desarrollar enfermedad atópica, en especial dermatitis, pero también rinitis alérgica y asma40. Este hecho ha provocado una extensa investigación de la relación existente entre las mutaciones en el gen FLG y las enfermedades atópicas, que ha ofrecido datos reveladores sobre la patogénesis de estos trastornos complejos.
Enfermedades atópicas: marcha atópicaLa atopia se define como una tendencia personal o familiar a la sensibilización y producción de anticuerpos IgE en respuesta a la exposición a alérgenos comunes en el ambiente, a los que todos los individuos están expuestos pero frente a los cuales la mayoría no desarrollan ninguna respuesta41. Esta tendencia predispone al desarrollo de las llamadas enfermedades atópicas, que afectan a un 20% de la población de los países desarrollados42. El concepto de marcha atópica fue introducido para describir la tendencia de la DA a preceder el desarrollo secuencial de asma y rinitis alérgica43, lo que sugiere que tiene un papel iniciador del proceso. Recientemente se ha sugerido que las alergias alimentarias también podrían formar parte de esta marcha atópica44.
Mutaciones en FLG e inicio de la marcha atópicaYa en 2006, el mismo año en que se describe su relación con la IV, se encontró que las mutaciones en el gen FLG se asociaban de forma significativa al desarrollo de DA, el primer paso de la marcha45. Tradicionalmente la DA se había considerado un trastorno inmunomediado que se acompañaba de una alteración secundaria de la barrera cutánea. Sin embargo actualmente, sobre todo desde el descubrimiento del papel que juega la filagrina en muchos pacientes, predomina la corriente de pensamiento que la entiende como un trastorno primario de la barrera cutánea40. Según este nuevo enfoque patogénico, en todos los pacientes con DA existe un defecto inherente de la barrera (y de hecho se ha demostrado que está alterada tanto en piel lesional como no lesional46,47). Este defecto puede estar determinado por distintos mecanismos moleculares, siendo uno de los más importantes y frecuentes el déficit de filagrina causado por las mutaciones en el gen FLG15. La alteración de la barrera cutánea, junto con los cambios inmunológicos que origina, dará lugar a las manifestaciones clínicas de la enfermedad21,40,42.
Influencia de las mutaciones en FLG en el sistema inmuneLa alteración del estrato córneo permite la entrada de alérgenos, los cuales son capturados y procesados por las células de Langerhans de la epidermis. Estas migran a los ganglios linfáticos donde interactúan con las células T y promueven una inmunidad Th240,42,48. La sensibilización percutánea a través de una barrera cutánea alterada ha sido demostrada en ratones con mutaciones en FLG49–51 y además se ha visto que pacientes con DA portadores de mutación en FLG tienen una frecuencia significativamente mayor de respuestas Th2 alérgeno-específicas52. La entrada constante de alérgenos acabará produciendo una polarización de la inmunidad adaptativa hacia Th242, caracterizada por la producción local de citocinas Th2 (IL-4, IL-5 e IL-13), aumento de la producción, supervivencia y activación de eosinófilos y mastocitos, y producción de IgE alérgeno-específicas con aumento de la IgE total40. Por otra parte, también promueven esta polarización hacia Th2 toda una serie de citocinas liberadas por los queratinocitos alterados40, como las IL-1 o la thymic stromal lymphopoietin (TSLP), a consecuencia de una mayor actividad de las proteasas endógenas22 y también por la acción de proteasas exógenas (como las liberadas por fuentes de alérgenos [como los ácaros del polvo, cucarachas, hongos y pólenes], o las producidas por Staphylococcus aureus (S. aureus), que frecuentemente coloniza la piel de estos pacientes)53.
Mutaciones en FLG y progresión de la marcha atópicaEstudios recientes han demostrado que los portadores de mutación en FLG tienen un mayor riesgo de progresión de la marcha atópica54, encontrándose en ellos un riesgo significativamente superior de desarrollar asma55, rinitis alérgica55 y alergia alimentaria al cacahuete56 respecto a los no portadores.
La filagrina no se expresa en mucosa bronquial, nasal ni digestiva y, por lo tanto, no habrá alteración de la función barrera a este nivel40,57,58. Así pues, el mecanismo por el cual las mutaciones en FLG promueven respuestas alérgicas en estas mucosas será a través de una sensibilización sistémica a alérgenos que han penetrado a través de una barrera cutánea alterada, no a través de la mucosa. Esto explica la tendencia de la DA a preceder al resto de trastornos atópicos en la marcha atópica5. En consecuencia, es posible que un correcto tratamiento de la DA en los niños, que restaure y mantenga la barrera epidérmica, pueda evitar el desarrollo posterior de asma, rinitis alérgica o alergias alimentarias42. Esto apoya la tendencia creciente a mantener una actitud terapéutica activa (versus reactiva) frente a la DA, sobre todo en los casos con clínica moderada-grave59,60.
Dermatitis atópicaMutaciones en FLG: papel en el riesgo, gravedad, manifestaciones y epidemiología de la dermatitis atópicaLa DA afecta al 20% de los niños, causando un fuerte impacto en su calidad de vida y constituyendo la enfermedad crónica más prevalente de la infancia61. Más de 30 estudios han confirmado su asociación con mutaciones en FLG5 y 2 metaanálisis recientes sitúan la razón de ocurrencia u odds-ratio (OR) de tener DA en asociación a mutación de FLG entre un 3,1262 y un 4,7863. Es decir, los portadores de mutaciones en FLG tienen 4 veces más riesgo de sufrir DA que los no portadores. Pero parece que no solo implica un mayor riesgo, sino también una mayor gravedad64. Globalmente, «solo» un 15-20% de los pacientes europeos con DA son portadores de mutaciones en FLG10. Sin embargo, si estos pacientes se dividen según la gravedad clínica se observa que las mutaciones son mucho más frecuentes en los que presentan una DA moderada-grave (50%) que en aquellos con DA leve (4-15%)65.
Agrupando los datos de todos los estudios realizados hasta el momento, se ha descrito un perfil clínico de DA asociada a mutaciones en FLG (DAFLG) distinto de aquellos en los que no existe mutación subyacente (DAno-FLG)5. De este modo, los pacientes con DAFLG presentan mayor gravedad clínica64, un inicio más temprano66,67, mayor tendencia a persistir en la edad adulta68, mayor alcalinización del pH del estrato córneo69, niveles de FHN mucho menores5, mayor producción de IL-1β en el estrato córneo22, hiperlinearidad palmar39, dermatitis fisurada en dorso de manos más frecuente38, niveles superiores de IgE sérica48, mayor sensibilización alérgica48 y desarrollo de múltiples alergias63, mayor riesgo de asma55,70 y mucho más riesgo de eccema herpeticum (10 veces más)71.
Además, esta división parece también importante desde el punto de vista de la investigación epidemiológica. La prevalencia de DA es muy superior en los países industrializados, por lo que se sospecha la influencia de factores ambientales5. Estudios recientes han demostrado que los niños que tienen un gato (no así un perro) a edades tempranas72,73, así como aquellos que tienen un hermano mayor (que posiblemente implica mayor exposición a patógenos y alérgenos)74 tienen un riesgo significativamente superior de desarrollar DA. Pero este riesgo únicamente lo presentan aquellos que son portadores de mutaciones en FLG. De modo similar, la gravedad clínica se correlaciona con la presencia de IgE específica para ácaros del polvo o caspa de gato entre los pacientes con DAFLG, pero no entre los DAno-FLG10. Por lo tanto, parece importante que en el futuro los estudios epidemiológicos de DA estratifiquen a los pacientes en portadores y no portadores de mutación en FLG5.
Mutaciones en FLG y Staphylococcus aureus en dermatitis atópicaSegún algunos estudios, más del 90% de los pacientes con DA están colonizados por S. aureus (frente al 5% de los sujetos sanos)5,75 y la gravedad clínica de la dermatitis se correlaciona con la cantidad de S. aureus presente en la piel76. Esta colonización está condicionada por la integridad de la barrera cutánea y por la expresión de proteínas bacterianas de adhesión, las cuales también contribuyen a la inflamación5. Se ha demostrado in vitro que el pH ácido del estrato córneo inhibe la expresión de estas proteínas en la superficie bacteriana y que los productos de degradación de la filagrina UCA y PCA son capaces por sí mismos, e independientemente del pH, de inhibir la expresión de algunas de ellas77. Por lo tanto, las mutaciones en FLG van a condicionar una mayor colonización por S. aureus no solo alterando la barrera cutánea sino también aumentando la expresión bacteriana de proteínas de adhesión, al provocar una alcalinización del pH córneo y una disminución de los niveles de UCA y PCA. Además, el «ambiente Th2» que existe en las lesiones de estos pacientes (y que está condicionado en parte por el déficit de filagrina) inhibe la expresión de péptidos antimicrobianos78.
Por otro lado, S. aureus secreta una amplia variedad de factores de virulencia que agravan la inflamación, exacerban las lesiones cutáneas y dificultan su curación77. Entre estos factores de virulencia el más importante es la α-toxina, que induce muerte celular formando poros en la membrana plasmática que provocan citólisis. Un estudio reciente ha demostrado in vitro que los queratinocitos con déficit de filagrina son más vulnerables a la acción de esta toxina que aquellos que la expresan normalmente79. Esto se debe a que las células que no expresan filagrina tienen también una expresión disminuida de esfingomielinasa, lo cual se traduce en un aumento de esfingomielina, un lípido de la membrana plasmática que sirve de receptor para la α-toxina79.
En definitiva, las mutaciones en FLG no solo van a facilitar la colonización por S. aureus sino que también van a hacer que los queratinocitos sean más vulnerables a la acción de sus toxinas. De hecho, en un estudio se observó que los pacientes con DA portadores de mutación (comparados con los no portadores) tenían 7 veces más riesgo de sufrir más de 4 episodios al año de infección cutánea que requiriera tratamiento antibiótico80.
A nivel terapéutico, todos estos datos apoyan la necesidad de tomar medidas que reduzcan la colonización por S. aureus y que acidifiquen el pH cutáneo para obstaculizarla77.
Otros mecanismos de déficit de filagrina en dermatitis atópicaAunque las mutaciones en FLG pueden justificar muchos casos de DA (sobre todo graves), una gran parte de estos pacientes no son portadores de ninguna mutación10. Sin embargo, se ha observado que en estos últimos la expresión de filagrina también está disminuida, si bien en menor medida10. Por lo tanto parece que hay otros mecanismos implicados en su déficit.
Citocinas Th2Las lesiones agudas de DA muestran una inflamación predominantemente Th2, en respuesta a la entrada de antígenos externos a través de la barrera cutánea alterada5,81. Se ha demostrado que la exposición in vitro de los queratinocitos a las citocinas Th2 produce una reducción significativa en la expresión de filagrina82. Por lo tanto, en muchos pacientes con DA sin mutaciones en FLG, existiría un déficit de filagrina adquirido a causa del «ambiente Th2». Esto a su vez causaría una mayor alteración del estrato córneo, con mayor entrada de antígenos que acabará produciendo mayor polarización inmune hacia Th2, estableciéndose un círculo vicioso. A esto se le suma que las citocinas Th2 también producen una reducción en la expresión de proteínas de la EC como loricrina e involucrina, alterándose más aún la estructura del estrato córneo83. De nuevo, quedaría justificada una actitud terapéutica activa que rompa estos círculos viciosos59.
Variación en el número de copiasComo se ha dicho previamente, la profilagrina codificada por el gen FLG puede contener entre 10 y 12 monómeros de filagrina2. A esto se le llama variación en el número de copias y un estudio reciente ha demostrado que tiene relevancia clínica84. En este estudio irlandés se observó que la variante más frecuente de profilagrina es la que contiene 11 monómeros (51,5%), seguida de la de 10 (33,9%) y la de 12 (14,6%) y vieron que la variación en el número de copias confiere mayor riesgo de DA de forma dosis dependiente. De este modo, un sujeto cuyos 2 alelos codifiquen 10 monómeros tiene un riesgo 1,67 veces superior de sufrir DA respecto a un paciente cuyos 2 alelos codifiquen 12 monómeros, y por cada monómero adicional este riesgo se reduce84. Además, un menor número de copias también se correlaciona con un menor nivel de UCA en estrato córneo84. Con los datos que obtienen, estiman que un aumento del 5-10% en los niveles de filagrina puede tener repercusión clínica, lo cual parece el punto de inicio para el desarrollo de nuevos tratamientos.
Mecanismos reguladores epigenéticosSe trata de mecanismos que alteran la expresión de un gen sin cambiar su secuencia de nucleótidos. De momento los únicos datos a este respecto en el campo de la filagrina proceden de un estudio en el que se observó que, en individuos haploinsuficientes, cuanto mayor es la metilación del gen FLG mayor es el riesgo de desarrollar DA85. Se supone que dicho riesgo se debería a una menor expresión del gen condicionada por la metilación, pero no evalúan este parámetro85.
Asma, rinitis alérgica y alergia alimentariaEl 40% de los niños con DA acaban desarrollando asma o rinitis alérgica10. En el caso del asma el riesgo se correlaciona con la gravedad de la afectación cutánea, de tal forma que el 70% de los pacientes con DA grave desarrolla asma, mientras que esto solo ocurre en el 20-30% de los que tienen DA leve y en el 8% de la población general42. Estudios poblacionales han demostrado que los portadores de mutaciones en FLG tienen un riesgo mayor de desarrollar asma, con una OR global de 1,855,70. Pero este riesgo queda limitado a aquellos que sufren DA, en los que la OR se eleva a 3,3 (3,16-3,49)55,70. Los portadores de mutación tienen también un riesgo incrementado de rinitis alérgica (con una OR de 2,64), aunque en este caso es independiente de si tienen eccema o no55. Finalmente, en cuanto al desarrollo de alergias alimentarias, se ha demostrado que ser portador de mutaciones en FLG confiere un riesgo significativamente superior de sufrir alergia al cacahuete, que es mayor si el paciente sufre DA pero que también existe independientemente de esta (OR global de 5,3, con una OR residual de 3,8 cuando se ajusta para DA)56.
Papel de las mutaciones en FLG en otros trastornosDesde el descubrimiento de las mutaciones en el gen FLG, se han realizado múltiples estudios que han intentado encontrar una posible relación con varias enfermedades cutáneas y extracutáneas, ya sea por asociarse a DA, por tener una base patogénica similar o por compartir el mismo locus de susceptibilidad15. En las tablas 2 y 3 se ofrece un resumen de los resultados obtenidos. Dada la alta frecuencia de individuos portadores en la población general, es probable que las mutaciones en FLG puedan actuar como un factor modificador en múltiples trastornos, sobre todo en aquellos relacionados con anomalías de la queratinización y de la barrera cutánea21.
ConclusionesLa filagrina es una proteína fundamental para la correcta formación y función de la barrera cutánea. Las mutaciones en el gen FLG son las responsables de la IV y confieren un mayor riesgo de desarrollar DA, asma, rinitis alérgica y alergia alimentaria. El descubrimiento de su función ha permitido comprender mejor la patogenia de distintos trastornos que cursan con alteración de la barrera cutánea, y es probable que sus mutaciones influyan en el desarrollo o la gravedad clínica de otras enfermedades dermatológicas. Además, el estudio de sus funciones y de las consecuencias de su déficit puede tener en el futuro importantes implicaciones terapéuticas, al abrir la posibilidad de desarrollar nuevos tratamientos específicos para los trastornos en los que se encuentra alterada.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.