Con el empleo de las nuevas terapias antiangiogénicas y su incorporación en el arsenal terapéutico de los distintos tipos de cáncer, se han detectado nuevos efectos adversos, no conocidos previamente, que afectan a la calidad de vida de los pacientes e incluso pueden obligar a suspender el tratamiento. Los efectos secundarios cutáneos ocurren en un 90% de los pacientes tratados con fármacos inhibidores de angiogénesis. En algunas ocasiones la severidad de las reacciones cutáneas se ha correlacionado con la eficacia y respuesta tumoral al tratamiento, por lo que resulta extremadamente importante para el dermatólogo ser capaz de reconocer y manejar este tipo de reacciones, diferenciar aquellas que pueden ser peligrosas para la vida del paciente y que obliguen a interrumpir el tratamiento de las que no lo son, evitando de esta forma la supresión no justificada de estas terapias que potencialmente pueden prolongar la vida del paciente. En esta revisión se analizan los efectos adversos cutáneos más importantes de los principales fármacos antiangiogénicos.
As new antiangiogenic therapies have been introduced and added to the therapeutic arsenal against various types of cancer, previously unknown adverse effects have been detected. These effects negatively impact patients’ quality of life and can even make it necessary to suspend treatment. Adverse skin reactions occur in 90% of patients treated with angiogenesis inhibitors. In some cases, a correlation has been observed between the severity of reactions and treatment efficacy and tumor response. It is therefore extremely important that dermatologists be able to recognize and manage these reactions. Moreover, in order to avoid the unjustified withdrawal of potentially life-extending treatments, dermatologists must be able to differentiate between non-life-threatening reactions and life-threatening reactions that necessitate the suspension of treatment. In this review article, we analyze the main cutaneous adverse effects of the most common antiangiogenic agents.
Existen diversos fármacos inhibidores de la angiogénesis que se están utilizando desde hace unos años en determinados tipos de tumores con resultados esperanzadores, y que han abierto una vía importante de abordaje del cáncer que sin duda será mejor explorada en el futuro. Estos fármacos, sin embargo, pueden producir toxicidades cutáneas en cerca del 90% de los pacientes tratados1. La observación de que el crecimiento de los tumores malignos se acompaña de una proliferación de vasos sanguíneos se hizo hace más de 100 años2. En 1968, por primera vez, se planteó la hipótesis sobre la capacidad de las células tumorales de producir sustancias proangiogénicas3,4, y fue en 1971 cuando Folkman formuló la hipótesis que marcó el comienzo de una nueva era en la investigación oncológica sobre el potencial terapéutico de la inhibición de la angiogénesis en el cáncer5. La esperanzadora idea de que bloqueando la proliferación de los vasos sanguíneos se podría inhibir el crecimiento del tumor maligno y de sus metástasis, llevó a una intensa búsqueda de factores pro y antiangiogénicos en los años posteriores a la publicación de Folkman. El resultado de estos años de ardua investigación han sido varias moléculas inhibidoras de angiogénesis, tales como sorafenib, sunitinib y bevacizumab, aprobadas por la FDA para el tratamiento de distintos tipos de cáncer, y muchas moléculas más cuya eficacia está siendo evaluada en diferentes fases de ensayos clínicos.
Sorafenib es un inhibidor multicinasa, aprobado por la FDA para el tratamiento del carcinoma de células renales avanzado y carcinoma hepatocelular. Se administra por vía oral y su vida media es de 25-48h6. Inhibe múltiples tirosín-cinasas, incluyendo la familia del receptor del factor de crecimiento endotelial vascular (VEGFR 2, 3), el receptor del factor de crecimiento derivado de plaquetas (PDGFR), receptor del factor de crecimiento de las células madre (c-KIT), tirosín-cinasa 3 Fms-like (FLT3), el receptor del factor neurotrófico derivado de células gliales codificado por el protooncogén ret (RET) y también inhibe cinasas RAF (RAF-1 y B-RAF)1.
Sunitinib también es un inhibidor multicinasa de administración por vía oral, con una vida media de 40-60h. Inhibe también ciertas tirosín-cinasas como los VEGFR 1, 2 y 3, los PDGRalfa y PDGFRbeta, el receptor del factor estimulante de colonias tipo 1 (CSF-1R), c-KIT, el receptor del factor neurotrófico derivado de células gliales (RET) y FLT3. Está aprobado por la FDA para el tratamiento de los tumores avanzados del estroma gastrointestinal (GIST) refractarios, metastásicos o por intolerancia o resistencia al tratamiento con mesilato de imatinib, tratamiento del carcinoma de células renales avanzado o metastásico y tumores neuroendocrinos pancreáticos no resecables o metastásicos6. También ha demostrado ser eficaz en el tratamiento de carcinomas de colon y de mama7, y se han descrito casos de estabilización de carcinomas anexiales cutáneos metastásicos8.
Bevacizumab es un anticuerpo monoclonal anti-VEGF recombinante humanizado (93% humano, 7% murino), disponible desde el año 2005 para el tratamiento del carcinoma colorrectal, de mama, no microcítico de pulmón, carcinoma de células renales, cáncer de ovario y trompas de Falopio o peritoneal primario, en asociación con otros agentes antineoplásicos9. Se administra en infusión intravenosa y ejerce su efecto antiangiogénico a través de su unión a todas las isoformas del VEGF, dando lugar a una disminución en el número de las células endoteliales y del número de los microcapilares en el tejido tumoral, así como a la disminución de la permeabilidad vascular10.
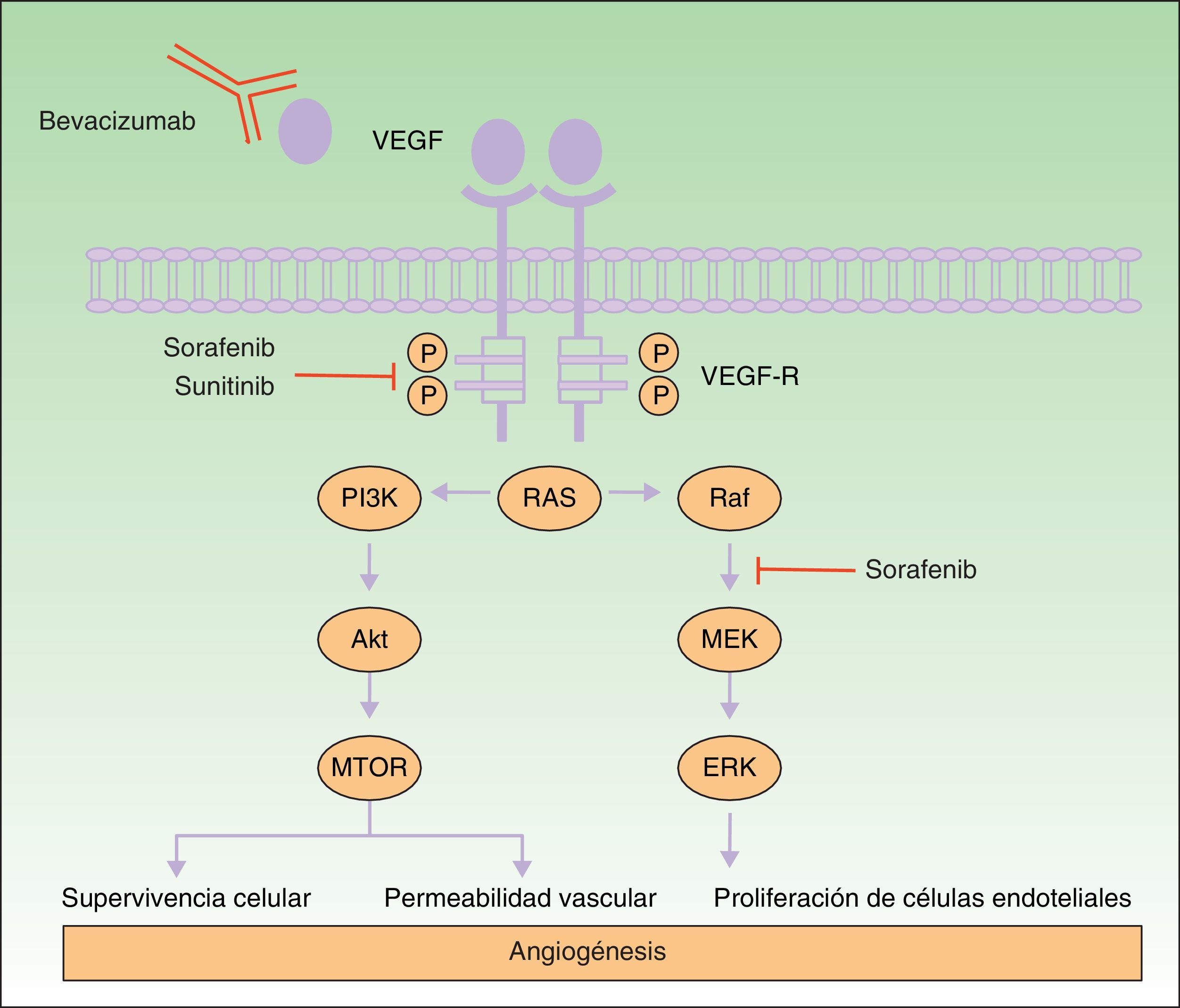
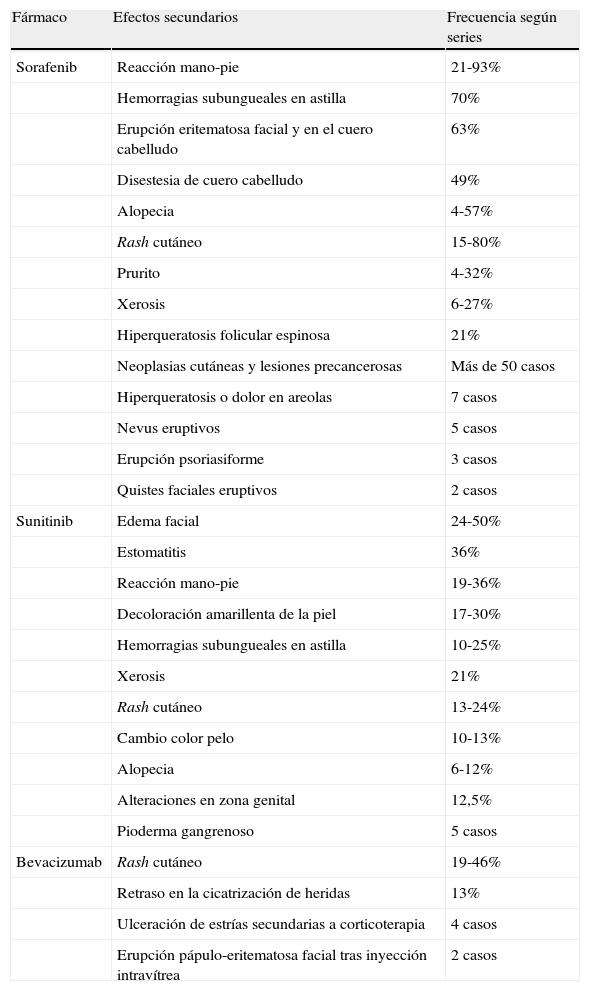
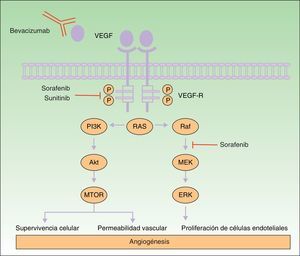
Muchos de los efectos secundarios de los fármacos antiangiogénicos son similares a los producidos por los quimioterápicos clásicos, tales como rash cutáneo, mucositis, alopecia, xerosis o prurito11. En esta revisión nos centraremos en aquellas reacciones cutáneas adversas más específicas de los fármacos antiangiogénicos (tabla 1). En la figura 1 se muestran esquemáticamente los diferentes mecanismos de acción de estos 3 fármacos.
Resumen de los efectos secundarios cutáneos más frecuentes de los fármacos inhibidores de la angiogénesis
| Fármaco | Efectos secundarios | Frecuencia según series |
| Sorafenib | Reacción mano-pie | 21-93% |
| Hemorragias subungueales en astilla | 70% | |
| Erupción eritematosa facial y en el cuero cabelludo | 63% | |
| Disestesia de cuero cabelludo | 49% | |
| Alopecia | 4-57% | |
| Rash cutáneo | 15-80% | |
| Prurito | 4-32% | |
| Xerosis | 6-27% | |
| Hiperqueratosis folicular espinosa | 21% | |
| Neoplasias cutáneas y lesiones precancerosas | Más de 50 casos | |
| Hiperqueratosis o dolor en areolas | 7 casos | |
| Nevus eruptivos | 5 casos | |
| Erupción psoriasiforme | 3 casos | |
| Quistes faciales eruptivos | 2 casos | |
| Sunitinib | Edema facial | 24-50% |
| Estomatitis | 36% | |
| Reacción mano-pie | 19-36% | |
| Decoloración amarillenta de la piel | 17-30% | |
| Hemorragias subungueales en astilla | 10-25% | |
| Xerosis | 21% | |
| Rash cutáneo | 13-24% | |
| Cambio color pelo | 10-13% | |
| Alopecia | 6-12% | |
| Alteraciones en zona genital | 12,5% | |
| Pioderma gangrenoso | 5 casos | |
| Bevacizumab | Rash cutáneo | 19-46% |
| Retraso en la cicatrización de heridas | 13% | |
| Ulceración de estrías secundarias a corticoterapia | 4 casos | |
| Erupción pápulo-eritematosa facial tras inyección intravítrea | 2 casos |
Mecanismo de acción de bevacizumab, sorafenib y sunitinib. Esquema de las vías de señalización implicadas en el proceso de angiogénesis y el lugar de actuación de los fármacos sorafenib, sunitinib y bevacizumab. La activación del receptor del VEGF actúa sobre el proceso de angiogénesis mediante la inducción de la proliferación celular, supervivencia celular y la permeabilidad vascular.
Aproximadamente el 90% de los pacientes tratados con sorafenib van a experimentar efectos adversos cutáneos12. Hasta la fecha se han publicado 5 principales series evaluando los efectos adversos cutáneos en pacientes tratados con sorafenib (tabla 2).
Principales series evaluando los efectos adversos cutáneos en pacientes tratados con sorafenib
| Autor y referencia | Año | Descripción |
| Autier et al.13 | 2008 | estudio prospectivo doble ciego con 85 pacientes (43 pacientes tratados con sorafenib) (42 pacientes grupo control con placebo) |
| Lee et al.7 | 2009 | Muestra de 109 pacientes en tratamiento con sorafenib |
| Robert et al.14 | 2009 | Pool de estudios incluyendo ensayos clínicos (4 fase i, uno fase ii y uno fase iii) |
| Kong et al.15 | 2009 | 65 pacientes: 24 en cohorte prospectiva y 41 en cohorte consecutiva |
| Zhang et al.12 | 2011 | Metaanálisis (6.011 pacientes, revisión sistemática de estudios en Medline y Embase) |
Es uno de los efectos secundarios cutáneos más frecuentemente asociados al tratamiento con sorafenib, detectándose en un 34-78% de los pacientes tratados con este fármaco, según las series publicadas12. El término hand-foot skin reaction (HFSR) se utiliza para diferenciar este tipo de lesiones del síndrome mano-pie clásico o eritrodisestesia palmo-plantar (hand-foot syndrome [HFS]), asociado a los agentes quimioterápicos habituales. Asimismo, esta reacción es la toxicidad cutánea más comúnmente asociada con la suspensión de sorafenib13.
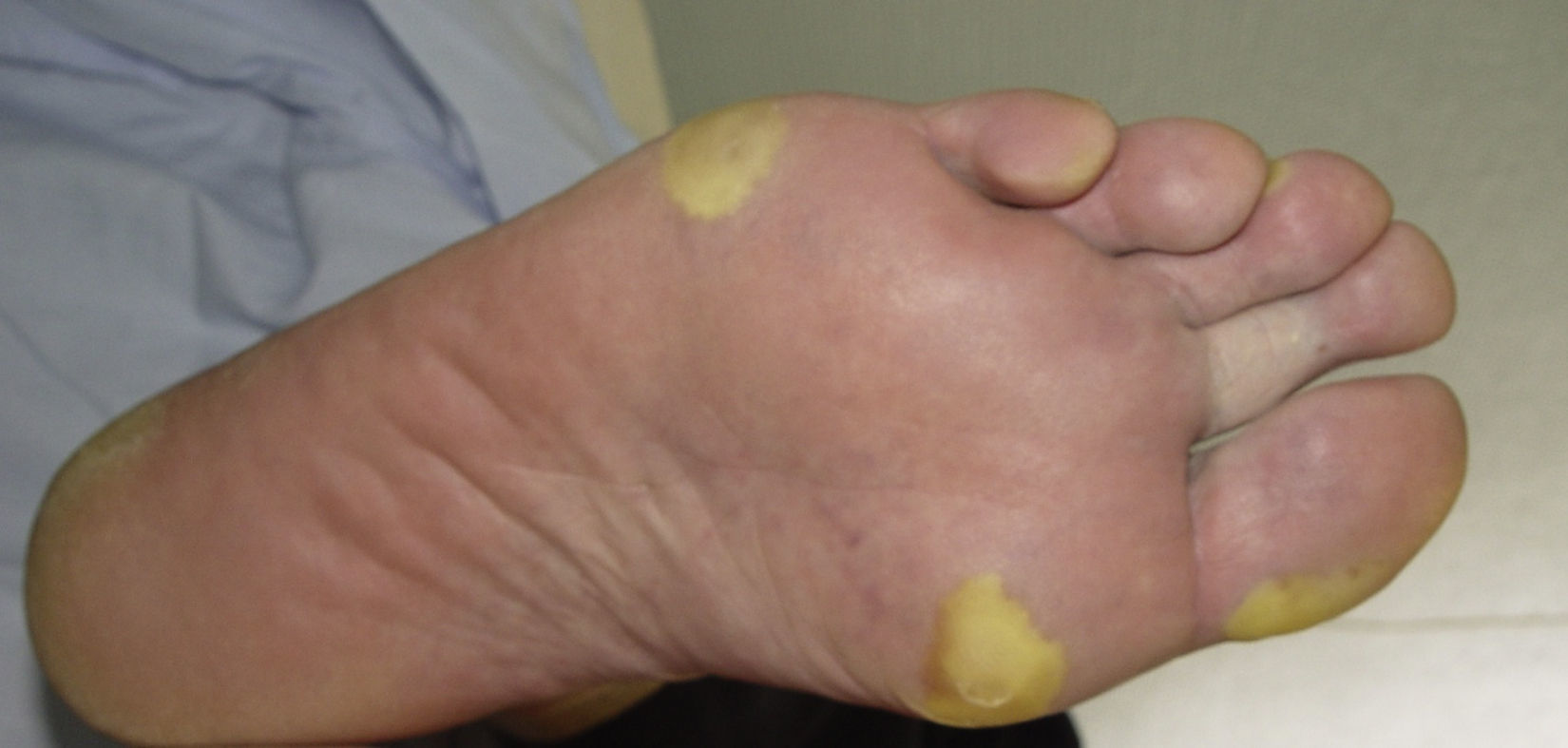
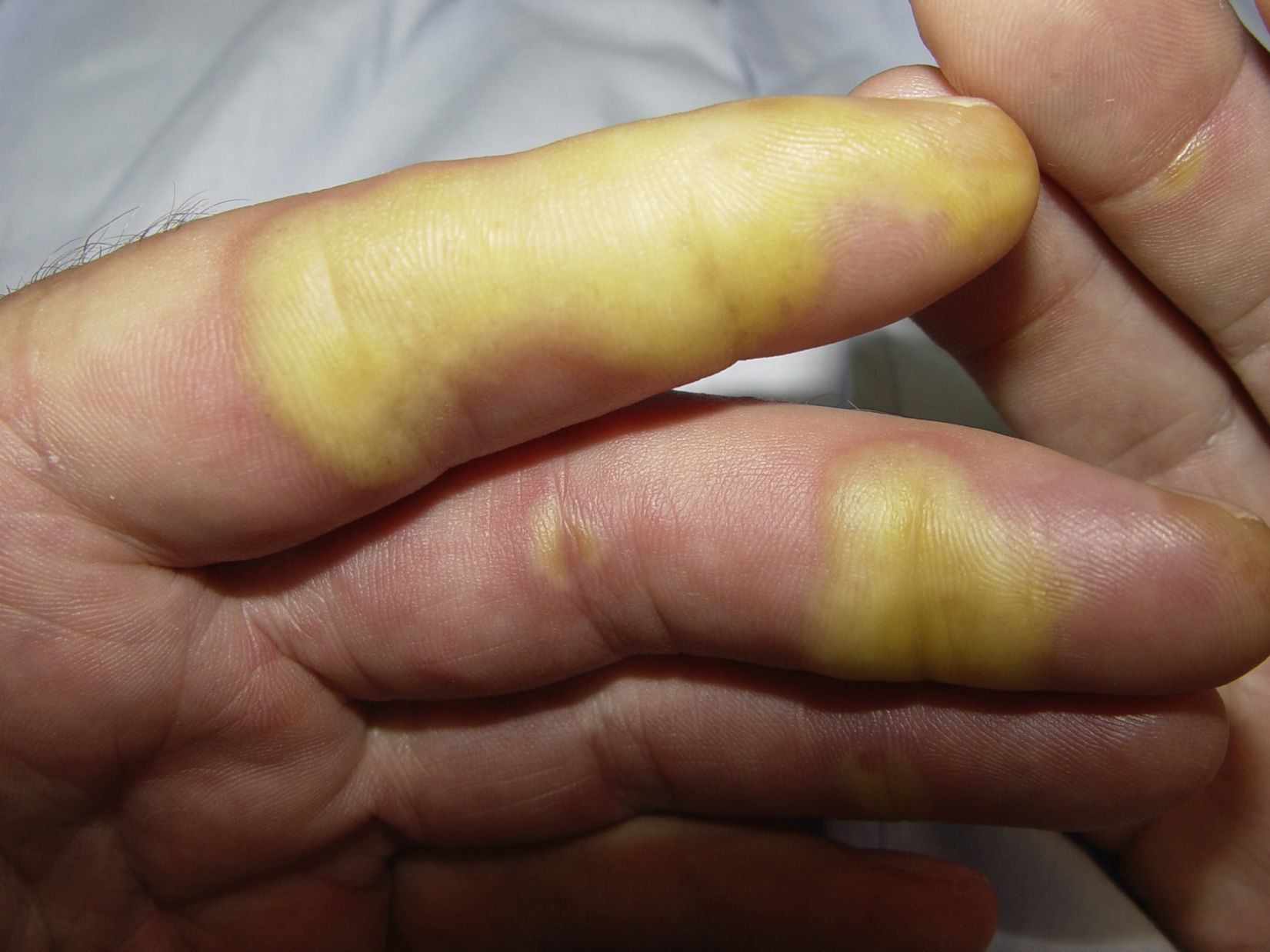
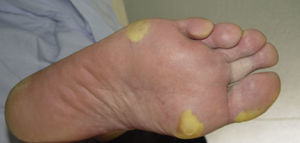
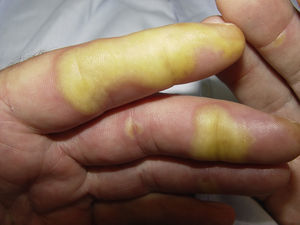
Clínicamente la HFSR aparece en las primeras 2-6 semanas de tratamiento como lesiones hiperqueratósicas, con formación de callosidades y en algunos casos de ampollas superficiales, sobre base eritematosa, localizadas preferentemente en las palmas y las plantas, así como en superficies flexoras de los dedos de forma bilateral. Las lesiones presentan de forma característica un halo eritematoso periférico14 (figs. 2 y 3). Esta presentación clínica contrasta con la aparición aguda de eritema, edema, parestesias, dolor y posterior descamación difusa típicos del HFS clásico. Otros síntomas asociados al HFSR son parestesias, sensación de quemazón, dolor en palmas y plantas y una menor tolerancia al contacto con objetos calientes. Estos signos subjetivos preceden usualmente a la aparición de las lesiones cutáneas y no ocurren sin la posterior aparición de las mismas. Estos síntomas se asocian con la dosis, así como con las zonas de presión y fricción de la piel16. El dolor asociado puede producir un gran impacto en la calidad de vida y puede dificultar notablemente las actividades diarias del paciente17. Una afectación severa puede derivar en una reducción de la dosis, interrupción temporal o incluso retirada permanente del fármaco.
Reacción cutánea mano-pie. Lesiones hiperqueratósicas, con formación de callosidades y en algunos casos de ampollas superficiales, sobre base eritematosa, localizadas en las superficies flexoras de los dedos de las manos. Se aprecia el característico halo eritematoso periférico.
Figura cedida por las Dras. Tuneu y López Pestaña del Hospital Donostia-San Sebastián.
En el estudio histológico se observa paraqueratosis, disqueratosis y un denso infiltrado inflamatorio superficial perivascular de predominio linfocitario. El hallazgo más relevante es el daño de los queratinocitos, con presencia de cuerpos intracitoplasmáticos eosinofílicos, degeneración vacuolar de los queratinocitos, queratinocitos disqueratósicos y necrosis confluyente de queratinocitos que produce clivaje intraepidérmico con formación de ampollas intraepidérmicas18. Puede asociar vasculitis no-leucocitoclástica13. El estudio inmunohistoquímico ha demostrado pérdida de la citoqueratina 10 e incremento de la expresión de la citoqueratina 14, sugiriendo un efecto del fármaco sobre la diferenciación de los queratinocitos14.
Jain et al. hipotetizaron que las diferencias clínicas entre HFS y HFSR pueden ser explicadas por las diferencias en el mecanismo etiopatogénico subyacente entre ambas entidades19. Así, uno de los mecanismos propuestos para el desarrollo de reacción mano-pie inducida por quimioterápicos clásicos es la excreción del agente quimioterápico a través de las glándulas sudoríparas11. En cambio, este mecanismo no se ha podido demostrar para la reacción mano-pie asociada a los inhibidores multicinasa, al no detectarse niveles significativos de sorafenib en el sudor de estos pacientes19. En este caso, los autores proponen como mecanismo patogénico la fuga del fármaco a través de los capilares dañados por los traumatismos subclínicos. La inhibición consiguiente de VEGFR y PDGFR afecta la reparación y regeneración de los capilares, impidiendo la regeneración del tejido en estas zonas. La localización de lesiones de HFSR de forma específica en áreas con hiperqueratosis preexistente expuestas crónicamente a la fricción20 apoyan esta hipótesis. Recientemente se ha descrito la existencia de una predisposición genética para el desarrollo de HFSR tras la terapia con sorafenib en pacientes con carcinoma hepatocelular21. Dranitsaris et al. han desarrollado y validado un modelo predictivo del desarrollo de HFSR en pacientes en tratamiento con sorafenib22-24.
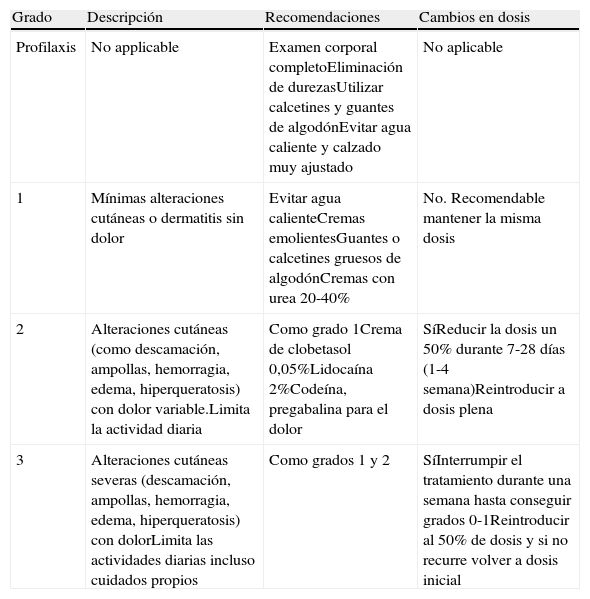
El manejo de HFSR se resume en la tabla 3.
Manejo de la reacción cutánea mano-pie (hand-foot skin reaction) asociada a sorafenib23,24
| Grado | Descripción | Recomendaciones | Cambios en dosis |
| Profilaxis | No applicable | Examen corporal completoEliminación de durezasUtilizar calcetines y guantes de algodónEvitar agua caliente y calzado muy ajustado | No aplicable |
| 1 | Mínimas alteraciones cutáneas o dermatitis sin dolor | Evitar agua calienteCremas emolientesGuantes o calcetines gruesos de algodónCremas con urea 20-40% | No. Recomendable mantener la misma dosis |
| 2 | Alteraciones cutáneas (como descamación, ampollas, hemorragia, edema, hiperqueratosis) con dolor variable.Limita la actividad diaria | Como grado 1Crema de clobetasol 0,05%Lidocaína 2%Codeína, pregabalina para el dolor | SíReducir la dosis un 50% durante 7-28 días (1-4 semana)Reintroducir a dosis plena |
| 3 | Alteraciones cutáneas severas (descamación, ampollas, hemorragia, edema, hiperqueratosis) con dolorLimita las actividades diarias incluso cuidados propios | Como grados 1 y 2 | SíInterrumpir el tratamiento durante una semana hasta conseguir grados 0-1Reintroducir al 50% de dosis y si no recurre volver a dosis inicial |
Fuente: National Cancer Institute Common Terminology Criteria for Adverse Events version 4.03 (NCI-CTCAE v 4.03)24.
La erupción facial eritematosa, muy similar a la dermatitis seborreica clásica, se objetivó en el 63% de los pacientes tratados con sorafenib en el estudio prospectivo llevado a cabo por Autier et al., frente al 2% de los pacientes del grupo control13. Generalmente aparece en las primeras 3 semanas tras el inicio del tratamiento y se resuelve espontáneamente en menos de 2 meses. En algunos casos se ha objetivado una exacerbación de los síntomas desencadenada por temperaturas altas. El mecanismo patogénico se desconoce, pero al no objetivarse erupción eritematosa facial durante el tratamiento con sunitinib o imatinib se piensa que la inhibición del RAF desempeña un papel importante en su patogénesis, más que la inhibición del VEGFR o PDGFR25. En la histología solo se aprecia un infiltrado linfocitario inespecífico sin eosinófilos ni vasculitis. No hay relación entre la erupción facial y la respuesta al tratamiento. En la mayoría de las ocasiones no precisa tratamiento o es similar al de la dermatitis seborreica13.
Disestesia de cuero cabelludoAl igual que la erupción eritematosa facial, se trata de una manifestación que aparece fundamentalmente entre la primera y la tercera semana del tratamiento. En el estudio de Autier et al. se objetivó en el 49% de los pacientes tratados con sorafenib. En un 30% de pacientes la disestesia de cuero cabelludo fue la única manifestación cutánea. Suele remitir de forma espontánea en un plazo de varios días a semanas y en general no precisa tratamiento13.
Hemorragias subungueales en astillaSe observan en alrededor del 70% de los pacientes. Clínicamente se presentan como líneas negras o rojas, indoloras, localizadas bajo la lámina ungueal en la zona distal, predominantemente en las manos, aunque también puede afectar a las uñas de los pies. Generalmente aparecen en los 2 primeros meses del tratamiento, resolviéndose espontáneamente con el crecimiento de la uña13. Clásicamente se ha descrito la aparición de este tipo de lesiones en pacientes con endocarditis o anticuerpos anticardiolipina circulantes, como consecuencia de fenómenos tromboembólicos. También pueden aparecer en personas sanas debido a microtraumatismos, donde generalmente se limitan a un solo dedo14. Cuando aparecen en pacientes tratados con sorafenib se postula que se producen como consecuencia del fallo en la regeneración de los capilares debido a la inhibición del VEGFR en zonas sometidas a microtraumatismos25.
AlopeciaLa frecuencia de alopecia en pacientes tratados con sorafenib varía según las series: desde el 21% reportado por Kong et al.15, 27% por Robert et al.14 y 26% por Lee et al.7 al 44% de Autier et al13. En el metaanálisis de Zhang et al.12, que englobó 18 ensayos clínicos con 4.444 pacientes tratados con sorafenib, la alopecia tuvo una incidencia global de un 25,5%. La alopecia asociada a sorafenib puede acompañarse de un lento crecimiento de la barba14, y suele aparecer entre la semana 3 y 15 del tratamiento. En la serie de Autier et al. un 19% de pacientes presentó pérdida de vello corporal, no siempre asociada a alopecia de cuero cabelludo13. No existe tratamiento específico, pero el trastorno es temporal y el paciente recupera la densidad de su cabello al completar el tratamiento, y en algunos casos incluso antes de finalizar el mismo. En ocasiones, al recuperarse, el pelo tiende a crecer quebradizo y rizado14.
Neoplasias cutáneas y lesiones preneoplásicasSorafenib se ha asociado con la aparición de queratosis actínicas, atipia escamosa focal, queratoacantomas (QA), carcinomas de células escamosas (CCE) queratoacantoma-like y carcinomas de células escamosas invasivos26,27. En la mayoría de los casos se trata de lesiones múltiples y son más frecuentes en varones. Suelen ser pacientes que no tenían historia previa de cáncer cutáneo, lesiones premalignas, piel fotodañada de forma significativa ni antecedentes de exposición a radiación en zonas afectadas. Se ha objetivado la aparición de este tipo de lesiones entre la segunda semana de tratamiento y hasta 3 años después del comienzo del mismo. Suelen localizarse en áreas fotoexpuestas, aunque también se han descrito casos de aparición en zonas no expuestas28. Recientemente Arnault et al. han demostrado que sorafenib produce una activación paradójica de la vía de la cinasa MAP, dependiendo del grado de activación, de la duración del tratamiento y de la dosis del fármaco recibida, lo que a su vez induce la proliferación celular, dando lugar a la aparición de lesiones benignas (lesiones foliculares quísticas), borderline (queratoacantomas) y malignas (CCE)29. De esta forma, mientras sorafenib es capaz de detener la proliferación celular en tumores sólidos, paradójicamente estimula la formación de neoplasias cutáneas. Se piensa que la inhibición de la vía de señalización de la cinasa RAF puede tener un efecto adicional en la diferenciación y proliferación del queratinocito30. Llama la atención que otros MKI que comparten el mismo mecanismo de acción no han demostrado incrementar el riesgo de lesiones malignas y premalignas cutáneas. Probablemente esta diferencia se deba a que sorafenib es el único de este grupo de fármacos que inhibe la serina/treonina cinasa RAF. A favor de esta hipótesis está la observación de que la suramina (fármaco usado frente a tripanosomas y recientemente también para el tratamiento de tumores sólidos), que comparte el mismo mecanismo de acción que sorafenib, inhibiendo la cinasa RAF, también induce el desarrollo de QA y CCE31. Además, vemurafenib, un inhibidor selectivo de RAF, utilizado en pacientes con melanoma metastásico con la mutación BRAF V600E, también ha demostrado incrementar la incidencia de CCE y QA29,32. Se ha demostrado que las células de carcinomas escamosos procedentes de pacientes tratados con inhibidores del RAF presentan un perfil de mutaciones distinto de los carcinomas escamosos clásicos. En el primer grupo se han detectado, por primera vez, mutaciones en MYC, FGFR3 y VHL, mientras que las mutaciones descritas previamente en carcinomas escamosos son en TP53, CDKN2A, HRAS, KRAS y PIK3CA33. Estos hallazgos podrían explicar, al menos en parte, la epidemiología y la presentación un tanto atípica de estas lesiones malignas y premalignas en pacientes tratados con sorafenib (como aparición de lesiones en áreas no fotoexpuestas, crecimiento rápido, lesiones múltiples, pacientes sin historia previa de cáncer cutáneo, etc.). Es de interés destacar las diferencias entre las características de los tumores cutáneos inducidos por sorafenib y vemurafenib. Los últimos estudios apuntan a que la paradójica activación de la vía MAPK se debe a que el bloqueo RAF en células portadoras de BRAF salvaje aumentaría la señalización a través de CRAF y ERK que incrementaría la vía MAPK provocando el desarrollo de CCE. Pero este hecho debe además ir unido a la presencia de mutaciones en RAS de los queratinocitos, posiblemente producidas por exposición solar o por virus, lo que sería en conjunto el mecanismo de activación de la señalización de MAPK para desarrollar los tumores30,34. Durante el tratamiento con vemurafenib la frecuencia de aparición de CCE y los QA es más alta (20-30% de pacientes) que con sorafenib (6-7% de los tratados) y además, se caracterizan por una latencia menor desde el inicio del tratamiento hasta la aparición de las neoplasias cutáneas secundarias en comparación con sorafenib29,34. Probablemente, esta diferencia se deba a que, aunque sorafenib tenga propiedades inhibitorias pan-RAF, la potencia frente a las isoformas RAF es mucho menos pronunciada comparada con la de los inhibidores selectivos como vemurafenib29,33. Los CCE inducidos por ambos fármacos suelen ser lesiones bien diferenciadas y con buen pronóstico. No se han descrito casos de metástasis ni recidivas locales tras la escisión quirúrgica de CCE en pacientes tratados con estos inhibidores de RAF30.
Con el fin de asegurar el diagnóstico precoz y el tratamiento adecuado de estas lesiones, se recomienda realizar una exploración completa previa al inicio del tratamiento y revisiones periódicas durante el mismo. Las queratosis actínicas se deben tratar precozmente para evitar su progresión rápida a CCE. Existe evidencia científica suficiente para recomendar fotoprotección a los pacientes que están en tratamiento con sorafenib o van a iniciarlo29. Aunque el objetivo principal es tratar el tumor inicial que pone en peligro la vida del paciente, no podemos olvidar que el riesgo metastásico del CCE, sobre todo en estos pacientes que se encuentran en un estado de inmunosupresión, es relativamente elevado. Además, se ha visto que la progresión de CCE en estos pacientes es más rápida, por lo que resulta extremadamente importante el diagnóstico precoz y el tratamiento adecuado de este tipo de lesiones. Se ha comprobado que los pacientes que continúan el tratamiento desarrollan más lesiones, mientras que el 90% de los que suspenden el tratamiento no desarrollan más lesiones ni recidivan las lesiones previas11. Ante el diagnóstico de un CCE en estos pacientes se puede plantear una breve discontinuación o disminución de la dosis de sorafenib hasta que los tumores puedan ser eliminados, y en el caso de que haya otro fármaco eficaz se debe valorar cambiar. Si ha sido posible realizar el tratamiento de las lesiones se puede continuar con la administración de sorafenib si estaba dando buen resultado, prestando una especial atención a la exploración cutánea completa y con una fotoprotección muy estricta28.
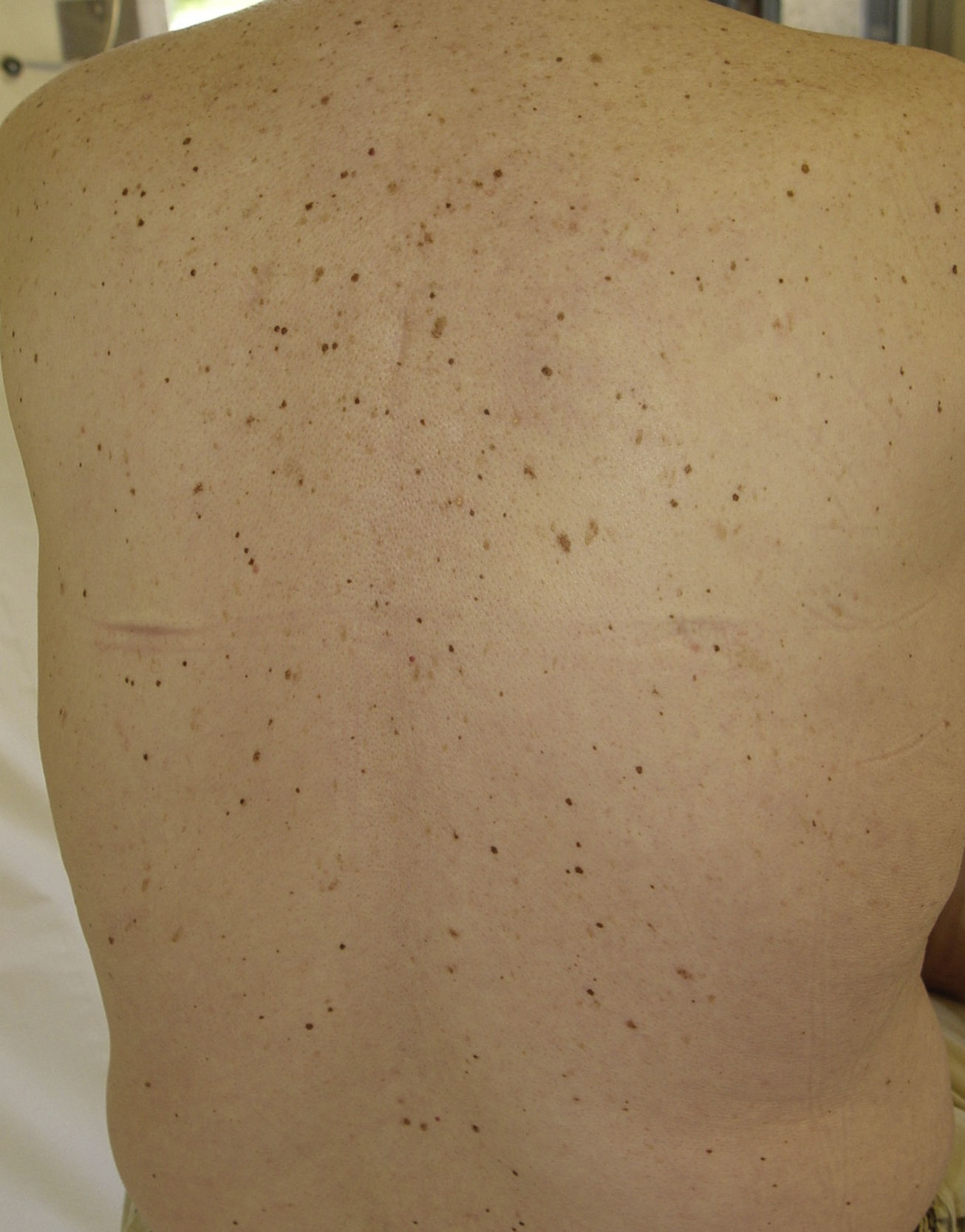
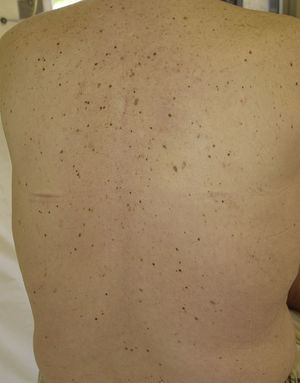
Lesiones melanocíticas eruptivasSe han descrito casos de aparición eruptiva de lesiones melanocíticas en pacientes tratados con sorafenib (fig. 4). Kong et al. describen 2 casos de aparición de múltiples lesiones pigmentadas con diagnóstico histológico de nevus melanocítico en un caso y lentigos en el otro. En el primer caso aparecieron varios nevus melanocíticos tras 2 meses de tratamiento con sorafenib en las palmas y las plantas. En el segundo caso aparecieron lentigos en el cuello, el tronco, los muslos, las palmas y las plantas al mes de iniciar el tratamiento35. Bennani-Lahlou et al. describen 5 casos de aparición de cientos de nevus de pequeño tamaño (de 1 a 3mm), homogéneos, de color marrón oscuro, después de 9 meses de media de tratamiento con sorafenib, distribuidos por el tronco y las extremidades superiores36. Este fenómeno se ha atribuido a la situación de inmunosupresión e inflamación. Se ha descrito en asociación con tratamientos quimioterápicos clásicos y otras situaciones de inmunodepresión35. También se ha descrito la aparición paradójica de lesiones melanocíticas atípicas, e incluso melanomas en relación con vemurafenib, un inhibidor de V600E BRAF, utilizado en el tratamiento de melanomas avanzados o metastásicos. Se piensa que este fenómeno se debe a la activación paradójica de la vía RAF-MEK-ERK a través de CRAF37,38.
Hiperqueratosis folicular espinosaEn el año 2009 López et al. describen, por primera vez, la aparición de pápulas foliculares queratósicas, de 1mm y color de piel normal en la cara de un paciente 10 días después de iniciar tratamiento con sorafenib39. Histológicamente se objetivó hiperplasia folicular prominente, sobre todo en el istmo folicular, con acantosis, cambios regenerativos con numerosas figuras de mitosis, con algunas células apoptóticas y un leve infiltrado linfocitario perifolicular. Los autores describen la desaparición total de las lesiones tras la supresión del tratamiento con sorafenib. Franck et al. estudian 43 pacientes en tratamiento con sorafenib, encontrando en un 21% (9 pacientes) lesiones cutáneas a modo de espinas de 0,5mm a 1mm de diámetro y 5mm de altura, que los autores denominan hiperqueratosis folicular espinosa (spiny follicular hyperkeratosis), que se distribuyen en la cara, el cuero cabelludo y el tronco, respetando las palmas y las plantas40. Las lesiones aparecieron a los 82 días de media tras iniciar el tratamiento, y desaparecieron a los 98 días tras la supresión de sorafenib. En 4 de los pacientes hubo que retirar sorafenib por otros motivos y la erupción desapareció en 5 a 7 días. En 2 pacientes que volvieron al tratamiento las lesiones volvieron a aparecer. El hallazgo histológico más destacable fue la presencia de una columna ortoparaqueratósica rellenando el infundíbulo y protruyendo por encima de la superficie de la epidermis. Joncas et al. describen un caso de un paciente con una erupción similar de lesiones hiperqueratósicas foliculares espinosas en el cuero cabelludo, el tronco y el abdomen, que además presentó alopecia de cuero cabelludo y cejas y una erupción dolorosa pápulo-pustulosa folicular en la cabeza y el cuello. En el estudio histopatológico se objetivaron folículos pilosos dilatados con hiperqueratosis ortoqueratósica y leve infiltrado polimorfo, así como metaplasia escamosa de conductos ecrinos41.
Es interesante destacar que en 1999 Haycox et al. describen un caso de un paciente inmunodeprimido con alopecia progresiva de cejas y pápulas eritematosas faciales, que daban un aspecto de facies leonina, y proyecciones de apariencia espinosa de distribución folicular. Al examinar la biopsia cutánea con microscopia electrónica, los autores identificaron partículas virales sugestivas de papovavirus. Este cuadro se denominó tricodisplasia espinulosa y consta de 3 características fundamentales: pápulas faciales foliculares que producen una facies leonina, alopecia de cejas y pestañas y las características espinas queratósicas42. Se han descrito casos de tricodisplasia espinulosa en diferentes situaciones de inmunodepresión, tales como la quimioterapia en leucemia linfocítica aguda43, leucemia linfocítica crónica44, trasplante cardiaco45 y trasplante renal46. Recientemente se ha demostrado que el virus asociado a la tricodisplasia espinulosa pertenece a la familia de poliomavirus y se le denominó poliomavirus asociado a tricodisplasia espinulosa (TSPyV)47. Desde el punto de vista histológico la tricodisplasia espinulosa se caracteriza por la presencia de folículos pilosos distendidos con maduración anómala, células de la vaina pilar interna con gran número de gránulos de tricohialina y espículas de queratina emergiendo de los folículos aberrantes de 1-3mm de longitud. En el estudio ultraestructural con microscopía electrónica se confirma la presencia de partículas víricas de 40nm en los núcleos de las células de la vaina48.
Teniendo en cuenta las similitudes en la presentación clínica entre ambos cuadros, tales como la aparición de estas características espinas queratósicas o la presencia de alopecia de cuero cabelludo y cejas, se nos plantea el interrogante de si la hiperqueratosis folicular espinosa está relacionada o es el mismo cuadro que la tricodisplasia espinulosa asociada a poliomavirus.
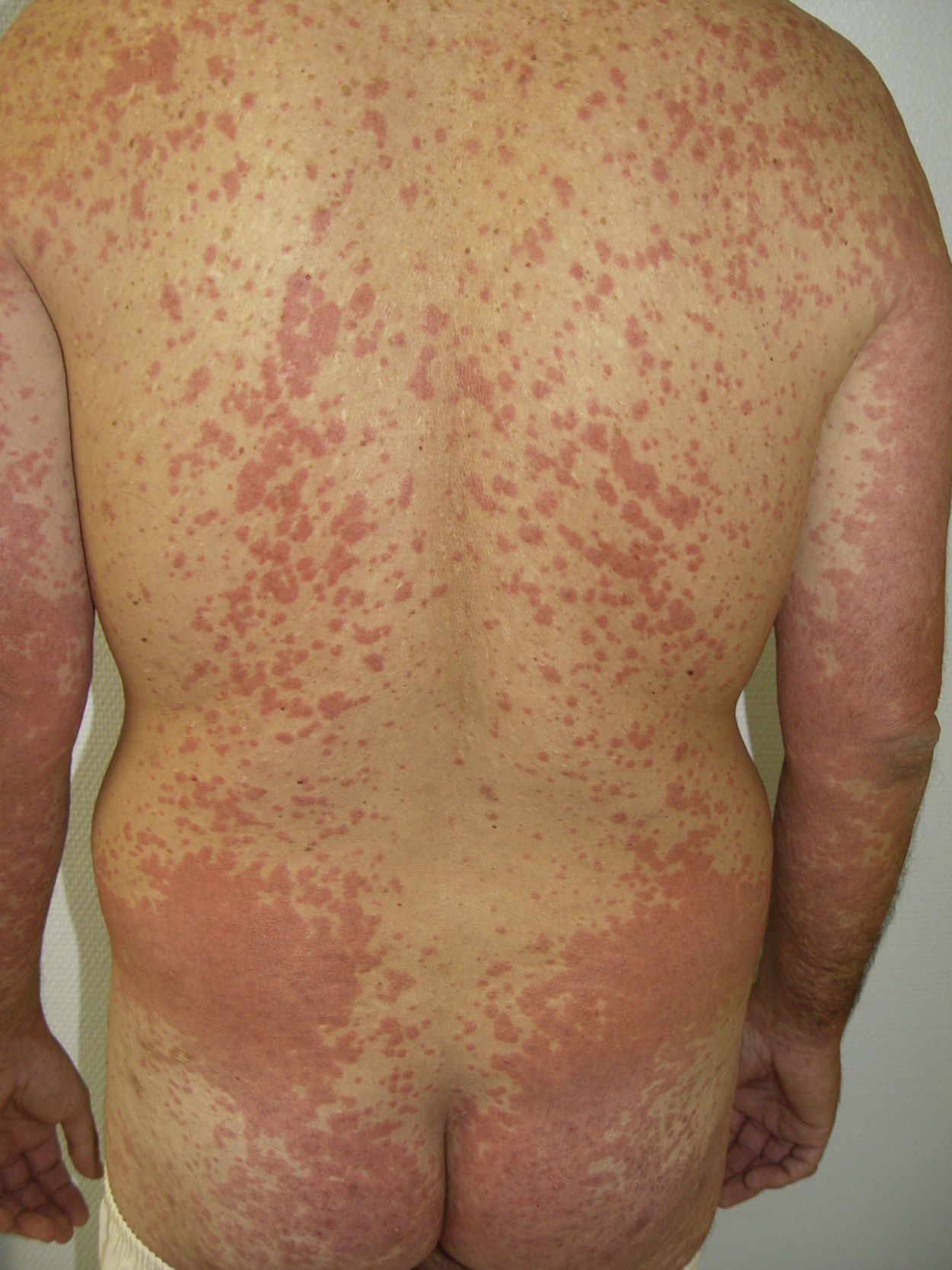
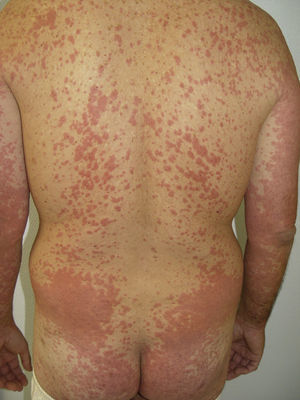
Otros efectos adversosDurante el tratamiento con sorafenib se ha descrito un caso de decoloración amarillenta de la piel49 (a diferencia de sunitinib, donde este efecto adverso es mucho más común) que remitió al interrumpir el tratamiento, lesiones erosivas dolorosas50, eritema marginado hemorrágico, consistente en máculas eritematosas anulares confluyentes, descamativas y ligeramente atróficas, con borde hemorrágico pronunciado, cuya aparición se ha relacionado con una buena respuesta tumoral al tratamiento51, toxicodermia atípica de morfología lineal52, erupciones psoriasiformes53–55, erupción queratosis pilaris-like generalizada, estomatitis, rash/exantemas (fig. 5), queratosis seborreicas inflamadas, quistes15 y eritema multiforme56.
Efectos secundarios cutáneos de sunitinibSunitinib comparte algunos efectos secundarios cutáneos con sorafenib, tales como la reacción cutánea mano-pie o la erupción cutánea similar a dermatitis seborreica, y presenta otros característicos como la decoloración amarillenta de la piel, la despigmentación del pelo o las lesiones genitales.
Reacción cutánea mano-pieLa HFSR ocurre en un 20% de los pacientes tratados con sunitinib, y es la reacción cutánea adversa más frecuentemente asociada a la supresión brusca del tratamiento por toxicidad cutánea57. Se ha descrito un caso de lesiones de HFSR inducidas por el manejo del dispositivo Blackberry58. Las características clínicas y las opciones terapéuticas de las lesiones de HSFR asociadas a sunitinib59 son similares a las expuestas en el capítulo de los efectos secundarios cutáneos de sorafenib, por lo que no se tratarán en este apartado. En un estudio reciente se ha demostrado que la presencia de toxicidad cutánea durante el tratamiento con sunitinib del carcinoma de células renales metastásico se asocia con un incremento significativo tanto de la supervivencia global como de la libre de enfermedad60. Se ha objetivado mejoría de las lesiones de psoriasis en pacientes que recibían tratamiento con sunitnib61, lo que parece lógico, ya que VEGF se ha relacionado tanto con la inducción del proceso de angiogénesis en la dermis como con la hiperplasia epidérmica, ambos procesos clave en la patogénesis de la psoriasis62.
Decoloración amarillenta de la pielSe puede ver en alrededor de un 30% de los pacientes tratados con sunitinib57. Generalmente aparece tras la primera semana de tratamiento y se resuelve espontáneamente al cesar la administración del fármaco. Cabe destacar que, a diferencia de otras causas sistémicas de decoloración amarillenta de la piel, la asociada a sunitinib respeta las mucosas y la esclerótica. Puede acompañarse de decoloración amarillenta de la orina, que se debe a la excreción del fármaco a través del riñón. Este efecto secundario tiene relación con el color de un metabolito del medicamento9,63.
Despigmentación del peloOcurre en alrededor del 10% de los pacientes, pudiendo afectar al cabello, las cejas y las pestañas57. Generalmente ocurre a las 5-6 semanas tras el inicio del tratamiento con sunitinib. Se resuelve espontáneamente en 2-3 semanas tras la supresión del fármaco. El pelo adquiere un característico color gris, no pudiéndose objetivar histológicamente alteraciones en los melanocitos de los folículos afectados9. Se han descrito casos de bandas de pelo normal y pelo despigmentado en aquellos pacientes que siguen un régimen de tratamiento discontinuo (4 semanas de tratamiento y 2 semanas de descanso). Se considera que este efecto adverso se debe a la inhibición del c-KIT que modula los genes de las enzimas tirosinasa y proteína-1 relacionada con la tirosinasa, implicadas en la síntesis de la melanina64.
Alteraciones cutáneas escrotalesBillemont et al. describen en una serie de pacientes varones tratados con sunitinib la presencia de efectos adversos cutáneos de localización inguino-escrotal en un 12%65. Los autores objetivaron la aparición de eritema y descamación a las 2 semanas del inicio del tratamiento, resolviéndose de forma espontánea tras la supresión del fármaco. Asimismo, los autores describen 3 pacientes, sin antecedentes de psoriasis, que desarrollaron lesiones severas psoriasiformes de localización escrotal, que se acompañaron de intenso dolor, precisando una reducción de dosis de sunitinib65. Recientemente se ha descrito un caso de aparición de lesiones similares en el área genital en una paciente mujer, que recibía tratamiento con sunitinib por recidiva y metástasis de carcinoma de células renales 7 años después de la nefrectomía. En este caso también fue necesaria la reducción de la dosis del fármaco para conseguir el control de la sintomatología66.
En una serie de 8 pacientes tratados con sunitinib los autores encuentran afectación genital en 5 de ellos, con eritema en el prepucio, el escroto o el pene, intértrigo o inflamación anal. En 4 de los pacientes se suspendió el tratamiento por afectación en la calidad de vida67.
En esta localización también se ha descrito aparición de lesiones compatibles clínica e histológicamente con hemangiomas, que desaparecían al suspender el tratamiento y recidivaban con cada ciclo de administración de sunitinib68.
Recientemente Chou et al. demostraron en un paciente tratado con sunitinib que presentó eritema, inflamación, descamación y desarrollo de angioqueratomas en el escroto acompañado de dolor la presencia en la biopsia cutánea de capilares dilatados con células endoteliales con tinción positiva para VEGF, mientras que en un control sano no se detectó69. Este hecho apoya el papel en la patogénesis de las lesiones genitales por sunitinib del VEGF que habían propuesto Billemont et al.65. Aunque el mecanismo es desconocido, esta hipótesis sugiere que el VEGF y el factor 1-alfa inducible por hipoxia podrían desempeñar un papel principal. El VEGF induce proliferación endotelial, vasodilatación e incrementa la permeabilidad vascular. Se ha publicado la presencia de niveles elevados de VEGF en plasma en pacientes tratados con sunitinib, y se ha especulado que existiría un feedback fisiológico que provocaría un aumento reversible del VEGF circulante y tisular tras la administración de sunitinib (antagonista del receptor de VEGF). El VEGF alcanzaría esta localización escrotal, caracterizada por un rico aporte vascular y sometida al mismo tiempo de forma repetida a fricción y traumatismos, y produciría síntomas localizados como eritema escrotal, edema tisular, telangiectasias y desarrollo de hemangiomas65,69. Aunque no se determinó en el paciente presentado por Chou et al. la presencia de VEGF circulante, sí se pudo demostrar el incremento notable de su presencia en el tejido escrotal69.
En relación con la formación de hemangiomas escrotales Tonini et al. proponen que podrían estar involucrados 2 procesos: la neoangiogénesis (la producción de nuevos vasos sanguíneos a partir de los capilares preexistentes) y la vasculogénesis, que consiste en la utilización de los precursores circulantes de células endoteliales para la formación de los nuevos vasos68. Durante el tratamiento con sunitinib se ha demostrado un incremento en el número tanto de las células endoteliales circulantes maduras (circulating endothelial cells [CEC]), como de sus precursores circulantes (circulating endothelial progenitors [CEP]). De manera similar, existe un incremento de las CEP en niños con hemangiomas proliferantes68. Se ha demostrado que las CEP ejercen un papel fundamental en el rápido crecimiento posnatal de los hemangiomas infantiles70. La desaparición espontánea de las lesiones tras suspender el tratamiento con sunitinib podría explicarse por la normalización de los niveles de CEC y CEP68.
Otros efectos adversosSe han descrito otros efectos adversos cutáneos asociados a sunitinib, tales como hemorragias subungueales en astilla (en el 10-25% de los pacientes), erupción acneiforme facial, similar a la producida por los inhibidores del factor de crecimiento epidérmico aunque muy poco frecuente y menos severa, disestesia del cuero cabelludo similar a la de sorafenib, erupción eritematosa en el tronco, edema de piernas, alopecia (6-12%), estomatitis (36%)7, edema facial (25-50%) mucho menos frecuente que el producido con imatinib y que se localiza fundamentalmente en la zona periorbital71, siringometaplasia escamosa ecrina72, vasculitis leucocitoclástica, pioderma gangrenoso del que se han descrito hasta la fecha de hoy 5 casos73–77(en todos los casos las lesiones remitieron tras finalizar el tratamiento con sunitinib y recidivaron en los que se reintrodujo), un caso de una erupción simulando pápulas de Gottron78 y 4 casos de erosiones/úlceras cutáneas dolorosas en las extremidades inferiores asociadas a la administración del sunitinib79.
Efectos secundarios cutáneos de bevacizumabLa toxicidad cutánea de este anticuerpo monoclonal anti-VEGF es menor que la de otros fármacos similares, pero existen cuadros característicos junto a otros más habituales.
Rash cutáneoUn rash cutáneo o dermatitis exfoliativa ocurre entre un 19-46% de los pacientes en tratamiento con bevacizumab. En la mayoría de los ensayos clínicos no se encuentra asociación entre el rash cutáneo y una respuesta positiva al tratamiento, a diferencia de los antagonistas del EGFR. Solo se han descrito en la literatura 2 casos en los que la aparición y la intensidad del rash cutáneo se ha relacionado con la respuesta positiva al tratamiento, con desaparición de las metástasis a la vez que las lesiones progresaban. Las lesiones eran de tipo pápulo-eritematosas y recurrían con cada nuevo ciclo de bevacizumab80,81. En todos los casos las lesiones se han resuelto espontáneamente tras la finalización del tratamiento con bevacizumab.
Erupción pápulo-eritematosa asociada a la inyección intravítrea de bevacizumabBevacizumab se utiliza en oftalmología, fuera de ficha técnica, mediante inyección intravítrea para el tratamiento de diversos procesos relacionados con la neovascularización, tales como la degeneración macular asociada a la edad, la retinopatía diabética o la neovascularización coroidal en miopía. Se han descrito 2 casos de aparición de lesiones pápulo-eritematosas en la cabeza y el tronco relacionadas con la administración intravítrea de bevacizumab para el tratamiento de la neovascularización coroidea. En uno de los casos las lesiones aparecieron en la cabeza y el tronco 6 días después de la primera inyección, y reaparecieron a los 5 días después de una segunda inyección, 2 meses después. En el segundo caso el paciente recibió 3 inyecciones de bevacizumab, desarrollando a los 12 días después de la primera una erupción pápulo-eritematosa en la frente y las regiones temporales alrededor de los ojos. Las lesiones remitieron a los 8 días con corticoides tópicos, pero reaparecieron a los 14 días después de la segunda inyección y a los 10 días después de la tercera82,83.
Cicatrización de heridasEl proceso de angiogénesis está implicado en múltiples procesos fisiológicos, como por ejemplo la cicatrización de las heridas. En modelos animales se ha demostrado que bevacizumab inhibe el proceso de reparación a nivel de la dermis, siendo este efecto dosis-dependiente y reversible si se interrumpe la administración del fármaco84. Se han descrito diversos efectos de bevacizumab sobre la cicatrización de las heridas, tales como dehiscencia de la sutura, equimosis, hemorragia de la herida quirúrgica e incremento del riesgo de infección85. Scappaticci et al. analizaron los datos de 2 ensayos clínicos en relación con las complicaciones en cicatrización de heridas quirúrgicas en pacientes en tratamiento con bevacizumab, y encontraron un 13% de complicaciones por retraso en la cicatrización en aquellos pacientes que fueron sometidos a cirugía durante el tratamiento con bevacizumab, frente al 3% de los que no recibieron el fármaco. En cambio, los pacientes con bevacizumab instaurado 28-60 días después de la cirugía no presentaron una frecuencia mayor de complicaciones84. Se ha demostrado que no solo la administración por vía sistémica, sino también la administración intravítrea del fármaco, tiene efecto negativo sobre la cicatrización de las heridas86.
Ulceración de estríasSe han descrito casos de ulceración de las estrías producidas por corticoides en pacientes con tumores cerebrales en tratamiento con bevacizumab87. Los autores explican que este fenómeno ocurre como consecuencia del efecto antiangiogénico de bevacizumab, que dificulta la reparación del tejido que ya está previamente debilitado por la corticoterapia.
Se ha descrito también un caso de necrosis de estrías en un paciente en tratamiento con bevacizumab e irinotecán por un glioblastoma una semana después de comenzar con el tratamiento. Se retiró bevacizumab 2 meses después por falta de eficacia y las lesiones cicatrizaron en un mes88. Recientemente se ha descrito un caso similar en un paciente en edad pediátrica, que recibía bevacizumab e irinotecán para el tratamiento de un glioblastoma recurrente, que desarrolló necrosis de sus estrías abdominales producidas por la corticoterapia de larga duración89. En el caso de los tumores cerebrales es frecuente la necesidad de corticoterapia a dosis altas durante un período de tiempo prolongado para el manejo del edema cerebral asociado, por lo que resulta especialmente importante prestar atención a los posibles efectos secundarios en el caso de introducción de una terapia antiangiogénica, como ocurre en el caso de bevacizumab. En la literatura se destaca la importancia de la prevención de aparición de úlceras sobre las estrías en estos pacientes, y una vez que estas aparecen se recomienda una hidratación adecuada de la zona y el uso de apósitos hidrocoloides87.
Dermatosis perforanteSe ha descrito un caso de aparición de lesiones papulosas umbilicadas de 5mm de diámetro en el cuello con un tapón central queratósico, ligeramente pruriginosas en un paciente que recibía bevacizumab desde hacía 2 meses. El estudio histológico puso de manifiesto la presencia de eliminación transepidérmica de colágeno. No fue necesaria la retirada del fármaco90.
ConclusionesEn los últimos años se han aprobado múltiples fármacos para el tratamiento de diversos tipos de tumores y muchas más moléculas están en fases 3 y 4 de ensayos clínicos. Entre ellos ocupan un lugar importante los fármacos antiangiogénicos. Los fármacos antiangiogénicos producen toxicidad cutánea en hasta un 90% de los pacientes. Por todo ello, resulta de gran importancia para el dermatólogo conocer los efectos cutáneos que pueden aparecer en relación con estos fármacos y saber cómo manejarlos.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
A las doctoras Tuneu y López Pestaña del Hospital Donostia-San Sebastián por el material iconográfico cedido.