El sunitinib (Sutent®) es un inhibidor de la vía de las quinasas (IQ) que actúa sobre la angiogénesis y sobre la proliferación celular. Este agente antineoplásico está asociado a varios efectos secundarios leves que incluyen diarrea, náuseas, fatiga e hipertensión, así como a numerosas manifestaciones cutáneas1–4. Entre estas últimas no se encuentran, sin embargo, el desarrollo de lesiones que asemejan a las típicas pápulas de Gottron de una dermatomiositis que se resuelven tras la disminución o retirada del sunitinib.
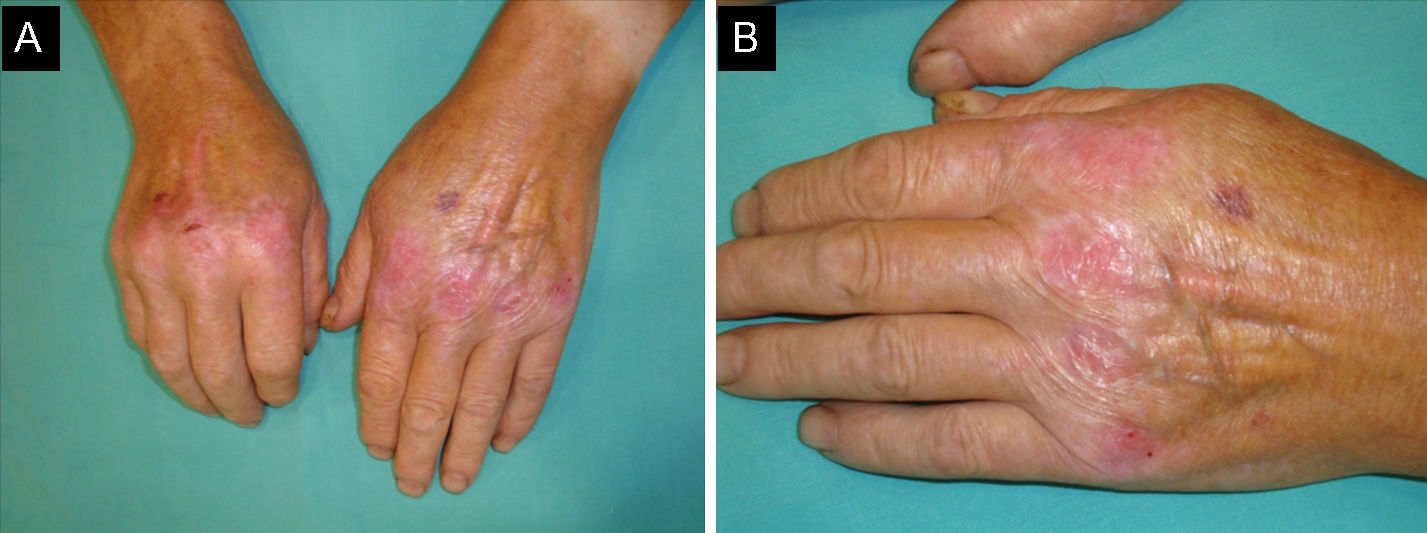
Un varón de 73 años, diagnosticado de cáncer renal metastático, estaba en tratamiento con sunitinib oral (Sutent®) en monoterapia desde hacía 4 años, a dosis de 37,5mg/ día, con un aceptable control de la enfermedad. El paciente fue remitido a nuestro departamento para la valoración de una dermatosis eritemato-violácea asintomática, discretamente indurada, confluente y bilateral, dolorosa, que mostraba una mayor intensidad sobre el tegumento de las articulaciones metacarpofalángicas y, en menor medida, interfalángicas. Este proceso inflamatorio se extendía con un patrón lineal siguiendo el trayecto de los tendones extensores de las manos y los pies (fig. 1A y B). De forma llamativa, la región palmar de las manos y plantar de los pies estaban completamente indemnes.
En el examen físico el paciente no mostró fiebre, artralgia, ni ningún otro síntoma cutáneo y/ o sistémico característico de dermatomiositis. La analítica de sangre general, que incluyó determinación de ANA, ENA, Anti Jo1, Anti Mi2, así como CPK y aldolasa, no mostró alteraciones significativas.
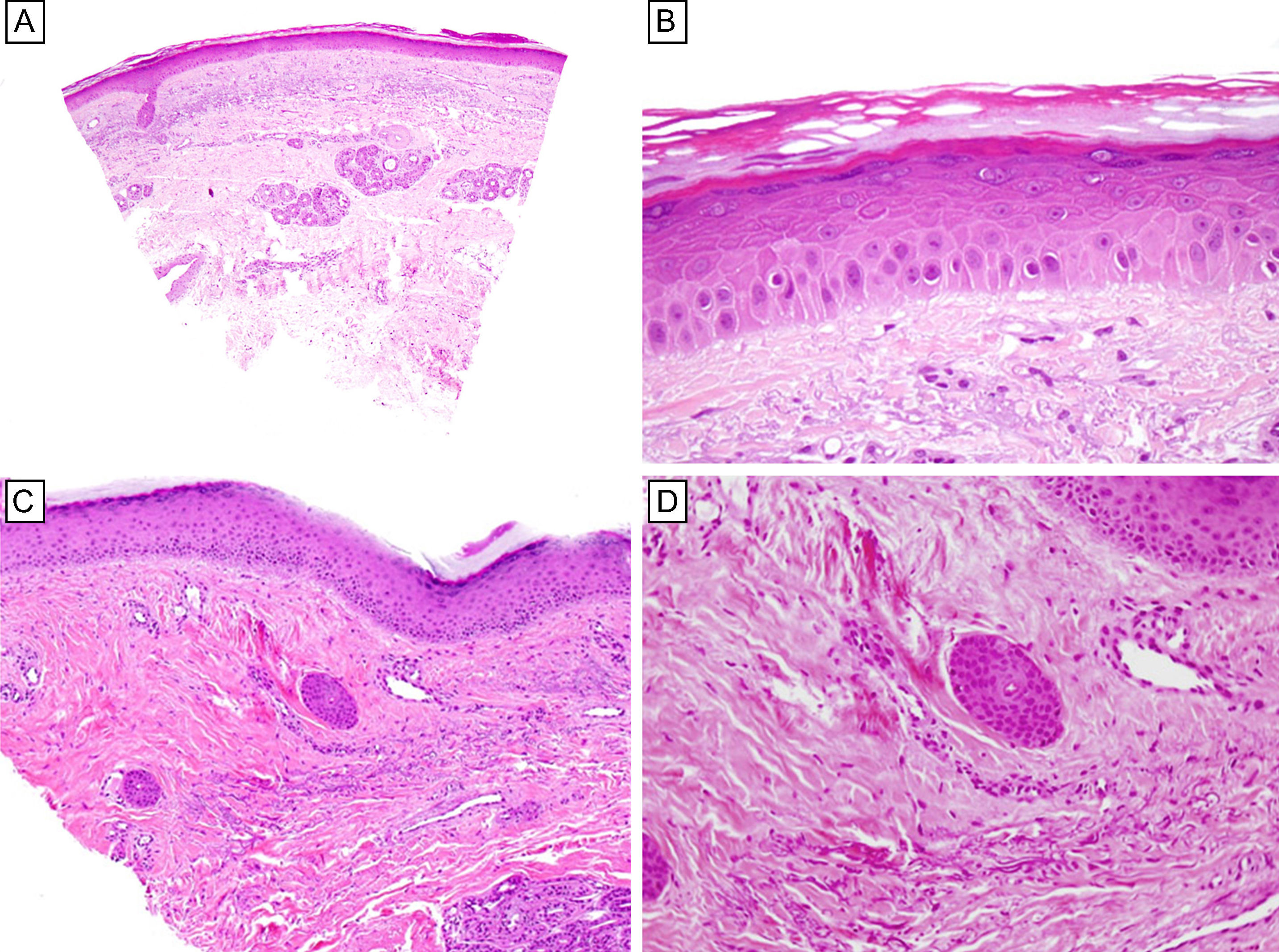
Ante la sospecha de una posible relación con la ingesta del sunitinib se realizó un punch-biopsia de una de las zonas más infiltradas localizadas en la piel de una de las articulaciones interfalángicas. El estudio histopatológico de la pieza permitió comprobar cambios microscópicos similares a aquellos que comúnmente se observan en pacientes tratados con fármacos quimioterápicos citotóxicos, que incluyen la presencia de queratinocitos necróticos con pérdida de la polarización, múltiples mitosis en la membrana basal y suprabasal y la existencia de un discreto infiltrado linfocítico intraepidérmico y perivascular superficial. Lo más llamativo fue el hecho de que el tercio inferior de la epidermis mostró múltiples queratinocitos engrosados con un citoplasma eosinofílico y edematoso, con núcleos hipercromáticos y nucleolos prominentes, acompañados de espongiosis, que generaba un patrón «pseudoestratificado» (fig. 2A y B). Otro dato histopatológico de interés fue la presencia de cambios en los ductos ecrinos, compatibles con siringometaplasia escamosa ecrina (fig. 2C y D). Este fenómeno, basado en nuestra experiencia, es un hallazgo usual en pacientes tratados con fármacos inhibidores de quinasas.
A. Presencia de queratinocitos con pérdida de la polarización y múltiples mitosis en la capa basal y suprabasal epidérmicas, junto con la existencia de un infiltrado linfocitario intraepidérmico y perivascular superficial (hematoxilina-eosina; x25). B. Múltiples queratinocitos con citoplasma eosinofílico y edematoso y núcleo hipercromático, con nucleolo prominente, organizados en un patrón «pseudoestratificado» en el tercio inferior de la epidermis (hematoxilina-eosina; x 100). C y D. Presencia de cambios en los ductos dérmicos ecrinos compatibles con siringometaplasia escamosa ecrina (hematoxilina-eosina; C: x25; D: x100).
Ante la sospecha clínica e histológica de toxicodermia cutánea por sunitinib se decidió, de forma consensuada con el oncólogo, la suspensión de este fármaco. Desde ese momento las lesiones comenzaron a involucionar, con resolución de las mismas tras tres meses de la retirada de sunitinib.
Seis meses más tarde, y debido a una recaída de la enfermedad neoplásica, el fármaco fue reintroducido. A los tres meses de su nueva administración el paciente sufrió una recidiva de las lesiones cutáneas, siguiendo el mismo patrón clínico previamente comentado. Debido a la intensa molestia percibida por el paciente, que le impedía llevar a cabo una actividad diaria normal y que incluso no le permitía conciliar el sueño, se procedió a la reducción de un 15% en la dosis total del fármaco, lo que permitió controlar la sintomatología del proceso.
El sunitinib es un IQ oral que actúa sobre diversos receptores, que incluyen el receptor del factor de crecimiento del endotelio vascular 1 y 3, el receptor del factor de crecimiento derivado de las plaquetas alfa, el receptor de factor estimulante de colonias 1 y el receptor del factor neurotrópico derivado de la línea celular glial. De la misma forma actúan bloqueando la expresión de diversas proteínas, entre las que destacan las proteínas KIT /CD117 y Flt-34,5. Las indicaciones aprobadas de este fármaco en la actualidad incluyen aquellos casos de tumores estromales gastrointestinales (GIST) resistentes al tratamiento con imatinib y el cáncer renal metastático4,5. La reacción cutánea mano-pie y la estomatitis son los dos cuadros cutáneos adversos más importantes relacionados con la ingesta de este fármaco antineoplásico, describiéndose en el 36% de los casos1–6. La reacción mano-pie se caracteriza por el desarrollo de placas eritemato-descamativas que progresivamente desarrollan una gruesa capa de queratina en su superficie, a modo de callosidad6. Estas lesiones aparecen de forma característica en zonas de presión de las palmas y de las plantas, y en ocasiones asocian lesiones en el dorso de los dedos. En nuestro caso las regiones palmares y plantares se encontraban completamente respetadas.
Otros eventos cutáneos secundarios a este medicamento incluyen, ordenados de mayor a menor frecuencia, hinchazón facial, discoloración amarillenta, despigmentación del pelo, hemorragias subungueales en astilla, erupción eritematosa en el tronco, alopecia, erupción facial acneiforme y disestesia en el cuero cabelludo1–4.
Describimos el caso de un exantema crónico con un patrón clínico semejante a pápulas de Gottron, que se consideran un hallazgo característico de la dermatomiositis. La ausencia de síntomas sistémicos, otras lesiones cutáneas y alteraciones séricas, así como los hallazgos histológicos descritos previamente, apoyan el papel del sunitinib como agente etiológico del cuadro cutáneo. Este patrón que simula a la dermatomiositis ha sido descrito previamente en pacientes sometidos a terapia con hidroxiurea durante un largo período de tiempo7.
Es importante reconocer las diferentes reacciones cutáneas adversas relacionadas con este fármaco, debido al incremento de su uso a largo plazo en el manejo de enfermedades oncológicas.