INTRODUCCIÓN
La micosis fungoide (MF) es el tipo más común de linfoma cutáneo (1). Se caracteriza por su lenta evolución, atravesando habitualmente distintas etapas cutáneas (placa limitada o generalizada, tumor, eritrodermia) y comprometiendo ganglios linfáticos y/o vísceras en fases avanzadas (2). Es una enfermedad fatal, citándose la infección como la principal causa de morbimortalidad (3, 4). En el presente trabajo se estudian 62 pacientes con diversos estadios de MF, determinándose la incidencia, etiología, factores predisponentes y evolución a sepsis.
MATERIAL Y MÉTODOS
Se analizaron retrospectivamente las historias clínicas de 62 pacientes con diagnóstico de MF sobre 82 pacientes con linfoma y compromiso cutáneo en piel en el período comprendido entre el primero de enero de 1990 al 31 de diciembre de 2000 en el Hospital de Clínicas José de San Martín de la ciudad de Buenos Aires (Argentina). Fueron únicamente seleccionados aquellos pacientes cuya clínica e histología fuera compatible con MF, excluyéndose los casos dudosos o las parapsoriasis.
Los pacientes fueron divididos en dos grupos: sépticos y no infectados o control. Los criterios para la inclusión en el grupo séptico fueron: a) presencia de respuesta sistémica a la infección manifestada por dos o más de las siguientes condiciones: fiebre o hipotermia, taquicardia, taquipnea o hiperventilación (PaCO2 < 32) y leucocitosis o leucopenia (5), y b) bacteriemia en dos o más hemocultivos para el mismo microorganismo obtenidos el mismo día de sitios venosos distintos según técnicas habituales.
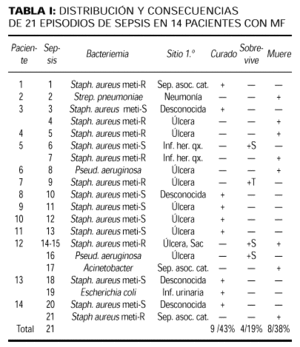
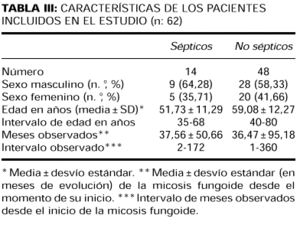
La sangre para hemocultivar fue colocada en frascos con caldo infusión cerebro-corazón (BHI) Britania® y procesados según normas hasta 1994, y desde entonces con frascos y sistema BACT-ALERT® (Organon técnica). La etiología y el origen de estos episodios de bacteriemia se especifican en las tablas I y II. La tabla III incluye el sexo, edad y tiempo de observación de los pacientes. Se realizaron: análisis séricos y urinarios, punción aspiración y biopsia de médula ósea, estudios por imágenes (radiografía de tórax, tomografía toracoabdominopelviana) y estudio histopatológico de las lesiones cutáneas y adenopatías palpables.
Para la estadificación de la MF se utilizó el sistema de clasificación análogo al TNM (tumor-ganglio-metástasis) del National Cancer Institute (6).
Las biopsias cutáneas fueron incluidas en parafina y teñidas con hematoxilina-eosina. Los criterios histopatológicos se basaron en los descriptos por Nickoloff (7) y por el grupo europeo de linfomas cutáneos (EORTC) (8). Requirió la presencia de linfocitos atípicos e hipercromáticos en epidermis y/o dermis papilar con la ocasional presencia de células con núcleo cerebriforme distribuidas o no a lo largo de la unión dermoepidérmica y/o a la formación de microabscesos de Pautrier. No se incluyeron pacientes con otros tipos de linfoma cutáneo de células T (LCCT) excepto aquellos con aumento de células atípicas en sangre periférica de más del 5%, considerado por muchos autores como síndrome de Sézary, si bien no hay un consenso en cuáles son los criterios diagnósticos de esta entidad (2, 9, 10).
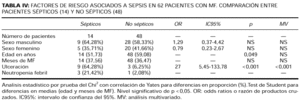
Se valoraron en ambos grupos las siguientes variables: edad, sexo, tiempo de observación, clínica, neutropenia febril, compromiso de ganglios linfáticos y/o vísceras, células atípicas circulantes y estadificación (tablas III, IV y V).
Cura de la infección se consideró cuando el paciente vivió más de 30 días después de terminado el antibiótico para su bacteriemia, sin los síntomas de sepsis especificados anteriormente y con hemocultivos de control negativos (11). Sobrevida de infección cuando vivió menos de 30 días después de terminado el antibiótico para su bacteriemia, falleciendo por un nuevo espisodio de sepsis o por otra causa (en nuestra serie, un deceso por tromboembolismo pulmonar) (11). Muerte por infección cuando el fallecimiento ocurrió por sepsis antes o durante el tratamiento antibiótico (11). El sitio primario de infección se definió como aquel que favoreció la diseminación bacteriana coincidiendo el hallazgo del mismo germen (género, especie y antibiograma)tanto en el sitio primario como en sangre periférica. Asimismo se definieron los focos primarios por la presencia de: a) infección de herida quirúrgica (clínica compatible con flogosis o presencia de pus); b) ulceraciones (biopsia compatible con infiltración linfomatosa); c) sepsis asociada a catéter --hemocultivos positivos más secreción purulenta en el sitio de inserción del catéter o cultivo ³ 15 unidades formadoras de colonias (UFC) semicuantitativo de la superficie externa del catéter (técnica de Maki) o retrocultivo cuantitativo con una relación ³ 10:1 UFC con respecto a los hemocultivos cuantitativos tomadas ambas muestras simultáneamente (12)--; d) neumonía (clínica más radiografía de tórax compatible), y e)infección urinaria (clínica más urocultivo ³ 105 UFC) (13).
Para determinar el número total de pacientes se realizó una búsqueda computarizada de las admisiones hospitalarias en el Servicio de Dermatología utilizando las palabras clave linfomas y micosis fungoide. Se utilizaron métodos univariados (correlaciones no paramétricas) y multivariados (regresión logística múltiple) para investigar la asociación de factores independientes de riesgo para desarrollar sepsis. La significación estadística de la diferencia entre los distintos factores evaluados entre el grupo con sepsis y el control fue determinada mediante la prueba del Chi2 con correlación de Yates para diferencias en proporción y por la prueba de Student para diferencias en medias. La fuerza de la asociación fue estimada calculando la razón de productos cruzados u odds ratio (OR) con sus correspondientes intervalos de confianza del 95% (IC95%) para cada factor. Se consideró significativa una p < 0,05. Los datos obtenidos fueron procesados mediante el software Epi Info (CDC, Atlanta, EE. UU.) versión 6.04 y Statistica (StartSoft Corp, Tulsa, EE. UU.) versión 3.1.
RESULTADOS
Sobre un total de 62 pacientes con MF, 14 (22,5%) presentaron 21 episodios de sepsis (tabla I). De ellos, 15/21 septicemias fueron atribuibles a Staphylococcus aureus (siete meticilino-resistente), 2/21 a Pseudomonas aeruginosa y 1/21 a Streptococcus pneumoniae, Acinetobacter sp. y Escherichia coli; 9/14 pacientes presentaron un episodio séptico, 4/14 tuvieron dos septicemias y 1/14 desarrolló sepsis en cuatro oportunidades. Staphylococcus aureus resultó ser el primer germen aislado en aquellos pacientes donde se aisló más de un germen.
Los síntomas y signos clínicos más frecuentes de sepsis incluyeron fiebre (18/21 septicemias, 85,71%), taquicardia (16/21; 76,19%), hipotensión (14/21; 66,66%), oliguria (13/21; 64,76%), taquipnea (8/21; 38,09%), alteración del estado de conciencia (4/21; 19,04%) e hipotermia (1/21; 4,76%).
En la bioquímica 11/14 pacientes presentaron leucocitosis durante la sepsis, mientras 3/14 desarrollaron neutropenia posterior a la administración de quimioterapia. Como sitio primario de entrada de la infección el 80,95% (17/21 pacientes) fue por compromiso de la barrera cutánea. Fueron las principales fuentes las úlceras cutáneas por infiltración linfomatosa (9/14; 64,28%) y la sepsis asociada al uso de catéteres endovenosos (4/14; 28,57%). En estos pacientes los hallazgos microbiológicos de la fuente de origen coincidieron con los de sangre periférica (tabla I). La tabla II muestra las otras fuentes de sepsis.
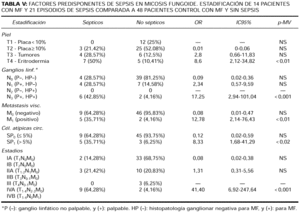
Como factores predisponentes a desarrollar sepsis mostraron una asociación significativa en los análisis univariados edades tempranas y ulceraciones cutáneas linfomatosas. En cambio en los análisis multivariados únicamente las ulceraciones cutáneas linfomatosas fueron estadísticamente significativas (tabla IV). En ningún procesamiento estadístico fueron significativas las diferencias de sexo o el tiempo de evolución de la MF para el desarrollo de sepsis. La presencia de neutropenia febril posterior a la administración de quimioterapia ocurrió en 3/14 pacientes con sepsis en comparación a 1/48 pacientes sin sepsis, por lo que estos datos no permiteron obtener resultados concluyentes. En cuanto a la predisposición a desarrollar sepsis de acuerdo al estadio de la enfermedad (tabla V), correlacionaron en los análisis uni y multivariados con alto riesgo para este evento la presencia de eritrodermia, adenopatías histológicamente infiltradas, metástasis viscerales, células atípicas en sangre periférica > 5% y estadio IV. Por el contrario, la presencia de placas limitadas o generalizadas, tumores, adenopatías no palpables o histológicamente no infiltradas, células atípicas circulantes ausentes o < 5%, ausencia de compromiso visceral y los estadios I al III caracterizaron a los pacientes con MF, en quienes el desarrollo de sepsis fue improbable.
En todos los casos de sepsis se inició antibioticoterapia empírica previa realización de cultivos. Los fármacos utilizados fueron cefalotina, inhibidores de β-lactamasas (amoxicilina-clavulánico, amoxicilina-sulbactam, piperacilina-tazobactam), imipenem, vancomicina y amikacina. La duración de la antibioticoterapia varió entre 14 y 28 días (media: 20); 9/14 pacientes (64,28%) en 12/21 septicemias (57,14%) fueron fatales antes del mes de finalizado el tratamiento antibiótico. De ellos, presentaron como causa asociada de mortalidad tromboembolismo pulmonar (un caso) y progresión del linfoma (tres casos); 6/9 (66,66%) pacientes fallecidos tenían estadio IV. Etiológicamente ninguna bacteriemia por Staphylococcus aureus meticilino-sensible o Escherichia coli fue mortal, a diferencia de las provocadas por Staphylococcus aureus meticilino-resistente, Pseudomonas aeruginosa, Streptococcus pneumoniae y Acinetobacter sp.
DISCUSIÓN
La sepsis es la causa más frecuente de mortalidad en pacientes con MF (3, 4). Staphylococccus aureus y Pseudomonas aeruginosa han sido los gérmenes más frecuentemente implicados y causarían más del 50% de las muertes en pacientes con LCCT (3). Los pacientes con estadios tardíos de la enfermedad son los más comúnmente afectados. Por ello la presencia de eritrodermia, compromiso ganglionar linfático y/o visceral por el linfoma y el hallazgo de células atípicas en sangre periférica son los factores más frecuentemente implicados (11).
Los sitios de infección cutánea son puertas de entrada de infección sistémica (11, 14), y en nuestra serie esta situación fue evidente en 15/21 (80%) episodios bacteriémicos. De ellos, 9/14 pacientes presentaban úlceras cutáneas linfomatosas y 4/14 sepsis asociada al uso de catéteres endovenosos. Similar microorganismo en piel y en sangre periférica fue demostrado en las úlceras cutáneas linfomatosas, aislándose principalmente Staphylococccus aureus en siete ocasiones (cuatro meticilino-resistente) y Pseudomonas aeruginosa en dos casos (tabla I). En un paciente ocurrió el aislamiento inicial de Staphylococcus aureus y la sobreinfección posterior con Pseudomonas aeruginosa. En cambio solamente 3/48 pacientes no sépticos presentaban úlceras por infiltración linfomatosa con estudios bacteriológicos negativos. Estos datos avalan los hallados en la literatura, que consideran la ulceración como una fuente fundamental de entrada de infecciones (11, 15).
Evolucionaron favorablemente todas las septicemias provocadas por Staphylococcus aureus meticilino-sensible, a diferencia de las provocadas por las cepas meticilino-resistentes y por Pseudomonas aeruginosa que tuvieron un fatal desenlace (tabla I). Por tanto es fundamental el estudio bacteriológico de lesiones cutáneas como úlceras, lugares de inserción de catéteres endovenosos o heridas quirúrgicas en pacientes con estadios tardíos de MF. Dado que las alteraciones de la continuidad de la barrera cutánea son la principal fuente de sepsis en este grupo de pacientes, una cuidadosa evaluación de las mismas debe ser realizado. Los catéteres endovenosos periféricos deben cambiarse frecuentemente, y en el caso de accesos venosos centrales debe evitarse su permanencia prolongada y hacerse un adecuado cultivo bacteriológico ante su retiro. Todas las heridas cutáneas deben cultivarse y tratarse según hallazgos microbiológicos.
Los pacientes con MF son especialmente susceptibles a la infección por Staphylococcus aureus (11). Un super-antígeno de esta bacteria fue hallado en 32/42 (76%) pacientes en fase eritrodérmica con linfoma cutáneo (16). Éste estimularía crónicamente a las células T y exacerbaría crónicamente la inflamación cutánea.
La incidencia de neutropenia en pacientes con MF y sepsis fue baja. Estos datos correlacionan con los encontrados en la literatura y se debería a que la MF no presenta alteración del sistema fagocítico-mononuclear (principal responsable del sistema de defensa contra el Staphylococcus aureus) ni defectos inmunológicos que favorezcan el desarrollo de sepsis (17, 18). Más aún, altos niveles de quemocina derivada de macrófagos se detectan en el suero de pacientes con MF, potente quimiotáctico de linfocitos Th2 (19). Éstos predominan en la MF en etapa eritrodérmica o con síndrome de Sézary (20) y son responsables de la producción de interleucinas 4, 5 y 6 e inversamente de interferón-g (21). En cambio, esto no ocurre en estadios iniciales de MF, donde el predominio es de los linfocitos Th1 (20). La presencia de células atípicas circulantes es un factor de mal pronóstico en la MF (22-24), determinándose por técnicas de PCR (reacción en cadena de la polimerasa) la existencia de un clón celular T (22). Bernengo y cols. determinaron que el patrón antigénico CD4 positivo-CD26 negativo es otro parámetro adicional para la identificación de células de Sézary (25).
La mortalidad fue mayor cuanto peor estadificación tenía el paciente (57% de los pacientes fallecieron por sepsis; de ellos, el 66% en estadio IV). Esto coincide con otros estudios donde un mayor compromiso tegumentario se asocia con un peor pronóstico (26-29). En síntesis, a mayor estadio los trabajos revelan peor pronóstico por la progresión del linfoma y por la mayor probabilidad de sepsis. Al respecto, Posner halló que el 42% de los pacientes con LCCT y sepsis fallecían antes del mes de finalizado el tratamiento antibiótico, cursando la mayoría con estadios avanzados de la enfermedad (11).
Una cuestión clave es cuando iniciar tratamiento antibiótico. De acuerdo a lo hallado aquel grupo de pacientes eritrodérmicos con compromiso ganglionar, visceral o de sangre periférica y en estadio IV tienen mayor predisposición a desarrollar sepsis. Por ello es imperioso un rápido examen físico en búsqueda de lesiones que impliquen una pérdida de la barrera cutánea. Su hallazgo determinará la realización de un precoz estudio microbiológico. Cuando exista evidencia clínica de septicemia (en nuestra serie por taquicardia, hipotensión y fiebre) una cobertura antibiótica empírica deberá ser instaurada cubriendo Staphylococcus aureus (incluyendo cepas meticilino-resistentes), principal causa de sepsis en estos pacientes y bacterias gramnegativas (en especial, Pseudomonas aeruginosa), que provocan una alta mortalidad.
En conclusión, el presente trabajo permite identificar aquellos pacientes con alto riesgo de desarrollar sepsis. El conocimiento de los mismos permitirá estar alerta para instaurar una precoz y adecuada terapia.