En diversos estudios se ha descrito la asociación de los polimorfismos del factor de necrosis tumoral α (TNF-α) y patologías inflamatorias como la psoriasis vulgar y la artritis psoriásica, aunque los resultados son variables según la población de origen de la muestra. No se han realizado estudios previamente en población española.
ObjetivoAnalizar los polimorfismos de la región promotora del gen del TNF-α en pacientes con psoriasis moderada-grave y establecer las posibles diferencias genotípicas con los hallados en un grupo de voluntarios sanos.
Material y métodosSe seleccionaron 89 pacientes con psoriasis moderada-grave y 76 controles sin antecedentes familiares ni personales de psoriasis. Se genotiparon los polimorfismos de la región promotora del gen del TNF-α en ambos grupos.
ResultadosObservamos una mayor prevalencia de genotipo con ambos alelos en estado silvestre en posición -238 (GG, 86,5% vs 70,4% respectivamente) y -1031 (TT, 80,2% vs 45,8% respectivamente) en el grupo de pacientes con psoriasis al compararlo con el grupo control. Las diferencias halladas en posición -308 y -857 no fueron significativas.
ConclusiónExisten diferencias en los polimorfismos en las posiciones -238 y -1031 entre pacientes con psoriasis moderada-grave y voluntarios sanos, lo cual apoya la importancia del papel del TNF-α en la fisiopatología de esta entidad.
Several studies have reported an association between tumor necrosis factor α (TNF-α) polymorphisms and inflammatory diseases such as psoriasis vulgaris and psoriatic arthritis, although the results vary according to the population studied. No studies have been performed in the Spanish population.
ObjectiveTo analyze the polymorphisms of the promoter region of the TNF-α gene in patients with moderate to severe psorasis and to identify potential differences in genotype compared to a group of healthy volunteers.
Material and methodsEighty-nine patients with moderate to severe psoriasis and 76 healthy controls with no personal or family history of psoriasis were selected. Polymorphisms of the TNF-α promoter region of both groups were genotyped.
ResultsWe observed a higher prevalence of the genotype with both wild-type alleles at positions -238 (GG genotype, 86.5% vs 70.4%, respectively) and -1031 (TT genotype, 80.2% vs 45.8%, respectively) in patients compared to the healthy control group. The differences at positions -308 and -857 were not significant.
ConclusionThere are differences in polymorphisms at positions -238 and -1031 in patients with moderate to severe psoriasis compared to healthy volunteers. This observation provides further support for the importance of the part that TNF-α plays in the pathophysiology of this disease.
Uno de los principales problemas a los que se enfrenta la farmacología clínica es la variabilidad interindividual existente en la respuesta a los fármacos, tanto en lo relativo a la efectividad como en lo que concierne a la toxicidad1. El mismo fármaco puede ser muy eficaz en un paciente mientras que en otro produce efectos adversos que pueden llegar a requerir la suspensión del tratamiento. Esta variabilidad se debe tanto a factores genéticos, que participan en el 20-95% de la variabilidad en la disponibilidad y efecto de un fármaco2, como a factores no genéticos, que a diferencia de lo que suele ocurrir con los anteriores varían a lo largo de la vida; entre ellos se encuentran los factores fisiológicos (edad, sexo, peso, grasa corporal), fisiopatológicos (función renal, hepática, cardiovascular, enfermedades asociadas) y medioambientales (tabaco, alcohol, tratamientos concomitantes).
El gran reto de la medicina actual consiste en identificar estas variables que permitan predecir el grado de respuesta a un fármaco o la toxicidad del mismo en cada individuo previamente al inicio del tratamiento. La farmacogenética se encarga de estudiar estas características genéticas y la relación existente entre ellas y la respuesta a un fármaco, tanto en lo que se refiere a eficacia como a fenómenos adversos. Así pues, el primer paso sería el estudio de estas variabilidades genéticas interindividuales.
En el caso de la psoriasis se han realizado algunos estudios que han intentado relacionar diferentes polimorfismos genéticos con la susceptibilidad a padecer esta enfermedad. Los principales genes que se han analizado han sido: el complejo mayor de histocompatibilidad HLA-Cw*06023, el gen del factor de necrosis tumoral alfa (TNF-α)4–10, varias interleuquinas como Il-1 beta, Il-6 e Il-1011,12, la subunidad p40 común a las IL-12 e IL-23, una de las subunidades del receptor de IL-23 (IL23R)13, IL-13 e IL1514, SNF313 (un gen implicado en la ubiquitinización de proteínas)15, el factor de crecimiento tumoral β (TGF-β)16 y el promotor del gen de interferón gamma (IFN-γ)17.
En el caso de la psoriasis es interesante el estudio de los polimorfismos del gen del TNF-α debido al papel que desempeña como diana de la mayoría de los fármacos biológicos18–21. El gen del TNF-α se encuentra en el brazo corto del cromosoma 6, muy próximo al complejo mayor de histocompatibilidad B. Esta región es muy polimórfica, habiéndose descrito hasta 44 polimorfismos22, algunos de los cuales se han asociado a diferentes patologías. Los polimorfismos en las posiciones -238 y -308 en el promotor del gen del TNF-α se han asociado en algunos estudios con la respuesta al tratamiento con fármacos biológicos anti-TNF-α en patologías reumatológicas como la artritis reumatoide y la espondilitis anquilosante22–29. Asimismo los polimorfismos en posición -857 también se han relacionado con la respuesta a otros fármacos biológicos en pacientes con artritis reumatoide30,31. El trabajo realizado en pacientes con artritis reumatoide publicado por Oregón-Romero et al. mostraba que aquellos pacientes que presentaban un genotipo con ambos alelos silvestres, tanto en posición -238 como en posición -308, presentaban una mayor producción de ARN mensajero y de TNF-α que aquellos con alguno de los alelos en estado mutante; no obstante estas diferencias no se encontraban en pacientes sanos32.
En la psoriasis los polimorfismos más estudiados son la sustitución de guanina por adenina en posiciones -238 y -308 (-238G→A, -308G→A), la sustitución de citosina por timina en posición -857 (-857C→T) y la sustitución de timina por citosina en posición -1031 (-1031T→C). Los dos primeros, localizados en la región promotora del gen, se han relacionado con el grado de severidad de la psoriasis32; la presencia de -857T se ha asociado a un mayor riesgo de artritis psoriásica, pero no de psoriasis. Sin embargo no existen asociaciones concluyentes en cuanto a los polimorfismos en posición -10319.
ObjetivoEl objetivo principal de este trabajo es estudiar los polimorfismos genéticos del promotor del TNF-α en pacientes con psoriasis y sujetos control y establecer las posibles diferencias alélicas y genotípicas entre ambos grupos.
Material y métodosDiseño experimentalSe trata de un estudio prospectivo en pacientes con psoriasis en placas moderada-grave, definiendo como tal un PASI mayor o igual a 10 y/o BSA mayor del 10% de la superficie corporal total, con o sin artritis psoriásica. Todos los pacientes pertenecían a la población de la Comunidad de Madrid y Castilla-La Mancha. El origen español no era un criterio de inclusión, si bien el 97% de los pacientes lo cumplían.
Para el grupo control empleamos voluntarios sanos de la Unidad de Ensayos Clínicos del Servicio de Farmacología Clínica. Los criterios de inclusión para los controles eran voluntarios sanos pertenecientes a la Comunidad de Madrid, no fumadores, de origen español y sin antecedentes personales ni familiares de psoriasis en parientes de primer grado.
Este estudio se aprobó por el Comité Ético de nuestro centro, y en todos los pacientes y voluntarios sanos se obtuvo el consentimiento informado por escrito previo a la obtención de la muestra.
Para este estudio se seleccionaron los polimorfismos que se han estudiado más en pacientes con psoriasis y que son los siguientes: -238 G→A (rs361525), -308 G→A (rs1800629), -857 C→T (rs1799724) y -1031 T→C (rs1799964).
Procesado de las muestrasA cada sujeto en estudio se le extrajo una muestra de 4 ml de sangre periferica que se añadió a un tubo de EDTA K3, registrándose e identificándose con un código. El ADN se extrajo con un extractor automático de ADN (MagNa Pure® System, Roche Applied Science, EE.UU.), cuantificándose mediante espectrofotometría (NanoDrop® ND-1000, Wilmington DE, EE.UU.). La pureza se determinó mediante la ratio de 260nm/280nm.
Reacción en cadena de la polimerasaLa determinación de estos Single Nucleotide Polymorphisms (SNP) se realizó por secuenciación utilizando diferentes cebadores. Los cebadores 308F (5’-TTCCTGCATCCTGTCTGGAA-3’) y 238R (5’-CAGCGGAAAACTTCCTTGG-3’) se utilizaron para determinar los polimorfismos -308 y -238, que se estudiaron en la misma secuencia debido a su proximidad en el gen. Los cebadores 857F (5’-AGGAATGGGTTACAGGAGAC-3’) y 857R (GTCCCCTGTATTCCATACCT) se utilizaron para determinar el polimorfismo -857, y para determinar el SNP -1031 se emplearon los cebadores 1031F (5’-TCAGAGAGCTTCAGGGATAT-3’) y 1031R (5’-ACATGTGGCCATATCTCCCA-3’).
Las concentraciones de los reactivos de la reacción en cadena de la polimerasa (PCR) fueron: Buffer 1X, 2,5mM MgCl2, 0,3μM de desoxirribonucleótidos trifosfato (dNTP) y 1 U/μl de Ampli Taq Gold© (Applied Biosystems). Además para el estudio del nucleótido en posición -1031 añadimos un 5% de dimetil sulfóxido (DMSO), ya que es una región rica en bases nitrogenadas G y C.
El producto de PCR se resolvió en un gel de agarosa al 3% y se purificó dicho producto de PCR mediante GENECLEAN© (MP Biomedicals), según las instrucciones del fabricante, para posteriormente realizar la secuenciación del producto amplificado.
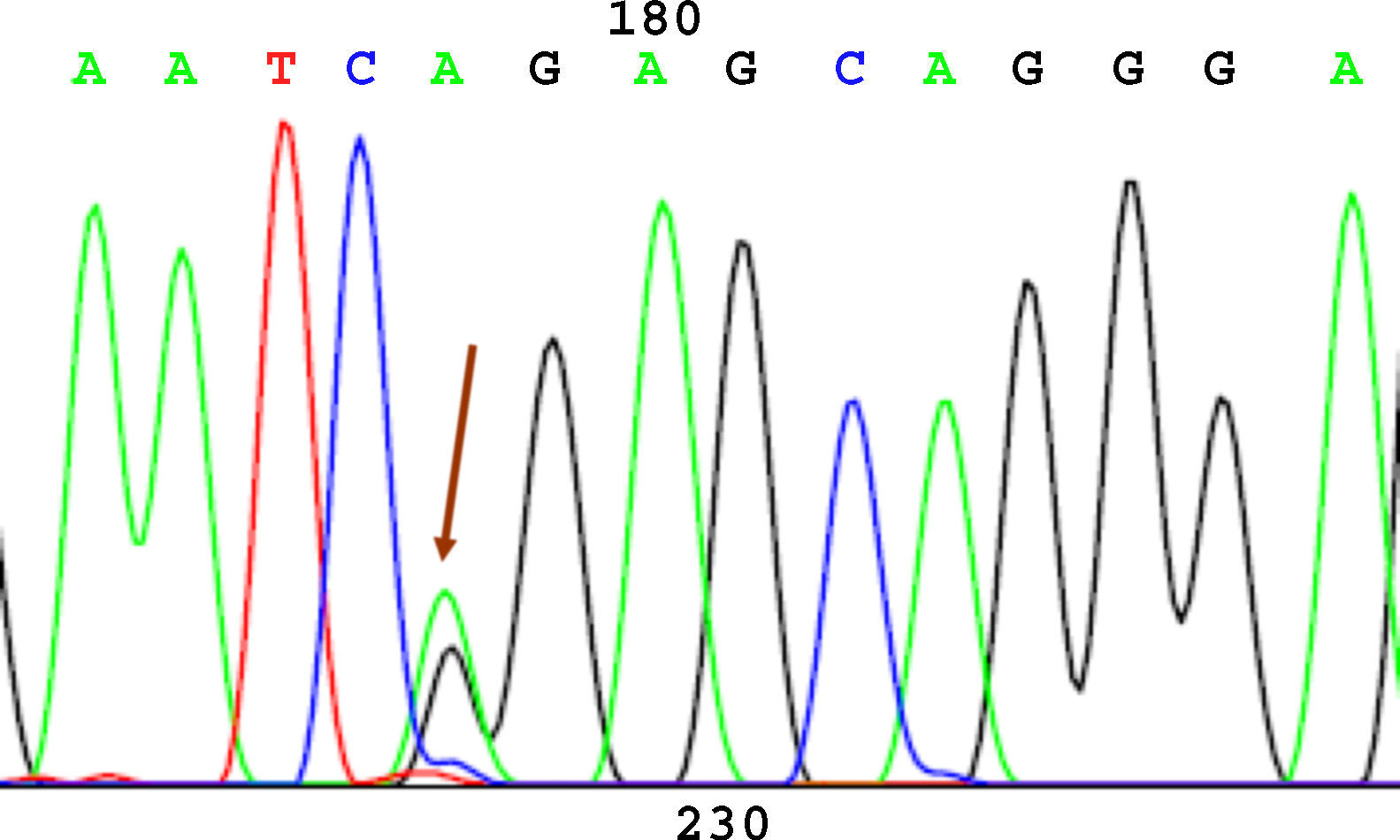
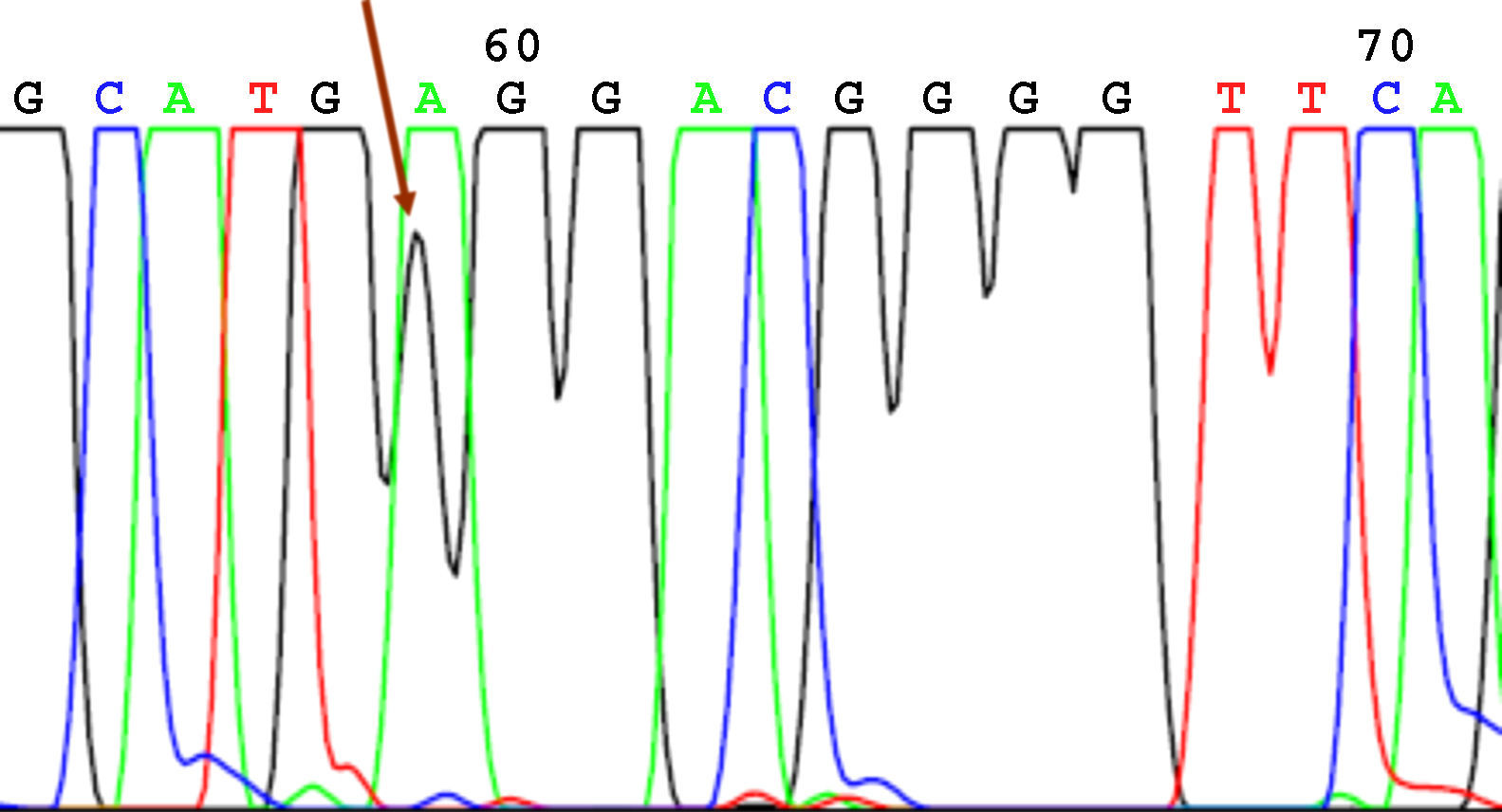
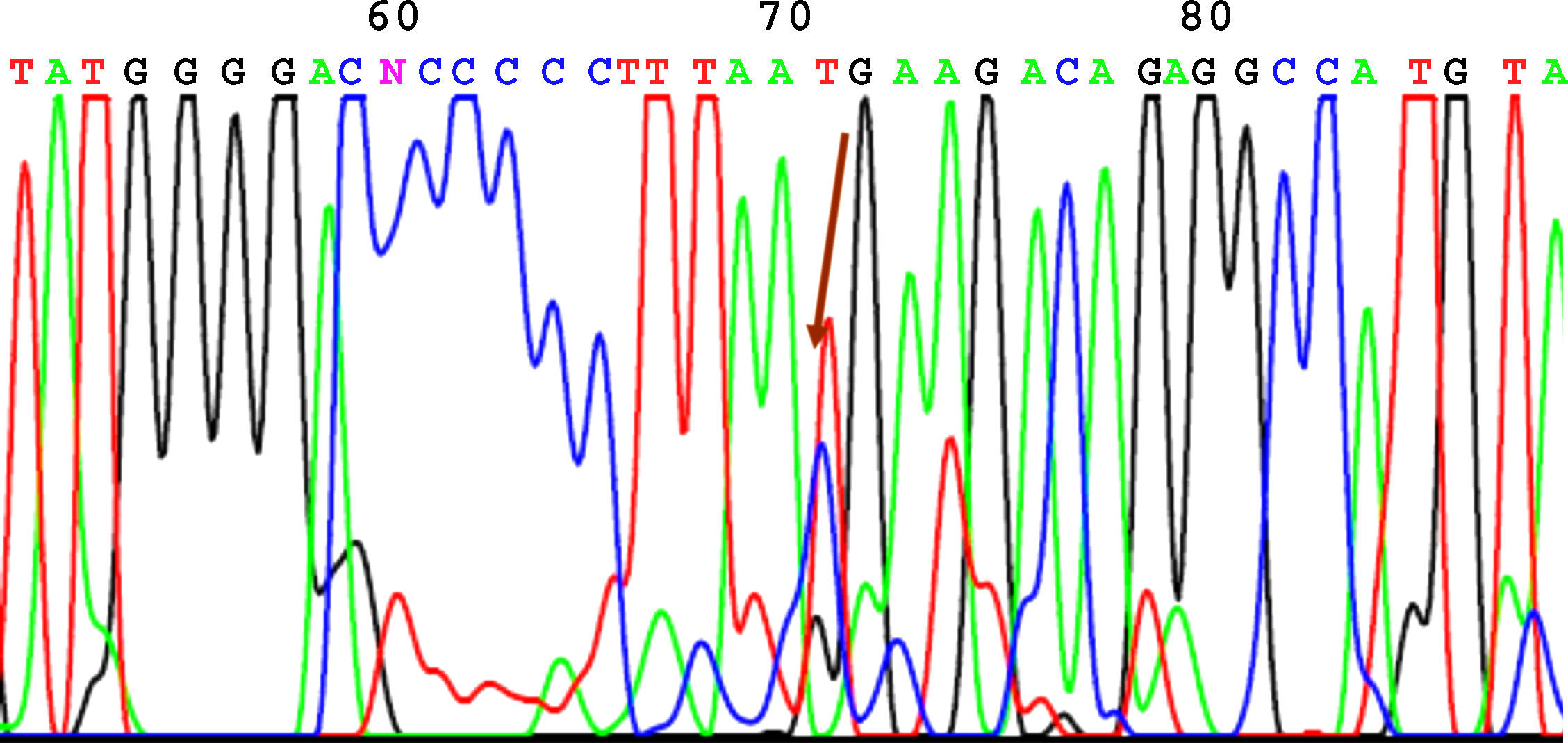
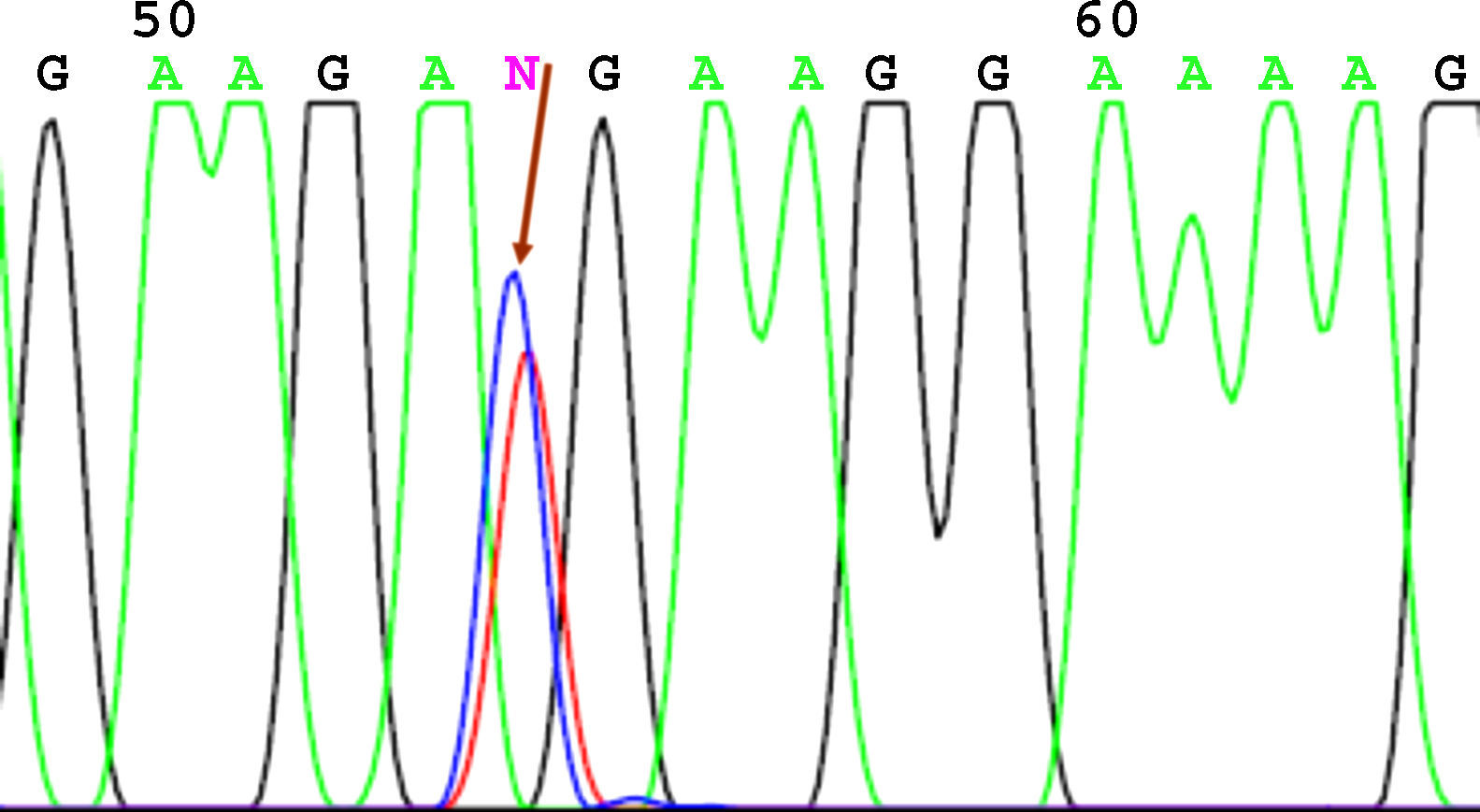
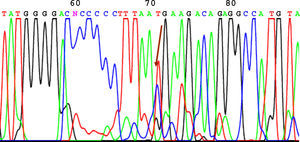
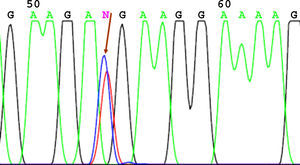
SecuenciaciónAntes de la secuenciación se realizó una PCR previa con el BigDye® Terminator v3.1 (Applied Biosystems) en el que se puso el primer cebador directo. Seguido de esta PCR se purificó el producto nuevamente para eliminar los restos de dNTP (desoxirribonucleótidos trifosfato) marcados con fluorescencia, que es lo que registra el secuenciador (Applied Biosystems). El resultado de la secuencia se analizó mediante el software Chromas V 1.45. En las figuras 1-4 se incluyen 4 ejemplos de secuencias para los polimorfismos en posición -238, -308, -857 y -1031.
Análisis de los resultadosPara analizar los resultados obtenidos empleamos el programa SPSS versión 15.0.1, y aplicamos el test de Chi cuadrado de Pearson para variables cualitativas, para analizar las diferencias en las proporciones genotípicas de cada uno de los 4 polimorfismos que estudiamos en los pacientes con psoriasis moderada-grave con respecto al grupo de voluntarios sanos.
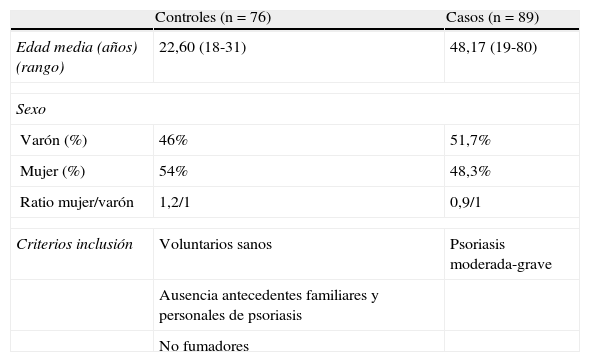
ResultadosHemos analizado el ADN de 89 pacientes y 76 individuos sanos, cuyas características epidemiológicas quedan recogidas en la tabla 1. La secuenciación de los 4 polimorfismos se realizó en 70 de los casos y 69 de los controles.
Características poblacionales de casos y controles
| Controles (n=76) | Casos (n=89) | |
| Edad media (años) (rango) | 22,60 (18-31) | 48,17 (19-80) |
| Sexo | ||
| Varón (%) | 46% | 51,7% |
| Mujer (%) | 54% | 48,3% |
| Ratio mujer/varón | 1,2/1 | 0,9/1 |
| Criterios inclusión | Voluntarios sanos | Psoriasis moderada-grave |
| Ausencia antecedentes familiares y personales de psoriasis | ||
| No fumadores | ||
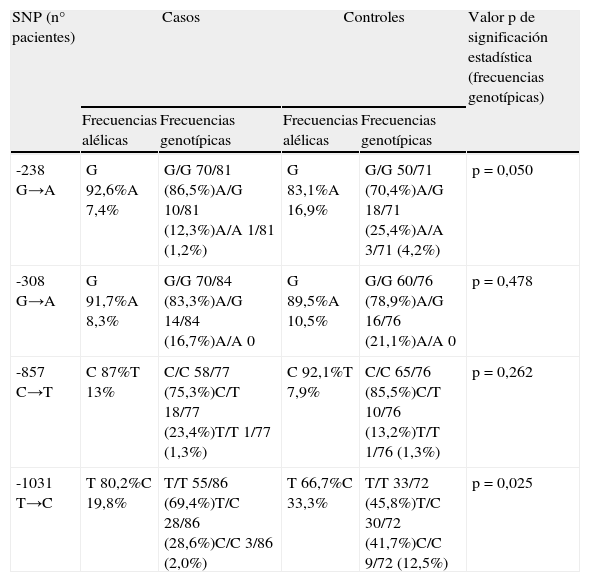
La distribución de las frecuencias alélicas y genotípicas encontradas hasta el momento se recogen en la tabla 2. La secuenciación del polimorfismo -238 mostró una mayor frecuencia del alelo silvestre G, así como una mayor frecuencia de genotipo con ambos alelos silvestres (GG), en pacientes con psoriasis que en el grupo de voluntarios sanos (86,5 y 70,4% respectivamente), resultando estas diferencias estadísticamente significativas (p=0,050).
Frecuencias alélicas y genotípicas obtenidas en nuestro estudio, comparando las observadas en casos y controles
| SNP (n° pacientes) | Casos | Controles | Valor p de significación estadística (frecuencias genotípicas) | ||
| Frecuencias alélicas | Frecuencias genotípicas | Frecuencias alélicas | Frecuencias genotípicas | ||
| -238 G→A | G 92,6%A 7,4% | G/G 70/81 (86,5%)A/G 10/81 (12,3%)A/A 1/81 (1,2%) | G 83,1%A 16,9% | G/G 50/71 (70,4%)A/G 18/71 (25,4%)A/A 3/71 (4,2%) | p=0,050 |
| -308 G→A | G 91,7%A 8,3% | G/G 70/84 (83,3%)A/G 14/84 (16,7%)A/A 0 | G 89,5%A 10,5% | G/G 60/76 (78,9%)A/G 16/76 (21,1%)A/A 0 | p=0,478 |
| -857 C→T | C 87%T 13% | C/C 58/77 (75,3%)C/T 18/77 (23,4%)T/T 1/77 (1,3%) | C 92,1%T 7,9% | C/C 65/76 (85,5%)C/T 10/76 (13,2%)T/T 1/76 (1,3%) | p=0,262 |
| -1031 T→C | T 80,2%C 19,8% | T/T 55/86 (69,4%)T/C 28/86 (28,6%)C/C 3/86 (2,0%) | T 66,7%C 33,3% | T/T 33/72 (45,8%)T/C 30/72 (41,7%)C/C 9/72 (12,5%) | p=0,025 |
SNP: single nucleotide polymorphisms.
Observamos una mayor frecuencia de -308GG en pacientes que en controles, aunque las diferencias no fueron significativas (83,3% vs 78,9%, p=0,478). En posición -857 la presencia de un genotipo con ambos alelos silvestres (CC) presentaba una frecuencia mayor en los controles (85,5%) que en los pacientes (75,3%), aunque estas diferencias tampoco resultaron significativas (p=0,262).
En el estudio de la secuenciación del polimorfismo -1031 encontramos una mayor frecuencia del alelo silvestre T en pacientes con psoriasis (80,2% vs 66,7%); el 69,4% de los pacientes presentaba un genotipo con ambos alelos silvestres (TT), mientras que éste solo estaba presente en un 45,8% de los controles, siendo también las diferencias significativas desde el punto de vista estadístico (p=0,025).
DiscusiónEl TNF-α es una citoquina proinflamatoria implicada en la fisiopatología de la psoriasis, así como de otras enfermedades inflamatorias como la artritis reumatoide y la enfermedad de Crohn. Se han descrito varios polimorfismos asociados a la psoriasis.
Hemos encontrado una asociación entre algunos polimorfismos del TNF-α y la susceptibilidad a padecer psoriasis. También hemos hallado diferencias en las secuencias genéticas de los polimorfismos del promotor del TNFα -238 y TNFα -1031 al comparar una población con psoriasis moderada-grave con una población de voluntarios sanos. Esto nos lleva a pensar que estas diferencias polimórficas deben desempeñar un papel importante en la fisiopatología de la psoriasis.
La presencia de una mayor frecuencia de -238GG y -308GG en los pacientes con psoriasis que en controles se podría explicar por el hecho de que en estos sujetos exista una mayor producción de TNF-α, tal y como han demostrado estudios de ARN mensajero realizados en otras patologías en las que existe un incremento de los niveles de TNF-α32. En cuanto a la mayor proporción de -1031TT en pacientes con psoriasis, podría tener el mismo significado, aunque los estudios sobre la frecuencia de este polimorfismo en pacientes con psoriasis son muy escasos y no encuentran diferencias; además no existen datos de relevancia in vitro de este polimorfismo.
Hemos observado que el alelo silvestre TNFα-238G es más frecuente en pacientes con psoriasis (92,6%) que en el grupo control (83,1%), así como el genotipo GG (86,5% vs 70,4%). La mayoría de los trabajos publicados por otros autores encuentran una mayor proporción de alelo mutante TNFα-238A entre pacientes con psoriasis, así como un riesgo de psoriasis aumentado en asociación con genotipos con alguno de los alelos mutantes (GA/AA)4–6,9,33. Sin embargo, un estudio recientemente publicado concluye que es más frecuente el genotipo -238GG entre aquellos individuos con formas de psoriasis más graves34, como sería nuestro caso. Algunos estudios han encontrado estas diferencias solo en pacientes con psoriasis de inicio precoz5,6, o únicamente en pacientes varones6. Estudios realizados en población oriental no han detectado diferencias en la distribución de estos polimorfismos7,35,36.
No hemos encontrado diferencias significativas en la distribución del genotipo TNFα-308, al igual que otros autores4,7,9,10,35,36. Sin embargo, algunos estudios han hallado una mayor frecuencia de genotipo TNFα-308GG en casos de psoriasis moderada-severa37, o una mayor frecuencia de portadores del alelo TNFα-308G en pacientes con psoriasis de inicio precoz5,8,33,38. En un metaanálisis publicado por Li et al. en 2007, incluyendo los estudios realizados sobre los polimorfismos de TNF-α en posición -238 y -308 hasta la fecha, concluían que la presencia del alelo silvestre G parecía ejercer un papel protector en la psoriasis39.
Los polimorfismos del TNF-α en posición -857 tampoco presentaron diferencias de distribución en nuestro trabajo. Estudios similares realizados en otras poblaciones no han encontrado diferencias en psoriasis9, aunque en artritis psoriásica se ha observado una mayor frecuencia de alelo mutante TNFα-857T en pacientes respecto a voluntarios sanos9,40.
Hemos encontrado diferencias en la distribución genotípica de TNFα-1031 entre pacientes y controles, existiendo una mayor frecuencia de genotipo salvaje TT entre pacientes. Hasta donde sabemos, el único grupo que ha estudiado este polimorfismo no ha hallado diferencias significativas9.
Tenemos que tener en cuenta que estas diferencias encontradas en los polimorfismos del gen del TNF-α entre los trabajos publicados se pueden deber a diferencias interpoblacionales e interraciales41.
En la realización de nuestro trabajo queremos señalar algunas limitaciones. Entre ellas se encuentra, en primer lugar, el tamaño muestral limitado tanto en pacientes como en controles. Además existe una diferencia importante de edad y no tan importante de sexo entre casos y controles. No obstante, no creemos que la relevancia de estos hechos sea importante, ya que el genotipo prácticamente permanece estable a lo largo de la vida. Por otro lado, el que únicamente hayamos valorado a aquellos pacientes con psoriasis moderada-grave, o que no hayamos ajustado por presencia o no de artritis psoriásica, ha podido introducir un sesgo a la luz de los artículos publicados. Por último, la procedencia de los pacientes y controles está limitada a la Comunidad de Madrid y Castilla-La Mancha, por lo que sería preciso realizar el mismo estudio con muestras procedentes de otras regiones para determinar si estos resultados son extrapolables a toda la población española.
Para la realización de este trabajo se ha construido una base de material genético que nos ha permitido iniciar el estudio de polimorfismos del TNF-α. Esto es muy importante, ya que hasta el momento no tenemos constancia de que exista en nuestro país una base de datos de polimorfismos del receptor del TNF-α en pacientes psoriásicos y controles, y además es escasa la literatura existente en este campo. El genotipado de estos polimorfismos del TNF-α es el primer paso para estudiar en el futuro nuevos polimorfismos, tanto del TNF-α como de la proteína p40 y otras proteínas implicadas en la fisiopatología y tratamiento de la psoriasis. Además, este análisis genético asociado a la evaluación de la seguridad y efectividad de los fármacos a estudio nos permite estudiar las posibles diferencias genéticas entre los pacientes según la respuesta de cada uno a determinados fármacos. Establecer las diferencias genéticas interindividuales, y así optimizar el tratamiento de las patologías en cada paciente, consiguiendo una terapia más segura para el paciente, es el objetivo primordial de la farmacogenética. Esto permitiría evitar retrasos en la administración de una terapia efectiva y evitar riesgos para el paciente, además de eliminar gastos innecesarios en tratamientos que no son efectivos.
Hay que pensar que no solo la dotación genética influye en el desarrollo de una determinada enfermedad, sino también el modo en que esos genes se expresan41, por lo que es interesante para futuros estudios el análisis de la expresión génica mediante técnicas como los microarrays de ADN, los cuales aportarían no solo un análisis cualitativo, sino también cuantitativo42.
Con este estudio hemos pretendido avanzar un paso más en el campo de la farmacogenética.
ConclusionesEn nuestro estudio queremos destacar que:
- 1.
Hallamos diferencias significativas en el polimorfismo -1031 en pacientes psoriásicos con respecto al grupo control, lo que significa que éste podría desempeñar un papel activo en la fisiopatología de esta enfermedad. Este hallazgo no ha sido descrito previamente en ningún estudio genético de pacientes con psoriasis moderada-grave.
- 2.
También encontramos diferencias relevantes en el polimorfismo -238, por lo que éste también podría participar de la génesis de esta patología. Este hallazgo no ha sido descrito previamente en pacientes con psoriasis moderada-grave de la población española.
- 3.
La determinación de estos polimorfismos tiene una notable aplicación práctica, pues puede permitir en la actualidad o en futuros estudios:
- a.
crear una genoteca de pacientes con psoriasis en placas con muestras obtenidas de sangre;
- b.
profundizar en el conocimiento de los mecanismos patogénicos que subyacen en la psoriasis;
- c.
identificar otras posibles dianas terapeúticas;
- d.
correlacionar estos resultados con la respuesta al tratamiento y la toxicidad, con lo que conseguimos:
- -
aumentar el conocimiento sobre el mecanismo de acción a nivel molecular de los fármacos a estudio y
- -
determinar a priori el fármaco de elección (medicina individualizada).
- -
- a.
Este estudio ha recibido ayuda para su financiación por parte de la Fundación Salud 2000 y ha sido parcialmente financiado por el proyecto FIS PI10-01740. Este trabajo recibió el Premio Juan de Azúa 2010 de la Academia Española de Dermatología y Venereología.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.