INTRODUCCIÓN
La microscopía confocal es una técnica de exploración no invasiva de reciente aplicación en diversos campos de la medicina1, 2. Dada la fácil accesibilidad de la piel y el carácter incruento de la técnica, no cabe duda que abre un amplio abanico de posibilidades de aplicación en Dermatología para el estudio microscópicoin vivo y en tiempo real de las alteraciones morfológicas y morfométricas de la piel normal y de diversos procesos patológicos con una resolución comparable a la obtenida con la microscopía convencional3, 4.
En el campo de la fotobiología es bien conocido que la exposición de la piel a dosis eritemogénicas de rayos ultravioleta A (UVA) y B (UVB) produce importantes alteraciones epidérmicas y dérmicas5-7. También, más recientemente, se ha demostrado en modelos animales y en humanos voluntarios sanos, a través del estudio de biopsias secuenciales, que tras la exposición repetitiva de la piel a dosis suberitemogénicas de UVA aparecen una serie de cambios en la epidermis y en la dermis que ayudan a comprender el efecto «crónico» que la exposición cotidiana a los UVA produce en la piel8, 9.
El objetivo de este estudio es examinar in vivo con microscopía confocal en tiempo real, los cambios producidos en el grosor de la epidermis y en sus distintas capas tras la exposición de la piel no expuesta de voluntarios sanos a dosis suberitemogénicas diarias de irradiación UVA.
MATERIAL Y MÉTODOS
Voluntarios
En el estudio participaron 4 voluntarias sanas con edades comprendidas entre los 19 y 26 años, tres de ellas con fototipo 2 y una con 3, sin antecedentes de enfermedades cutáneas y que no estaban tomando fármacos que afectaran la respuesta cutánea a la exposición a radiación ultravioleta. Todas firmaron el consentimiento informado aprobado por el Comité de Ética del Massachussets General Hospital, en el que se detallaba la naturaleza, metodología y finalidad de la investigación.
La piel de todas las voluntarias fue cuidadosamente explorada, con especial énfasis en la cara interna del antebrazo, para confirmar la ausencia de alguna lesión que pudiera interferir en la investigación.
Asimismo se solicitó a las participantes la no administración de productos tópicos en el área en estudio. La irradiación se realizó sobre la superficie de flexión del antebrazo, zona no expuesta a la radiación solar en ninguna de las voluntarias.
Fuente de luz ultravioleta
Se utilizó una lámpara de arco de xenón de 150 W equipado con un filtro WG-320 de 1 mm y UG-5 de 1 mm (Schott Glass Technologies Duryea, Pa) que producía una irradiación ultravioleta similar a la del sol. El espectro UVA (320-400 nm) se obtuvo mediante la filtración de esta radiación por un filtro Schott WG-345 de 1 mm (Schoot Glass Technologies). La dosimetría se realizó con un espectrorradiómetro (modelo 752 Optronics Co., Orlando, Florida). La iluminación estaba enfocada a través de una fibra óptica en cuidadoso contacto con el área cutánea expuesta (diámetro = 8 mm).
Determinación de la dosis mínima eritemogénica
Se irradiaron en cada voluntaria 6 áreas de 8 mm de diámetro localizadas en la cara interna del antebrazo. En la primera se utilizó una dosis de 20 J/cm2, que se fue incrementando un 30% en cada una de las otras áreas. A las 24 horas de la irradiación se procedió a su lectura. Se definió la dosis mínima eritemogénica (DME) como aquella que indujo en el área irradiada una mácula con un eritema perceptible, mínimo y uniforme 24 h después de la irradiación. Las DME así obtenidas de cada voluntaria fueron 39, 55, 55 y 75 J/cm2, respectivamente.
Protocolo de irradiación
Todas las voluntarias fueron irradiadas sobre un área de 1 cm2 localizada en la cara interna del antebrazo durante 5 días consecutivos por semana (de lunes a viernes), hasta alcanzar un total de 15 dosis acumuladas. La dosis de UVA empleada fue la mitad de la DME que para cada uno de los sujetos fue de 19, 27, 27 y 38 J/cm2, respectivamente.
Microscopio confocal
Se utilizó el microscopio confocal de reflectancia (Vivascope 1000®, Lucid, Inc), que utiliza como fuente de luz un láser diodo de 830 nm, cuyo poder de iluminación en piel es > 20 mW (aprobado por la Food and Drug Administration [FDA]). Se usó un objetivo de inmersión en agua de 30 x y apertura numérica 0-85. Previamente se ha publicado información detallada del mismo3.
La resolución lateral es de 0,5-1 µm y la resolución axial (grosor del corte óptico) de 3-5 µm, con profundidad máxima de imagen de 200-250 µm. Cada imagen tiene un campo de visión de 1/4 mm de lado y un índice de grabación de imágenes de 10 imágenes por segundo.
Evaluación con el microscopio confocal
Se realizó una vez por semana en el momento previo a la irradiación de la quinta dosis semanal con objeto de evitar posibles alteraciones secundarias a la presión y el calor de la lámpara de irradiación que podrían producirse si el examen de la piel se realizase inmediatamente después de la irradiación. Dicho procedimiento se realizó, pues, tras la cuarta, novena y decimocuarta dosis. Durante la visualización cutánea con el microscopio se midió el grosor del estrato córneo, de la epidermis suprapapilar desde la capa más superficial del estrato córneo hasta la unión dermoepidérmica y de los procesos interpapilares. A este respecto, en cada paciente se realizaron 6 medidas en distintos puntos de la misma área irradiada, calculando después la media de todas ellas y la desviación estándar a partir de la media. De forma paralela se midieron los mismos parámetros en la zona simétrica del otro brazo, no irradiado, para tener medidas de control. Una vez realizada la visualización con sus correspondientes mediciones irradiamos a la voluntaria con la dosis suberitemogénica correspondiente.
Análisis estadístico
Se realizó con un análisis de la varianza (SAS Proc Mixed, SAS Institute, Inc., Cary, NC). Los resultados se consideraron estadísticamente significativos con valores de p ¾ 0,05.
RESULTADOS
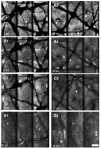
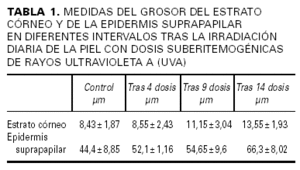
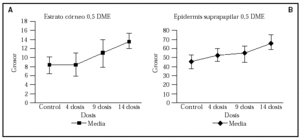
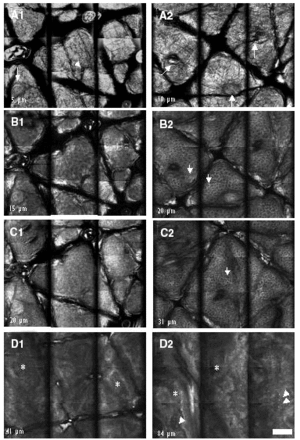
En la tabla 1 se recogen las mediciones del grosor de la capa córnea (fig. 1A) y de la epidermis suprapapilar (fig. 1B) tras la cuarta, novena y decimocuarta irradiaciones con dosis suberitemogénicas de UVA. En ella puede apreciarse cómo la epidermis de todas las voluntarias mostró un aumento progresivo tanto del grosor de la capa córnea como de la epidermis suprapapilar a partir de la segunda visualización (9 dosis) en caso del estrato córneo y de la primera (4 dosis) en caso de la epidermis suprapapilar. Este incremento fue estadísticamente significativo ya desde la tercera evaluación (tras 14 dosis) (fig. 1). Por el contrario, el grosor de los procesos interpapilares no mostró cambios significativos. Otro hallazgo, accidental, fue un aumento progresivo de los depósitos de melanina en la epidermis, siendo particularmente evidente en el estrato córneo (fig. 2 [A2]) tras 4 dosis de exposición. Asimismo se observa un aumento de la refractibilidad en el estrato basal. Otros hallazgos fueron paraqueratosis, espongiosis (fig. 2 [B2], [C2]) e infiltrado inflamatorio perivascular (fig. 2 [D2]), probablemente de naturaleza mastocitaria o histiocítica.
Fig. 1.--Representación esque mática del aumento progresivo del grosor (µm) de la capa córnea (A) y de la epidermis suprapapilar (B) tras la irra diación de la piel con dosis suberitemogénicas de rayos ultravioleta A (UVA).
Fig. 2.--Imágenes ópticas obtenidas mediante microscopia confocal en piel no irradiada (A1, B1, C1, D1) y piel irradiada (A2, B2, C2, D2) de forma repetida (14 exposiciones) a dosis equivalentes a la mitad de la dosis mínima eritemogénica (DME). Cada una de las imágenes corresponde a un mosaico compuesto de 9 cortes de 250 µm de anchura, siendo el campo de visión total de cada mosaico de 1 mm. Las imágenes A1 y A2 corresponden a cortes del estrato córneo; véase la microtopografía del mismo con plegaduras y desembocaduras de glándulas sudoríparas ecrinas (flechas). Las imágenes B1 y B2 corresponden a cortes obtenidos del estrato granuloso; obsérvese que los queratinocitos de este estrato son de mayor tamaño y tienen menor contraste en la piel no irradiada que en la irradiada. Aquí el contraste parece ser consecuencia principalmente del edema intercelular. Éste se pone también de manifiesto en el estrato espinoso (cortes C1 y C2). Las flechas apuntan queratinocitos en ambos estratos. D1 y D2 corresponden a cortes obtenidos de la unión dermoepidérmica que muestran un engrosamiento de la epidermis (de 41 µm a 84 µm) y presencia de dermis papilar*. En la piel irradiada se aprecia un infiltrado inflamatorio (flechas, D2). (Objetivo de inmersión en agua, 30x, 0,85 NA, escala 100 µm).
DISCUSION
La microscopía confocal es una técnica con la que se puede ver la piel in vivo o en biopsias en fresco (ex vivo) sin fijación, sección, ni tinción alguna. Su carácter no invasivo y la posibilidad de visualizar in vivo y en tiempo real secciones ópticas transversales de la piel (paralelas a la superficie cutánea) con alta resolución y contraste le abre un amplio abanico de posibilidades de aplicación en diversas áreas de la Dermatología3, 10-15.Sus aplicaciones son múltiples ya que permite la visualización in vivo de células, núcleos, capilares, folículos, etc., a la vez que permite el recuento de queratinocitos, del número de papilas y otras estructuras por unidad de superficie y la práctica de análisis morfométricos tales como la medición del grosor de la epidermis y de sus distintas capas hasta una profundidad de 200-300 µm con una resolución comparable a la obtenida mediante histología convencional16. Ha sido utilizada también en el estudio y diagnóstico de enfermedades inflamatorias11, 14, 15, 17, proliferativas18 y tumorales12, 19, así como para visualizar los márgenes microscópicos de los tumores cutáneos de forma previa a la microcirugía, por lo que constituye así un método potencialmente adyuvante a la cirugía micrográfica de Mohs18. Además permite observar los procesos dinámicos de forma no invasiva durante un extenso período de tiempo10, 20.
El presente estudio demuestra el uso potencial de esta técnica en el diagnóstico y la evaluación de las alteraciones epidérmicas inducidas por dosis suberitemogénicas de UVA.
Son numerosas las investigaciones que han descrito las alteraciones epidérmicas y dérmicas secundarias a la exposición de la piel a dosis altas de UVA y UVB. Estos dos tipos de radiaciones son consideradas como los factores más importantes en el fotoenvejecimiento de la piel y también, sobre todo los UVB, en la inducción del cáncer cutáneo21-27. Gilchrest et al5 estudiaron los cambios histológicos inmediatos de la piel tras exponerla a dosis eritemogénicas de UVA y concluyeron que las alteraciones más importantes dentro de las primeras 48 horas postirradiación eran la depleción de células de Langerhans de la epidermis y el reclutamiento de neutrófilos en la dermis, siendo las alteraciones en la dermis más pronunciadas que las producidas por los UVB. Por el contrario, las alteraciones epidérmicas son mucho más manifiestas tras la irradiación de la piel con dosis eritemogénicas de UVB28, 29.
Sin embargo, poco se sabe del efecto que dosis pequeñas y repetitivas de UVA, mucho menores a las empleadas en estudios experimentales23, 25, 30-33, tienen sobre el fotoenvejecimiento. Ello sería de gran interés porque probablemente esta situación reproduce mucho más fielmente lo que ocurre a lo largo de la vida en un núcleo importante de población, representada por aquellas personas cuya actividad profesional se realiza bajo techo y que reciben pequeñas dosis de UVA ya sea a través de las ventanas o durante cortos períodos de actividad al aire libre (por ejemplo, paseos cortos o conduciendo un coche, etc.), a los que habría que añadir aquellos que trabajan al aire libre y utilizan filtros solares que protegen contra los UVB, pero no, o sólo parcialmente, contra los UVA. Evidentemente, la cantidad de UVA que recibe la piel de estos pacientes es muy inferior a las dosis empleadas en estudios con animales de experimentación. En nuestro estudio hemos tratado de reproducir esta situación exponiendo a las voluntarias a pequeñas dosis diarias de UVA.
En cuanto a las alteraciones epidérmicas encontradas, nuestros resultados han sido similares a los obtenidos en estudios semejantes, pero con microscopía convencional, realizados previamente8, 9. En este sentido, Lowe et al8, tras un estudio morfométrico practicado sobre biopsias secuenciales realizadas a voluntarios irradiados repetitivamente con la DME de UVA y con UV de un simulador solar, encontraron un aumento en el grosor de la capa córnea y espinosa que se ponía de manifiesto a las pocas semanas, así como una disminución de la cantidad de tejido elástico de la dermis. Las alteraciones epidérmicas producidas por los UVA persistían más tiempo que las producidas por la radiación UV del simulador solar, siendo las producidas por dosis suberitemogénicas de UVA las más precoces. Las alteraciones en el tejido elástico fueron diferentes, pues mientras la irradiación con el simulador solar producía un ligero aumento del tejido elástico, la radiación UVA produjo una marcada disminución que fue más persistente con la DME que con la dosis suberitemogénica. De esta forma se demuestra que dosis pequeñas y acumulativas de UVA contribuyen de forma importante al fotoenvejecimiento cutáneo como ya había sido sugerido previamente8.
También Lavker et al9, en una investigación de las mismas características en la que comparan las alteraciones epidérmicas producidas en la piel por los UVA y la irradiación UV de un simulador solar tras irradiarla con un protocolo semejante al utilizado por nosotros, encuentran un aumento del grosor de la capa córnea y una hiperplasia epidérmica que fueron más marcados en las áreas irradiadas con la mitad de la DME de UVA que en la zona irradiada con la mitad de la DME con el simulador solar. El método utilizado para comparar las alteraciones fue a través de la práctica de biopsias y su posterior estudio inmunohistoquímico con análisis de imágenes asistidas por ordenador. En estos estudios la necesidad de practicar biopsias de forma secuencial para estudiar las alteraciones de la piel es un factor limitante que impide o dificulta la comprensión de un proceso dinámico como es el fotoenvejecimiento.
Nuestros resultados son equiparables a las investigaciones previas, pero demostramos, al poder estudiarlas in vivo y en tiempo real, que se presentan más precozmente de lo señalado con anterioridad. El carácter no invasivo de la microscopía confocal nos ha permitido ir valorando día a día y en tiempo real las alteraciones secundarias a la irradiación de la piel con dosis suberitemogénicas de UVA y nos ha permitido asegurar que éstas aparecen incluso a los 4 días de irradiación y que van aumentando progresivamente en los días posteriores, siendo ya realmente significativas a partir de la novena dosis de irradiación. Este período, mucho más corto que el encontrado por Lowe et al8, puede deberse sin duda a que en el citado estudio8 las primeras biopsias no fueron tomadas hasta 12 semanas después de iniciar la irradiación. El uso de la microscopía confocal en nuestro estudio nos permitió realizar valoraciones continuas al no requerir la práctica de biopsias.
La presente investigación confirma que la irradiación repetida de la piel con dosis suberitemogénicas de UVA produce una serie de modificaciones epidérmicas consistentes en un aumento del grosor de la capa córnea y de la epidermis suprapapilar, que pueden ser consideradas como alteraciones precoces del fotoenvejecimiento cutáneo. Estas alteraciones probablemente representan una respuesta protectora de la piel contra la radiación UV. Por otra parte, su desencadenamiento tras dosis bajas y repetitivas de UVA resalta la necesidad de utilizar protectores solares de amplio espectro incluso para aquellos individuos que no trabajan al aire libre y que se exponen al sol durante cortos períodos de tiempo.