La telomerasa es una enzima implicada en el mantenimiento de los telómeros y la senescencia celular. Numerosos estudios han demostrado que en más del 90% de las neoplasias malignas se detecta actividad telomerásica. El objetivo del presente estudio es analizar la expresión de telomerasa por inmunohistoquímica en una serie de neoplasias melanocíticas.
Material y métodosEstudio observacional retrospectivo realizado en una serie de 85 melanomas primarios, 12 metastásicos y 22 nevus melanocíticos. La expresión de telomerasa se analizó empleando el anticuerpo monoclonal hTERT (Rockland). El análisis de los datos se realizó con el programa SPSS.
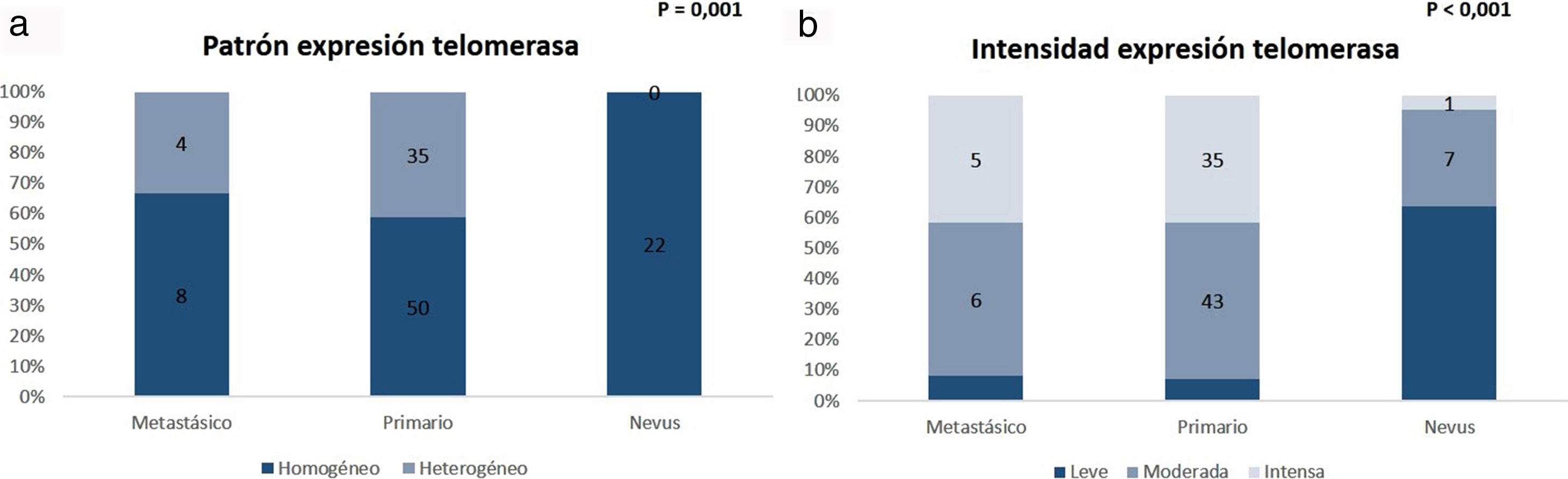
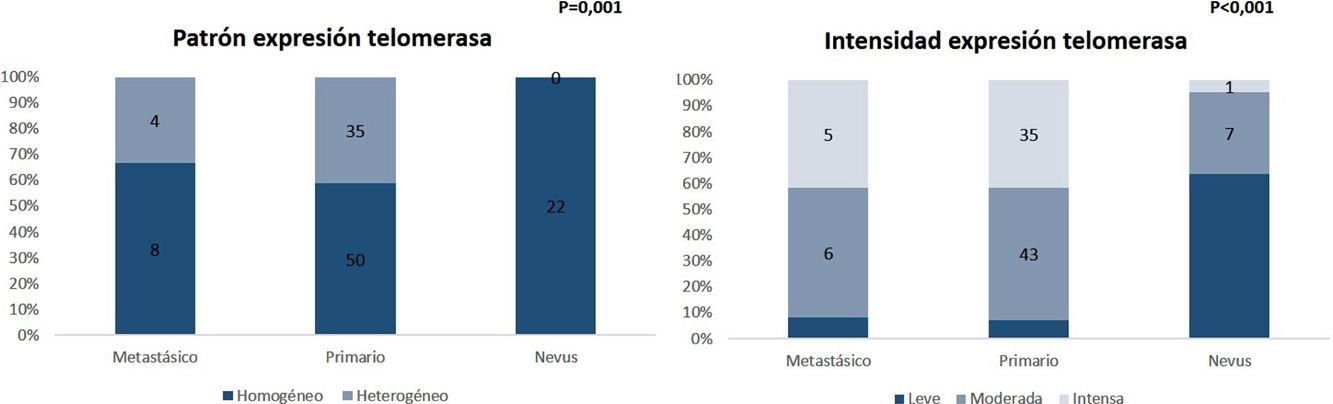
ResultadosEn todas las neoplasias melanocíticas analizadas se demostró expresión de telomerasa. En el caso de los melanomas predominó el patrón de expresión heterogéneo, y la expresión moderada o intensa. En los nevus resultó más frecuente una expresión homogénea con intensidad leve. El patrón de expresión heterogéneo se asoció a los melanomas de rápido crecimiento (p=0,028), con Breslow > 4mm (p=0,004), con mitosis (p=0,032), y con mutaciones en el gen TERT (p=0,002). En el caso de los nevus, la intensidad fue menor en los nevus intradérmicos, seguidos de los compuestos y de los diplásicos (p=0,054).
ConclusionesLa expresión de telomerasa está presente en la totalidad de las neoplasias melanocíticas, con mayor expresión en los melanomas que en los nevus. En el caso de los melanomas, la expresión de forma heterogénea se asocia a un fenotipo de mayor agresividad.
Telomerase is an enzyme involved in maintaining the length of telomeres and cell senescence. Numerous studies have shown that in more than 90% of malignant tumors telomerase activity is detected.
Material and methodsRetrospective observational study in a series of 85 cases of primary melanomas, 12 metastatic melanomas, and 22 melanocytic nevi. We used the monoclonal antibody hTERT (human telomerase reverse transcriptase, Rockland) to assess telomerase activity. The SPSS software package was used to analyze data.
ResultsTelomerase expression was present in all the melanocytic neoplasms analyzed. Expression was heterogenous and moderate or high in the melanomas. In contrast, expression was homogeneous and lower in the nevi. Heterogeneous expression was associated with rapid melanoma growth (P=.028), a Breslow thickness of more than 4 mm (P=.004), mitosis (P=.032), and mutations in the TERT gene (P=.002). Activity was less intense in intradermal nevi, and more intense in compound and dysplastic nevi (P=.054).
ConclusionsTelomerase expression is found in all melanocytic neoplasms but is higher in melanomas than in nevi. A heterogeneous pattern of expression in melanomas is associated with more aggressive tumors.
La telomerasa es una enzima formada por una subunidad catalítica (telomerasa transcriptasa inversa o TERT) y un ácido ribonucleico (TERC)1. Es bien conocido que juega un papel importante en el mantenimiento de los telómeros y la senescencia celular. En condiciones normales, su expresión está presente únicamente en las células de la línea germinal, tejidos fetales y células madre. Por el contrario, las células somáticas del resto de los tejidos carecen de actividad telomerásica, lo que conlleva a un acortamiento progresivo de sus telómeros tras repetidas divisiones celulares. Numerosos estudios han demostrado que la actividad telomerásica se detecta en más del 90% de las neoplasias malignas2, incluyendo diversos tipos de cáncer cutáneo3. Concretamente en las neoplasias melanocíticas, varios estudios han identificado un incremento de la actividad telomerásica en las células neoplásicas desde nevus a melanoma, con la máxima actividad telomerásica detectada en melanomas metastásicos4. De forma adicional, recientemente se ha demostrado la implicación de las mutaciones en el promotor del gen TERT en la patogenia del melanoma5,6. Diversos estudios han identificado mutaciones recurrentes en la región promotora del gen TERT (c.1-146C>T, c.1-124C>T, c.1-124/-125CC>TT, c.1-138/-139 CC>TT) en un 22-71% de melanomas esporádicos asociadas a individuos de mayor edad, con melanomas en áreas fotoexpuestas, del subtipo histológico nodular, mayor índice de Breslow, presencia de ulceración y alto índice mitótico7–9. Estudios en tejido y líneas celulares han corroborado que estas mutaciones conllevan una mayor expresión de telomerasa al crearse nuevos sitios de unión para factores de transcripción de la familia ETS9–12. Se ha demostrado que la presencia de dichas mutaciones es un factor pronóstico independiente que se asocia a menor supervivencia libre de enfermedad y supervivencia global8,13. Adicionalmente, se ha descrito que dicha asociación con la supervivencia varía en función del tipo de mutación identificada, y es modificada por la presencia del polimorfismo rs285366914,15. Asimismo, estudios recientes han demostrado el valor pronóstico de la longitud de los telómeros, al haber identificado menores tasas de supervivencia en pacientes con menor longitud16,17.
Por tanto, parece que la expresión de telomerasa juega un papel importante en la carcinogénesis de los melanomas, sin embargo son escasos los estudios que analizan su expresión a nivel de proteína, y los que están disponibles incluyen series cortas con un escaso número de melanomas. De forma adicional, el estudio de la expresión de telomerasa podría ser de utilidad para la estratificación de los pacientes en función de su pronóstico. El objetivo del presente estudio es analizar la expresión de telomerasa por inmunohistoquimia en una serie de melanomas (primarios y metastásicos) y nevus melanocíticos, y correlacionar los niveles de expresión con las características clínico-patológicas y evolutivas de los pacientes, así como con las mutaciones en el promotor del gen TERT.
Material y métodosPacientes y muestras seleccionadasEstudio observacional retrospectivo realizado en el Servicio de Dermatología y Anatomía Patológica del Hospital Universitario y Politécnico La Fe en una muestra de 85 pacientes diagnosticados de melanoma y 22 pacientes con nevus melanocíticos (cinco nevus intradérmicos, siete compuestos y diez displásicos) atendidos durante el periodo comprendido entre 1 enero del 2014 y 1 diciembre de 2016. Se seleccionaron aquellas muestras en las que se disponía de muestra suficiente en el bloque de parafina para realizar la tinción inmunohistoquímica. En el caso de los melanomas primarios, se incluyeron únicamente aquellos con componente invasivo, clasificados en los cuatro subtipos histológicos principales (lentigo melanoma maligno, melanoma de extensión superficial, melanoma nodular y melanoma lentiginoso acral), y en los que se disponía del estudio del promotor del gen TERT. En los 85 pacientes con melanoma se estudió el tumor primario y adicionalmente, en 12 de ellos se estudió también una metástasis de melanoma. De cada uno de los pacientes con melanoma se recogieron las características clínico-patológicas (tabla 1). El índice de Breslow se categorizó de acuerdo con la última clasificación de la AJCC (≤1,00, 1,01-2, 2,01-4 y > 4mm)18; el índice mitótico se expresó como el número de mitosis por milímetro cuadrado y se categorizó según la presencia o ausencia de mitosis; la regresión histológica se definió según lo descrito previamente19, y se categorizó en ausente o presente; y la velocidad de crecimiento se definió acorde a lo descrito previamente20. Todos los pacientes manifestaron por escrito su consentimiento para participar en el estudio.
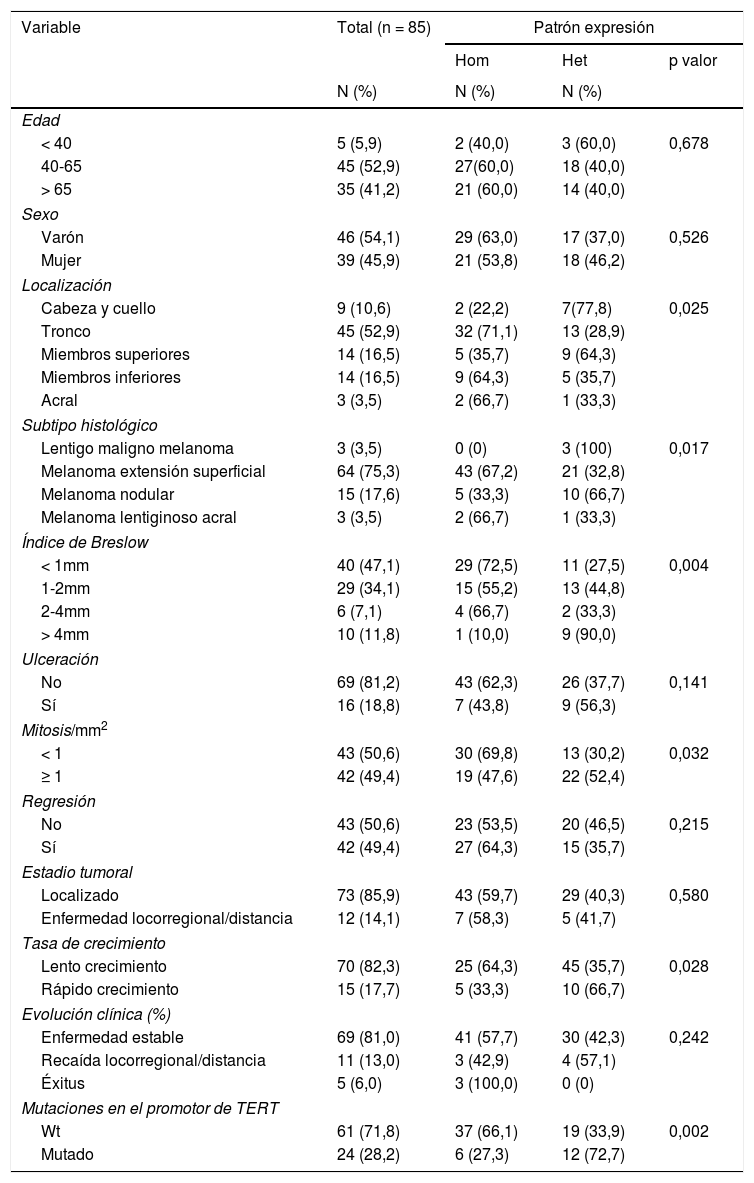
Características clínico-patológicas de los pacientes con melanoma y distribución de las características en función del patrón de expresión de telomerasa
| Variable | Total (n = 85) | Patrón expresión | ||
|---|---|---|---|---|
| Hom | Het | p valor | ||
| N (%) | N (%) | N (%) | ||
| Edad | ||||
| < 40 | 5 (5,9) | 2 (40,0) | 3 (60,0) | 0,678 |
| 40-65 | 45 (52,9) | 27(60,0) | 18 (40,0) | |
| > 65 | 35 (41,2) | 21 (60,0) | 14 (40,0) | |
| Sexo | ||||
| Varón | 46 (54,1) | 29 (63,0) | 17 (37,0) | 0,526 |
| Mujer | 39 (45,9) | 21 (53,8) | 18 (46,2) | |
| Localización | ||||
| Cabeza y cuello | 9 (10,6) | 2 (22,2) | 7(77,8) | 0,025 |
| Tronco | 45 (52,9) | 32 (71,1) | 13 (28,9) | |
| Miembros superiores | 14 (16,5) | 5 (35,7) | 9 (64,3) | |
| Miembros inferiores | 14 (16,5) | 9 (64,3) | 5 (35,7) | |
| Acral | 3 (3,5) | 2 (66,7) | 1 (33,3) | |
| Subtipo histológico | ||||
| Lentigo maligno melanoma | 3 (3,5) | 0 (0) | 3 (100) | 0,017 |
| Melanoma extensión superficial | 64 (75,3) | 43 (67,2) | 21 (32,8) | |
| Melanoma nodular | 15 (17,6) | 5 (33,3) | 10 (66,7) | |
| Melanoma lentiginoso acral | 3 (3,5) | 2 (66,7) | 1 (33,3) | |
| Índice de Breslow | ||||
| < 1mm | 40 (47,1) | 29 (72,5) | 11 (27,5) | 0,004 |
| 1-2mm | 29 (34,1) | 15 (55,2) | 13 (44,8) | |
| 2-4mm | 6 (7,1) | 4 (66,7) | 2 (33,3) | |
| > 4mm | 10 (11,8) | 1 (10,0) | 9 (90,0) | |
| Ulceración | ||||
| No | 69 (81,2) | 43 (62,3) | 26 (37,7) | 0,141 |
| Sí | 16 (18,8) | 7 (43,8) | 9 (56,3) | |
| Mitosis/mm2 | ||||
| < 1 | 43 (50,6) | 30 (69,8) | 13 (30,2) | 0,032 |
| ≥ 1 | 42 (49,4) | 19 (47,6) | 22 (52,4) | |
| Regresión | ||||
| No | 43 (50,6) | 23 (53,5) | 20 (46,5) | 0,215 |
| Sí | 42 (49,4) | 27 (64,3) | 15 (35,7) | |
| Estadio tumoral | ||||
| Localizado | 73 (85,9) | 43 (59,7) | 29 (40,3) | 0,580 |
| Enfermedad locorregional/distancia | 12 (14,1) | 7 (58,3) | 5 (41,7) | |
| Tasa de crecimiento | ||||
| Lento crecimiento | 70 (82,3) | 25 (64,3) | 45 (35,7) | 0,028 |
| Rápido crecimiento | 15 (17,7) | 5 (33,3) | 10 (66,7) | |
| Evolución clínica (%) | ||||
| Enfermedad estable | 69 (81,0) | 41 (57,7) | 30 (42,3) | 0,242 |
| Recaída locorregional/distancia | 11 (13,0) | 3 (42,9) | 4 (57,1) | |
| Éxitus | 5 (6,0) | 3 (100,0) | 0 (0) | |
| Mutaciones en el promotor de TERT | ||||
| Wt | 61 (71,8) | 37 (66,1) | 19 (33,9) | 0,002 |
| Mutado | 24 (28,2) | 6 (27,3) | 12 (72,7) | |
Het: heterógeneo; Hom: homogéneo.
La tinción inmunohistoquímica se realizó en cortes de 5μm utilizando el anticuerpo monoclonal hTERT (Rockland) de acuerdo a lo descrito previamente21. Como control negativo se realizó la misma técnica con omisión del anticuerpo. En el caso de los melanomas en los que se disponía de varios bloques, se seleccionaron aquellos con mayor porcentaje de celularidad tumoral. La valoración de la expresión de telomerasa de todas las muestras incluidas se realizó por dos observadores independientes (BU y RB). En los casos con discrepancias en las observaciones de ambos investigadores, se tomaron para el análisis las observaciones del investigador con mayor experiencia (RB). Se cuantificó la extensión de la expresión mediante el establecimiento de una puntuación basada en el porcentaje de células con positividad, 0: 0%, 1: < 10%, 2: 10-50% y 3: > 50%. La intensidad de la expresión se clasificó del 0-3 (0: ausente; 1: leve; 2: moderada; 3: intensa). El patrón de expresión se clasificó en homogéneo o heterogéneo en función de la uniformidad de la expresión en las células tumorales.
Análisis estadísticoEl análisis descriptivo de las variables se analizó mediante frecuencias absolutas y relativas. El análisis inferencial de las variables cualitativas se realizó mediante pruebas basadas en la ley de χ2. El análisis de SLE y SG se calcularon mediante el método de Kaplan-Meier. El grado de acuerdo entre los observadores independientes se evaluó mediante el coeficiente Kappa (κ). Para el análisis se utilizó el paquete estadístico SPSS tomando como límite de significación P < 0,05.
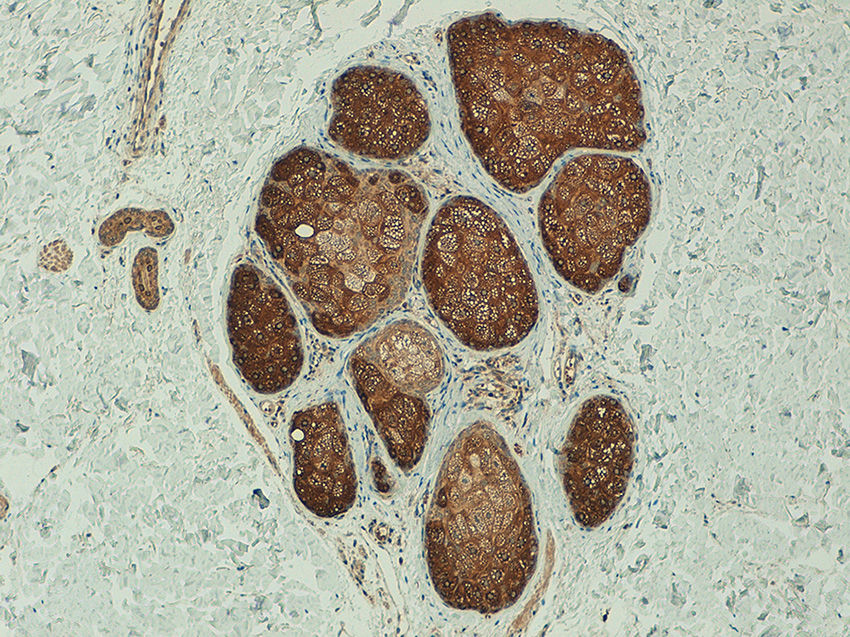
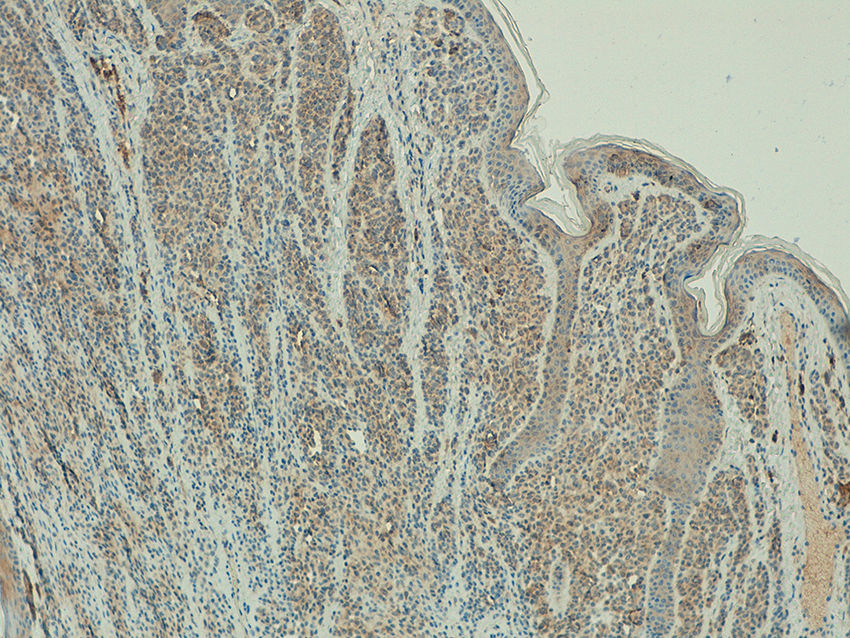
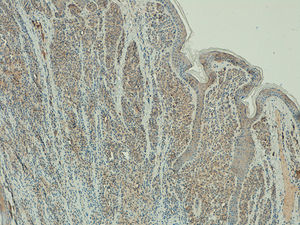
ResultadosExpresión de telomerasa en piel sanaEn la piel sana perilesional a las lesiones melanocíticas se observó expresión de telomerasa a nivel de la epidermis, el folículo piloso, las glándulas sudoríparas y sebáceas así como en el endotelio de los vasos de la dermis. La expresión a nivel de la epidermis y folículos era leve, mientras que era moderada e intensa a nivel de las glándulas sudoríparas y sebáceas, respectivamente (fig. 1) (figs. S1- S3 del material adicional disponible en la versión electrónica). La expresión en estos anejos cutáneos se empleó como control positivo en todos los casos analizados.
Expresión de telomerasa en las neoplasias melanocíticasEl grado de concordancia observado en los tres parámetros analizados por ambos investigadores fue bueno, con un índice κ de 0,65 en la intensidad, 0,83 en la extensión, y 0,73 en el patrón de expresión de telomerasa.
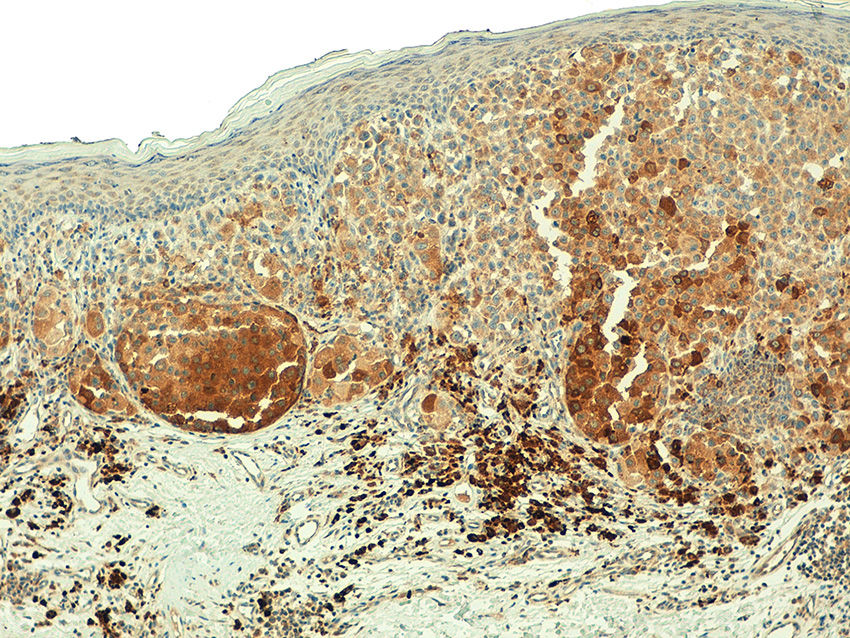
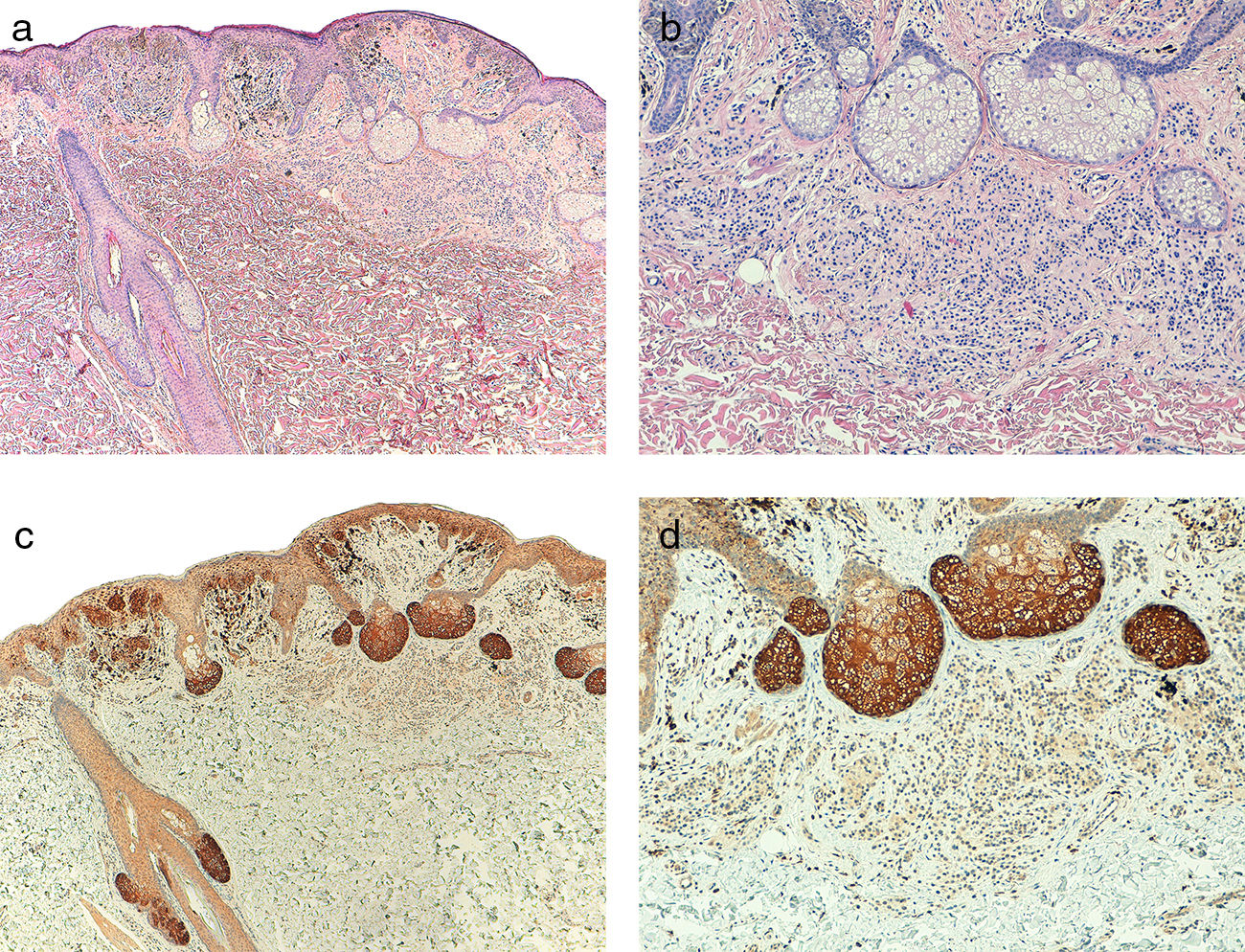
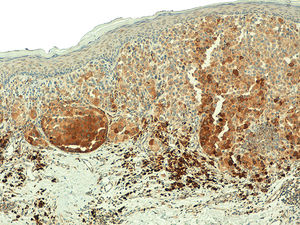
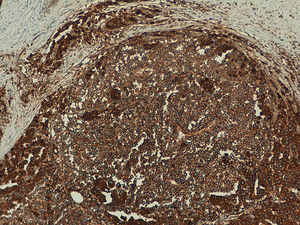
En todas las neoplasias melanocíticas analizadas se demostró expresión de telomerasa. En el caso de los melanomas primarios, en el 59% (50/85) de los casos el patrón de la expresión era homogéneo en toda la celularidad tumoral (fig. S4 del material adicional), mientras que en el 41% (35/85) era heterogéneo, con diferente intensidad en la expresión entre las células tumorales (fig. 2) (fig. S5 del material adicional). En la mayoría de los casos analizados (95%; 81/85) se observó expresión en > 50% de la celularidad tumoral (fig. S6 del material adicional) y solo en un caso se observó expresión en < 10% del infiltrado tumoral (fig. S7 del material adicional). Con respecto a la intensidad, en el 41% (35/85) de las muestras la expresión era intensa (fig. S8 del material adicional), en el 51% (43/85) era moderada (fig. S9 del material adicional), y solo en el 8% (7/85) era leve (fig. S10 del material adicional). En aquellos melanomas en los que existía una lesión névica precursora (5%; 4/85), se observaba expresión intensa de telomerasa en las células tumorales del melanoma, pero con expresión leve en las células névicas acompañantes (fig. 3a-d).
a) Melanoma asociado a nevus intradérmico (H&E; x40). b) Detalle del nevus intradérmico asociado al melanoma (H&E; x100). c) Expresión de telomerasa intensa en las células tumorales del melanoma y leve en las células névicas (x40). d) Detalle de la expresión leve de telomerasa en las células del nevus (x100).
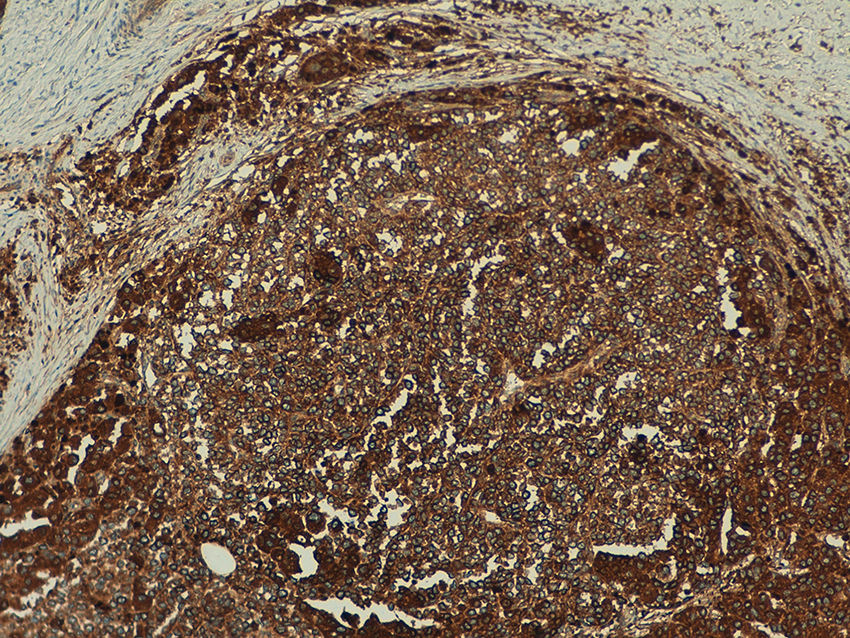
En los melanomas metastásicos, el patrón de la expresión era homogéneo en el 67% (8/12) y heterogéneo en el 33% (4/12). Se observó expresión de hTERT en > 50% de la celularidad tumoral en el 100% de las muestras, siendo intensa en el 42% (5/12), moderada en el 50% (6/12), y leve en el 8,3% (1/12) (fig. 4).
La expresión de telomerasa en los nevus melanocíticos presentaba un patrón homogéneo en el 100% de los nevus melanocíticos, con una extensión en > 50% de la celularidad tumoral en el 91% (20/22). La intensidad de la expresión era leve en el 64% (14/22), moderada en el 32% (7/22) e intensa en el 4% (1/22) (fig. 5).
En cuanto a las diferencias de expresión en función de las características clínico-patológicas de los melanomas primarios, el patrón de expresión heterogéneo se asoció a los melanomas de rápido crecimiento (p=0,028), con índice de Breslow > 4mm (p=0,004), con presencia de mitosis (p=0,032), y con mutaciones en el promotor del gen TERT (p=0,002) (tabla 1). El patrón de expresión no mostró diferencias significativas entre los diferentes tipos de mutación en el promotor del gen TERT (c.1-146C>T, c.1-124C>T, y c.1-124/-125CC>TT). No se observaron diferencias estadísticamente significativas con la intensidad ni con la extensión de la expresión (tabla S1 del material adicional). La intensidad de la expresión resultó mayor en los melanomas del subtipo lentigo melanoma maligno, y menor en los lentiginosos acrales, aunque este dato no alcanzó significación estadística (p=0,523). En el análisis de supervivencia no se observaron diferencias estadísticamente significativas en función de la expresión de telomerasa.
El análisis comparativo de los nevus con melanomas primarios y metastásicos demostró que la expresión de telomerasa en los nevus era menos intensa que en los melanomas primarios y metastásicos (p=0,001) y que a diferencia de los melanomas, era característico un patrón de expresión homogéneo en toda la celularidad tumoral (p < 0,001) (fig. 6). Con respecto a los melanomas, no se identificaron diferencias estadísticamente significativas entre los melanomas primarios y metastásicos. Adicionalmente, en el caso de los nevus cabe destacar que la intensidad era menor en los nevus intradérmicos, seguidos de los compuestos y de los displásicos, aunque este dato no alcanzó significación estadística (p=0,054).
DiscusiónLos resultados del presente estudio demuestran que la expresión de telomerasa está presente en todas las neoplasias melanocíticas analizadas, y que existe una tendencia a incrementarse de forma progresiva desde nevus a melanomas, por lo que podría estar implicada en la progresión tumoral de este tipo de neoplasias.
En los melanomas primarios de nuestra serie hemos demostrado que el patrón de expresión heterogéneo se asocia a melanomas de mayor agresividad (melanomas de rápido crecimiento, con espesor tumoral > 4mm, con mitosis y mutaciones en el promotor de TERT), hecho que no estaba reportado anteriormente. Estos resultados contrastan con los reportados recientemente por Hugdahl et al., que describen una expresión de telomerasa homogénea en la mayor parte de sus casos22. Sin embargo, nuestros hallazgos podrían estar en relación con los reportador por Kohli et al., que describen una expresión de telomerasa no nucleolar de forma heterogénea en los melanomas pero no en lesiones benignas23. Este patrón de expresión heterogéneo podría ser consecuencia de la denominada heterogeneidad intratumoral en el melanoma, que se ha asociado a la presencia de distintas subpoblaciones tumorales, y que se relaciona con la resistencia a los tratamientos sistémicos24,25. Por otro lado, no podemos descartar que la heterogeneidad observada en nuestro estudio se deba a un defecto en la tinción, si bien es poco probable ya que en ninguna de las lesiones melanocíticas benignas observamos este patrón.
A diferencia de otros estudios, en nuestra serie la intensidad y la extensión de la expresión de telomerasa han sido independientes de las características clínico-patológicas. Hugdahl et al., reportaron asociación estadísticamente significativa entre la expresión de telomerasa (44% de los melanomas primarios de su serie) y el espesor tumoral22; y Zygouris et al. describieron asociación con el índice de Breslow y la ulceración26. A su vez nuestros resultados contrastan con varios estudios en los que analizan la actividad telomerásica, como es el de Ramírez et al.27, en el que se demostraba mayor actividad telomerásica en melanomas con mayor espesor tumoral, mayor nivel de Clark y mitosis; los resultados de Miracco et al.28 en los que la actividad telomerásica también se asociaba al índice de Breslow y al nivel de Clark; y a lo publicado por Carvahlo et al.29 donde se demostraba mayor actividad telomerásica en los melanomas ulcerados, con mayor Breslow, mitosis, invasión vascular y satelitosis. En nuestra serie los melanomas del subtipo lentigo melanoma maligno han demostrado mayor intensidad de expresión, aunque este dato no ha alcanzado significación estadística. Este último hallazgo no concuerda con lo descrito en la serie de Pópulo et al.8, en la que la expresión de telomerasa únicamente se asociaba al subtipo histológico de extensión superficial.
Con respecto a las mutaciones en el promotor del gen TERT, acorde a lo descrito por otros autores8,9, en una publicación previa hemos descrito una prevalencia del 33%, y una asociación a melanomas de mayor espesor tumoral, ulcerados, con mitosis, y del subtipo histológico nodular30. Al igual que en otros estudios, en la presente serie no hemos encontrado diferencias en la expresión de telomerasa por inmunohistoquimia entre los melanomas mutados y los no mutados8,22,23. Este hallazgo contrasta con varias publicaciones previas en las que se demostraba mayor expresión de telomerasa en los melanomas portadores de mutaciones en el promotor9–12. Dicha discrepancia podría deberse a que en estos estudios se analiza la expresión de telomerasa a nivel del ARN mensajero y no de la proteína, y por tanto pueden existir otros mecanismos moleculares que regulen su expresión. De hecho, varios estudios se han centrado en la regulación epigenética de la expresión de telomerasa. En este sentido, se ha descrito que la regulación postranscripcional del gen TERT mediante expresión de microRNA, puede reprimir la expresión de telomerasa31,32; y adicionalmente, que la hipermetilación en el ADN del gen TERT puede incrementar la expresión de telomerasa33. A este respecto, podría resultar de utilidad medir la longitud de los telómeros y/o la actividad telomerásica y correlacionarlo con la presencia de la mutación, con el fin de dilucidar si solo los mutados tienen aumento de actividad, o bien los wild-type también tienen mayor actividad telomerásica mediante esos otros mecanismos moleculares.
De forma adicional, hemos identificado niveles variables de expresión de telomerasa en una serie de 22 nevus melanocíticos, con una expresión leve en la gran mayoría de las muestras, y con una tendencia a incrementarse la expresión desde nevus intradérmicos, a nevus displásicos. Asimismo, cabe destacar que en todos los melanomas con lesión névica precursora, la expresión de telomerasa en el nevus acompañante era mucho menos intensa que en las células tumorales de los melanomas. Estos resultados sugieren un posible papel de la telomerasa en la progresión tumoral de las neoplasias melanocíticas. De hecho, varios autores han analizado la actividad telomerásica en diferentes tipos de neoplasias melanocíticas, y han demostrado que la expresión de telomerasa se incrementa de forma progresiva desde nevus comunes a nevus displásicos y melanomas4,34. A pesar de estas diferencias en la expresión de telomerasa entre nevus y melanoma, dado que la expresión puede ser variable en ambos tipos de neoplasias, se ha demostrado que no es de utilidad en el diagnóstico diferencial30.
En el presente estudio la expresión de telomerasa se ha analizado mediante imnunohistoquímica, a diferencia de la mayoría de los estudios publicados previamente en los que se analizaba la actividad telomerásica utilizando el Protocolo de amplificación de las secuencias repetitivas teloméricas (TRAP)4,23–25. El estudio mediante inmunohistoquimia tiene la ventaja de que es un método sencillo, barato, que se realiza en muestras parafinadas, y que permite visualizar la intensidad y la extensión de la expresión no solo en las células de interés, sino también en la piel sana adyacente. De hecho, acorde a lo descrito previamente30, hemos identificado niveles variables de expresión de telomerasa no solo en las células tumorales, sino también en la epidermis, los folículos pilosos, las glándulas, los vasos de la dermis e incluso en el infiltrado inflamatorio acompañante.
En conclusión, los resultados de este estudio ponen de manifiesto que la expresión de telomerasa está presente en la totalidad de las neoplasias melanocíticas analizadas, con mayor expresión en los melanomas que en los nevus. En el caso de los melanomas primarios, la expresión de forma heterogénea se asocia a un fenotipo de mayor agresividad, sin embargo la intensidad de la expresión es independiente de las características clínico-patológicas de los tumores. Asimismo, se demuestra que no existen diferencias en la expresión de telomerasa en función del estado mutacional del gen TERT, por lo que deben existir otros mecanismos moleculares adicionales que regulen la expresión del gen TERT en los melanomas.
FinanciaciónEste trabajo se ha realizado gracias a las ayudas concedidas por la Fundación Piel Sana (Ayuda de la Fundación de la AEDV «EUROMELANOMA 2016»), el ISCIII (PI16/01559), el IISLaFe (2014/0370), y la Consellería de Educación, Investigación, Cultura y Deporte (GV/2016/064).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.