Los inhibidores de las tirosincinasas (ITK) son fármacos de uso creciente en oncología, desplazando en numerosas ocasiones a los fármacos utilizados en los regímenes quimioterápicos clásicos. Estas terapias presentan un perfil de eficacia mejor y una tasa menor de efectos adversos, factores que explican la mayor utilización de estos tratamientos. No obstante, la inhibición de una diana molecular conlleva reacciones adversas fármaco-específicas, no descritas previamente y de etiología desconocida1. El pazopanib es un ITK indicado como primera línea terapéutica en el carcinoma renal de células claras (CCR) avanzado y para los pacientes con CCR avanzado refractarios a tratamiento con citocinas (interleucina-2 o interferón-α). También tiene indicación en adultos con determinados sarcomas de tejidos blandos (STB) metastásicos refractarios a quimioterapia y en STB en progresión de enfermedad tras 12meses de haber recibido quimioterapia adyuvante o neoadyuvante2. Este fármaco ejerce una inhibición potente sobre los receptores del factor de crecimiento endotelial vascular (VEGFR), los receptores del factor de crecimiento derivado de plaquetas y el receptor del factor de células madre (c-KIT)2. Se han descrito diversas reacciones adversas cutáneas tras la administración de pazopanib, entre las que destacan los cambios en la coloración del pelo, la alopecia y los exantemas inespecíficos2,3.
Describimos a un paciente con enrojecimiento escrotal asociado al uso de pazopanib, una reacción adversa cutánea no descrita previamente con relación a dicho fármaco.
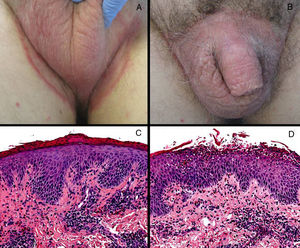
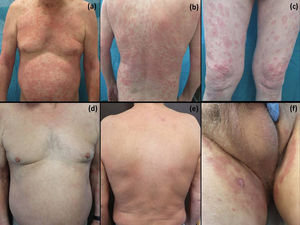
Caso clínico. Un varón de 66 años, con antecedentes de diabetes mellitus y con CCR metastásico en tratamiento con pazopanib desde hacía 3 meses, consultó por la aparición de unas placas eritematosas y descamativas de bordes bien definidos en la zona inguinoescrotal de un mes de evolución (fig. 1a y b). Los cultivos microbiológicos y micológicos resultaron negativos. El estudio histológico de una biopsia mostró una dermatitis psoriasiforme con exocitosis neutrofílica epidérmica y la presencia de eosinófilos en la dermis. (fig. 1c y d). A pesar del tratamiento con antihistamínicos orales y corticoides orales y tópicos, las lesiones se extendieron al tronco y a las extremidades superiores e inferiores (fig. 2 a-c). Dado el empeoramiento progresivo con una afectación importante de la calidad de vida y la falta de respuesta al tratamiento, se decidió retirar el pazopanib. Se observó una mejoría clínica importante con la resolución de prácticamente la totalidad de las lesiones (fig. 2d y e), siendo las lesiones escrotales las últimas en desaparecer (fig. 2f). Finalmente, se realizó el diagnóstico de toxicodermia por ITK teniendo en cuenta la clínica, los hallazgos histológicos y la mejoría tras la retirada del medicamento.
Clínica e histología. (A) Placa eritematosa de bordes bien definidos que afectaba la región púbica. (B) Eritema escrotal que se extiende a modo de placa a zona inguinal bilateral con borde eritematodescamativo más marcado. (C) Acantosis epidérmica con paraqueratosis extensa e infiltrado linfocitario perivascular (H-E, 200X). (D) Acantosis epidérmica con espongiosis neutrofílica, e infiltrados linfocitarios perivasculares dérmicos con eosinófilos (H-E 200X).
Evolución: exantema maculopapuloso en el tronco y las extremidades superiores (a y b). Lesiones eritematoedematosas anulares con borde más acenudado discretamente descamativas (c). Resolución de las lesiones en tronco y extremidades a las 2 semanas de suspender el pazopanib (d y e) con mejoría de las lesiones inguinoescrotales (f).
El uso de fármacos antidiana se relaciona con la aparición de efectos adversos cutáneos. En concreto, los ITK presentan un perfil específico de reacciones adversas cutáneas cuyas manifestaciones clínicas son variables y, en la mayoría de las ocasiones, dosis y dependientes de la duración1. El eritema escrotal es una reacción cutánea infrecuente que se manifiesta clínicamente por la aparición de placas eritematosas pruriginosas de bordes bien definidos, que aparecen generalmente en el área escrotal y que pueden extenderse al resto del área genital incluyendo la zona inguinal. Esta reacción se ha objetivado tras la administración de sorafenib, sunitinib y cabozantinib, sin haberse descrito hasta el momento su relación con la administración de pazopanib4,5. Los escasos estudios histopatológicos realizados en este contexto han mostrado acantosis con paraqueratosis, sin otros cambios específicos6,7. La patogenia de esta reacción es desconocida, sin embargo, se postula que la neoangiogénesis y el aumento de la permeabilidad vascular inducidos por VEGF y el factor 1α inducible por hipoxia tienen un papel importante, si bien es conocido el mecanismo de retroalimentación tras la administración de inhibidores de VEGF que provocan un aumento plasmático y tisular del mismo6,7.
Se trata de un efecto adverso poco frecuente, si se tienen en cuenta el global de reacciones cutáneas recogidas en las diferentes series de pacientes tratados con ITK. En la serie de Lee et al., que incluye a 109 pacientes tratados con sorafenib, se describe un 48% de reacciones palmo-plantares, un 26% de alopecias y estomatitis, y 1,83% a escroto rojo4. Por otra parte, en la serie de Zuo et al., que incluye a 41 pacientes tratados con cabozantinib, se objetiva un 54% de reacciones palmo-plantares, un 44% de despigmentaciones de cabello, un 20% de xerosis y un 15% de pacientes con eritema o ulceración escrotal5. De forma análoga, Iacovelli et al. describen un caso de prurito y dolor vulvar asociados a eritema local tras la administración de sunitinib8.
Es importante el conocimiento de esta entidad, cuyo diagnóstico es fundamentalmente clínico, para realizar un correcto diagnóstico que nos permita establecer unas medidas terapéuticas adecuadas. Se ha propuesto el uso de medidas físicas para reducir la fricción y la presión cutáneas, las cremas y los ungüentos barrera5, y como últimas alternativas, el fraccionamiento o la reducción de la dosis y, ante el fracaso de todo lo anterior, la interrupción temporal del tratamiento6,7. La recidiva del escroto rojo tras la reintroducción del tratamiento es un evento adverso frecuente que, en ocasiones, condiciona la interrupción definitiva del fármaco4,5. En el diagnóstico diferencial se incluyen diversas entidades de origen inflamatorio, traumático, tumoral e infeccioso, destacando los eccemas de contacto alérgico e irritativo, la dermatitis atópica, la psoriasis, algunas ictiosis, la enfermedad de Bowen, la enfermedad de Paget extramamaria y las dermatofitosis9. Además, existe otra entidad de curso crónico y de etiología desconocida llamada síndrome del escroto rojo, cuyo curso clínico puede superponerse al descrito previamente. Histológicamente, consta de telangiectasias sin gran infiltrado inflamatorio, hallazgos explicables por vasodilatación neurogénica eritromelalgia-like o rosácea-like9. Su diagnóstico se establece por exclusión del resto de dermatosis incluidas en el diagnóstico diferencial y requiere un tratamiento específico, habiendo demostrado eficacia el carvedilol por vía oral y el timolol tópico9,10. Se han usado otros tratamientos, como los inhibidores de la calcineurina tópicos, la doxiciclina oral y la gabapentina oral con una eficacia menor9.
Por tanto, en el futuro es necesario estudiar la correlación entre la administración de pazopanib y la aparición de reacciones cutáneas adversas en forma de escroto rojo. Además, es fundamental realizar un adecuado seguimiento clínico y tratamiento para evitar las reducciones de dosis y las interrupciones de tratamiento que, en ocasiones, son la única alternativa terapéutica ante la aparición de toxicidad cutánea.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.