El tumor fibromixoide osificante (TFMO), originalmente descrito como tumor benigno de pequeño tamaño a nivel subcutáneo, recubierto de una cápsula ósea y formado por pequeñas células dispuestas en cordones y nidos en un estroma fibromixoide1, cuenta con publicaciones más recientes señalando hallazgos histológicos de malignidad asociados con enfermedad metastásica2. Su linaje histológico continúa siendo controvertido. A pesar de ser considerados inicialmente como tumores de diferenciación schwanniana o cartilaginosa1 en función de su ultraestructura e inmunohistoquímica, positiva para la proteína S-100, estudios proteómicos y genéticos más recientes abogan por un origen neural y/o mioepitelial3,4. En la última década se ha puesto de manifiesto la idea de que no existen TFMO malignos, puesto que no cumplen la descripción histológica clásica, y podrían corresponderse con otras entidades tumorales malignas de partes blandas5.
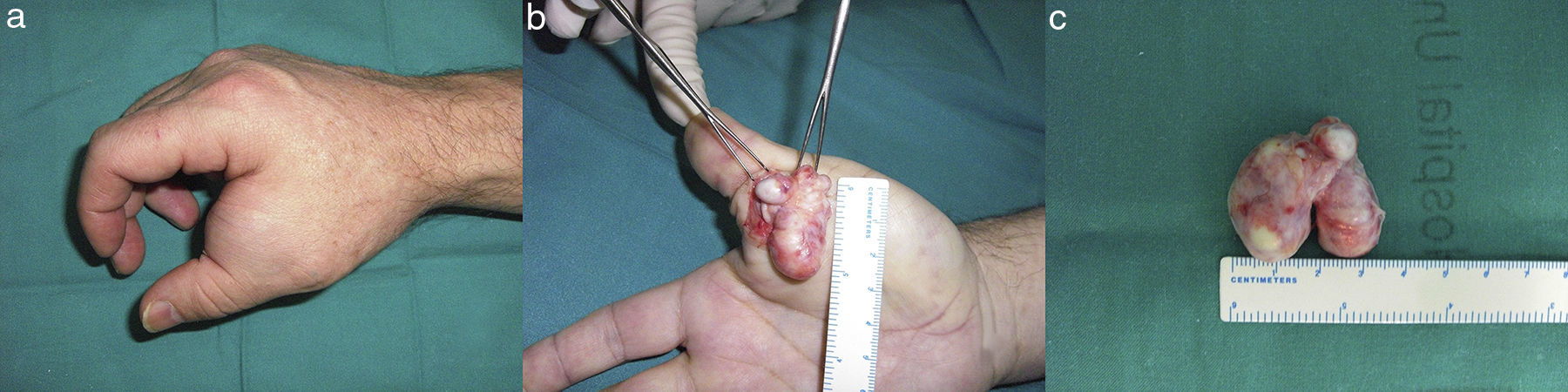
En los últimos 20 años se han identificado 2 casos de TFMO en nuestra institución, ambos afectando a varones de 55 y 46 años en el cuero cabelludo y la mano (fig. 1) respectivamente, de curso clínico indoloro. La histología de las biopsias escisionales coincidió con la descripción clásica de TFMO: cápsula bien delimitada, áreas fibrosas compuestas por láminas de células uniformes ovoides, de núcleos redondos en un estroma hialino y otras áreas mixoides de menor celularidad con positividad moderada y difusa a la proteína S-100 (fig. 2). En ninguno de los casos de realizó ampliación de márgenes. Tras un seguimiento de 18 años y 21 meses, respectivamente, no hay signos de recidiva local ni metástasis.
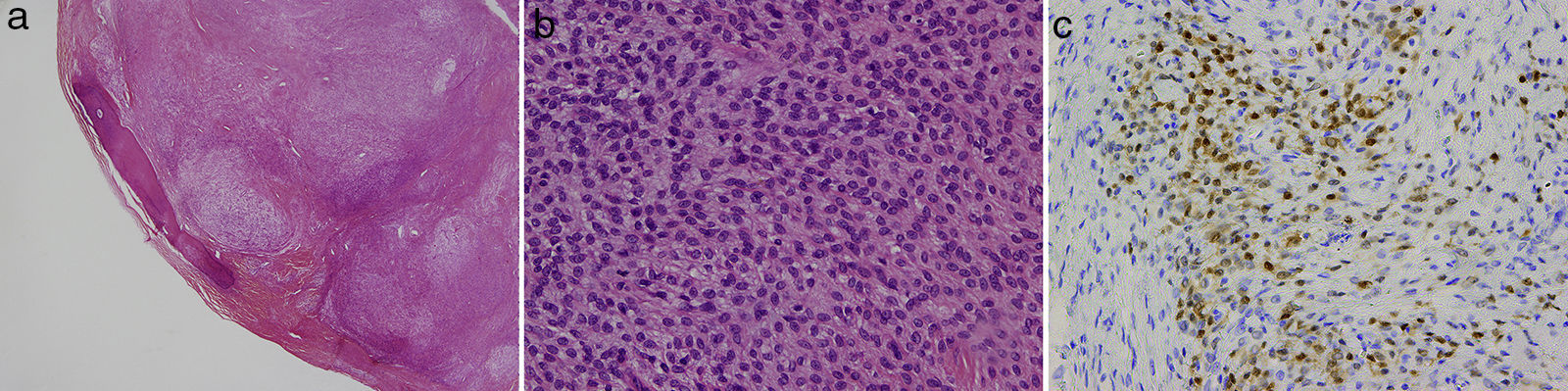
Imágenes histológicas. Tinción con H-E con aumento ×2 donde se aprecia TFMO con la característica cápsula incompleta de hueso lamelar (A). Tinción H-E con aumento ×40 mostrando células epitelioides monomorfas con pequeños nucléolos y bordes nítidos (B). Inmunohistoquímica con aumento ×20, positividad difusa para S-100 (C).
Esta entidad aparece típicamente en hombres con una edad media de 50 años. Suelen localizarse en la región proximal de los miembros, con mayor frecuencia en la extremidad inferior1,3–6.
La inmunohistoquímica presenta una estrecha relación con la controversia existente en torno a la histogénesis del tumor. Los orígenes que se han postulado con más fuerza son el schwanniano (en función de la existencia de una lámina externa bien desarrollada y duplicada, y la positividad para la proteína S-1007) y el cartilaginoso (por la presencia de bordes celulares irregulares con pequeñas digitaciones y microfilamentos intracelulares con S-100 positiva1). Otros trabajos apuntan un linaje mioepitelial por hallazgos ultraestructurales4, y neural por la positividad de CD56, una molécula de adhesión en células neurales y de EAAT4, un transportador neuronal de ácido glutámico3.
Los análisis citogenéticos de este tipo de tumores enfocan la atención sobre 2 genes, INI-13, un gen supresor tumoral y PHF18, que codifica una proteína encargada, entre otras funciones, de regular la actividad del complejo represor polycomb 2, un silenciador de genes encargados del desarrollo. Se postula la disregulación de este complejo, por alteraciones en estos u otros genes adyacentes, como mecanismo de desarrollo del TFMO.
En 1995 Kilpatrick9 describe por primera vez la existencia de TFMO de comportamiento maligno, asociado con hallazgos morfológicos atípicos. Folpe y Weiss6 identifican criterios predictores de un comportamiento agresivo o maligno. Posteriormente, Miettinen5 niega la existencia del TFMO maligno, aludiendo a que la mayoría de esos tumores no se corresponden con la descripción clásica del TFMO y podrían ser mejor clasificados como otros tipos de sarcomas. Graham3, continuando con la labor de Folpe, valida su clasificación, al comprobar que el subtipo maligno se asociaba con un comportamiento más agresivo durante el seguimiento.
El comportamiento biológicamente agresivo ha sido otro aspecto tratado en las series más importantes de TFMO. Folpe6 obtiene cifras de 18% de recidiva local (RL) y 16% de metástasis (MT). Miettinen5, incluyendo solo TFMO típicos, obtuvo 22% de RL y ningún caso de MT. Por último, Graham3 aporta resultados de RL de 4,3% y 6,5% de MT, considerando solo el TFMO maligno. Reuniendo los datos de estas series, el riesgo metastásico de la variante típica sería inferior al 5%, de lo cual se deduce que, aun presentando características histológicas de benignidad, el TFMO puede dar lugar a metástasis.
La escasez de TFMO reclutados en los últimos 20 años en nuestra institución, dado que atiende a una población cercana al millón de habitantes, parece estar en relación con una visión del diagnóstico más cercana a la de Miettinen que a la de Folpe y Graham. De esta forma, los tumores que no se adaptaran a la descripción típica de TFMO, y con características de malignidad, serían catalogados como sarcomas de bajo grado, en lugar de TFMO malignos. Esto podría explicar la ausencia de recurrencias en ninguno de los 2 pacientes, a pesar de haberse realizado escisiones sin márgenes.
En conclusión, el TFMO constituye una entidad infrecuente, cuya epidemiología podría estar sesgada por el diagnóstico de cada departamento de anatomía-patológica respecto a las variantes atípica y maligna. A pesar de mostrar características benignas, puede presentar comportamiento agresivo, por lo que debería evitarse su catalogación como benigno y considerarlo un tumor de malignidad intermedia.
Queremos agradecer la estrecha colaboración de los doctores José Juan Pozo-Kreilinger, Adrien Yvon y Estefania Alonso-Rodríguez, que han hecho posible este trabajo.