La incidencia de carcinoma epidermoide anal ha aumentado de forma alarmante, especialmente en grupos de riesgo como son los pacientes homosexuales y los inmunosuprimidos. La infección por un genotipo oncogénico del virus del papiloma humano (VPH) en el canal anal o en la piel perianal, desencadena una progresión de lesiones displásicas intraepiteliales (neoplasia intraepitelial anal o NIA), que son las precursoras del carcinoma epidermoide anal.
La NIA puede diagnosticarse a través del cribado mediante citología y biopsia guiada por anoscopia de alta resolución, y puede tratarse mediante diferentes procedimientos, con el fin de evitar la progresión a carcinoma anal invasivo.
En vista de los recientes avances en el conocimiento de esta patología, y de que cada vez son más los expertos que recomiendan la puesta en marcha de programas de cribado de la NIA, revisamos el concepto actual de la misma, su diagnóstico y tratamiento desde una perspectiva dermatológica.
The incidence of anal squamous cell carcinoma has increased alarmingly, particularly in high-risk groups such as men who have sex with men and immunosuppressed patients. Infection with an oncogenic strain of the human papillomavirus in the anal canal or perianal skin leads to anal intraepithelial neoplasias (AIN), progressive dysplastic intraepithelial lesions that are the precursors of anal squamous cell carcinoma. AIN can be diagnosed through cytological screening and biopsy guided by high-resolution anoscopy and can be treated using a range of procedures in an effort to prevent progression to invasive anal carcinoma. Given the recent advances in the understanding of this disease, and the increasing calls from experts for the establishment of screening programs to identify AIN, we review current knowledge on the condition, its diagnosis, and treatment from the point of view of dermatology.
En la última década se ha producido un incremento significativo en la incidencia de carcinoma epidermoide anal, fundamentalmente a costa del aumento en grupos de riesgo como son los hombres que tienen sexo con hombres (HSH), inmunosuprimidos y mujeres con antecedentes de displasia cervical.
De forma paralela a lo que ocurre en el cáncer de cérvix, el cáncer anal aparece como una progresión de lesiones displásicas intraepiteliales (neoplasia intraepitelial anal o NIA), que se desarrollan en la unión escamocolumnar del epitelio del canal anal. Estas lesiones displásicas se producen como consecuencia de la infección por el virus del papiloma humano (VPH) oncogénico, especialmente el VPH 16.
La NIA puede diagnosticarse a través del cribado mediante citología y anoscopia de alta resolución. Son muchos los avances recientes en el tratamiento de la NIA que nos ofrecen diferentes alternativas para lograr evitar la progresión de estas lesiones a un carcinoma anal invasivo.
Aunque en el momento actual el cribado y tratamiento de la NIA en los pacientes de alto riesgo es aún motivo de debate, se trata de una práctica cada vez más extendida, y es probable que en un futuro se trate de una prestación que se ofrezca desde la consulta de Dermatología.
Epidemiología del carcinoma epidermoide analEl carcinoma epidermoide anal es una neoplasia infrecuente, constituyendo menos de un 5% del total de las neoplasias gastrointestinales. La incidencia del carcinoma epidermoide anal en EE.UU. en varones sanos es de 0,8 casos por cada 100.000 habitantes1. Desafortunadamente no podemos precisar con exactitud la incidencia y prevalencia del mismo en España por no existir ningún registro oficial que recoja estos datos. No obstante, estudios epidemiológicos recientes en otros países, fundamentalmente en Europa2–4 y Estados Unidos5, reflejan un incremento importante en la incidencia del carcinoma epidermoide, que se estima que es aproximadamente del 2% anual en los últimos 10 años, especialmente en determinados grupos de riesgo.
A diferencia de lo que ocurre en la población general, las cifras de incidencia cambian si analizamos distintos subgrupos poblacionales. Así, la incidencia de carcinoma anal en HSH sanos asciende a 35 casos cada 100.000 personas6,7. Aunque esta cifra es la mitad de la comunicada en pacientes infectados por el virus de la inmunodeficiencia humana (VIH), es equiparable a la incidencia del cáncer de cérvix en las mujeres antes de la generalización del cribado mediante citología.
Más alarmante resulta la incidencia de carcinoma anal en pacientes HSH infectados por el VIH, que asciende a 70-128/100.000 personas-año8–10, lo que lo convierte en el grupo poblacional de mayor riesgo. Diversos estudios han examinado los cambios en la incidencia de carcinoma anal en relación con la epidemia de sida (1980-1990) y la introducción de la terapia antirretroviral de gran actividad (TARGA) en 1996. Casi todos ellos coinciden en que la introducción de la TARGA no sólo no ha reducido la incidencia de carcinoma anal, como ha ocurrido con otros tumores asociados al sida (como el sarcoma de Kaposi, el linfoma no-Hodgkin o la retinitis por CMV)6, sino que incluso ha aumentado de manera importante en la era post-TARGA8,10,11.
Puesto que la TARGA no parece tener impacto sobre la historia natural del carcinoma epidermoide anal, y sin embargo prolonga significativamente la supervivencia, cabe esperar que la incidencia de esta neoplasia siga aumentando de forma progresiva. A día de hoy el carcinoma epidermoide anal constituye la neoplasia no definitoria de sida más frecuente12, de forma que en los últimos años se ha convertido en uno de los mayores problemas de salud en la población infectada por el VIH.
Merece también la pena destacar como población de riesgo a los pacientes inmunosuprimidos por causas diferentes a la infección por el VIH, como son los pacientes que han recibido un trasplante de órgano sólido y que por consiguiente siguen un tratamiento inmunosupresor. Concretamente, varios estudios han comunicado tasas de carcinoma anal de hasta 10 veces mayor a la población general en pacientes trasplantados renales12–14.
Por otra parte, en las mujeres, el riesgo de cáncer anal va ligado a la presencia de otros tumores en la región anogenital, probablemente en relación con la exposición común al VPH por proximidad anatómica (tanto el cérvix como el canal anal actúan como reservorios que favorecerán la infección mutua por proximidad, independientemente de la localización anatómica inicial de la misma). Así, las pacientes que han presentado una neoplasia en esta región tendrán un riesgo considerablemente mayor al de la población general de presentar una segunda neoplasia en la región anogenital. Un reciente estudio documentó una incidencia de hasta el 12,2% de neoplasia intraepitelial anal en pacientes con antecedente de displasia cervical, vulvar o vaginal a las que se sometió a un cribado mediante citología y anoscopia de alta resolución con biopsia15. Obviamente este riesgo es mucho mayor en pacientes inmunosuprimidas, especialmente infectadas por el VIH.
EtiopatogeniaNo se dispone todavía de estudios a largo plazo que establezcan de forma definitiva un modelo que explique de forma perfecta la historia natural de la neoplasia anal. Por analogía con el carcinoma de cérvix se acepta un modelo evolutivo que incluye una gradación, desde lesiones precursoras displásicas intraepiteliales hasta el desarrollo de lesiones tumorales invasivas; esta evolución ha sido confirmada en estudios recientes9,16–18.
Existe evidencia de que el VPH desempeña un papel fundamental en la etiopatogenia de hasta el 93% de los carcinomas anales. Así, tanto en el carcinoma epidermoide anal, como en su lesión precursora, la NIA de alto grado, se ha detectado un aumento significativo de los genotipos 16 y 18 del VPH19–21. De manera análoga a lo que ocurre en el cervix, donde el virus infecta el epitelio de la unión escamo-columnar (epitelio de transición), en el canal anal el virus tiende a infectar la zona de transición entre el epitelio columnar rectal y el epitelio estratificado de la piel, precisamente donde se producirán los cambios displásicos que definen la NIA.
En relación con lo anterior, resulta sencillo entender los factores implicados en la alta incidencia de NIA y carcinoma epidermoide en los pacientes HSH VIH+. Por una parte está bien documentado en la literatura que los HSH tienen una prevalencia de infección por VPH de hasta el 60%, siendo aún mayor si el paciente está infectado por el VIH (entonces la prevalencia asciende a más del 93%)22–25, en parte debido a que en estos pacientes la infección es mucho más persistente en el tiempo26.
Por otro lado, se conoce también que la NIA está íntimamente relacionada con la presencia de distintos grados de inmunodepresión, y muy especialmente relacionada con la infección por el VIH. Se han postulado distintos mecanismos de interacción entre el VIH y el VPH, incluyendo una atenuación de la respuesta celular a los antígenos del VPH en los pacientes infectados por el VIH, una expresión aberrante de las citoquinas (IL-6) que modulan la expresión de los genes del VPH, un aumento en la expresión de factores de crecimiento locales y un efecto directo del VIH sobre la expresión de los oncogenes E6 y E725.
Historia natural de la neoplasia intraepitelial analFenger y Nielsen27 describieron en 1981 la lesión precursora del carcinoma anal, la NIA.
El patrón oro para el diagnóstico de NIA es la biopsia anal. El diagnóstico se basa en la detección de la displasia y en la determinación de su profundidad en el epitelio. Teniendo en cuenta la hipotética división del mismo en tres partes, la NIA se clasifica en grado I-III en función de la aparición de células displásicas que afecten al epitelio de menor a mayor profundidad, respectivamente.
Además la NIA puede detectarse mediante citología anal de forma similar a lo que sucede con las lesiones displásicas del cérvix uterino y, por lo tanto, puede utilizarse la clasificación de Bethesda28, que diferenciaría entre lesiones escamosas intraepiteliales de bajo y de alto grado. Esta definición citológica tiene su correspondencia histológica en la biopsia anal, que constituye siempre el diagnóstico definitivo.
Aunque existen menos estudios sobre la historia natural de la NIA que en la displasia cervical, no hay duda de que la NIA II y III son las lesiones precursoras del carcinoma epidermoide anal. Son varios los autores que han podido constatar mediante control histológico prolongado la transformación de un epitelio displásico grado III a un carcinoma in situ9,16–18. Sin embargo, y a pesar de la evidencia que apoya la progresión en algunos casos de la NIA II y III hasta un carcinoma anal, son necesarios más estudios que aclaren el significado clínico de la NIA.
Respecto a la evolución de las lesiones clasificadas como NIA I, estas pueden experimentar una regresión espontánea sin ningún tratamiento o progresar hacia grados mayores de displasia29. Se ha descrito que aproximadamente el 10% de los pacientes con NIA de bajo grado (NIA I) pueden evolucionar a NIA II, NIA III o incluso a carcinoma escamoso anal26. Por el contrario, Scholefield et al observaron que de 32 pacientes con NIA III el 15,6% desarrollaron carcinoma anal invasor con un seguimiento de 18 meses18.
Lógicamente, los grupos de población con más riesgo para presentar una NIA coinciden con aquellos con más riesgo de presentar carcinoma anal; así, la prevalencia de NIA se estima en torno al 35% en HSH30, entre el 72-81% en aquellos que además están infectados por el VIH17,23,24,30, el 20% en pacientes con CIN III o carcinoma de cérvix y también aumenta en pacientes inmunosuprimidos por otras causas como el trasplante renal12,15,19. Además, aproximadamente un 10% de los pacientes con condilomas anales presentan diferentes grados de NIA, lo cual demuestra la idoneidad de realizar el estudio histológico de los condilomas anales y perianales de nuestros pacientes19,31.
El aumento de riesgo de NIA en la población infectada por el VIH se refleja en un estudio reciente que demuestra que el 81% de los HSH positivos para el VIH presenta displasia anal de algún grado, y el 52% displasia de alto grado23,24. Otro estudio, realizado en Alemania con 446 HSH infectados por el VIH, encontró tasas de displasia de cualquier tipo del 72%, y del 35% considerando sólo la de alto grado16.
En el paciente infectado por el VIH se ha podido demostrar una relación directa del riesgo de NIA con los valores de CD4, de manera que el riesgo de presentar una NIA crece a medida que los CD4 disminuyen24,32. Se ha propuesto que otro factor que puede conducir a un mayor riesgo de carcinoma anal es el tiempo de inmunosupresión, es decir, de la duración de la infección por el VIH33. Así, en un reciente estudio llevado a cabo en una cohorte de 4.901 pacientes positivos para el VIH, se observó que los pacientes infectados por el VIH de más de 15 años de evolución tenían una incidencia de carcinoma anal 12 veces mayor que aquellos en los que la infección tenía una duración de menos de 5 años (p<0,01)10. Esta observación resulta muy interesante a la hora de seleccionar los pacientes con el mayor riesgo de presentar un carcinoma anal (y por tanto en los que el cribado resulta más necesario), que serían por tanto aquellos pacientes homosexuales en los que la infección por el VIH es de mayor tiempo de evolución.
Los factores que parece que influyen en la evolución natural de la NIA (regresión o progresión) son: la infección por el VIH, el potencial oncogénico del VPH, la carga viral de VPH, la coinfección por genotipos diferentes del VPH y el estado inmunológico del huésped34.
Varios estudios evidencian que el progreso de la enfermedad es más rápido en los pacientes positivos para el VIH, con una menor tasa de regresión espontánea y una mayor progresión a estadios más avanzados24,35. En dichos estudios Palefsky encontró que el 32% de los pacientes VIH HSH con citologías normales y el 52% de los que presentaban displasia de bajo grado desarrollaban lesiones de alto grado en un período de tan sólo 4 años.
En contraste con lo que observamos en los pacientes infectados por el VIH, la incidencia de carcinoma anal en los pacientes HSH inmunocompetentes, aun siendo alta, resulta menor de lo esperable si tenemos en cuenta las altísimas cifras de prevalencia de NIA descritas36. Este hecho probablemente se debe a que en los pacientes inmunocompetentes es mucho más frecuente la regresión espontánea de la NIA.
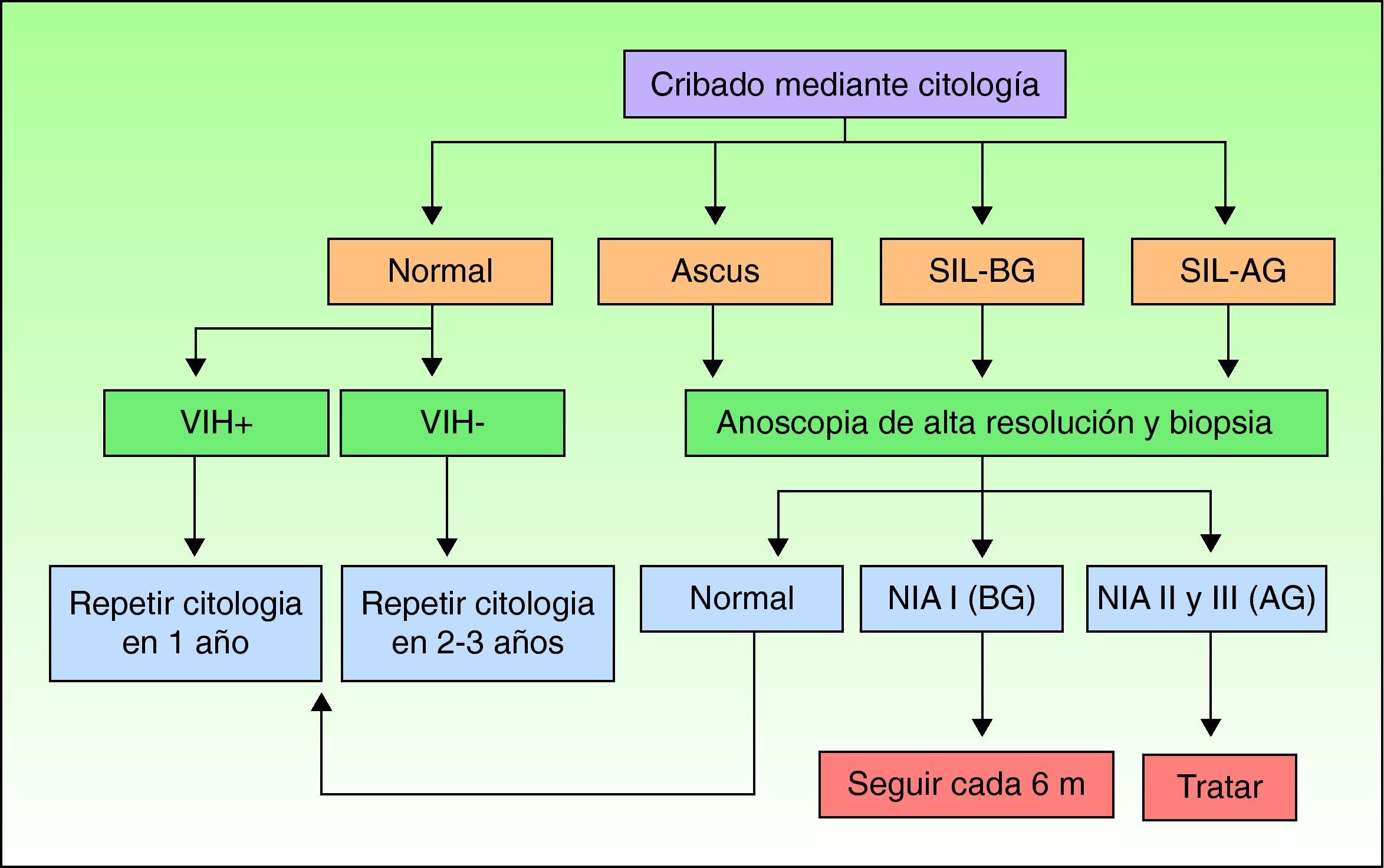
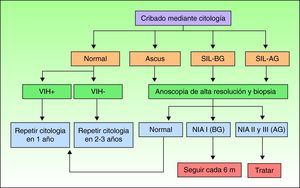
Cribado de la neoplasia intraepitelial anal mediante citología y anoscopia de alta resoluciónEl primer paso en el cribado de la población de riesgo es la realización de una citología anal. Cualquier hallazgo patológico en la citología será indicación para la realización de una anoscopia de alta resolución con toma de biopsia (fig. 1).
Algoritmo adaptado con permiso del Dr. JM. Palefsky (Chin-Hong PV, Palefsky JM9).
Se trata de una técnica sencilla y cómoda de realizar que permite la obtención de células para el análisis citopatológico, siendo posible además la determinación cualitativa del VPH cuando se realiza en medio líquido.
Se lleva a cabo mediante la introducción en el canal anal, aproximadamente hasta 3cm de profundidad, de un cepillo de citología (por ejemplo Cytobrush®), que se extraerá siguiendo un movimiento circular con el objeto de favorecer el contacto con las paredes del canal anal. Posteriormente el cepillo se sumerge en un vial con líquido conservador (por ejemplo PreservCyt®), que permite la obtención de células para el análisis citopatológico. Una parte de la muestra se procesará para detección del VPH por la técnica de captura de híbridos.
Actualmente las técnicas citológicas han mejorado de forma significativa y han demostrado tener una sensibilidad y especificidad comparables al menos a la citología cervical. Se trata por tanto de una prueba sencilla e incruenta, que cuando se realiza en medio líquido presenta sensibilidades (69-93%) y especificidades (32-59%) similares a la citología cervical36–40. Sin embargo, y al igual que ocurre en el cérvix, la citología no predice de forma adecuada el grado de afectación histológica. Sabemos que un resultado de displasia de alto grado en la citología tiene un alto valor predictivo positivo para la displasia de alto grado histológico. Sin embargo, las alteraciones epiteliales de bajo grado obtenidas mediante citología no son fiables para determinar el verdadero grado de la lesión, ya que un resultado citológico de ASCUS o de displasia de bajo grado puede aparecer en el contexto de una displasia de alto grado histológico. Por tanto, cualquier alteración citológica se seguirá de una anoscopia de alta resolución con biopsias de las zonas sugestivas de NIA para confirmar el diagnóstico y determinar el grado de displasia.
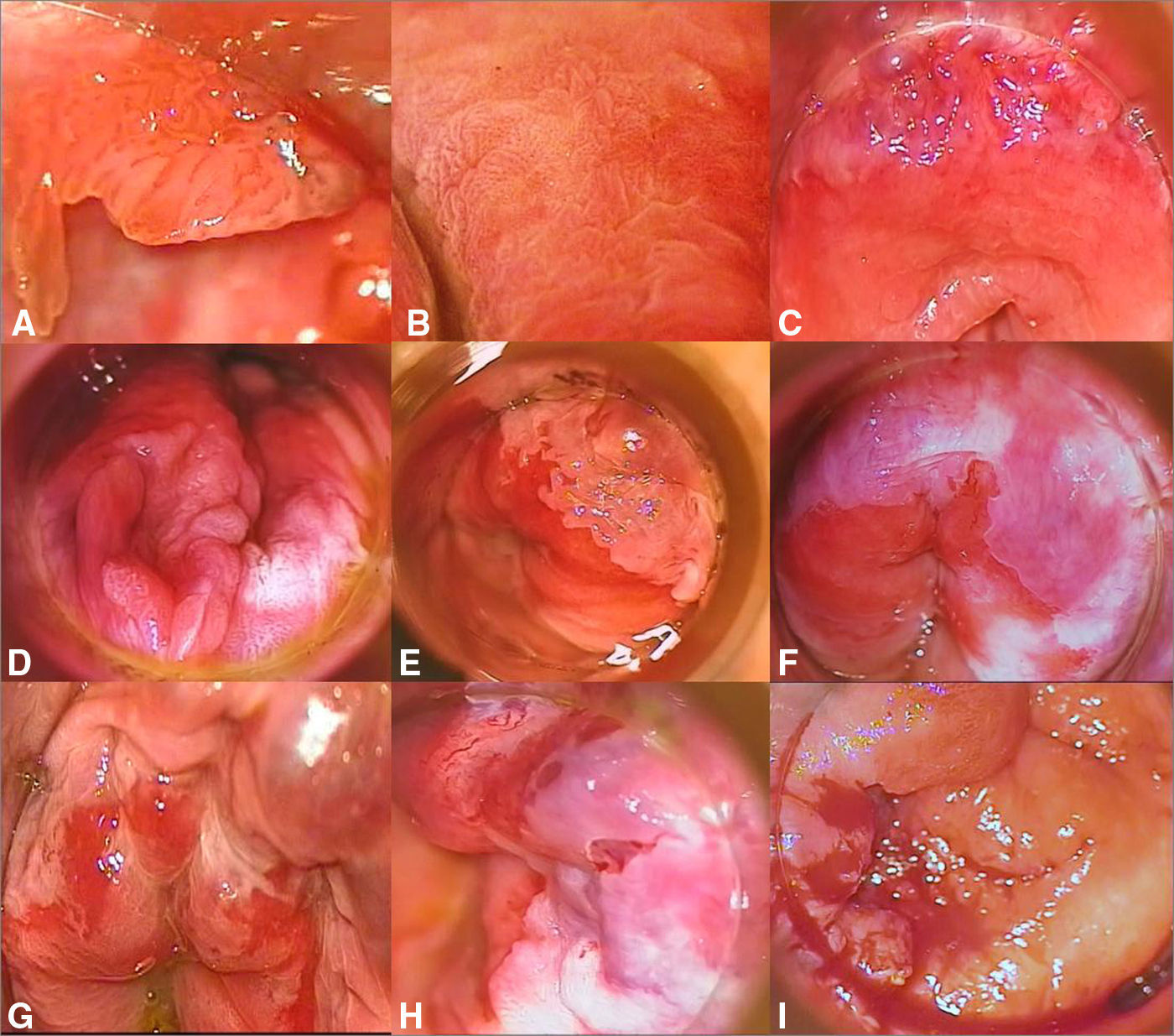
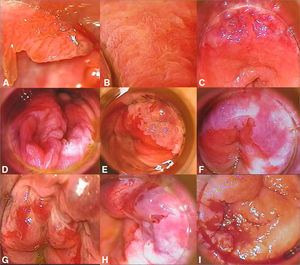
Anoscopia de alta resolución y biopsiaEsta técnica se considera de elección para el diagnóstico dirigido de las lesiones de NIA. Requiere la utilización de un colposcopio con luz, equipado con una lente magnificadora de imágenes que nos permitirá el estudio del epitelio de transición del canal anal. Se utiliza para esta exploración una gasa empapada en una solución de ácido acético al 3% que ha de permanecer en contacto con la mucosa durante unos minutos. Las lesiones de NIA suelen adquirir al contacto con la solución una coloración blanquecina que permite seleccionar las zonas de sospecha de NIA para realizar una biopsia. También puede aplicarse posteriormente una tinción con lugol. Debemos sospechar una NIA ante la presencia de placas acetoblancas, placas que no captan lugol y aquellas zonas de la mucosa que presenten un patrón vascular anómalo. En la figura 2 podemos observar imágenes de NIA I, II y III, tal y como se visualizan mediante anoscopia de alta resolución (fig. 2A-I). El estudio histológico mediante biopsia en sacabocados de las lesiones constituye la prueba de elección para el diagnóstico y la evaluación de la gravedad de la NIA22.
A. Condiloma en paciente con NIA I. B. Patrón papilomatoso con punteado vascular que corresponde a NIA II. C. Placa acetoblanca con vascularización anómala en ambos cuadrantes superiores en paciente diagnosticado de NIA II. D. Placa extensa en empedrado acetoblanco en ambos cuadrantes inferiores en paciente con NIA II. E. Placa acetoblanca circunscrita localizada en cuadrante superior izquierdo que corresponde a una NIA II. F. Placas acetoblancas de extensión circunferencial en paciente con NIA III. G. Placas acetoblancas y mucosa friable con zonas hemorrágicas y erosiones en NIA III. H. Placa acetoblanca y vasos gruesos tortuosos en sector superior. I. Masa excrecente hemorrágica en paciente con carcinoma epidermoide infiltrante.
Existen controversias sobre el valor del diagnóstico del VPH en el cribado de la NIA. Esto se debe a la altísima prevalencia de la infección por VPH en los grupos de mayor riesgo, como son los pacientes HSH y positivos para el VIH. Es bien conocido que la mayoría de los HSH infectados por el VIH presentan múltiples variantes del VPH, habiendo poca diferencia en las tasas de infección entre pacientes con y sin NIA.
La detección del VPH se utiliza en el cribado de las mujeres con diagnóstico citológico de ascus cervical para determinar cuáles deben ser sometidas a colposcopia. En HSH positivos para el VIH con diagnóstico de ascus anal, la detección del VPH probablemente no sea útil porque la mayoría de los pacientes estarán infectados por VPH oncogénico, y esta prueba por tanto no mejorará la especificidad del cribado39. Sin embargo, algunos autores han propuesto complementar el cribado de la NIA mediante la detección del VPH en HSH negativos para el VIH en los que la sensibilidad del cribado es menor40. El papel de la detección del VPH en otros grupos de riesgo, como en mujeres con antecedente de displasia cervical, podría tener más valor por ser menor la prevalencia de infección anal por VPH.
Por otra parte, la detección del VPH como técnica de rutina en el cribado de la NIA puede tener valor si nos basamos en su valor predictivo negativo, ya que sabemos que en el paciente en el que no se detecta VPH oncogénico no encontraremos displasia39, y por ello en estos pacientes podremos evitar la anoscopia de alta resolución. Desgraciadamente esto ocurre en un porcentaje bajo de los pacientes de riesgo.
Pacientes de riesgo a los que recomendar el cribadoSe ha comentado previamente cuáles son los fundamentales grupos de riesgo para el desarrollo de neoplasias epiteliales relacionadas con la infección por el VIH. Sin embargo, la decisión de cuáles deben someterse al cribado resulta compleja, y lleva implícita la necesidad de que esta intervención sea coste-efectiva. En la figura 3 se recogen los pacientes a los que podría recomendarse realizar el cribado por presentar factores de riesgo (fig. 3). Sin embargo sólo existen estudios que demuestran que esta intervención es coste-efectiva en pacientes positivos para el VIH una vez al año y HSH negativos para el VIH cada dos o tres años41,42.
En algunas guías oficiales de seguimiento del paciente VIH (NY State Department of Health AIDS Institute) ya se recomienda realizar este cribado de manera sistemática a los pacientes infectados por el VIH43. Las guías de CDC (Centers for Disease Control and Prevention) no se pronuncian al respecto y se limitan a indicar que la citología es utilizada por muchos expertos para el cribado de la NIA en pacientes positivos para el VIH44.
Esquema de cribadoNo existe un esquema universal de cribado, y la mayoría de los autores se basan en el inicial propuesto por Palefsky9 (fig. 1). A todos los pacientes se les realiza una citología anal mediante la técnica previamente comentada. Si es negativa, y el paciente está infectado por el VIH, se repetirá la citología en un año. Si el paciente no es positivo para el VIH, entonces la citología se repetirá en dos o tres años. Cualquier alteración en la citología será indicación de exploración mediante anoscopia de alta resolución y biopsia. Si se detecta en la biopsia una NIA grado I está indicada una nueva anoscopia en 6 meses. Si se encuentra una NIA II o III estará indicado tratar. Si tras una alteración de bajo grado en la citología no se observan hallazgos en la anoscopia habrá que repetir la citología en 6 meses. En la rara ocasión en que no encontremos hallazgos en la anoscopia tras una citología de alto grado, tomaremos biopsias ciegas y repetiremos la citología en un plazo breve.
Limitaciones en el cribado de la neoplasia intraepitelial anal: perspectivas futurasSe ha comentado previamente que la sensibilidad y especificidad de la citología anal es similar a la de la cervical, habiéndose documentado que es mayor en pacientes con afectación extensa en más de un cuadrante de la mucosa anal y en los pacientes positivos para el VIH, sobre todo si presentan CD4 disminuidos45.
Sin embargo, como ocurre en el cérvix, se trata de un cribado de características subóptimas, ya que existen pacientes con NIA-AG que no son detectados mediante citología, y por otra parte muchos pacientes sanos son sometidos a anoscopia de alta resolución de forma innecesaria.
Por este motivo, se están investigando técnicas moleculares que intentan mejorar la sensibilidad y especificidad del cribado de la NIA. Se han propuesto marcadores moleculares citológicos, histológicos y microbiológicos para intentar determinar qué pacientes deben ser explorados mediante anoscopia de alta resolución. Entre ellos cabe destacar el papel de las proteínas marcadoras de disregulación del ciclo celular, biomarcadores de daño del ADN, la gammatubulina, las betadefensinas o el tipaje del VPH y su integración46,47.
Por otra parte, siendo tan alta la incidencia de NIA en determinados subgrupos de riesgo, hay autores que incluso proponen obviar la citología e indicar la anoscopia de alta resolución como test de cribado desde el principio39.
Tratamiento de la neoplasia intraepitelial analEl tratamiento de la NIA supone un reto terapéutico por varios motivos. En primer lugar por el riesgo de recurrencias y de lesiones metacrónicas, que se asocia a cualquiera de los tratamientos que se describen a continuación. Desafortunadamente, el tratamiento de la NIA no se acompaña de la erradicación de la infección viral, por lo que la persistencia del VPH oncogénico obliga a una monitorización prolongada del paciente tras el mismo.
No existe un tratamiento de elección para la NIA, sino que hay que seleccionar el mismo en función de la localización y extensión de la enfermedad, así como de la disponibilidad y experiencia con los distintos tratamientos en cada centro48.
No se considera necesario tratar la NIA de bajo grado, salvo que el paciente presente síntomas o gran ansiedad al respecto. Sin embargo, se recomienda tratar la NIA de alto grado, con el fin de evitar la progresión a un carcinoma invasor, salvo en el caso de que la afectación sea tan extensa que su tratamiento pueda derivar en complicaciones mayores que la propia enfermedad. En estos casos el seguimiento con anoscopia de alta resolución y examen digital cada 3-6 meses permitirá asegurar el diagnóstico precoz de un posible carcinoma invasor.
El tratamiento de la NIA puede abordarse mediante tratamientos tópicos, tratamientos ablativos o procedimientos quirúrgicos. Los distintos tratamientos que se han utilizado se resumen en la tabla 148.
Cuando la NIA se presenta de forma localizada el tratamiento es relativamente sencillo y las posibilidades terapéuticas múltiples, incluyendo la crioterapia, el ácido tricloroacético, el tratamiento mediante el coagulador infrarrojo, electrobisturí, láser CO2, cirugía, etc.48.
Más complejo resulta el abordaje de las formas extensas, en las que puede ofrecerse un tratamiento tópico autoaplicado, bien con intención curativa, bien con intención de reducir la extensión de la enfermedad hasta que sea tratable mediante métodos ablativos, como puede ser el coagulador infrarrojo. Entre los tratamientos tópicos autoaplicados utilizados destaca el papel de imiquimod tópico49–52 y 5-fluorouracilo53 (5-FU), con tasas de remisión histológica de la NIA tras el tratamiento del 74 y 57% respectivamente49–53. En ambos casos el tratamiento se acompañó de una reducción de la carga viral del VPH oncogénico. Ambos tratamientos se asociaron a altas tasas de recurrencia, que fueron del 58% (a los 30 meses del final del tratamiento) en el caso del imiquimod y del 50% en el caso del 5-FU (a los 6 meses del final del tratamiento.) Sin embargo, la mayoría de las recurrencias se presentaron en zonas diferentes a las de la NIA inicial y se asociaron a detección por VPH-AR de diferentes genotipos a los de la exploración inicial, es decir, se debieron a reinfecciones por VPH.
Entre los estudios recientes cabe destacar un estudio aleatorizado doble ciego52 con imiquimod en el que se ofrecía un segundo ciclo de 4 meses de tratamiento a los pacientes no respondedores, y que demostró una remisión total de la NIA mantenida durante al menos 36 meses en el 61% de los pacientes.
Muy prometedor resulta el papel del coagulador infrarrojo en el tratamiento de la NIA54–56. Se trata de un dispositivo que actúa mediante coagulación térmica y tiene la ventaja de que permite tratar zonas extensas en consulta (con/ sin anestesia según la zona a tratar), y de que a diferencia del láser CO2 no precisa extractor porque no se produce humo. Varios estudios retrospectivos indican que se trata de un procedimiento seguro que presenta una eficacia en el tratamiento de una lesión concreta de NIA del 60-70%. La eficacia es mayor cuando se realizan varias sesiones y en pacientes negativos para el VIH55.
El papel de la vacunaMás del 70% de los casos de carcinoma epidermoide se atribuyen al VPH 16, por lo tanto, las perspectivas de la vacunación como prevención primaria de la NIA y el cáncer anal son al menos prometedoras. En octubre de 2009 la FDA aprobó la vacuna tetravalente contra el VPH (6, 11, 16 y 18) para su uso en varones entre los 9 y 26 años con la indicación de prevenir condilomas asociados a dichos genotipos. Uno de los principales problemas asociados al uso de la vacuna en varones, con la finalidad de prevenir el carcinoma anal en grupos de riesgo, es que la vacuna es más eficaz en pacientes que no han estado aún en contacto con el VPH, es decir, que de forma ideal habría que administrarla a varones antes del inicio de las relaciones sexuales.
Obviamente, identificar qué varones jóvenes presentan riesgo de cáncer anal antes de que inicien sus relaciones sexuales resulta imposible, por lo que, hipotéticamente, para lograr disminuir la incidencia de carcinoma anal en los pacientes de riesgo habría que vacunar a toda la población masculina48. Ante esta última posibilidad habría que considerar si resultaría coste-efectivo teniendo en cuenta el alto precio de la vacuna y la relativa baja incidencia de carcinoma epidermoide anal.
Frente a este argumento Kim ha publicado recientemente un estudio57 que trata de estimar el coste-efectividad de la vacuna tetravalente en varones HSH, administrada a las edades de 12, 20 y 26 años, con el objetivo de prevenir la NIA y el carcinoma epidermoide anal. Según el modelo que construye la autora, la ratio coste-beneficio de la vacunación es máxima a los 12 años, pero sigue siendo coste-efectiva a los 20 y 26 años, es decir, a edades en las que es más probable que el propio paciente solicite la vacunación.
Por otra parte, y al igual que ocurre con otras infecciones de transmisión sexual, se ha demostrado que la infección por múltiples genotipos de VPH se asocia de forma independiente con la adquisición del VIH por parte de los HSH58, lo cual aportaría un motivo adicional para plantear la vacunación a edades tempranas en varones jóvenes.
ConclusionesEl cribado de la NIA y su generalización han sido objeto de controversia en los últimos 10 años, y en el momento actual la realidad es que aún no existen guías nacionales o internacionales que lo impongan como práctica clínica habitual. Sin embargo, durante todos estos años los estudios poblacionales y nuestra experiencia clínica como dermatólogos reflejan la realidad del incremento alarmante en el diagnóstico de carcinoma anal, especialmente en los pacientes infectados por el VIH.
Nuestro conocimiento actual acerca del papel del VPH en el carcinoma anal, y acerca de la historia natural de la NIA, nos obliga a ofrecer a nuestros pacientes la mejor prevención disponible. La citología anal es una técnica sencilla e incruenta, pero antes de generalizarla en nuestros pacientes de riesgo debemos ser capaces de ofrecer un diagnóstico de certeza y un tratamiento si existen alteraciones en la misma. Es decir, que si no existe anoscopia de alta resolución en el propio centro, los pacientes deberán ser remitidos a centros en los que esta sea posible. Si no existe la posibilidad de realizar una anoscopia de alta resolución, el seguimiento regular en la consulta de los pacientes de alto riesgo debería incluir la exploración mediante examen digital rectal, con el fin de detectar masas sugestivas de un carcinoma anal.
En nuestra opinión, al igual que ocurre en otros países europeos, el cribado de la NIA puede y debe ser una prestación a ofrecer en la consulta de dermatología como especialistas en infecciones de transmisión sexual, y más concretamente en el diagnóstico y tratamiento de las lesiones intraepiteliales asociadas al VPH. Sin embargo, el abordaje de la misma debe establecerse desde una perspectiva multidisciplinar, en la que una estrecha colaboración con otras especialidades, como medicina interna, cirugía general, digestivo, microbiología y anatomía patológica resultan cruciales para lograr la mejor calidad en la atención a estos pacientes.
Por supuesto, son necesarios más estudios que permitan definir mejor cuál es el esquema de cribado óptimo para detectar la NIA, y sobre todo que establezcan las pautas y el tratamiento más eficaz para la misma.