Los ß-bloqueantes orales –principalmente el propranolol– se consideran una opción más en el tratamiento de los hemangiomas infantiles. Se ha sugerido que pueden actuar a través del efecto vasoconstrictor, mediante la regulación de las vías implicadas en la angiogénesis y ocasionando apoptosis de las células endoteliales. Aunque su uso no está aprobado para esta indicación, en muchos centros se indican antes que los corticoides. La dosis más empleada es 2mg/kg/día repartida cada 8h. Es un fármaco seguro con escasos efectos secundarios. Se ha descrito hipoglucemia, hipotensión, diarrea, reflujo, frialdad de manos y pies, broncoespasmo e hiperpotasemia, generalmente sin repercusiones graves. Su indicación en el síndrome de PHACES es controvertida. Antes de iniciar el tratamiento se recomienda en todos los casos la realización de una evaluación cardiológica, la determinación de la presión arterial y el seguimiento pediátrico. En esta revisión se evalúan los conocimientos actuales sobre las indicaciones, la respuesta clínica, los efectos secundarios y los ensayos clínicos en curso de esta modalidad terapéutica que ha revolucionado la visión y el abordaje de los hemangiomas infantiles.
The therapeutic arsenal for hemangiomas in early childhood can now be considered to include oral β-blockers, mainly propranolol. These drugs are thought to act as vasoconstrictors, regulating angiogenic pathways and inducing apoptosis of vascular endothelial cells. Although infantile hemangioma is not among the approved indications for β-blockers, many specialized clinics will prescribe propranolol before resorting to corticosteroids. A dosage of 2mg/kg/d, is usually employed with a dosing interval of 8hours. Propranolol is safe, causing few side effects, although cases of hypoglycemia, hypotension, diarrhea, reflux, cold hands and feet, bronchospasm, and hyperkalemia have been described. Generally, these adverse effects have not had serious consequences. Prescription in PHACE syndrome is controversial. In all cases, a cardiologist should assess the patient before treatment begins, blood pressure should be monitored, and pediatric follow-up should be scheduled. This review covers our current understanding of the indications, clinical response, and adverse effects of propranolol, a drug has revolutionized our attitude toward infantile hemangioma and the way we approach therapy. Clinical trials under way are also reviewed.
Los hemangiomas infantiles (HI) son tumores vasculares benignos de la infancia que se caracterizan por la presencia de 3 fases a lo largo de su evolución: proliferativa, de involución e involutiva. Existe unanimidad a la hora de indicar tratamiento para los HI en fase proliferativa en las siguientes situaciones: afectación de la visión o riesgo de afectarla, HI viscerales que comprometan la vida, HI de rápido crecimiento que distorsionen la anatomía y que previsiblemente se resolverán de forma parcial con secuelas, HI que afecten a la vía aérea y, finalmente, aquellos que causen fallo cardiaco congestivo1,2. En relación con los HI no complicados, el enfoque actual está experimentando un cambio hacia una actitud terapéutica más activa, si bien todavía persiste la postura de «esperar y ver» en muchos casos. Esta decisión puede estar justificada por el carácter benigno y la tendencia natural a la involución espontánea. Sin embargo, un porcentaje elevado de pacientes requerirá algún tipo de intervención al finalizar el periodo de involución, consecuencia de una regresión incompleta. La dificultad para predecir en cada caso particular la duración del periodo de involución, así como el grado que alcanzará, justifica adoptar una actitud activa en edades tempranas3.
El tratamiento en cada caso deberá establecerse de forma individualizada valorando el tamaño y la localización del HI, las complicaciones, la fase evolutiva, la afectación de otros órganos y los factores psicológicos. En este artículo se expone el tratamiento de los HI con ß-bloqueantes, un tratamiento novedoso con resultados muy prometedores. Es una realidad que el tratamiento con propranolol en los HI está resultando muy eficaz, por lo que las indicaciones se están ampliando. Una consecuencia de ello es la reducción del número de procedimientos quirúrgicos, que se limitan en la mayoría de los casos a eliminar o mejorar las secuelas de una involución incompleta.
¿Corticoides o ß-bloqueantes?Los corticoides orales han sido hasta ahora el tratamiento de elección en los HI complicados4. Muy probablemente se vean desplazados en el futuro inmediato por el tratamiento con ß-bloqueantes orales, ya que las complicaciones con este grupo de fármacos son escasas y los resultados globales mejores. Aunque en algunos protocolos los corticoides siguen siendo el primer fármaco utilizado, en la actualidad no hay apenas centros de referencia que así lo indiquen o que los antepongan al propranolol. En nuestro protocolo los ß-bloqueantes son el tratamiento de elección desde hace 2 años.
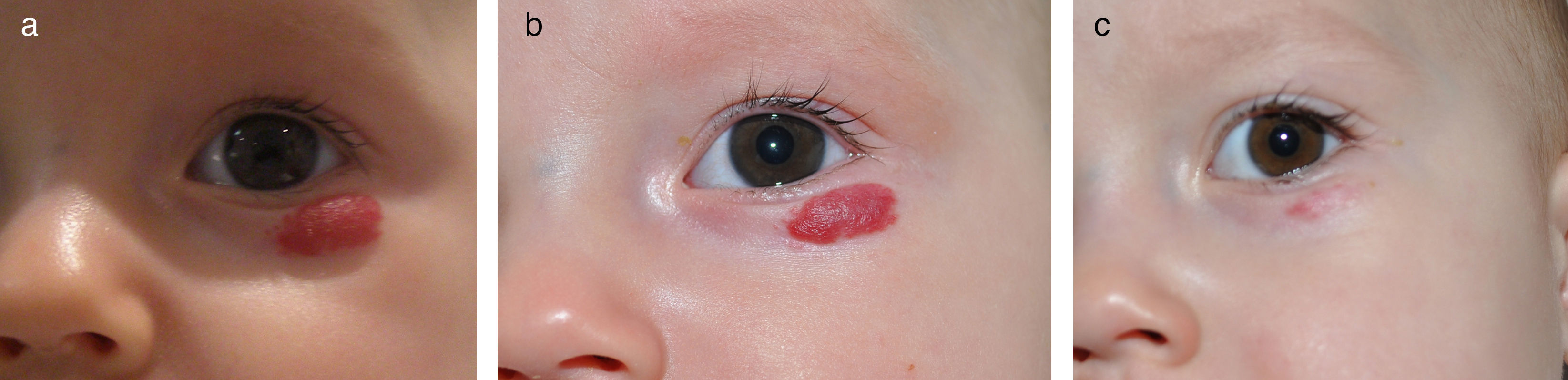
Con los datos clínicos y la experiencia acumulada hasta la fecha puede afirmarse que la respuesta al propranolol es superior a los corticoides orales en el caso de los HI de tipo segmentario, por lo que los recomendamos como primera alternativa (fig. 1). Para los HI focales (fig. 2) es posible que las diferencias sean más discretas por lo que en estos casos los corticoides se pueden considerar una alternativa, en concreto cuando se administran intralesionalmente. Los corticoides tópicos, como el propionato de clobetasol al 0,05%, han demostrado ser eficaces en los HI de pequeño tamaño y superficiales5. Parece por lo tanto más lógico y razonable indicar un tratamiento tópico con clobetasol en estas situaciones que propranolol por vía oral, aunque los ß-bloqueantes tópicos, como el timolol, pueden ser también una alternativa.
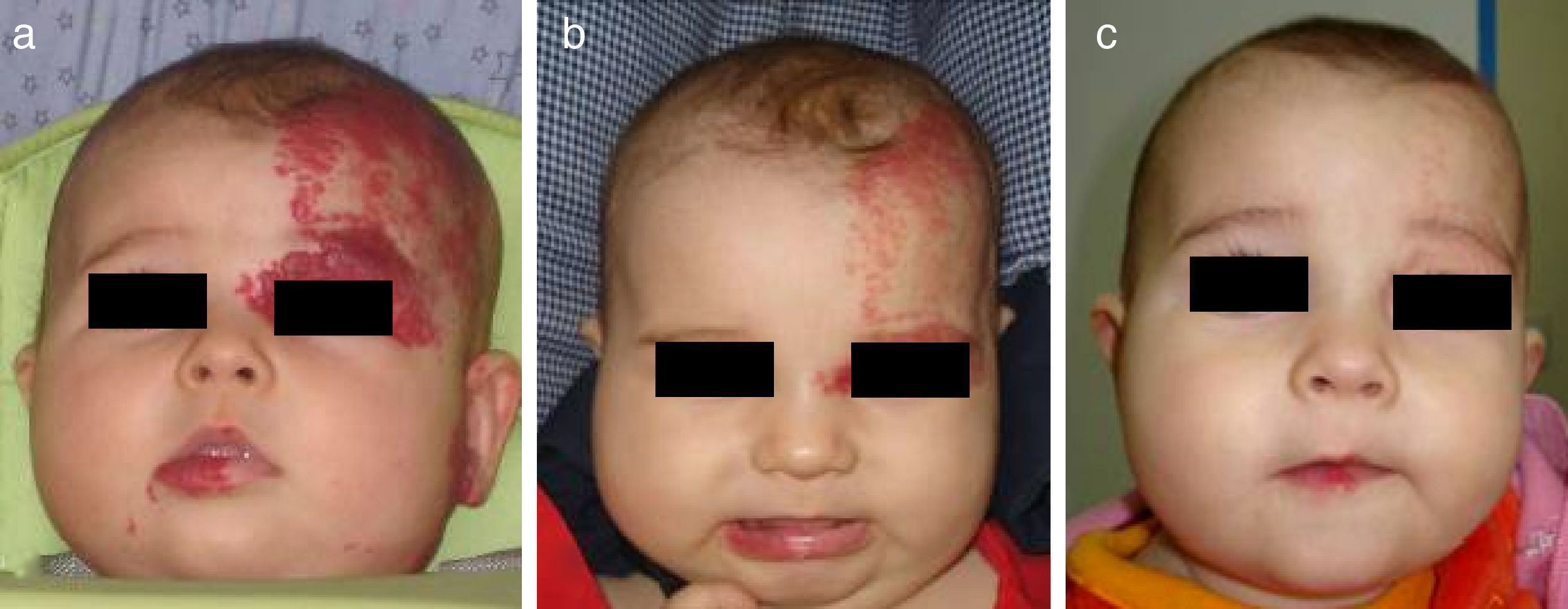
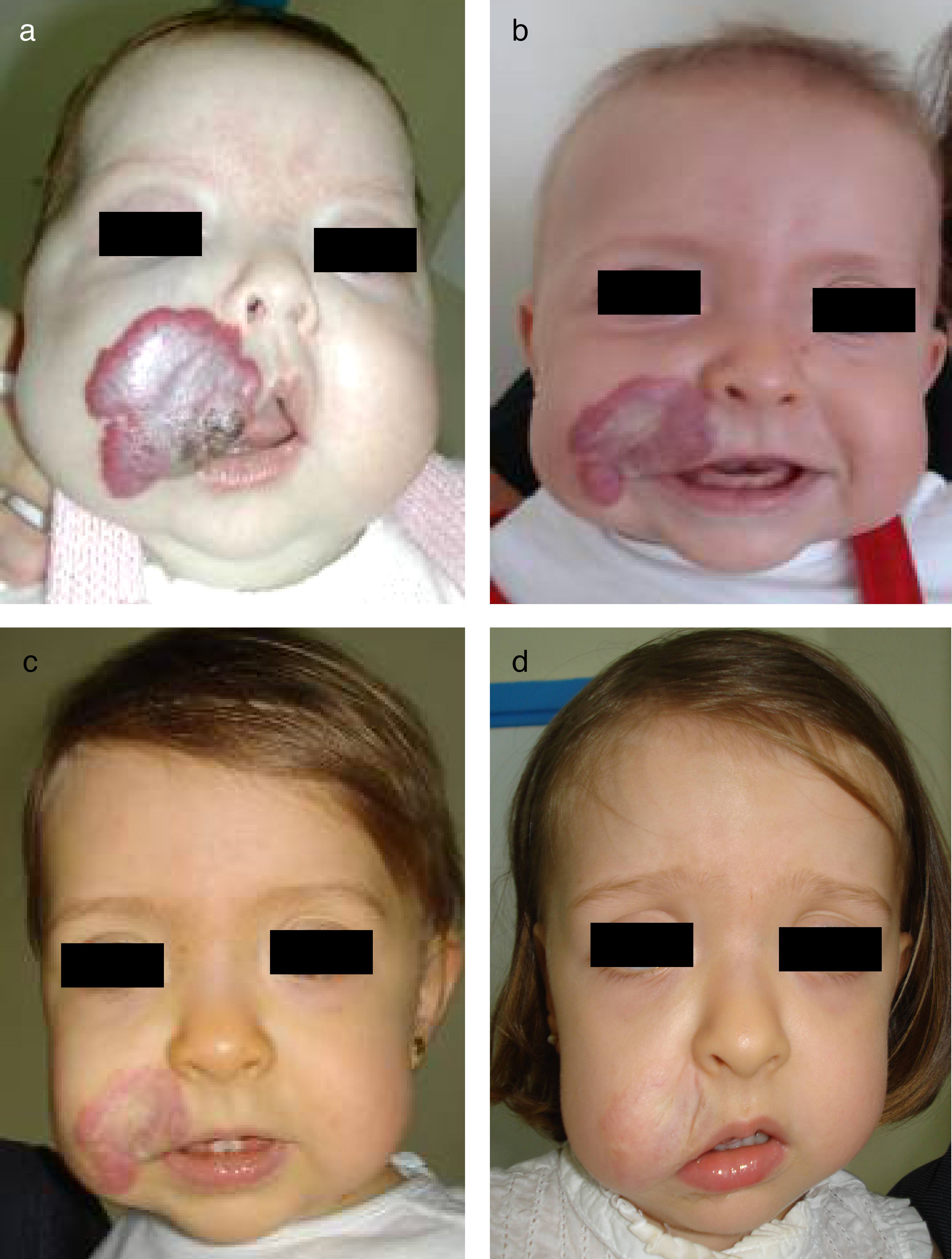
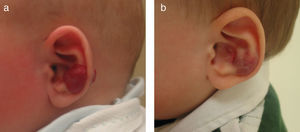
Hemangioma segmentario en niño de 3 meses de edad (a). La respuesta a los 3 meses de iniciar el tratamiento con propranolol a dosis de 2mg/kg/día es muy llamativa (b). A los 9 meses de tratamiento se suspende, apreciándose una desaparición prácticamente completa y sin secuelas de la lesión (c).
El hecho, reflejado en numerosas publicaciones, de que muchos pacientes con HI en tratamiento con corticoides no respondan y al cambiarles a propranolol sí lo hagan ha sido el hallazgo más revolucionario6. Al generalizarse en la actualidad la administración de ß-bloqueantes como tratamiento de primera línea será imposible determinar si dichos HI iban a responder a los corticoides. Actualmente hay 2 ensayos clínicos que aportarán información valiosa: en uno de ellos se comparan los corticoides orales y propranolol y en el otro corticoides con propranolol frente a corticoides más placebo (tabla 1)7. Los pacientes en tratamiento con corticoides orales en los que se añade propranolol y posteriormente, en pauta descendente, se eliminan los corticoides, responden de forma satisfactoria, de manera similar a los que reciben solo propranolol. Parece por tanto que la administración conjunta no tiene mucho sentido.
Estudios clínicos actuales con ß-bloqueantes para hemangiomas infantiles
| Título original | Objetivos del estudio y diseño |
| Double Blind, Randomised, Placebo-controlled Study of Propranolol in Infantile Capillary Hemangiomas | - Determinar la eficacia de 1 mes de tratamiento con propranolol (3 mg/kg/día x 15 días y 4 mg/kg/día x 15 días) en comparación con placebo, en niños menores de 4 meses que no requieren tratamiento |
| Propranolol Versus Prednisolone for Treatment of Symptomatic IH | - Propranolol oral 0,5 mg/kg, en 4 tomas al día, 4- 6 meses |
| Propranolol vs Prednisolone for IH-A Clinical and Molecular Study | - Prednisolona oral 1,0 mg/kg, en 2 tomas al día, 4-6 meses |
| Nadolol for Proliferating IH: A Prospective Open Label Study With a Historical Control | - Nadolol oral 0.5 mg/kg/día, dividido en 2 dosis. Se incrementa la dosis semanalmente, si la presión arterial y la frecuencia cardiaca es aceptable, 0,5 mg/kg/día hasta 2 mg/kg/día |
| Open-label, Uncontrolled Study of the Off Label Use of Propranolol for IH to Identify Side Effects | - Tratamiento inicial con propranolol 1 mg/kg/día y tras 24 h o más tarde, se incrementa si las 3 dosis previas se han tolerado bien sin bradicardia u otros efectos secundarios.- Tratamiento físico (crioterapia o láser) en 16 pacientes de forma paralela a propranolol en HI complicados- Propranolol 2 mg/kg/día, dividido en 3 dosis, con o sin terapia concomitante (cirugía, láser) |
| Topical Timolol 0.5% Solution for Proliferating IH: A Prospective Double Blinded Placebo Controlled Study | - Aplicación de timolol 0,5% tópico en solución acuosa, 2-3 gotas, 2 veces al día |
| A Comparative Study of the Use of ß Blocker and Oral Corticosteroid in the Treatment of Proliferative and Involuting Cutaneous IH | - Propranolol oral, 2 mg/kg/día, dividido en 2 dosis, 60 días- Prednisona oral, 2 mg/kg/día, en 2 dosis, 60 días |
| Corticosteroids With Placebo Versus Corticosteroids With Propranolol Treatment of IH | - Prednisolona oral, 1-2 mg/kg/días, 7 días y después se va reduciendo lentamente hasta suspenderla después de 3 semanas (2 meses en total de tratamiento) junto con dosis de placebo- Prednisolona oral, 1-2 mg/kg/día, 7 días y después se va reduciendo lentamente hasta suspenderla después de 3 semanas (2 meses en total de tratamiento) junto con propranolol oral, 2 mg/kg/día |
| Phase II/III Study in Infants With Proliferating IH Requiring Systemic Therapy to Compare 4 Regimens of Propranolol (1 or 3 mg/kg/Day for 3 or 6 Months) to Placebo (Double Blind) | Propranolol oral a dosis de 1 o 3 mg/kg/día durante 3 o 6 meses |
IH: hemangioma infantil.
Fuente: http://clinicaltrials.gov/7.
Otro aspecto interesante y novedoso es la respuesta al propranolol de HI que están en la fase de involución, a los 2 o 3 años de edad8–10. Este hecho marca otra diferencia clara con los corticoides, los cuales solo son eficaces en la fase proliferativa. Es cierto que, en general, la respuesta es menos llamativa y en algunos casos puede no observarse, pero, a la vista de la experiencia acumulada, un tratamiento de prueba de al menos 3 meses es razonable en muchos pacientes con involución incompleta o lenta.
ß-bloqueantesLos fármacos β-bloqueantes son antagonistas de los receptores β-adrenérgicos y bloquean estos receptores en diferentes órganos como el corazón, los vasos periféricos, los bronquios, el páncreas y el hígado. Algunos de ellos, como el oxprenolol, el pindolol, el acebutolol y el celiprolol, muestran actividad simpaticomimética intrínseca que se define como la capacidad para estimular y también para bloquear los receptores adrenérgicos, de forma que inducen menos bradicardia y menor frialdad de las extremidades. También se distinguen ß-bloqueantes cardioselectivos o no, hidrosolubles y liposolubles. Los hidrosolubles, como por ejemplo el atenolol, el celiprolol, el nadolol y el sotalol, al penetrar menos en el cerebro ocasionan menos alteraciones del sueño. Propranolol pertenece al grupo de los ß-bloqueantes no cardioselectivos.
Los β-bloqueantes que tienen una duración relativamente corta de sus efectos se administran 2 o 3 veces al día. Algunos β-bloqueantes, como el atenolol, el bisoprolol, el carvedilol y el nadolol solo requieren una toma diaria. Propranolol oral se absorbe completamente, alcanzando el pico máximo en plasma al cabo de 1 o 2h después de tomarlo en ayunas. El hígado retira hasta el 90% de la dosis oral con una vida media de eliminación de 3-6h. La pauta recomendada es de una toma cada 8h. Propranolol se distribuye de forma amplia y rápida por todo el cuerpo con concentraciones altas en pulmones, hígado, riñón, cerebro y corazón. Se une a proteínas el 80-95%.
Sus principales indicaciones son la hipertensión arterial, la angina de pecho, el infarto agudo de miocardio, determinadas arritmias, la insuficiencia cardiaca y la tirotoxicosis. También se emplean para aliviar la ansiedad, el glaucoma y en la profilaxis de la migraña. La indicación para el tratamiento de los HI no está aprobada en la ficha técnica del producto por lo que debe explicarse a los familiares, informándoles adecuadamente mediante un consentimiento informado que deben firmar.
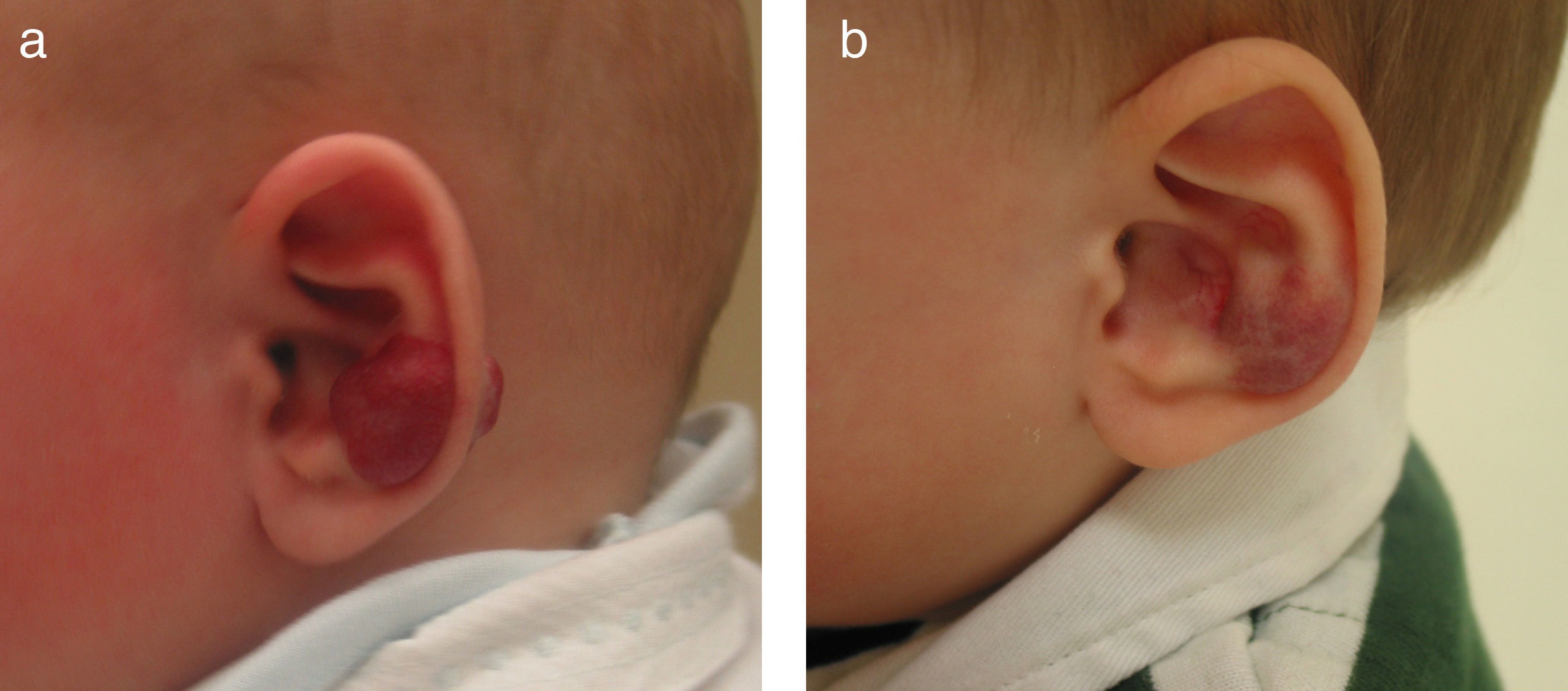
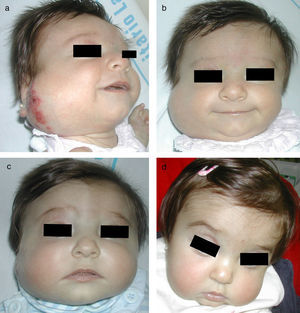
ß-bloqueantes y hemangiomas infantilesLos ß-bloqueantes orales –principalmente el propranolol– se consideran desde su primera publicación en el año 2008 una opción más en el tratamiento de los HI11 y en la mayoría de los centros, a pesar de no estar aprobado su uso para esta dermatosis, se indican como el tratamiento de elección. En la primera publicación se incluyeron 11 pacientes con respuesta clínica muy llamativa11. Estos resultados han ido confirmándose en posteriores series clínicas y en casos aislados publicados. Solo los HI parecen responder al propranolol (fig. 3). No responden los hemangiomas congénitos (NICH), ni el angioma en penacho (JCLG, observaciones no publicadas) ni lesiones vasculares de otro tipo como el granuloma piógeno que son Glut-1 negativos10.
Se desconoce el mecanismo último por el que actúan los ß-bloqueantes en los HI. Se han señalado 3 posibles vías de actuación12: a) por su efecto vasoconstrictor, visible clínicamente al observarse un cambio de la coloración; b) mediante la regulación de las vías implicadas en la expresión de genes angiogénicos, disminuyendo la expresión de factores proangiogénicos involucrados en el crecimiento de los HI como el VEGF y el bFGF, a través de una reducción de la vía proteincinasa RAF mitógeno-activada13, y c) por último, ocasionando una apoptosis de las células endoteliales14.
Datos recientes parecen indicar que los HI y la retinopatía del prematuro comparten mecanismos similares, en donde el factor VEFG podría desempeñar un papel determinante15. Por ejemplo, se ha señalado la posibilidad de utilizar ß-bloqueantes en el tratamiento de la retinopatía del prematuro16, basándose en estudios realizados en un modelo animal de retinopatía inducida por oxígeno en el que se ha observado que tras la aplicación tópica de timolol se consigue prevenirla en el 40% y mitigarla en el resto. Un mejor conocimiento de la patogenia de esta enfermedad y su respuesta a los ß-bloqueantes abre una nueva vía de investigación que contribuirá a conocer mejor el mecanismo de acción en los HI.
Efectos secundariosLos β-bloqueantes enlentecen la frecuencia cardiaca y deprimen el miocardio por lo que están contraindicados en el bloqueo cardiaco de segundo o tercer grado. Además, deben evitarse en la insuficiencia cardiaca progresiva e inestable, la bradicardia intensa, la hipotensión, la enfermedad del nódulo sinusal y el shock cardiogénico. Pueden desencadenar un episodio de asma por lo que se recomienda evitarlos en esta situación y si hay broncoespasmo. Pueden ocasionar hipotensión severa, bradicardia e insuficiencia cardiaca congestiva, además de trastornos digestivos, disnea, cefaleas, fatiga, alteraciones del sueño, como pesadillas o insomnio, parestesias, mareos, vértigos, psicosis y depresión mental, púrpura, trombocitopenia, alteraciones visuales, empeoramiento de la psoriasis y alopecia, fatiga y frialdad de las extremidades. Así mismo, pueden deteriorar la tolerancia a la glucosa e interferir la respuesta metabólica y vegetativa a la hipoglucemia. Otros efectos secundarios descritos, como consecuencia de la vasoconstricción periférica, son la claudicación intermitente y el fenómeno de Raynaud. Muchos de estos efectos secundarios se observan con menor frecuencia al usar fármacos selectivos ß1.
En líneas generales puede afirmarse que la administración de propranolol oral en la edad pediátrica es segura y se asocia a escasos efectos secundarios17. Es excepcional tener que suspender definitivamente el tratamiento a causa de ellos. Aunque se desconocen los efectos secundarios que pueden desarrollarse a largo plazo debe tenerse en cuenta que el uso de propranolol data de hace unos 50 años y hasta la fecha se ha demostrado que es un fármaco seguro, también en la edad pediátrica18,19. A este respecto, es llamativa la atención que se está prestando a los posibles efectos secundarios del propranolol en contraste con los corticoides orales. ¿Qué estudios previos pedíamos a los pacientes antes de iniciar la toma de corticoides? Tampoco se hacían chequeos del eje hipotálamo suprarrenal, ni se monitorizaba el sistema inmunitario ni se tomaba la presión arterial de forma sistemática. ¿Por qué se aconseja ahora ingresar a los niños, realizar un ecocardiograma previo y determinar la glucemia y la presión arterial al administrar propranolol? No cabe duda de que propranolol es menos tóxico (una paciente tratada en nuestro centro tomó durante 3 días por error una dosis 10 veces superior a la prescrita y solo tuvo hipotensión moderada); sin embargo, hay casos de fallecimiento de pacientes en tratamiento con corticoides, como el que ocurrió en nuestro centro por una meningitis por criptococo secundaria a la inmunodepresión que ocasionó 9 meses de terapia esteroidea en un HI segmentario (JCLG, observaciones no publicadas)20. Si esto ocurriera ahora con el propranolol probablemente sería tema de portada en alguna revista de alto impacto. Se ha llegado a plantear en un artículo reciente que pueda pasar con propranolol algo similar a lo que ocurrió con la utilización de interferón, fármaco apenas indicado en la actualidad por su relación con efectos neurológicos irreversibles graves21.
Hasta la fecha son escasas las publicaciones en las que se muestran efectos secundarios relevantes en pacientes con HI tratados con propranolol. Se han descrito 3 pacientes con hipoglucemia severa, en 2 de ellos además asociada a hipotermia22, bradicardia e hipoglucemia21 o solo hipoglucemia23. Otro paciente con múltiples hemangiomas hepáticos y cutáneos, sin afectación cerebral, desarrolló un episodio de epilepsia causada por hipoglucemia24. En relación con la hipoglucemia se conoce que su incidencia es mayor en el periodo neonatal por lo que en este grupo de edad se debe vigilar más. Su aparición no parece que sea un efecto dependiente de la dosis, ya que se ha descrito en pacientes que toman dosis bajas (1-2mg/kg/día)22. Tampoco parece que sea una complicación relacionada con el inicio del tratamiento ya que se ha detectado en pacientes que llevaban hasta 9 meses de tratamiento. Aunque se ha indicado que esta complicación puede estar relacionada con la presencia de largos periodos de ayuno tampoco está claro: hay casos descritos con síntomas tras solo 2-3h después de haber comido. Por tanto, aunque se recomienda evitar periodos de ayuno prolongados tampoco una alimentación frecuente evitaría esta complicación. Tampoco parece que la evite comenzar con dosis crecientes o dividir la dosis total de propranolol en 2 o 3 tomas al día. Ante estos datos cabe plantearse si realmente tiene sentido monitorizar estrechamente a los niños y llegar incluso a ingresarlos 48h como se recomienda en algunos protocolos. Parece más lógico educar a los padres para que reconozcan tanto los síntomas iniciales asociados a la hipoglucemia como sudoración, temblor, taquicardia y hambre, así como las manifestaciones tardías como estupor, letargia, apneas, epilepsias, alimentación pobre, pérdida de conciencia e hipotermia.
Dentro de los efectos secundarios digestivos descritos se encuentra la diarrea y el reflujo. Hasta la fecha se ha descrito únicamente la presencia de diarrea en una serie corta de 3 pacientes con HI tratados con una dosis de 1mg/kg/día, 2 veces al día25, y en otros 3 pacientes de una serie de 17 con HI perioculares9. La aparición de diarrea también puede ser secundaria al excipiente de determinados preparados con propranolol en suspensión que llevan maltitol, como ocurre por ejemplo con Syprol®, fármaco comercializado en Reino Unido25. El desarrollo de reacciones alérgicas es poco frecuente y podría estar relacionado con compuestos presentes en el excipiente. La presencia de reflujo se ha descrito hasta en un 10% de los casos en una serie de 30 pacientes26. Otro efecto que pueden referir los padres es la frialdad de manos y pies. Más preocupante puede ser la posibilidad de desarrollarse hiperpotasemia con el tratamiento, tal y como se ha descrito recientemente en una paciente de 4 meses de edad, con un HI en la pared abdominal27. Se ha indicado que dicha elevación sea consecuencia de una lisis masiva de las células del HI y motivada también por la dificultad de las células de incorporar potasio por el efecto ß-bloqueante27.
Otro efecto descrito es el desarrollo de caries en los incisivos tras la administración de propranolol en un paciente de 10 meses de edad con un HI en el labio, complicación que puede ser debida al excipiente del preparado –que llevaba sucrosa–, o bien a la disminución de la salivación, consecuencia del efecto antagonista adrenérgico del propranolol28. Finalmente se puede detectar somnolencia hasta en un 27% de los pacientes, según se constata en una serie de 30 pacientes26.
Hay numerosas publicaciones que muestran la seguridad de propranolol en la edad infantil, sin que se hayan constatado casos de muertes o complicaciones graves29, incluso en prematuros tratados por otras causas30,31. Tampoco hay hasta la fecha ninguna complicación grave en niños con HI tratados con β-bloqueantes por lo que puede afirmarse que es un fármaco seguro.
¿Cuál es la dosis y tiempo adecuado de tratamiento?La dosis indicada de propranolol varía según las series siendo lo más habitual una pauta de 1-3mg/kg/día, repartida 3 veces al día6,32. Solo hemos encontrado un artículo en el que tratan a 2 pacientes con propranolol en dosis crecientes de hasta 2mg/kg/día, repartido cada 12h, sin asociarse a ningún efecto adverso como hipoglucemia33. La forma de administración habitual es la vía oral; como no está todavía comercializado se indica en fórmula magistral en solución-jarabe. Solo hemos encontrado un artículo en el que los 5 primeros días de tratamiento se había administrado por vía intravenosa34. No hay un protocolo definido en relación con la dosificación, tiempo de administración ni monitorización. En nuestra experiencia no hemos visto diferencias en la respuesta clínica cuando se usan dosis de 2 o 3mg/kg/día por lo que iniciamos el tratamiento con una dosis de 2mg/kg/día, repartido en 3 tomas y mantenemos la misma dosis si se objetiva una respuesta clínica. En vista de la experiencia acumulada no parece que haya diferencias ni mayor tasa de efectos secundarios si se administra desde el principio la dosis de 2mg/kg o si se hace en pauta ascendente.
En algunos casos al suspender el tratamiento, si aún está el HI en fase proliferativa, se puede producir un recrecimiento35. En estos casos se puede reintroducir de nuevo la medicación y habitualmente se vuelve a producir una mejoría clínica36. En general se recomienda mantener la medicación hasta que finalice la fase proliferativa o hasta los 12 meses de edad32. De todas formas propranolol no parece que elimine por completo los HI: es frecuente ver áreas con telangiectasias tras su finalización las cuales pueden eliminarse posteriormente con el láser de colorante pulsado (fig. 4). La experiencia a este respecto con otros ß-bloqueantes como acebutolol o nadolol es más limitada37. Según la respuesta clínica en nuestro protocolo se mantiene la medicación hasta los 8-10 meses o más tiempo si sigue observándose respuesta.
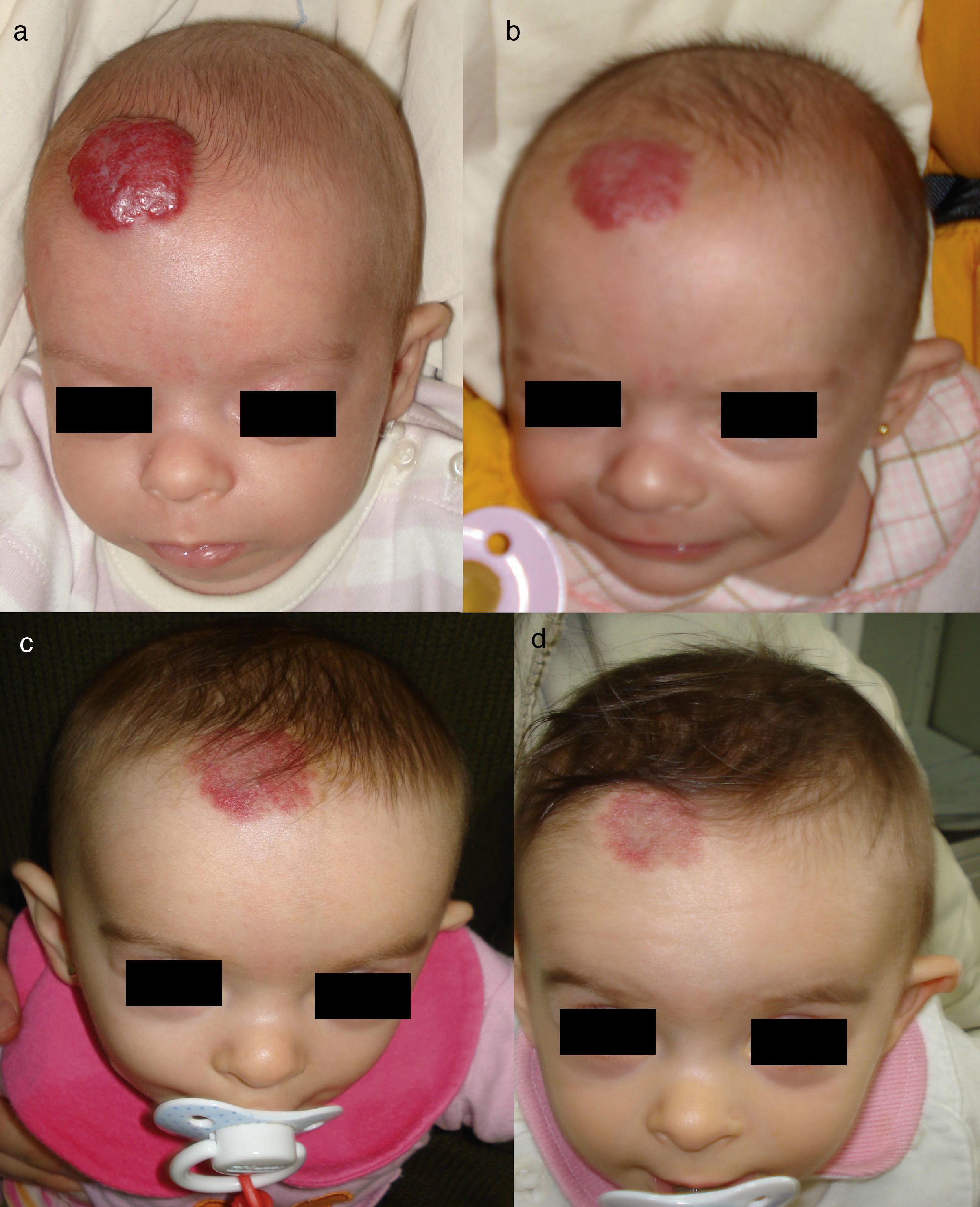
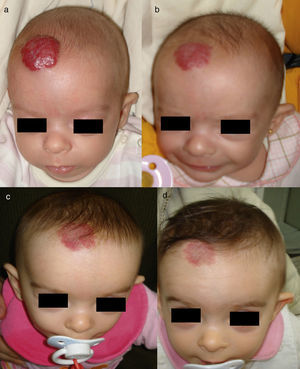
Niño de 7 semanas con un HI en el cuero cabelludo (a). A los 2 y 4 meses de tratamiento con 2mg/kg/día de propranolol se puede apreciar una mejoría sustancial, con aplanamiento de la lesión (b y c). La eliminación del HI no es completa: con frecuencia persisten placas con telangiectasias (d) que pueden ser eliminadas posteriormente con láser.
Es conocido que la retirada brusca de propranolol en la angina de pecho puede desencadenar o agravar la angina y las arritmias cardiacas, así como provocar un infarto agudo de miocardio. En el caso de los HI no parece que sea necesario, aunque en algunos centros así lo indican, reducir la dosis de propranolol de forma paulatina antes de suspenderlo6,34. En teoría, reduciendo paulatinamente la dosis se puede minimizar el riesgo de ocasionar una respuesta hiperadrenérgica. Algunos autores proponen disminuir a la mitad la dosis durante 2 semanas y de nuevo dar otras 2 semanas más la mitad de esta última dosis y suspenderlo de manera definitiva6. Aunque en la práctica diaria se suspende de forma brusca el tratamiento, sin detectar ninguna anomalía, parece lógico aconsejar la reducción paulatina para detectar un posible recrecimiento del HI y para evitar los potenciales efectos secundarios desconocidos hasta la fecha. Además la aparición del efecto rebote es más paulatina y permite tomar la decisión de reinstaurar el tratamiento con más tiempo.
MonitorizaciónNo existe consenso sobre cómo monitorizar a los pacientes en tratamiento con propranolol ni siquiera sobre si realmente es necesario hacerlo. Hay unanimidad a la hora de realizar una evaluación previa con un cardiólogo pediátrico que incluya un electrocardiograma, y medición de la presión arterial y de la frecuencia cardiaca. En algunos protocolos se incluye también la realización de un ecocardiograma pero en nuestra opinión no es necesario si el estudio previo es normal. Aunque en algunos centros se ingresa a los pacientes las primeras 24-48h de tratamiento para un mejor control, para medir la glucemia, la presión arterial y la frecuencia cardiaca17, no se ha demostrado su necesidad real y nos parece, al igual que a otros autores, una medida innecesaria38. En nuestro protocolo recomendamos determinar de forma ambulatoria los valores de glucemia, la presión arterial y la frecuencia cardiaca 48h después de iniciar el tratamiento y, posteriormente, la presión arterial y frecuencia cardiaca cada semana durante el primer mes y después mensualmente. No es necesario realizar determinaciones periódicas de glucemia. Como se ha mencionado previamente tiene más sentido educar a los padres para que reconozcan los síntomas asociados a una hipoglucemia.
¿Propranolol u otro ß-bloqueante?El propranolol es un ß-bloqueante no cardioselectivo. Hasta la fecha es el ß-bloqueante que más se ha empleado en el tratamiento de los HI. Hay escasas publicaciones con otros ß-bloqueantes como el nadolol o el acebutolol en los que se han observado resultados similares37,39. No hay estudios comparativos entre diferentes ß-bloqueantes para decantarnos por uno u otro.
En la serie de Blanchet et al que incluye 3 pacientes con HI subglóticos tratados con acebutolol se observa respuesta en 2 de ellos. Acebutolol al ser un ß-bloqueante ß1 selectivo tiene hipotéticamente menos efectos secundarios que el propranolol. Además, su administración es más cómoda ya que se divide la dosis cada 12h. Se recomienda una dosis inicial de 2mg/kg/día y aumentarla paulatinamente hasta 8-10mg/kg/día37. Acebutolol está comercializado en Francia con el nombre de Sectral® en solución de 40mg/ml y hay experiencia en la edad pediátrica para el tratamiento de las arritmias y la hipertensión infantil. Por otra parte, el tratamiento con nadolol (Solgol®), en dosis similares al propranolol, también es eficaz como hemos podido constatar clínicamente en más de 20 pacientes tratados (JCLG, observaciones no publicadas). Dado que la experiencia clínica acumulada con propranolol es mayor parece lógico continuar usando este ß-bloqueante hasta que no dispongamos de más estudios.
Tratamiento tópico con ß-bloqueantesBasándose en la buena respuesta al propranolol oral cabría preguntarse si su aplicación tópica es eficaz para los casos de HI de pequeño tamaño, de tipo superficial. La primera publicación recoge una serie de 6 pacientes con hemangiomas superficiales tratados con propranolol tópico, con una respuesta buena40. Posteriormente se han publicado casos aislados, como el de una niña de 4 meses de edad con un HI en la región periorbitaria que ocasionaba blefaroptosis y una oclusión de la pupila casi completa. Tras la aplicación de maleato de timolol al 0,5% en solución, 2 veces al día, durante 5 semanas se observó una mejoría sustancial tanto del tamaño como del grosor y color de la lesión41. En otro estudio se recoge una serie de 5 pacientes tratados con timolol gel en la que en uno de los pacientes presentó una respuesta llamativa y en los otros cuatro una mejoría parcial, sin ningún efecto secundario local o sistémico42. Recientemente se ha publicado otro caso de un HI en un paciente con síndrome de PHACE con una respuesta muy buena tras la aplicación de timolol en loción43.
Actualmente hay en marcha un ensayo clínico prospectivo, doble ciego, que compara timolol al 0,5% solución versus placebo, que sin duda alguna aportará más información7. En nuestra experiencia los resultados observados en un número limitado de casos no han sido constantes: algunos pacientes han mejorado de forma significativa (fig. 5) pero en otros apenas se detectan cambios. En España está comercializado para uso oftalmológico timolol en gel al 0,1% y en colirio al 0,5%. La indicación de tratamiento con β-bloqueantes tópicos puede plantearse como alternativa para los HI no complicados superficiales y de pequeño tamaño, al igual que otros fármacos como imiquimod o los corticoides5,44.
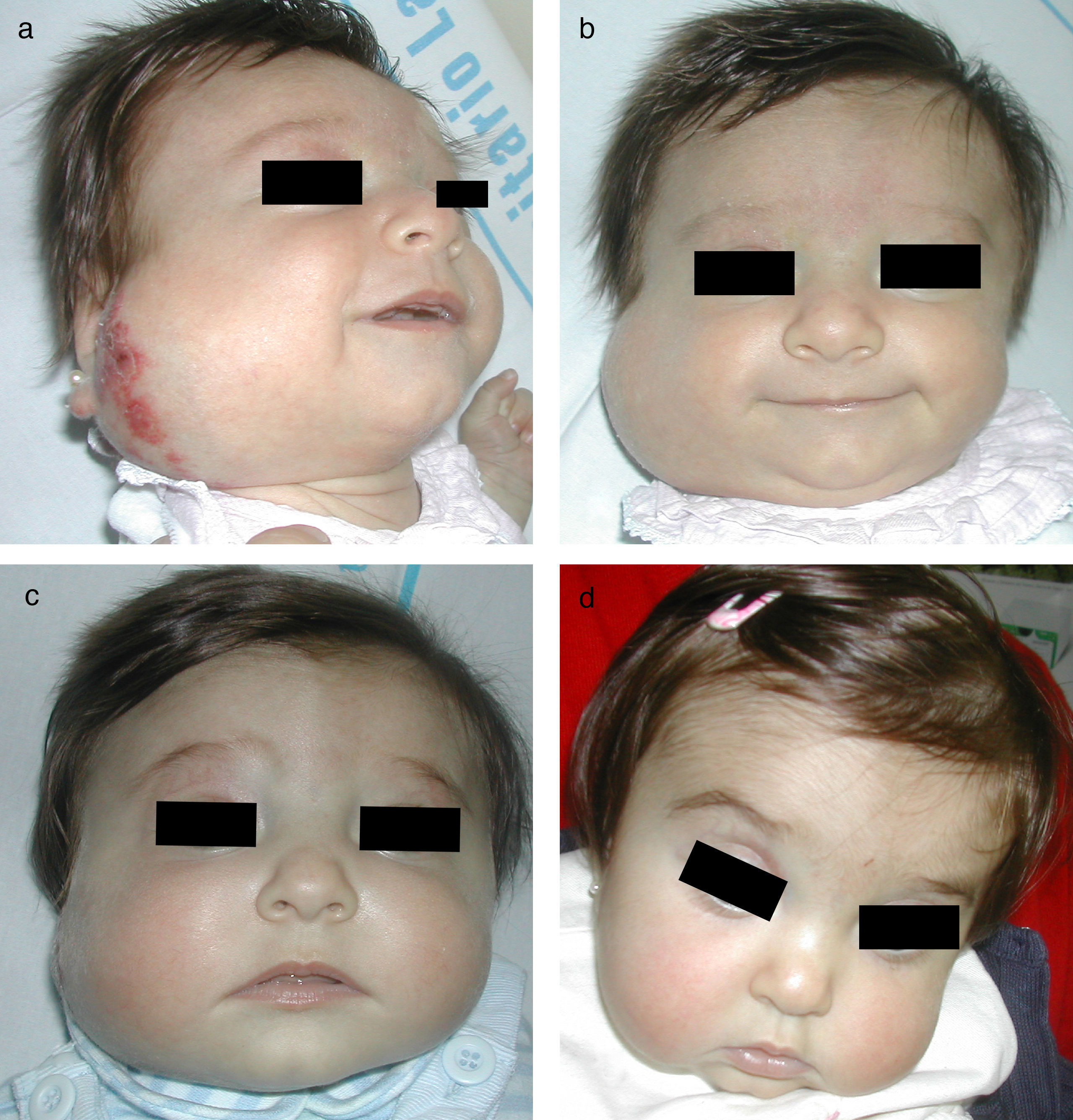
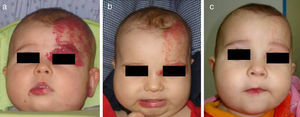
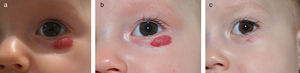
Hemangioma en párpado inferior, de tipo superficial, en una niña de 4 meses y medio de edad (a). Se indica tratamiento tópico con timolol al 0,5%, 2 veces al día. La respuesta clínica empieza a observarse a las 2 semanas (b) y es muy evidente a los 6 meses, observándose la desaparición casi completa del hemangioma (c).
La ulceración es la complicación más frecuente en los HI, afectando a entre el 5 y el 16% de los casos1,45. La curación espontánea puede producirse después de varios meses, por lo que es necesario tomar una actitud terapéutica activa. Además del tratamiento con corticoides orales se ha demostrado que el láser de colorante pulsado es eficaz46,47. También hay casos descritos con buena respuesta tras la aplicación de imiquimod48 y becaplermin49.
La administración oral de propranolol también se ha demostrado eficaz en casos de HI ulcerados6,36,50,51, aunque no todos ellos responden o incluso empeoran6,52 (fig. 6). En una serie de 30 pacientes con HI ulcerados, en 10 de ellos se observó que las úlceras de pequeño tamaño respondían bien pero si estas eran profundas la respuesta era más limitada6. En otro estudio reciente que recoge una serie de 33 pacientes con HI ulcerados se ha observado un tiempo medio de curación de la úlcera de 4,3 semanas en 30 de ellos53.
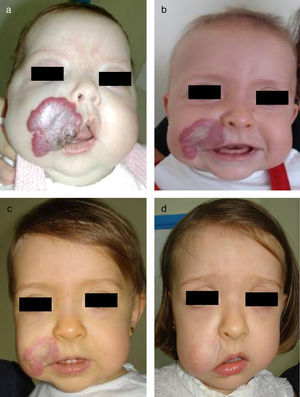
Niña de 2 meses de edad con HI en parótida, mejilla y labio, con ulceración asociada (a). La respuesta clínica es muy satisfactoria con propranolol 2mg/Kg/día al mes y a los 3 meses de tratamiento (b y c). Tras finalizar el tratamiento, después de 9 meses, se puede ver tejido redundante, piel de aspecto atrófico y leve deformidad de la anatomía facial, subsidiaria de tratamiento quirúrgico y láser (d).
Los HI en la región periorbitaria son una de las indicaciones más claras de tratamiento precoz. Dos semanas con la visión afectada pueden ser suficientes para causar un daño irreversible. Hasta ahora el tratamiento de elección eran los corticoides orales o intralesionales. La posibilidad de producirse tras la inyección una embolización del material54 y ocluir la arteria retiniana con el desarrollo posterior de ceguera ha originado una reacción contraria a esta práctica.
Propranolol puede ser una buena alternativa para HI en esta localización (fig. 7). En la mayoría de los artículos se menciona la rapidez de su acción, objetivándose cambios notables en el tamaño en las primeras 48-72h de iniciarlo55,56. En una serie de 17 pacientes con HI perioculares se ha constatado una reducción del tamaño del HI tras solo un mes de tratamiento en el 82% de los pacientes9. Aunque no se especifica en la publicación se intuye que la respuesta no fue diferente en función de si el HI era de tipo focal, segmentario o indeterminado9. En otra serie de 10 pacientes, tratados con 2mg/kg/día de propranolol, se observa una respuesta clínica en todos ellos. Además, la ambliopía presente en 5 de los pacientes mejoró sustancialmente en 3 de ellos56. En otra serie corta de 4 pacientes observan respuesta clínica en todos ellos, sin ningún efecto secundario, comenzando con dosis bajas de 0,1-0,25mg/kg/día hasta alcanzar 2mg/kg/día8, incluso en uno de los pacientes que comenzó con el tratamiento a la edad de 2 años y 5 meses8.
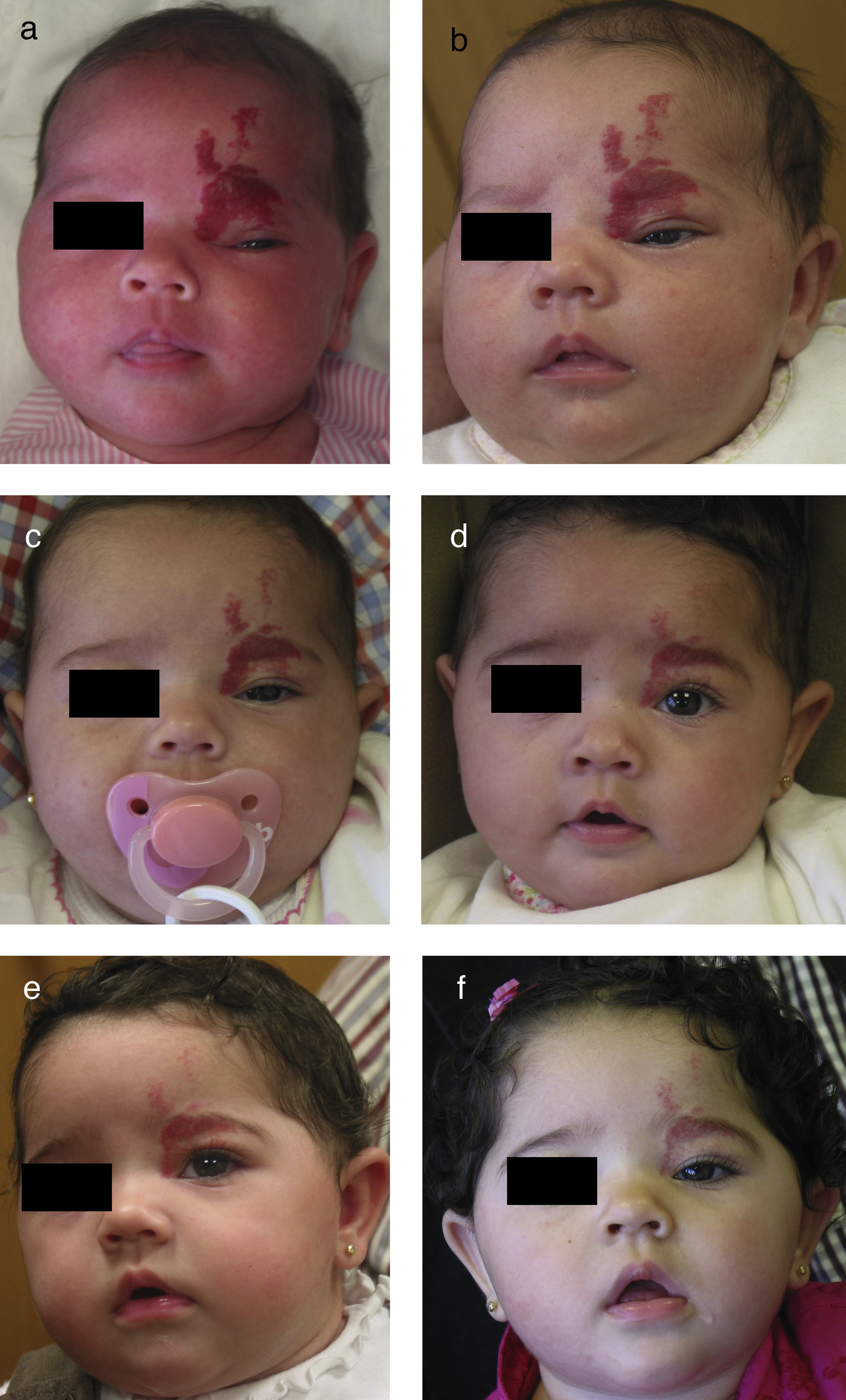
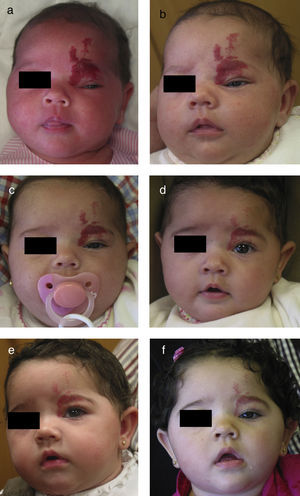
Niña de 6 semanas de edad con HI de rápido crecimiento, de tipo segmentario, localizado en frente y párpado, con ptosis marcada progresiva. En la resonancia magnética se apreciaba una desviación de todo el globo ocular debido a la afectación retrobulbar. Se inicia tratamiento con propranolol oral en dosis de 2mg/kg/día (a). La mejoría clínica puede verse ya en las primeras 72h (b). La evolución es muy satisfactoria en los meses siguientes: mes y medio (c), 3 meses (d), 4 meses (e) y 6 meses de tratamiento (f).
Los HI localizados en la región cervicofacial pueden asociarse a una afectación simultánea de la vía aérea superior en donde el HI suele ser superficial, unilateral y de localización subglótica57. Los corticoides han sido hasta la fecha el tratamiento de elección si bien en un porcentaje elevado de casos es necesaria una traqueotomía (40%). También se puede usar el láser de CO258.
Existen varias publicaciones que muestran la eficacia de propranolol en HI localizados en la vía aérea, la mayoría de ellos subglóticos. Una vez más, en muchos centros se está indicando como tratamiento de elección59–61. En una serie de 14 pacientes se observa una mejoría clínica en todos los casos, apreciándose un porcentaje de obstrucción de la vía aérea de tan solo el 22% y del 12% tras 2 y 4 semanas de tratamiento, respectivamente39.
Aunque los casos comunicados son aislados debe tenerse en cuenta que es posible la aparición de resistencias al propranolol. En la serie de Leboulanger et al se incluye un paciente que dejó de responder tras un mes de tratamiento y reintroducción más tardía de la medicación39. También se ha descrito otro caso en un paciente con una obstrucción inicial del 95% de la vía aérea que, tras observarse a las 2 semanas de tratamiento una reducción del 50%, comenzó de nuevo varios meses después con síntomas y una obstrucción del 80% a pesar de seguir tomando 2mg/kg/día62. Aunque se aumentó la dosis no mejoró ninguno de los pacientes.
La mayoría de los pacientes publicados con HI de la vía aérea están en tratamiento concomitante con corticoides10. En un artículo reciente se incluyen 2 pacientes que reciben solamente y desde el principio propranolol, observándose mejoría muy llamativa33. No parece necesario combinar ambas medicaciones.
Destacamos finalmente el caso de otro paciente de 12 meses que precisó por un procedimiento quirúrgico cardiaco la toma de ß-miméticos. Llevaba 6 meses antes en tratamiento con propranolol, con buena respuesta, por lo que estaba ya con una dosis baja y en pauta descendente antes de la cirugía (0,5mg/kg/día). Tras la intervención no se pudo desentubar, requiriendo finalmente una traqueotomía. Al examinar la vía aérea se observó una estenosis de un 95%. Al incrementar de nuevo la dosis de propranolol a 2mg/kg la obstrucción, al cabo de un mes, era de nuevo de tan solo un 5%37.
Hay también casos descritos con buena respuesta tras la toma de acebutolol, sin efectos secundarios asociados37,39. Dos de los 3 pacientes descritos en una serie respondieron satisfactoriamente a una dosis inicial de 2mg/kg/día repartido en 2 tomas, alcanzando la dosis de 10mg/kg/día37.
Hemangiomatosis y hemangiomas visceralesLa presencia de múltiples HI diseminados por toda la superficie corporal se conoce con el término hemangiomatosis. Cuando hay lesiones viscerales el órgano más frecuentemente afectado es el hígado. Los pacientes con HI hepáticos asociados a múltiples lesiones cutáneas tienen un riesgo alto de desarrollar insuficiencia cardiaca63 por lo que deben controlarse periódicamente e instaurar tratamiento solo cuando se produzca alguna complicación. La respuesta satisfactoria observada en algunos pacientes tras la toma de propranolol, con desaparición completa de las lesiones en muchos casos y resolución del fallo cardiaco e hipotiroidismo asociado, sin duda alguna va a cambiar afortunadamente el pronóstico64. También se han publicado casos con hemangiomas hepáticos difusos sin respuesta previa a corticoides, vincristina, interferón y ciclofosfamida en los que la respuesta a propranolol resultó definitiva y además de forma muy rápida65,66. Finalmente, se han descrito casos aislados con HI en mediastino y subglóticos tratados con propranolol en los que, gracias a esta medicación, se ha conseguido evitar un desenlace fatal67.
Propranolol en pacientes con síndrome PHACESPara el diagnóstico del síndrome PHACES (malformación en la fosa Posterior del cerebro, Hemangiomas de gran tamaño localizados en la región facial, anomalías Arteriales, Cardiacas, oculares [Eye] y del eSternón o línea media)68,69 no es necesario que estén presentes todas las manifestaciones. Se calcula que el 70% de los casos presenta únicamente una de las manifestaciones extracutáneas. Dentro de las alteraciones cerebrales se ha descrito la malformación de Dandy-Walker y anomalías arteriales como las dilataciones aneurismáticas y la presencia de ramas anormales de la arteria carótida interna68. Las alteraciones cardiacas y anomalías de la aorta, como la coartación de aorta, pueden estar presentes en un tercio de los casos70.
Existe cierta controversia acerca de si la administración de propranolol en pacientes con síndrome de PHACES puede ocasionar alguna complicación potencialmente peligrosa como por ejemplo infartos cerebrales. La toma de propranolol no está contraindicada en pacientes con estenosis vasculares, pero los pacientes con PHACES con este tratamiento y que tengan anomalías arteriales que ocasionen un aporte sanguíneo deficiente podrían hipotéticamente tener complicaciones graves, como episodios de isquemia cerebral, como consecuencia de una hipotensión o bradicardia secundarias al efecto bloqueante ß-adrenérgico6,71. Esta complicación no se ha descrito hasta la fecha si bien es cierto que el número de pacientes tratados con dicho síndrome es limitado39,72. A este respecto es muy interesante el estudio realizado sobre la perfusión cerebral mediante tomografía de emisión por fotón único (SPECT; single photon emission computed tomography), técnica que ya ha demostrado ser útil en enfermedades neurovasculares como el síndrome de Sturge-Weber, en 7 niños con síndrome de PHACES en tratamiento con 2mg/kg/día de propranolol. Dicho estudio se realizó tras 3 o 6 meses de tratamiento, observándose una captación normal en las regiones frontal y temporal a pesar de las anomalías halladas previamente con angio-RM. Además, todos los pacientes tuvieron una mejoría significativa de los síntomas y disminución del volumen del HI73. En otro artículo se recoge el caso de un paciente con PHACES con coartación aórtica y ausencia de la arteria vertebral derecha que respondió favorablemente al tratamiento6. En conclusión, en todo paciente en el que se sospeche síndrome de PHACES se le aconseja antes de iniciar tratamiento con propranolol realizar un estudio cardiológico y pruebas de neuroimagen para confirmar el diagnóstico. A la vista de la experiencia actual no hay indicios para pensar que la tasa de ictus en pacientes con síndrome de PHACES esté relacionada con el tratamiento elegido, sino más bien con el grado de afectación cerebrovascular. De hecho, los corticoides y el interferón se utilizaron indiscriminadamente en pacientes con PHACES aun teniendo en cuenta el efecto antiangiogénico de estos fármacos tanto sobre el HI como en la región cerebral, no registrándose una mayor incidencia de accidentes cerebrovasculares.
ConclusionesLos ß-boqueantes muy probablemente serán en el futuro inmediato el tratamiento de elección de los HI. Hay todavía muchas cuestiones controvertidas, como por ejemplo la dosis óptima, el tipo de ß-bloqueante más eficaz o la monitorización necesaria durante el tratamiento, entre otras. Hasta que no tengamos más información derivada de la experiencia clínica y de los ensayos clínicos hemos de ser especialmente cautos a la hora de establecer las indicaciones de tratamiento. Seguramente, debido a las excelentes respuestas obtenidas hasta el momento, las indicaciones se irán ampliando cada vez más. Es necesario advertir a los padres, con un consentimiento informado, que esta medicación no tiene la aprobación para su uso en HI, hecho que conviene recordar que también ocurre con los corticoides orales. Aunque se han descrito efectos secundarios aislados, se puede afirmar que es un tratamiento seguro en la edad pediátrica. En este sentido siguen apareciendo publicaciones con series cada vez más amplias que confirman la ausencia de efectos secundarios con esta medicación74, incluso en recién nacidos de bajo peso75. Hasta que no haya más datos derivados de los ensayos clínicos en marcha el modo de monitorizar a estos pacientes puede variar entre las diferentes instituciones. En nuestra opinión un seguimiento ambulatorio por su pediatra parece lo más razonable. También aconsejamos remitir a los pacientes a unidades especializadas en anomalías vasculares para confirmar el diagnóstico y establecer la indicación del tratamiento, así como para la realización de un mejor seguimiento y tratamiento completo, ya que algunos pacientes pueden necesitar también procedimientos terapéuticos complementarios con láser o cirugía.
Conflicto de interesesEl Dr. Juan Carlos López Gutiérrez es investigador principal del ensayo V00400SB201 aleatorizado, controlado, multidosis, multicéntrico de fase adaptativa II/III en niños con hemangioma que requieran terapia sistémica con propranolol financiado por Pierre Fabre.
Responsabilidades éticasConfidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio. Ninguno de los niños con imágenes mostradas en este artículo ha participado en dicho ensayo.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.