El dermatofibrosarcoma protuberans es un tumor fibrohistiocitario de grado intermedio de malignidad, muy infrecuente en la infancia, con tan solo un 6% de estos tumores diagnosticados en la edad pediátrica. El diagnóstico clínico en los estadios iniciales es muy difícil, pero es necesario realizarlo lo más precozmente posible, así como excluir otros procesos benignos que son más frecuentes en la infancia para asegurar un tratamiento correcto.
Tanto la presentación clínica como la histopatología y las anomalías moleculares en los niños son similares a las que encontramos en los adultos. Sin embargo, el diagnóstico inicial es más difícil y requiere un alto índice de sospecha por parte del dermatólogo. La ausencia de rasgos característicos, junto a la rareza de este cuadro, conducen en muchas ocasiones a un retraso en el diagnóstico. Es muy importante realizar una extirpación quirúrgica completa del tumor para reducir el riesgo de recidiva.
Este artículo proporciona una revisión de los actuales conocimientos y opciones terapéuticas más novedosas en el manejo del dermatofibrosarcoma protuberans infantil.
Dermatofibrosarcoma protuberans (DFSP) is a fibrohistiocytic tumor of intermediate malignancy that is very rare in childhood. Only 6% of these tumors present in children. Clinical diagnosis is very difficult in the early stages of disease, but to ensure appropriate treatment it is important to identify DFSP as early as possible and rule out benign conditions that are more common at this age.
The clinical presentation and histopathologic and molecular characteristics of DFSP are similar in children and adults. Clinical diagnosis is, however, more difficult in children and requires a high degree of suspicion. The absence of characteristic features and the rarity of this tumor explain why diagnosis is often delayed. Complete surgical excision of the tumor is very important to reduce the risk of recurrence.
This article presents a review of current knowledge about the management of DFSP in children and examines the latest treatment options.
El dermatofibrosarcoma protuberans (DFSP) es un sarcoma de partes blandas de grado intermedio de malignidad, descrito por Darier y Ferrand en 19241. Se caracteriza por un alto índice de recidivas locales y una baja capacidad metastásica.
Es un tumor bastante infrecuente y representa aproximadamente un 4% de todos los sarcomas de tejidos blandos2, con una prevalencia de 0,1% de todos los tumores malignos cutáneos en los adultos3,4. En los niños la incidencia es desconocida, pero parece menor que en los adultos y requiere un alto grado de sospecha clínica5,6.
La presentación clínica, las características histopatológicas e inmunohistoquímicas y las anomalías moleculares del DFSP en la infancia son similares a las observadas en los adultos, así como la traslocación entre los cromosomas 17 y 22 y su asociación con el producto de fusión COL1A1-PDGFB7,8. Sin embargo, la localización del tumor varía en la población infantil, con una mayor afectación de las extremidades inferiores y las zonas acras7.
En la población pediátrica el diagnóstico clínico resulta mucho más difícil, lo que lleva a importantes retrasos en su tratamiento. Intentaremos en este artículo realizar una extensa revisión de la literatura en relación con el DFSP en este grupo de edad.
EpidemiologíaEn la edad pediátrica se ha descrito una mayor incidencia de este tumor en las niñas5,9 o con idéntica proporción en ambos sexos, según diversas publicaciones7, siendo más frecuente en la raza negra4,10,11. En series largas de pacientes se ha establecido una incidencia de 0,8-5 casos anuales por millón de habitantes4,12,13.
El DFSP aparece con mayor frecuencia entre los 20 y los 50 años de edad, y su presentación en la infancia es excepcional, con tan solo un 6% de los DFSP en menores de 16 años4,14. Sin embargo, una proporción importante de los DFSP diagnosticados en adultos comienzan en la infancia o, incluso, en el nacimiento, y la falta de sospecha clínica conduce a importantes retrasos en el diagnóstico. Por este motivo, la prevalencia del DFSP infantil está probablemente infraestimada9,15. Gooskens et al., en una revisión en 2010, recogieron los 166 casos publicados previamente en la edad infantil, de los que aproximadamente 38 eran formas congénitas6.
EtiopatogeniaMuchos autores discuten su histogénesis, y probablemente representa un tumor de lento crecimiento que se origina a partir de los fibroblastos o de los histiocitos3,16, o de una célula mesenquimal indiferenciada con características fibroblásticas, musculares o neurológicas3,11.
Los traumatismos se han considerado un posible factor etiológico, ya que en un estudio de 115 pacientes un 16,5% refería un traumatismo previo en la zona17. Si bien el traumatismo puede ser una coincidencia que tan solo pone de manifiesto una lesión previamente existente, a favor de su relación se ha descrito la aparición de DFSP en cicatrices quirúrgicas, quemaduras antiguas y lugares de vacunación18–20.
En la mayoría de los niños existen anomalías específicas citogenéticas en las células tumorales, sobre todo traslocaciones en los cromosomas 17 y 22, que se tratarán de forma más extensa posteriormente.
En los casos congénitos las alteraciones cromosómicas tienen lugar intraútero, aunque se desconoce el mecanismo de producción. No hay datos epidemiológicos que hayan permitido identificar ningún factor predisponente o ambiental que induzca el desarrollo del DFSP durante la gestación9.
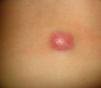
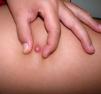
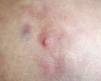
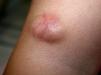
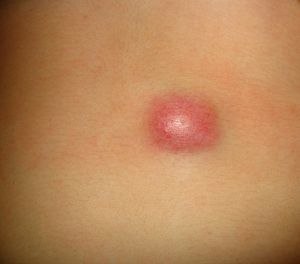
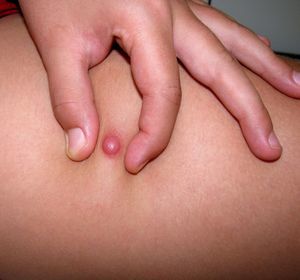
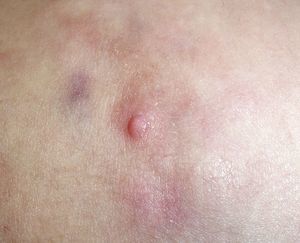
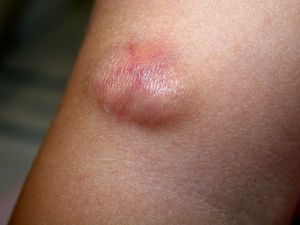
ClínicaLa presentación clínica en la infancia es similar a la de los adultos, y depende del tiempo de evolución. En los estadios iniciales predominan las lesiones en forma de pápulas o placas únicas, y con menor frecuencia nódulos profundos5 (fig. 1). Una de las características más constantes de este tumor es su induración (fig. 2). Normalmente la lesión se desplaza libremente sobre los tejidos más profundos, hasta los estadios tardíos en los que se produce una invasión de los mismos16. La piel suprayacente adopta un color eritematoso, marronáceo, violáceo, o similar al resto de la piel. La tonalidad azulada puede ser la primera manifestación del tumor, sugiriendo el diagnóstico inicial erróneo de una lesión vascular15 (fig. 3). Normalmente son lesiones asintomáticas que miden de 1 a 5cm en el momento del diagnóstico y con tendencia al crecimiento progresivo21.
El diagnóstico diferencial clínico debe incluir los tumores y las malformaciones vasculares, queloides, cicatrices, higroma quístico, necrobiosis lipoídica, miofibroma infantil, dermatofibroma, rabdomiosarcoma y pilomatricoma, entre otros15 (tabla 1).
Diagnóstico diferencial clínico del dermatofibrosarcoma protuberans infantil
| Lesiones máculo-pápulo-nodulares |
| • Tumores vasculares |
| • Malformaciones vasculares |
| • Queloides y cicatrices |
| • Higroma quístico |
| • Miofibroma infantil |
| • Dermatofibroma |
| • Rabdomiosarcoma, pilomatricoma |
| • Necrobiosis lipoídica |
| Lesiones atróficas y anetodérmicas |
| • Morfea |
| • Anetodermia |
| • Atrofodermia |
| • Lipoatrofia |
| • Cicatrices |
| • Linfocitomas |
| • Carcinoma basocelular morfeiforme |
| Formas congénitas |
| • Malformaciones vasculares |
| • Tumores vasculares |
| • Fibromatosis o miofibromatosis infantil |
| • Fibrosarcoma |
| • Hamartoma fibroso |
| • Aplasia cutis |
| • Necrosis grasa subcutánea |
| • Picaduras de artrópodos |
| • Traumatismo intrauterino |
Es frecuente encontrar, sobre todo en las formas congénitas, una variante atrófica en forma de placas deprimidas de aspecto esclerótico que tienden a permanecer planas, y variantes anetodérmicas en forma de placas deprimidas de consistencia blanda22,23. Para algunos autores estas variantes representan formas clínicas precoces del DFSP en la infancia24. Clínicamente estas lesiones se confunden con placas de morfea, anetodermia, atrofodermia, lipoatrofia, cicatrices, linfocitomas, dermatofibroma atrófico o, más raramente, carcinoma basocelular morfeiforme15,21,25,26.
Independientemente de la forma clínica inicial, después de un periodo variable que puede llegar a ser de 60 años, la lesión comienza a crecer de forma rápida, apareciendo múltiples nódulos en la superficie de aspecto protuberante, que dan nombre a la lesión15. En este momento el tumor puede complicarse con sangrado, ulceración y dolor10,15. Es frecuente que en estos estadios invasivos el tumor infiltre estructuras profundas como la fascia, el músculo o el hueso16.
Al igual que en los adultos, la mayoría se localizan en el tronco y en la zona proximal de las extremidades3,15. Las localizaciones más frecuentemente afectas en los niños son la espalda3,26 o las extremidades inferiores7,11. En este grupo de edad, a diferencia de la población adulta, es frecuente la afectación de zonas acras reforzándose la idea de un traumatismo como etiopatogénesis de la lesión21,24. En una revisión de 27 casos infantiles de DFSP un 14,8% se localizaban en las manos o en los pies27. En el año 2006 otros autores revisan todos los casos publicados en la literatura (150) y bajan esta cifra hasta un 9%28.
Como hemos señalado existen tumores congénitos, y se han recogido en la literatura de 38 a 61 niños, según las series6,13. El retraso en el diagnóstico de estos casos es sorprendente, con una media de 14 años, producido sobre todo por una demora en la consulta inicial con el dermatólogo por parte de los padres, debido a la aparente inocuidad clínica de la lesión primitiva, y en otros casos debido al diagnóstico histológico inicial erróneo, sobre todo antes de tener el marcador CD34 para el marcaje de estos tumores9,13. Los DFSP congénitos también se localizan con mayor frecuencia en el tronco y en la parte proximal de las extremidades9,26. La clínica es muy variable, con formas en placa nodular eritemato-violácea (la más frecuente), tumores solitarios, parches discrómicos y placas atróficas, escleróticas o anetodérmicas. Se ha descrito asociado al «signo del collar de pelo»26. Con frecuencia se confunden con malformaciones o tumores vasculares, fibromatosis o miofibromatosis infantil, fibrosarcoma o hamartoma fibroso, aplasia cutis, necrosis grasa subcutánea, picaduras de artrópodos o traumatismo intrauterino13,26. En estos pacientes las evaluaciones radiológicas pueden ser útiles, pero el gold-standard en el diagnóstico son la biopsia cutánea y los estudios inmunohistoquímicos y moleculares9,26.
Es importante recalcar la dificultad diagnóstica de este tumor en la fase no-protuberante, que junto a su rareza en los niños hace que en ocasiones el diagnóstico no se realice hasta la edad adulta, cuando la lesión tiene la clínica abollonada característica y su comportamiento proliferante peculiar29. La media clínica para llegar a un diagnóstico definitivo en algunas series infantiles es de unos 5 años13,29, con casos de hasta 14-15 años9,15.
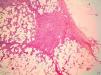
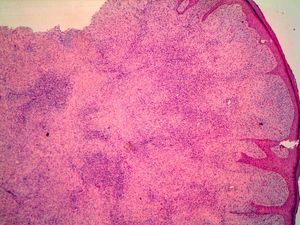
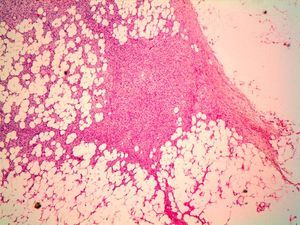
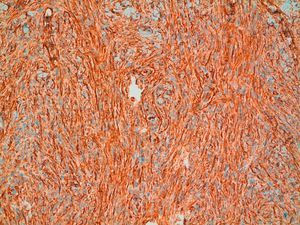
HistopatologíaEn la histopatología se observa una lesión de aspecto tumoral, originada en la dermis, que invariablemente infiltra de forma irregular y difusa el tejido celular subcutáneo (fig. 4). Existen dos patrones de invasión de los tejidos profundos, una infiltración difusa con islotes de adipocitos entre los fragmentos tumorales o «en panal de abejas», o una infiltración en bandas, como «en hojaldre» (fig. 5). Lo más característico de este tumor es su crecimiento en forma de seudópodos, que se extienden como brazos a lo largo de los bordes laterales y/o del profundo hasta 3cm o más del borde macroscópico del tumor15. Este patrón infiltrativo es el principal responsable de la alta tasa de recurrencias locales y de la dificultad de realizar una extirpación completa de las lesiones. Ocasionalmente se afectan la fascia, el tejido muscular o el tejido óseo.
El DFSP se compone de células alargadas fusiformes de aspecto bastante monomorfo, con poco pleomorfismo, núcleo alargado y citoplasma escaso, que se distribuyen con un patrón estoriforme «como en ruedas de carro» o en espiral. Las mitosis suelen estar presentes, pero en pequeño número (menos de 5 mitosis por 10 campos de gran aumento)15 y sin formas atípicas3. El estroma suele ser escaso. La epidermis con frecuencia está respetada, aunque ocasionalmente se encuentra ulcerada, atrófica o hipertrófica. En general las lesiones están separadas de la epidermis por una zona estrecha de dermis respetada, sobre todo en los estadios iniciales. En los neonatos este tumor está formado principalmente por células fusiformes u ovoideas con aspecto inmaduro y de pequeño tamaño7.
Ni la profundidad de la invasión ni el índice mitótico, la celularidad o la atipia nuclear permiten identificar aquellos DFSP con capacidad para metastatizar15.
Se han descrito variantes histológicas, como la presencia de zonas hipercelulares sin características fibrosarcomatosas, el tipo mixoide, el tipo granular, atrófico, esclerótico, la presencia de células multinucleadas y el tumor de Bednar o variante pigmentada, este último más frecuente en la raza negra15,25,30. Estas variantes no afectan al pronóstico del paciente31.
Aproximadamente un 7-15% de los tumores contienen un componente fibrosarcomatoso, aunque esta presentación es excepcional en la infancia. Se objetivan áreas hipercelulares, un aumento en la cifra de mitosis y una disposición clara de las células fusiformes en espiga, formando fascículos y recordando un fibrosarcoma31. En un 50% de los casos se produce una pérdida de la respuesta al CD3416. En general se admite que estos cambios fibrosarcomatosos representan una forma de progresión tumoral que lleva consigo una mayor agresividad con respecto a la forma clásica de DFSP, asociándose con un rápido crecimiento, un mayor tamaño tumoral, un crecimiento expansivo con invasión muscular, un mayor intervalo de evolución previo al diagnóstico y una mayor inmunorreactividad frente a p53 y Ki6732. Clásicamente también se ha asociado a un alto grado de recurrencias y a un aumento del riesgo de metástasis de un 10-15%, y se han relacionado estos cambios con extirpaciones incompletas que favorecen que las células tumorales residuales desarrollen cambios moleculares que permitan adquirir ese potencial metastásico30,33,34. Recientemente varios autores han demostrado que si se realiza una extirpación quirúrgica adecuada, con márgenes libres, la probabilidad de recurrencia local es similar a la del DFSP convencional32,35. Es importante que los patólogos reconozcan e informen de la presencia de estos cambios en los tumores analizados, aunque sea en pequeñas proporciones, ya que incluso cambios pequeños pueden ser clínicamente relevantes33–36.
En la actualidad se considera al fibroblastoma de células gigantes (FCG) como una expresión diferente de la misma neoplasia37 o como una variante histológica de DFSP propia de la infancia (aunque se han descrito casos en la edad adulta)9,16,38,39. La clínica es muy similar a la del DFSP y se carcateriza por la presencia de un tumor nodular de lento crecimiento que evoluciona a un aspecto protuberante, y que fundamentalmente se localiza en el tronco (fig. 6). El estudio histopatológico demuestra células fusiformes que adoptan un patrón estoriforme, junto a la presencia de células gigantes multinucleadas y peculiares espacios pseudovasculares, que parecen reflejar una pérdida de la cohesión celular30. Los hallazgos inmunohistoquímicos y citogenéticos también son los mismos. Al igual que el DFSP tiene una tendencia alta a la recurrencia local, aunque no se ha descrito la aparición de metástasis hasta el momento actual38. Existen híbridos de ambas lesiones, coexistiendo en la misma lesión características tanto de DFSP como de FCG7,40.
Es evidente que resulta difícil realizar el diagnóstico diferencial histológico del DFSP con otras entidades, sobre todo con los tumores fibrohistiocíticos. Debe diferenciarse del neurofibroma, dermatofibroma, hemangioma, fibrosarcoma, histiocitoma fibroso maligno y liposarcoma mixoide, entre otros3,37.
La inmunohistoquímica permite confirmar el diagnóstico de DFSP con los marcadores CD34 y vimentina positivos (fig. 7) y la negatividad para S100, factor XIIIa, desmina y actina del músculo liso. Se diferencia del dermatofibroma convencional en que el CD34 es negativo y la tenascina y el factor XIIIa son positivos30. Se han propuesto recientemente unos nuevos marcadores que son positivos en el DFSP y negativos en el dermatofibroma: la apolipoproteína D41, y positivos en el dermatofibroma y negativos en el DFSP: la estromelisina 342 y el CD 16343. Por último señalar que no todas las proliferaciones de células fusiformes CD34+ en la dermis indican la presencia de un DFSP, ya que se ha encontrado positivo en otros sarcomas, e incluso en algunas lesiones benignas fibrohistiocitarias44. Recientemente se ha descrito en la infancia una nueva entidad congénita denominada hamartoma dendrocítico dérmico, cuyas células son CD34+, pero carecen de la expresión de COL1A1-PDGFB en los estudios moleculares9,45.
Un método alternativo para confirmar el diagnóstico de DFSP es la tinción de PDGFRB (receptor β del factor de crecimiento derivado de plaquetas), al demostrar la sobreexpresión de esta molécula en la superficie de las células tumorales, aunque su utilidad debe ser aún demostrada31.
Estudios citogenéticosEl DFSP se caracteriza tanto en la población adulta como en la infantil por la presencia de una anomalía citogenética característica en un 70-90% de los casos, un anillo cromosómico supernumerario o una traslocación entre los cromosomas 17 y 22. En ambos casos se produce una fusión (17q22) (22q13) del gen COL1A1 (cadena α1 del colágeno de tipo 1) del cromosoma 17 con el gen PDGFβ (cadena β del factor de crecimiento derivado de plaquetas) del cromosoma 22. PDGFB codifica la cadena β del PDGF, un ligando del receptor tirosinquinasa PDGF localizado en la superficie celular. En la población pediátrica las traslocaciones son más frecuentes, y no se han detectado hasta el momento anillos cromosómicos supernumerarios7,9,15,21,28.
PDGFB es un factor de crecimiento que actúa como un potente mitógeno para las células del tejido conectivo16. El producto de fusión COL1A1-PDGFB induce la formación tumoral a través de un aumento en la expresión del PDGFB en las células tumorales, produciendo una estimulación autocrina o paracrina del tumor, a través de la activación de los receptores PDGFB. Esta alteración molecular es fundamental para el desarrollo del DFSP. El producto de fusión COL1A1-PDGFB puede detectase mediante técnicas de PCR en muestras en parafina, y mediante el análisis de hibridación in situ con fluorescencia (FISH). Esta traslocación también está presente en el tumor de Bednar y en el fibroblastoma de células gigantes7.
En todos los casos estudiados la traslocación entre los cromosomas 17 y 22 resulta en un producto quimérico COL1A1-PDGFB ARN, en el cual el exón 1 del PDGFB ha sido eliminado y sustituido por un segmento variable del gen COL1A1, del exón 7 al exón 47. Esto podría indicar que las secuencias COL1A1 desempeñan un papel secundario en la proteína final, y que no son esenciales para el crecimiento tumoral, a diferencia de las secuencias PDGFB que sí permiten la síntesis de la proteína correspondiente madura, que ejercería un papel primordial30,46. No se ha encontrado ninguna asociación entre los diferentes productos de fusión COL1A1-PDGFB y diferencias en la clínica (edad, sexo, tamaño tumoral y localización tumoral) ni en el subtipo histológico de los pacientes estudiados44.
En una minoría de casos (8%) estas alteraciones no se detectan9,13,15,44,47,48. Esto sugiere que otros genes deben participar en este proceso tumoral, localizados hasta el momento en los cromosomas 5, 7, 8 y 2130. En niños se ha descrito también una traslocación recíproca 46, XX, t (X,7) (q2112;q11.2)48.
Diagnóstico y estadificaciónEl diagnóstico del DFSP se sospecha por la clínica, aunque en algunos casos resulte extremadamente difícil debido a la rareza de este tumor, a su clínica anodina y a su curso lentamente progresivo. Debe realizarse un examen completo de toda la piel en todo paciente diagnosticado de DFSP.
El diagnóstico definitivo requiere un estudio histopatológico con inmunohistoquímica. Cuando la sospecha clínica es alta, pero la biopsia inicial no es diagnóstica, se recomienda repetir la biopsia36. Los estudios citogenéticos permiten realizar el diagnóstico de confirmación, aunque en un 8% de los casos éstos resulten negativos.
Para establecer el diagnóstico de las recidivas tumorales puede realizarse una biopsia de la zona o una aspiración con aguja fina16.
La resonancia magnética de la zona afecta se utiliza para definir la extensión del tumor y la penetración del mismo en los diferentes tejidos, y para la monitorización de las recurrencias21,29,49. Sin embargo, no parece útil para detectar la persistencia tumoral en casos de tumores extirpados recientemente de forma incompleta, ni para delimitar los márgenes laterales del tumor50.
La ecografía puede ser útil en casos seleccionados. La tomografía axial computarizada no está indicada salvo que se sospeche una afectación ósea o cuando haya sospecha de metástasis pulmonares16,39.
Ya que la diseminación linfática o hematógena es infrecuente no se indica de forma complementaria un despistaje tumoral a distancia, salvo que los hallazgos clínicos lo sugieran. La resección electiva de los ganglios linfáticos regionales no está indicada en el manejo de este tumor. Sin embargo, el examen clínico de los mismos sí es importante en el seguimiento de estos pacientes15,16.
No se ha descrito una estadificación definitiva para el DFSP, aunque se usa una escala clínica alemana para su clasificación en estadio I o enfermedad localizada primaria, estadio II con metástasis en los ganglios linfáticos y estadio III con metástasis a distancia51.
Evolución y seguimientoLa recidivas tumorales son menos frecuentes en la población infantil (9%)6. Jafairan et al. no observaron ninguna recurrencia local en 8 niños, con una media de 5 años de seguimiento15.
Las recurrencias son más frecuentes en aquellos pacientes con cambios fibrosarcomatosos, con márgenes microscópicos positivos, celularidad aumentada, altas cifras de mitosis y edad superior a los 50 años21,30,52. El tamaño tumoral no parece tener una influencia significativa en la recurrencia ni en el pronóstico53. No hay que olvidar que el principal predictor de recurrencias es la extirpación incompleta de la lesión12,33.
La mayoría ocurren en los 3 primeros años tras la cirugía, aunque se han descrito recurrencias tardías, incluso de 26 años tras la extirpación del tumor primario54. Esto obliga a realizar seguimientos a largo plazo en estos pacientes.
Las metástasis son infrecuentes, entre un 3-5%, y suelen ir precedidas de múltiples recurrencias locales, aunque se han descrito casos de metástasis sin recidivas previas55. En la serie más larga recogida en la población infantil de 166 pacientes, tan solo uno murió por enfermedad recurrente local progresiva6. Se han publicado 2 casos con metástasis en ganglios linfáticos a los 21 años, y de metástasis pulmonares a los 31 años, tras un DFSP en la infancia56,57. McKee y Thornton no han encontrado recidivas ni metástasis en 2 series de 8 y 10 pacientes respectivamente, con una media, cada una, de 13 y 36 meses de seguimiento14,29.
La aparición de metástasis es un signo de mal pronóstico, con una supervivencia media de 2 años12,58. Se afectan fundamentalmente los pulmones, y menos de un 1% de las metástasis ocurren en los ganglios linfáticos, por lo que la extirpación ganglionar sistemática tiene poco valor en el manejo de este tumor15.
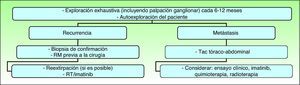
Es necesario realizar un seguimiento clínico cada 6-12 meses al paciente, sobre todo los 3 primeros años tras la cirugía, que incluya palpación de la cicatriz quirúrgica y de los ganglios linfáticos locorregionales5,36. Algunos autores preconizan un seguimiento de por vida15,59. Cualquier alteración en la cicatriz debe ser considerada como una potencial recidiva, y debe ser biopsiada lo antes posible15. Es imprescindible educar al paciente y a los padres sobre un examen regular de la cicatriz. No es necesario realizar ninguna prueba de imagen de forma rutinaria en el seguimiento de estos pacientes, aunque si existe sospecha de una recurrencia la prueba de imagen más útil es la resonancia magnética, que ayuda a establecer la extensión tumoral y a programar el tratamiento posterior (fig. 8).
Seguimiento clínico. Modificado de Nacional Comprehensive Cancer Network (NCCN). Practice Guidelines in Oncology. 201053.
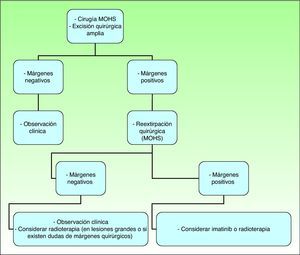
El principal objetivo del tratamiento en estos pacientes es conseguir la resección quirúrgica completa de la lesión, ya que si se realiza de forma correcta constituye el factor pronóstico más significativo, con tasas muy bajas de recidivas y cifras de supervivencia cercanas al 100%2,16. Las cifras de recurrencias tras extirpaciones simples son del 33-60%; este intervalo se reduce al 10-30% si se realizan extirpaciones amplias y al 0-6,6% con la cirugía de Mohs21.
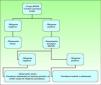
Las guías Nacional Comprehensive Cancer Network (NCCN) Clinical Practice Guidelines in Oncology de 2010 resumen las directrices de tratamiento actuales recomendadas en el DFSP, aunque no son específicas para la población infantil36 (fig. 9).
Tratamiento del dermatofibrosarcoma protuberans. Modificado de Nacional Comprehensive Cancer Network (NCCN). Practice Guidelines in Oncology 201053.
En las últimas dos décadas se ha promovido el uso de la cirugía micrográfica de Mohs, con la que el índice de recidivas se reduce a un 0,6-6%, por lo que se ha consolidado como técnica de elección en el DFSP29. Su uso es especialmente importante en tumores de márgenes mal definidos, en localizaciones de cabeza, cuello, zonas acras, superficie anterior del tórax (sobre todo en las niñas) y en las recidivas tumorales. Thornton no ha encontrado recurrencias en una serie de 10 niños tratados con esta técnica29. Snow et al. han presentado una serie de 29 pacientes de todas las edades sin recurrencias locales a los 5 años. En una revisión publicada en la literatura de estos autores, de 136 pacientes con un seguimiento mínimo de 5 años, se halló una tasa de recidiva del 6,6%59. Las ventajas fundamentales de esta técnica radican en el menor número de intervenciones quirúrgicas, el menor tamaño de las cicatrices y el respeto de los tejidos sanos, por razones cosméticas y funcionales13,60.
La aplicación de esta técnica a la población pediátrica tiene algunas limitaciones. En primer lugar la ausencia de ensayos prospectivos aleatorizados controlados comparando la cirugía convencional y la cirugía de Mohs en este grupo de edad3. Love et al. compararon en un estudio retrospectivo el uso de la cirugía convencional con extirpación de márgenes amplios y la cirugía de Mohs en los 61 casos de DFSP congénitos. Encontraron unas cifras de extirpación tumoral del 100% con cirugía de Mohs, y de un 89% con cirugía convencional, por lo que abogan por el uso de esta primera técnica13. Iqbal et al., en una revisión de 15 pacientes menores de 18 años, no observaron recidivas tras 4 años de seguimiento en los pacientes tratados con exéresis amplia convencional ni en los tratados con cirugía de Mohs5. Una dificultad añadida en la realización de esta técnica en la edad pediátrica es la necesidad de realizar múltiples pases en pacientes que suelen estar bajo una anestesia general3.
En los casos en que no pueda emplearse esta técnica debe realizarse una extirpación quirúrgica amplia, hasta conseguir márgenes negativos confirmados histológicamente. No está claro en los niños cuáles son los márgenes adecuados para conseguir el control local del tumor, ya que el nivel de evidencia es bajo2. Algunos autores establecen 3cm de diámetro, incluyendo la fascia muscular, en todos aquellos niños mayores de 5 años. Para aquellos niños menores de 5 años, incluyendo a los neonatos, márgenes de 1cm libres de tumor parecen ser razonablemente suficientes7. Kimmel et al. investigaron los márgenes de resección de los DFSP y concluyeron que el tamaño macroscópico del tumor es un pobre indicador de la extensión real histológica61. Otros autores en una revisión de 66 pacientes con DFSP observaron cifras de recurrencias locales en torno a un 47%, con márgenes de extirpación menores de 3cm, y de un 7% en aquellos entre 3-5cm12.
Por problemas anatómicos de espacio, como en la cabeza, el cuello o las zonas acras, no siempre es posible realizar resecciones amplias debido a importantes deformidades cosméticas y funcionales secundarias, y en estos casos las cifras de recurrencia se sitúan en torno al 50-75%3. En el caso de que los márgenes sean positivos, y no pueda repetirse el tratamiento quirúrgico, está indicada la radioterapia postoperatoria, o el imatinib, como veremos a continuación2.
En las lesiones muy extensas es necesario realizar colgajos o injertos para cubrir el defecto quirúrgico. En estos casos es importante que no haya dudas sobre la negatividad de los márgenes, ya que un colgajo puede dificultar la detección precoz de una recurrencia local2. Si no puede demostrarse la negatividad de los márgenes quirúrgicos se recomienda evitar el desbridamiento y realizar un injerto de piel total para poder monitorizar precozmente las recurrencias36.
Terapia molecularDebido a la reciente identificación de la importancia de la señal PDGFB-PDGFRB en la patogénesis del DFSP, se ha investigado la utilidad del imatinib (Glivec®), un inhibidor selectivo del receptor transmembrana tirosinquinasa de diversas proteínas como el PDGFRB en el tratamiento de estos tumores. El imatinib está aprobado como primera línea de tratamiento en la leucemia mieloide crónica y el tumor metastásico o irresecable del estroma gastrointestinal, que son tumores que también presentan activaciones aberrantes de las tirosinquinasas16.
Imatinib se ha aprobado recientemente por la FDA para el tratamiento del DFSP en adultos, con las indicaciones de tumores inoperables, recurrentes o metastáticos62. También se ha usado de forma preoperatoria para disminuir el tamaño tumoral y permitir resecciones de menor tamaño. La dosis oscila entre 400-800mg diarios orales, con escasos efectos secundarios, aunque está en discusión tanto la dosis como la duración del tratamiento6. Los efectos secundarios conocidos de este fármaco incluyen dispepsia, náuseas, vómitos, inmunosupresión, hemorragia, elevación de enzimas hepáticas y fallo renal8.
La respuesta global a imatinib se consigue en un 65% de los casos en la población adulta16. La falta de respuesta se ha relacionado con mutaciones que inducen resistencia en el PDGFRB63. Aquellos tumores que no presentan esta traslocación o que no dependen de la señal a través de PDGFRB tampoco responden a imatinib64. Por eso parece necesario solicitar previamente un estudio citogenético del tumor antes de tomar la decisión del tratamiento a escoger16,36.
Algunos autores lo han utilizado en niños, aunque actualmente no está aprobado en pacientes menores de 18 años, y los datos de farmacocinética en este grupo no están disponibles. Sin embargo, parecen existir suficientes datos en estudios de fase I y II en la leucemia mieloide crónica como para poder administrar la dosis correcta en niños59,65. Las dosis que se han usado corresponden a 400-500mg/m2/día. En los casos pediátricos publicados en la literatura con imatinib no se han registrado efectos adversos6. Las tabletas tienen un sabor amargo, y la administración rectal puede ser una alternativa66.
Price et al. lo utilizaron con éxito en un paciente de 18 meses con un DFSP congénito, comprobando la buena respuesta a las 23 semanas mediante resonancia magnética. Sin embargo, el autor no da a conocer la evolución a largo plazo8. Gooskens et al. aportaron 3 casos más de tratamiento con imatinib durante 6 y 12 meses, consiguiendo una reducción significativa del tamaño tumoral para su posterior la extirpación quirúrgica6.
Estos autores señalan la utilidad de realizar un screening molecular para detectar la alteración COL1A-PDGFB en los márgenes quirúrgicos, ya que a pesar de que sean negativos histológicamente pueden persistir zonas microscópicas con remanentes tumorales. En el caso de que el screening sea positivo podría usarse imatinib de forma coadyuvante para disminuir el riesgo de recurrencias. Nosotros hemos tenido la oportunidad de comprobar esto en un niño de 8 años, con márgenes negativos histológicamente, pero en uno de ellos se detectó la traslocación (en muestras en parafina, mediante FISH), mientras que en la ampliación de márgenes todos fueron negativos histológica y citogenéticamente. El paciente está libre de enfermedad a los 11 meses de seguimiento (datos personales, no publicados). Es necesario determinar en estudios futuros prospectivos de mayor tamaño el valor clínico de este análisis citogenético de los márgenes tumorales para detectar una enfermedad residual mínima, pero indudablemente en los niños puede ser una herramienta útil para dirigir las decisiones terapéuticas después de la cirugía6.
RadioterapiaAunque la radioterapia ha sido empleada como tratamiento principal67, se utiliza con mayor frecuencia de forma adyuvante a la cirugía en los casos de resecciones con márgenes positivos, y/o si existen cambios fibrosarcomatosos68. Debe considerarse de forma postoperatoria en aquellas lesiones de gran tamaño o si no existe seguridad acerca de lo adecuado de los márgenes quirúrgicos. Se aplica 5.000-6.000 cGy en aquellas lesiones con márgenes positivos, o en aquellos con límites cercanos al margen quirúrgico, unas 200 cGy fracciones por día. Si clínicamente es viable el campo se extiende más allá del margen quirúrgico unos 3-5 cm36.
QuimioterapiaEn casos seleccionados la quimioterapia puede tener un papel importante. Se ha descrito un paciente con recurrencias locales que respondió al uso combinado de metotrexato y vinblastina69.
Se ha utilizado la perfusión aislada hipertérmica del miembro afecto con melfalán y TNF-alfa para disminuir el tamaño del tumor, de forma previa a la cirugía70.
En aquellos pacientes con metástasis debe considerarse el uso de quimioterapia, radioterapia, resección quirúrgica, imatinib, o su inclusión en ensayos clínicos16.
ConclusionesEl diagnóstico del DFSP en la infancia es un reto, y requiere un alto nivel de sospecha clínica. Tanto los tumores congénitos como aquellos adquiridos que aparecen en la infancia se confunden durante mucho tiempo con otras lesiones benignas como hemangiomas y malformaciones vasculares. Por este motivo, cualquier placa o nódulo mal definidos, de lento crecimiento e incierta interpretación, debe ser biopsiada. La confirmación del diagnóstico suele requerir técnicas de immunohistoquímica, y también es posible realizar estudios citogenéticos para detectar la alteración COL1A-PDGFB.
El comportamiento de este tumor en pacientes en edad pediátrica suele ser menos agresivo con cifras de recurrencia y metástasis menores que las publicadas en los adultos.
El principal objetivo en el tratamiento del DFSP es la erradicación completa del tumor. Si el tumor es de gran tamaño o está mal delimitado, una resonancia magnética antes de la cirugía puede ayudar a determinar la extensión y tamaño exacto del tumor, lo que conduce a un adecuado planteamiento quirúrgico. La cirugía de Mohs es la técnica de elección en el DFSP, y es especialmente útil en localizaciones como cabeza, cuello y zonas acras, permitiendo resecciones menos cruentas y disminuyendo la incidencia de recidivas locales.
La radioterapia o el imatinib deben ser considerados en el manejo inicial de niños con tumores irresecables, para disminuir el tamaño previo a la cirugía, y en aquellos casos con lesiones recurrentes o metastásicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Dra. Teresa Aramendi por su inestimable ayuda con las fotos histológicas.