Uno de los aspectos clínicamente más relevantes de los recientes avances en el conocimiento de la psoriasis es su asociación con un aumento en la prevalencia de factores de riesgo cardiovascular, que determina un mayor riesgo de morbimortalidad relacionada con infarto agudo de miocardio, accidente cerebrovascular y arteriopatía periférica. La inflamación sistémica crónica asociada podría explicar en gran medida que la psoriasis moderada-grave sea un factor de riesgo independiente de enfermedad cardiovascular. La introducción de la terapia biológica ha mejorado en gran medida nuestras expectativas terapéuticas y el control a largo plazo de la enfermedad, y existen evidencias epidemiológicas de que puede mejorar también el riesgo cardiovascular, como ocurre en los pacientes con artritis reumatoide. Sin embargo, se han descrito algunos efectos adversos del tratamiento con agentes bloqueadores del factor de necrosis tumoral alfa en pacientes con insuficiencia cardíaca congestiva avanzada que obligan a tener especial precaución con su empleo en estos pacientes. Por otra parte, recientemente se ha observado un desequilibrio (aunque no estadísticamente significativo) en el número de acontecimientos adversos cardiovasculares mayores, que incluyen infarto de miocardio no letal, accidente cerebrovascular no letal y muertes de causa cardiovascular, en la fase controlada con placebo de los ensayos clínicos con briakinumab y ustekinumab, 2 anticuerpos monoclonales dirigidos contra p40, la subunidad común a IL-12 e IL-23. En el presente artículo se revisa la evidencia científica disponible en este campo.
One of the most clinically important aspects of recent advances in our understanding of psoriasis has been the detection of an association between this disease and an increased prevalence of cardiovascular risk factors. This increase in prevalence is, in turn, linked to a greater risk of morbidity and mortality related to acute myocardial infarction, cerebrovascular accident, and peripheral arterial disease. The chronic systemic inflammation present in psoriasis could explain why moderate to severe psoriasis is an independent risk factor for cardiovascular disease. The introduction of biologic therapies has greatly improved the expectations of treatment as well as the long-term control of psoriasis, and there is epidemiological evidence that these therapies may lower cardiovascular risk in psoriasis as they do in rheumatoid arthritis. Caution should, however, be exercised when prescribing biologic drugs in this setting, because adverse effects have been reported in association with the use of tumor necrosis factor inhibitors in patients with advanced congestive heart failure. Furthermore, a numerical imbalance (without statistical significance) between the groups receiving the biologic drug and the placebo groups was recently observed in the incidence of major cardiovascular events (nonfatal myocardial infarction and cerebrovascular accident and cardiovascular death) during the controlled periods of clinical trials of briakinumab and ustekinumab, 2 monoclonal antibodies that target the p40 subunit shared by IL 12 and IL-23. We review the current scientific evidence on this topic.
En el presente artículo se revisa la asociación de la psoriasis con los factores de riesgo y la propia enfermedad cardiovascular, con especial atención a las implicaciones terapéuticas y en especial del tratamiento biológico.
Algunos de los tratamientos sistémicos convencionales presentan efectos contraproducentes desde el punto de vista de las comorbilidades en los pacientes con psoriasis. Es bien conocido el potencial de la ciclosporina para provocar o empeorar la hipertensión, la diabetes mellitus o la dislipidemia, y esta última es otro efecto adverso frecuente del acitretino. Los agentes biológicos carecen de estas contraindicaciones, lo que justificaría su empleo en pacientes con estas y otras comorbilidades. Sin embargo, también existen indicios que sugieren que el tratamiento de la psoriasis con fármacos biológicos podría tener en algunos casos efectos contraproducentes desde el punto de vista del riesgo cardiovascular.
La posibilidad de un empeoramiento de la insuficiencia cardíaca congestiva (ICC) obliga a tener una especial precaución en estos pacientes, como indican las fichas técnicas de los fármacos inhibidores del factor de necrosis tumoral (TNF). Por otra parte, recientemente se ha planteado la posibilidad de que algunos tratamientos biológicos pudieran aumentar la morbimortalidad cardiovascular: se ha observado en algunos ensayos clínicos de anticuerpos monoclonales anti-p40 un desequilibrio numérico con respecto al grupo placebo (sin significación estadística) en cuanto a la aparición de acontecimientos adversos cardiovasculares mayores (MACE), es decir, infarto de miocardio no letal, accidente cerebrovascular no letal o muerte de causa cardiovascular, especialmente al inicio del tratamiento1.
Psoriasis y riesgo cardiovascularExiste abundante evidencia científica acerca de la asociación de la psoriasis moderada-grave con una mayor prevalencia de factores de riesgo cardiovascular, que no revisaremos de forma exhaustiva, por haber sido objeto de excelentes revisiones.
A lo largo de los últimos años se han ido desarrollando diversos modelos multivariantes de estimación del riesgo cardiovascular en individuos asintomáticos y aparentemente sanos. Las tablas de Framingham permiten estimar el riesgo de infarto de miocardio o muerte de causa coronaria en el transcurso de 10 años. Los factores de riesgo inicialmente incluían edad, sexo, colesterol LDL, colesterol HDL, presión arterial, diabetes y tabaco2. Según la puntuación de Framingham, se identifican 3 categorías de riesgo: bajo (riesgo de infarto de miocardio inferior al 10%), intermedio (10 al 20%) y alto (>20%). Los criterios de Framingham, desarrollados a partir del estudio de una cohorte de residentes en Framingham, Massachusetts, no son estrictamente aplicables a otras poblaciones, y la estimación del riesgo no incluye ictus ni otras manifestaciones de enfermedad cardiovascular. Aunque la puntuación de riesgo de Framingham y otras escalas similares (REGICOR, Reynolds, SCORE) son ampliamente utilizadas, se han empleado poco en la evaluación sistemática del riesgo cardiovascular en pacientes con psoriasis moderada-grave.
En un estudio de casos-controles se observó que el riesgo cardiovascular a 10 años según la puntuación de Framingham (promedio 11,2) era intermedio para los pacientes con psoriasis, pero significativamente superior al de los controles equiparados por edad y sexo3. En un ensayo clínico efectuado en pacientes con psoriasis moderada-grave y PASI>10, aunque la puntuación media de riesgo de Framingham a 10 años era de 5,634, el 41% de los pacientes tenía síndrome metabólico, y la presencia de niveles elevados de proteína C reactiva (PCR) sería indicativa de un riesgo elevado de enfermedad cardiovascular5 en esta población.
Un estudio de cohorte basado en la General Practice Research Database (GPRD) y recientemente publicado6 indica que la psoriasis grave (definida por el empleo de tratamiento sistémico) conlleva un aumento en el riesgo de MACE (cociente de riesgo o hazard ratio [HR] 1,53; intervalo de confianza del 95% [IC 95%], 1,26-1,85) tras ajustar la edad, el sexo, la presencia de diabetes, hipertensión, tabaquismo e hiperlipidemia; el incremento absoluto en el riesgo de MACE a los 10 años se estima en un 6,2%.
La GPRD del Reino Unido ha proporcionado abundantes datos, aunque se han cuestionado tanto el diagnóstico de psoriasis como la definición de gravedad (basada en el tratamiento sistémico) o la aplicabilidad a otros entornos geográficos. En el año 2006, Gelfand et al.7 publicaron un estudio de cohortes poblacional prospectivo partiendo de esta base de datos en pacientes con psoriasis de edades comprendidas entre los 20 y los 90 años, comparando la incidencia de infarto de miocardio en pacientes con y sin un diagnóstico de psoriasis (la gravedad venía definida por el registro de prescripciones de tratamiento sistémico). Los datos fueron recogidos por médicos de familia entre 1987 y 2002, con un seguimiento promedio de 5,4 años. En el estudio se tuvieron en cuenta, con fines de ajuste, la presencia de hipertensión, diabetes, antecedentes de infarto de miocardio, hiperlipidemia, edad, sexo, tabaquismo e índice de masa corporal, con hasta 5 controles por caso de psoriasis, y se incluyeron un total de 556.995 pacientes controles, 127.139 pacientes con psoriasis leve y 3.837 pacientes con psoriasis grave. Los autores de este estudio hallaron evidencias de que la psoriasis constituye un factor de riesgo independiente de los anteriormente mencionados para el infarto de miocardio, con un riesgo relativo (RR) dependiente de la edad: en los pacientes de 30 años con psoriasis leve y grave era de 1,29 (IC 95% 1,14-1,46) y 3,10 (IC 95% 1,98-4,86), respectivamente; mientras que en los de 60 años, los RRs correspondientes eran 1,08 (IC 95% 1,03- 1,13) y 1,36 (IC 95% 1,13-1,64). En otro estudio se confirmó el aumento en el riesgo de infarto de miocardio (HR 1,21; IC 95% 1,10-1,32), así como de angor (HR 1,20; IC 95% 1,12-1,29), aterosclerosis (HR 1,28; IC 95% 1,10-1,48), enfermedad vascular periférica (HR 1,29; IC 95% 1,13-1,47) e ictus (HR 1,12; IC 95% 1,00-1,25) en 44.164 pacientes con un diagnóstico incidente de psoriasis8. También partiendo de los datos de la GPRD se ha reportado en otra publicación un aumento en el riesgo de ictus en los pacientes con psoriasis, tanto moderada (HR 1,06; IC 95% 1,0-1,1) como grave (HR, 1,43; IC 95% 1,1-1,9)9. Asimismo se ha observado que la psoriasis grave constituye un factor de riesgo independiente (después de ajustar edad, sexo, tabaquismo, diabetes, hipertensión e hiperlipidemia) de mortalidad cardiovascular (HR 1,57; IC 95%1,26-1,96)10. El RR resulta mayor en pacientes jóvenes: para los de 40 años es de 2,69 (IC 95% 1,45-4,99) y de 1,92 (IC 95% 1,41-2,62) para los de 6011.
Recientemente se han publicado otros estudios con resultados contradictorios, que se describen a continuación. Analizando la incidencia de enfermedad cardiovascular después del diagnóstico de psoriasis (en los estudios del grupo de Gelfand la psoriasis era prevalente, no incidente) se ha observado una tendencia a un aumento en el riesgo de infarto de miocardio (odds ratio [OR] 1,66; IC 95% 1,03-2,66) solo en los pacientes menores de 60 años, en la mayoría de los casos con psoriasis grave11. Sin embargo, el riesgo absoluto era bajo (0,51/1.000 pacientes-años). El riesgo de infarto de miocardio no estaba aumentado cuando se consideraba el conjunto de la cohorte, como tampoco lo estaba el de ictus o accidente isquémico transitorio. En otro estudio de una cohorte muy extensa de pacientes holandeses12 tampoco se encontró una asociación de la psoriasis (con independencia de la gravedad) con un aumento en el riesgo, ajustado por edad y sexo, de ingreso hospitalario por cardiopatía isquémica aguda. En una base de datos de pacientes ambulatorios alemanes tampoco se ha observado una asociación de la psoriasis con un mayor riesgo de infarto de miocardio o ictus, aunque sí con una mayor prevalencia de factores de riesgo cardiovascular como obesidad, diabetes, dislipidemia o hipertensión13. El riesgo de mortalidad de causa cardiovascular podría estar aumentado solo en los pacientes cuya psoriasis requiere ingreso, y no en los ambulatorios, y puede ser mayor en los pacientes jóvenes14. En un estudio de pacientes hospitalizados en Israel se ha confirmado que la psoriasis es un factor de riesgo independiente para diabetes, hipertensión, obesidad y tabaquismo, pero cuando se corrigieron estos factores de riesgo en el análisis estadístico no se observó un incremento en el riesgo de enfermedad cardiovascular15.
Con las salvedades anteriormente mencionadas, la mayoría de las publicaciones concuerdan: una reciente revisión sistemática de la evidencia disponible, incluyendo 90 estudios, indica que los pacientes con psoriasis tienen una mayor prevalencia de factores de riesgo cardiovascular y presentan un riesgo aumentado de cardiopatía isquémica, enfermedad cerebrovascular y arteriopatía periférica16. Recientemente se han publicado evidencias que confirman estos hallazgos en poblaciones asiáticas17,18.
Este aumento en la morbilidad cardiovascular podría ser independiente de los factores de riesgo compartidos y podría contribuir al incremento en la mortalidad por todas las causas (además de la debida a cardiopatía isquémica, enfermedad vascular cerebral y vasculopatía periférica) observado en los pacientes con psoriasis en un estudio de 3.236 casos y 2.500 controles efectuado en un gran hospital de la Veterans Administration19.
En un estudio de cohortes de toda la población danesa adulta20, incluyendo 34.371 pacientes con psoriasis leve y 2.621 con psoriasis grave (607 con artritis psoriásica), se ha observado asimismo un aumento en el riesgo de mortalidad de cualquier causa, mortalidad cardiovascular, infarto de miocardio, revascularización coronaria, ictus y MACE. Loscorrespondientes cocientes de densidad de incidencia (rate ratios, equivalentes a RR) ajustados aumentan con la gravedad de la enfermedad y disminuyen con la edad de inicio. Los RRs para MACE fueron 1,20 (IC 95% 1,14-1,25) y 1,58 (IC 95% 1,36-1,82) para los pacientes con psoriasis leve y grave, respectivamente; los RRs correspondientes a muerte cardiovascular fueron 1,14 (IC 95% 1,06-1,22) y1,57 (IC 95% 1,27-1,94). El riesgo fue similar en los pacientes con psoriasis grave solo con afectación cutánea y con artritis psoriásica. En esta misma cohorte también se ha observado un aumento en el riesgo de fibrilación auricular y accidente cerebrovascular isquémico, dependiente de la gravedad de la psoriasis, con un RR mayor (prácticamente doble que el de los de mayor edad) en los pacientes menores de 50 años21. Es interesante destacar que, en esta cohorte danesa, los pacientes con psoriasis que han sufrido un infarto de miocardio presentan un peor pronóstico que la población sin psoriasis, con un HR de 1,18 (IC 95% 0,97-1,43) por lo que respecta a muerte de cualquier causa y un HR de 1,26 (IC 95% 1,04-1,54) por lo que respecta a la aparición de MACE, con un período de seguimiento promedio de 19,5 meses para los pacientes con psoriasis y 22 meses para los pacientes sin psoriasis22.
Este aumento del riesgo cardiovascular en la psoriasis, independiente de los factores de riesgo tradicionales, podría explicarse en parte por la presencia de inflamación crónica, que puede reflejarse en la presencia de niveles séricos elevados de proteína C reactiva (PCR), al menos en algunos pacientes. La determinación de niveles séricos de PCR puede contribuir a la estimación del riesgo cardiovascular en pacientes con riesgo intermedio según Framingham7; y se ha reportado una correlación significativa entre los niveles de PCR y la gravedad de la psoriasis23, con un porcentaje significativo de pacientes con valores por encima de 3mg/l, que indican un riesgo cardiovascular alto. La respuesta al tratamiento con fototerapia se asocia con una reducción de dichos niveles, aunque su promedio continúa siendo superior al de los controles24.
En pacientes con artritis psoriásica sin factores de riesgo cardiovascular se ha encontrado asimismo evidencia ultrasonográfica de aterosclerosis subclínica24y disfunción endotelial en la arteria braquial25, lo que apoyaría el papel de la inflamación crónica asociada a la enfermedad como factor de riesgo cardiovascular independiente.
Efectos del tratamiento sobre el riesgo cardiovascular en la psoriasisSi la psoriasis grave o la inflamación asociada a la misma conllevan un incremento del riesgo de enfermedad cardiovascular independiente de los factores de riesgo tradicionales, el adecuado control terapéutico de la enfermedad contribuiría a reducir la morbimortalidad cardiovascular, como parece ser el caso en la artritis reumatoide cuando se trata con metotrexato26 o antagonistas del factor de necrosis tumoral α (anti-TNF)27. Recientemente se han publicado evidencias indirectas y epidemiológicas en favor de esta hipótesis en el caso de la psoriasis, que se discuten a continuación. La información disponible se ampliará sin duda en el futuro con nuevos datos epidemiológicos, pero no con ensayos clínicos, impracticables por la duración y número de pacientes requeridos.
Posibles efectos beneficiososExisten indicios epidemiológicos de que el tratamiento con metotrexato, en especial a dosis bajas y asociado a suplementos de ácido fólico, reduce la incidencia de enfermedad vascular en pacientes con psoriasis o artritis reumatoide28. En un estudio llevado a cabo en una cohorte de 25.554 pacientes afiliados a una compañía aseguradora estadounidense, diagnosticados de psoriasis (ICD9 696.1) y que habían recibido tratamiento sistémico o fototerapia se observó una tendencia a un aumento en el cociente de riesgo para infarto de miocardio en los primeros (HR 1,33; IC 95% 0,90-1,96)29. Aunque la diferencia no era significativa, el cociente de riesgo en los pacientes sometidos a tratamiento sistémico dependía de la edad: en pacientes menores de 50 años el HR era 0,65 (IC 95% 0,32-1,34), mientras que en los de edades comprendidas entre 50 y 70 era de 1,37 (IC 95% 0,79-2,38).
Por lo que respecta al tratamiento biológico, se han publicado datos de un estudio retrospectivo en una cohorte de 11.475 pacientes con psoriasis o artritis psoriásica afiliados al plan de salud Kaiser Permanente South California30. Los resultados de este estudio sugieren que el tratamiento con fármacos anti-TNF se asocia con una reducción significativa (del 44%) en la incidencia de infarto de miocardio en comparación con la de los pacientes con psoriasis leve, sometidos a tratamiento tópico. En el análisis multivariante se identificaron como factores protectores el tratamiento con inhibidores del TNF, el sexo femenino, la edad igual o inferior a 65 años y el tratamiento con estatinas, mientras que se asociaban con un mayor riesgo de infarto la presencia de diabetes tipo 2, dislipidemia, hipertensión y artritis psoriásica30.
Por otra parte, en pacientes con psoriasis y artritis psoriásica se ha descrito una reducción significativa de los niveles de PCR a las 12 semanas de tratamiento con etanercept, con independencia del tratamiento concomitante con estatinas, y una asociación entre el PASI basal y los niveles basales de PCR con independencia del índice de masa corporal, aunque la mejoría en los niveles de PCR era inferior en los pacientes obesos31. Esta diferencia podría relacionarse con la menor eficacia de los tratamientos biológicos a dosis fijas en el tratamiento de la psoriasis en los pacientes obesos o de peso superior a 90-100kg32.
El efecto beneficioso del tratamiento eficaz de la psoriasis sobre los marcadores biológicos del riesgo cardiovascular también se ha descrito en el caso de la fototerapia24 y el tratamiento sistémico en general33.
Posible efecto perjudicial de los anti-TNF en la insuficiencia cardíaca congestivaLos efectos directos e indirectos del TNF sobre el miocardio son complejos y difíciles de comprender: el TNF puede provocar hipertrofia del cardiomiocito y afectar indirectamente al corazón por medio de la inflamación crónica34. Se han descrito elevaciones en los niveles séricos de TNF en un alto porcentaje de pacientes con insuficiencia cardíaca congestiva (ICC), que se asocian con una disminución de la supervivencia35. Sin embargo, en los 3 ensayos clínicos efectuados con inhibidores del TNF (etanercept e infliximab) en pacientes con ICC no se demostró un efecto terapéutico36, y en un ensayo llevado a cabo con infliximab la mortalidad en el grupo tratado con infliximab a dosis de 10mg/kg (superiores a las que se emplean en la psoriasis o la artritis reumatoide) fue superior a la del grupo placebo37. En estos datos se basa la contraindicación del empleo de anticuerpos anti-TNF en pacientes con ICC grado III-IV de la New York HeartAssociation (NYHA) y la recomendación de una especial precaución cuando se emplea etanercept, que recogen las correspondientes fichas técnicas.
Es recomendable remitir al cardiólogo a los pacientes con ICC grados I-II de la NYHA (ausencia de síntomas o ligera limitación con esfuerzos muy intensos o intensos) antes de iniciar el tratamiento con anti-TNF y en el transcurso del mismo, en especial si existe disnea de esfuerzo, para descartar que la fracción de eyección sea menor del 45-50% o detectar signos objetivos de ICC (fibrilación auricular, alteraciones ecográficas o niveles elevados de propéptido natriurético cerebral)38. Ustekinumab podría considerarse el biológico de primera elección en pacientes con ICC, puesto que no se menciona ninguna contraindicación o precaución especial en la ficha técnica del producto39.
Las cardiopatías diferentes de la ICC no contraindican el tratamiento con biológicos, y de hecho los anti-TNF podrían proteger contra el desarrollo de enfermedad cardiovascular31.
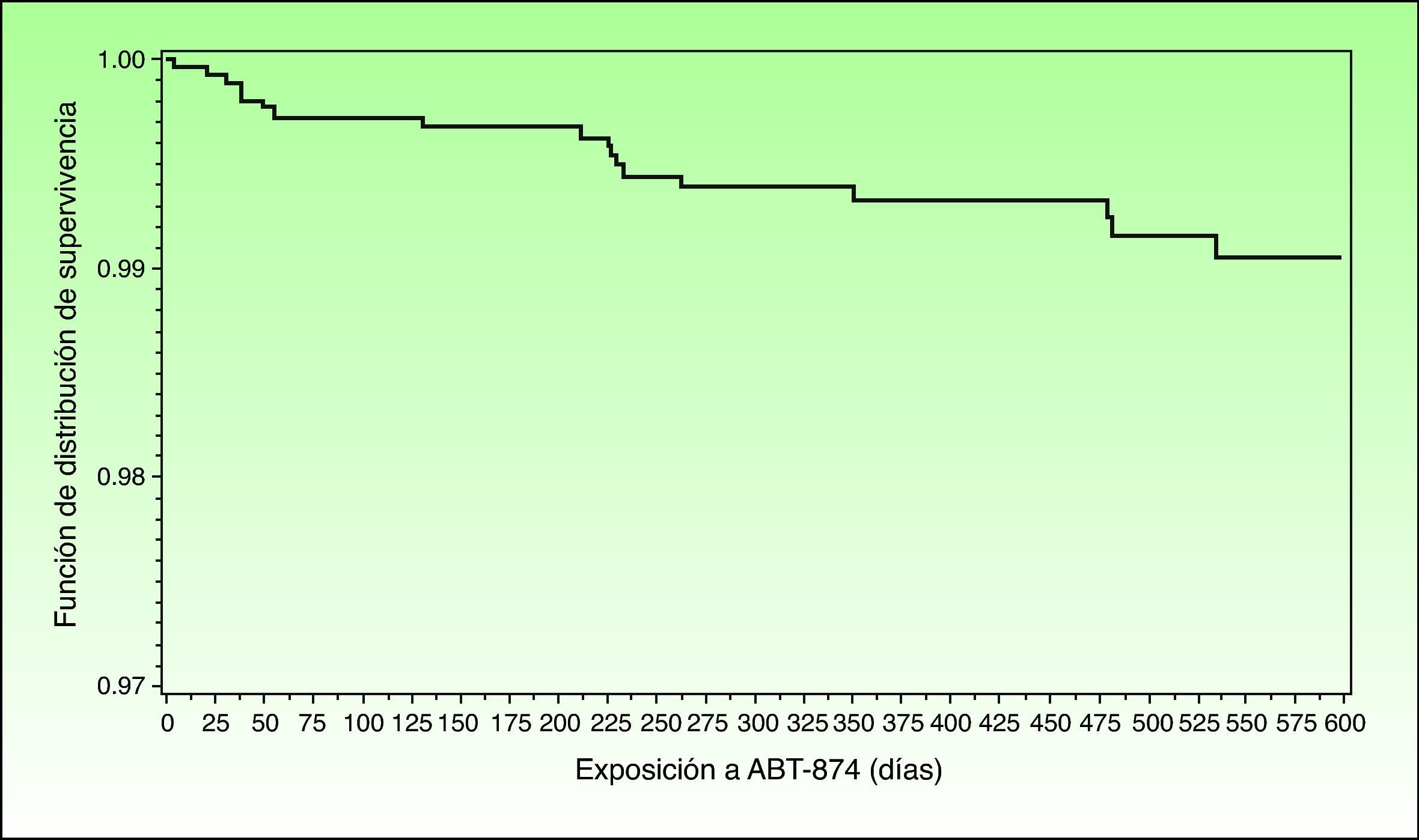
Incidencia de acontecimientos adversos cardiovasculares mayores en los ensayos clínicos de biológicosEn uno de los 4 ensayos pivotales de briakinumab, un anticuerpo monoclonal anti-p40, se detectaron 18 casos de MACE (11 infartos de miocardio no letales, 3 accidentes cerebrovasculares no letales y 4 muertes de causa cardiovascular) hasta finales de noviembre de 2009. Cinco de estos acontecimientos adversos tuvieron lugar durante las 12 primeras semanas de tratamiento controlado con un grupo placebo (en el que no se produjeron MACE), 2 entre la semana 12 y la semana 52, y 11 en la fase de extensión abierta40. La frecuencia de aparición de los MACE se distribuyó de forma aparentemente homogénea en el tiempo, no apareciendo ningún patrón claro que indicara que fueran más frecuentes en un período determinado (fig. 1). Las correspondientes tasas de incidencia fueron 1,33/100 pacientes-años (IC 95% 0,43-3,10) en la fase controlada con placebo y 0,60 (IC 95% 0,35-0,94) en todos los períodos de tratamiento con briakinumab. La tasa de MACE fue superior en los pacientes con 2 o más factores de riesgo (antecedente de diabetes, obesidad, hipertensión (≥140/90) basal no controlada o antecedentes de enfermedad cardiovascular (2,15 eventos/100 pacientes-años) que en los otros (0,13 eventos/100 pacientes-años) y el protocolo se enmendó en consecuencia41. Es interesante hacer notar que en la fase controlada con placebo o etanercept de los otros 2 ensayos clínicos publicados no se observaron MACE41–43, ni tampoco en otro ensayo en el que se comparó briakinumab con metotrexato y se dispone de 52 semanas de seguimiento44. Sin embargo, las tasas de infecciones, neoplasias e infecciones ajustadas a la exposición fueron superiores en el análisis combinado de los 3 primeros ensayos42 y en el cuarto45. Por razones no aclaradas, aunque posiblemente relacionadas con el coste de efectuar estudios adicionales, el laboratorio promotor primero retiró la solicitud de autorización de comercialización de briakinumab (Ozespa®)45 y posteriormente suspendió su desarrollo clínico, en julio de 2011.
Función de distribución de supervivencia que muestra el tiempo transcurrido hasta la aparición de los MACE ocurridos a partir de la primera administración de briakinumab hasta 101 días después de la última dosis de briakinumab en los estudios M05-736, M06-890, M10-114, M10-315, M10-255, y M10-016 (análisis provisional de los datos a fecha 26 de noviembre de 2009). Fuente: Langley R, et al.41.
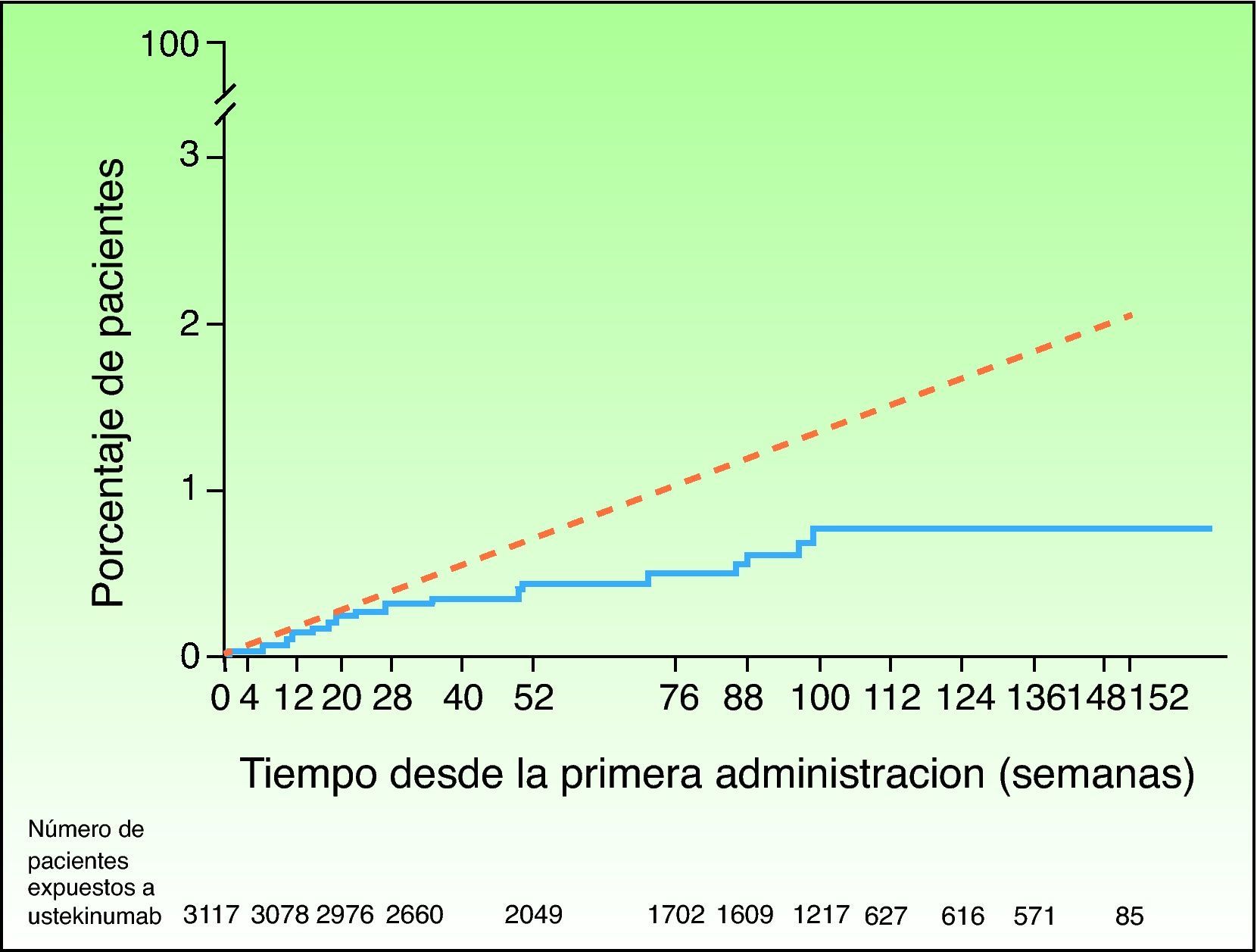
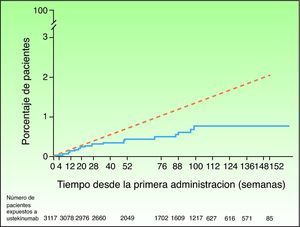
Ante la sospecha de que este desequilibrio numérico en la incidencia de MACE en la fase controlada con placebo de uno de los ensayos clínicos de briakinumab fuera una señal indicadora de un posible efecto adverso de clase y no un producto de la casualidad en una población con alto riesgo de enfermedad cardiovascular, se ha llevado a cabo un análisis de seguridad de los ensayos clínicos efectuados con ustekinumab para el tratamiento de la psoriasis y en otras posibles indicaciones46. En la fase controlada con placebo se reportaron 5 MACE en 1.582 pacientes (0,3%; IC 95% 0,1-0,7) con psoriasis tratados con ustekinumab en los ensayos clínicos de fase II y III, y ninguno en los 732 pacientes asignados a recibir placebo (0,0%; IC 95% 0,0-0,5); el riesgo diferencial no fue estadísticamente significativo en ninguno de los estudios47. Las tasas de MACE permanecieron estables a lo largo del tiempo tanto en los períodos de los estudios controlados con placebo como en los no controlados; 19 de 3.117 pacientes tratados con ustekinumab sufrieron 21 MACE en un período de seguimiento de 3 años, siendo del 0,44% (IC 95% 0,27-0,67) la tasa combinada de MACE por 100 pacientes-años. El 95% de los pacientes que presentaron MACE tenían 2 o más factores de riesgo cardiovascular, en comparación con el 55% en los pacientes que no los presentaron. En comparación con las tasas esperadas a partir de los datos del Framingham Heart Study (EE. UU.) o la GPRD (Reino Unido), las tasas acumuladas de infarto de miocardio e ictus fueron similares hasta la semana 28 e inferiores posteriormente (fig. 2); la tasa de incidencia estandarizada de infartos e ictus en los ensayos clínicos de fase II/III de ustekinumab en la psoriasis oscila entre 0,34 y 0,52, lo que sugiere que el riesgo de ambos acontecimientos en la población tratada con ustekinumab en los ensayos clínicos podría ser inferior al de la población general de EE. UU. o la población con psoriasis de la GPRD47.
Tasas acumuladas de infarto de miocardio e ictus a lo largo del tiempo basadas en las estimaciones (Kaplan-Meier) del tiempo transcurrido hasta el primer acontecimiento en los pacientes tratados con ustekinumab en los ensayos de fase II y fase III para psoriasis (línea continua azul) y tasa esperada a lo largo del tiempo basada en un modelo predictivo desarrollado empleando datos del Framingham Heart Study, ajustando los factores de riesgo basales (línea discontinua roja). Fuente: http://www.nelm.nhs.uk/en/NeLM-Area/News/2011---January/17/Marketing-authorisation-application-for-briakinumab-Ozespa-withdrawn- (acceso 30 Enero 2012)45.
Los datos correspondientes a inhibidores del TNF son incompletos. Por lo que se refiere a etanercept, solo se ha publicado un estudio de 506 pacientes canadienses seguidos durante 48 meses, con una significativa tasa de abandonos y un período de seguimiento de 1.305 pacientes-años, en el que la tasa de MACE fue de 1,7 por 100 pacientes-años47. En el caso de adalimumab, se ha publicado una revisión de los datos de seguridad acumulados para todos los pacientes tratados con adalimumab en los ensayos clínicos de psoriasis moderada-grave48; durante los períodos iniciales controlados con placebo en los 3 estudios de registro se reportó un MACE en 294 pacientes-años de exposición a adalimumab (tasa de incidencia 0,34 por 100 pacientes-años [IC 95% 0,01-1,90]) y un MACE en 148 pacientes-año de exposición a placebo (tasa de incidencia 0,68, IC 95% 0,02-3,76)48. En los 7 estudios de registro de adalimumab se reportaron 15 MACE (6 infartos no fatales, 4 ictus no fatales, 5 muertes cardiovasculares) en 4.185 pacientes-años de exposición a adalimumab, con una tasa de incidencia de 0,36 por 100 pacientes-años (IC 95% 0,20-0,59)48.
En un metaanálisis recientemente publicado2 se han revisado 22 ensayos clínicos controlados con placebo de biológicos anti-TNF (adalimumab, etanercept e infliximab) y anti-p40 (briakinumab y ustekinumab), incluyendo a 10.183 pacientes, y se ha evaluado la diferencia absoluta en el riesgo de MACE durante la fase controlada con placebo. En el caso de los ensayos con anti-p40, 10 de 3.179 pacientes sufrieron MACE, en comparación con ninguno de los 1.474 expuestos a placebo. El riesgo diferencial (Mantel-Haenszel) fue de 0,012 por persona-año (IC 95% -0,001 - 0,026; p=0,12). En el caso de los ensayos con anti-TNF, solo se encontró un caso de MACE en 3.858 pacientes sometidos a tratamiento, y uno entre los 1.812 expuestos a placebo. El correspondiente riesgo diferencial fue de -0,0005 acontecimientos por persona-año (IC 95% -0,010–0,009; p=0,94).
La diferencia en el riesgo no fue significativa en ninguno de los casos, por lo que no se puede demostrar la hipótesis de que el tratamiento con biológicos de cualquier clase conlleve un aumento en el riesgo de MACE durante la fase controlada con placebo. Sin embargo, no puede descartarse que en una población mayor de pacientes pudiera encontrarse una diferencia estadísticamente significativa, los ensayos clínicos no son el formato idóneo para identificar señales de riesgo infrecuentes, para lo que son más adecuados los estudios de registros. Recientemente se ha publicado otro metaanálisis de los ensayos efectuados con anti-p40, empleado un método que excluye los ensayos en los que no se producen MACE49. En este metaanálisis se ha detectado un aumento significativo en el riesgo de MACE en los pacientes tratados con anticuerpos anti-p40 en comparación con los de los grupos placebo (OR = 4,23, IC 95% 1,07-16,75, P = 0,04), pero no cuando se consideran los ensayos de cada fármaco por separado..
Papel de la interleucina 17 en la aterogénesisRecientemente se ha propuesto que la IL-17 podría tener un papel estabilizador de la placa de ateroma50,51, lo que podría explicar un posible aumento en la incidencia de MACE al principio del tratamiento, no solo en el caso de los anticuerpos anti-p40, sino también en el de la nueva clase de antagonistas de la IL-17 actualmente en desarrollo52.
En cualquier caso, las evidencias son contradictorias. Por una parte, se ha demostrado la presencia de IL-17 e interferón-γ en placas de aterosclerosis coronaria, en las que se encuentran linfocitos T que expresan ambas citocinas, así como un efecto sinérgico de ambas en cuanto a la producción de citocinas proinflamatorias en cultivos de células de músculo liso vascular humano53. En otro estudio se ha identificado un incremento significativo en el número de linfocitos Th17 y los niveles de citocinas relacionadas con los mismos (IL-17, IL-6 e IL-23) en sangre periférica de pacientes con síndrome coronario agudo, asociado con una disminución en los niveles de citocinas relacionadas con los linfocitos Treg (IL-10 y transforming growth factor [TGF]-β1) en comparación con pacientes con angina estable y controles54. Recientemente se ha propuesto que este incremento en número y activación se limitaría a los linfocitos Th1 y a una subpoblación recientemente descrita de linfocitos Th17/Th1, pero no afectaría a los Th17 de forma global55.
En el año 2009, Taleb et al.49 publicaron un estudio en el que demostraban que la deleción del gen del suppressor of cytokine signaling 3 (SOCS3) en linfocitos T de ratones predispuestos genéticamente a la aterosclerosis por una doble deleción del receptor de las lipoproteínas de baja densidad (Ldlr−/−) inducía la producción de IL-17 e IL-10 y conducía a una reducción dependiente de IL-17 en el desarrollo de lesiones y la inflamación vascular. La administración de IL-17 in vivo reducía la expresión endotelial de vascular cell adhesión molecule 1 (VCAM1) y la infiltración de linfocitos T en los vasos y limitaba el desarrollo de las lesiones de aterosclerosis. Por el contrario, la sobreexpresión de SOCS3 en los linfocitos T reducía los niveles de IL-17 y aceleraba la aterosclerosis. En muestras humanas procedentes de endarterectomía carotídea, estos autores observaron un aumento en la expresión de IL-17 en las placas con fenotipo estable (fibroso) en comparación con las placas con fenotipo inestable (ateromatoso)51.
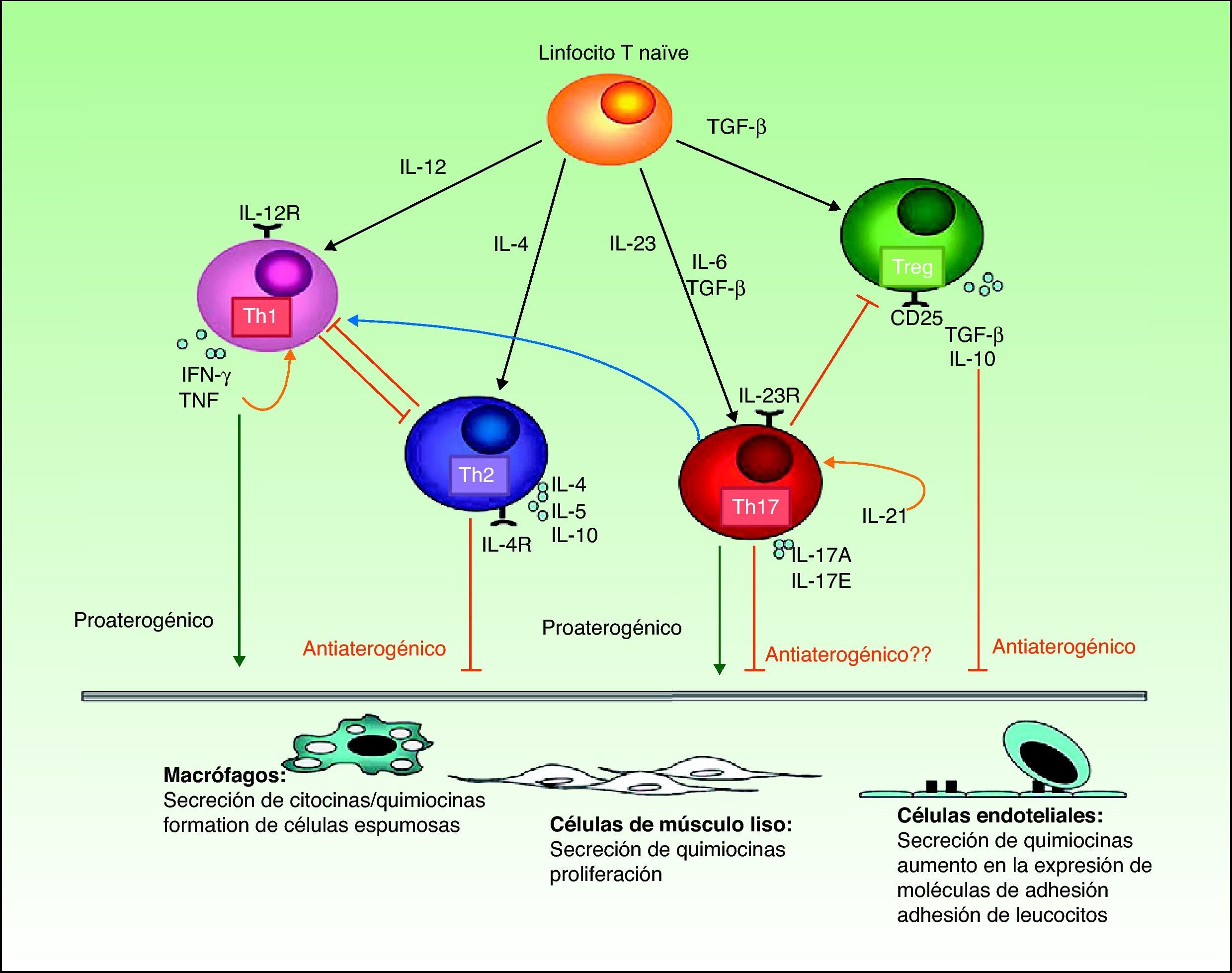
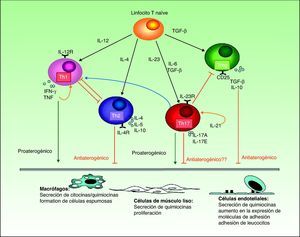
Sin embargo, la mayoría de los estudios publicados indican que tanto las citocinas Th1 como Th17 tienen un efecto proinflamatorio favorecedor del desarrollo de la placa de ateroma (fig. 3). La activación de la respuesta Th1 por la IL-12 es bien conocida tanto en la psoriasis como en la aterosclerosis, siendo en esta última necesaria no solo para la iniciación de las placas sino también para la perpetuación de su inflamación y el desarrollo del fenotipo inestable, propenso a la ruptura56. Los linfocitos Th17 producen IL-17, IL-6, IL-21, IL-22 y TNF, y ejercen un profundo efecto sinérgico sobre la aterogénesis. Aunque en las placas de aterosclerosis las células Th1 predominan en la proporción de 10 a 1 sobre las Th1754, estas tendrían un efecto sinérgico con las primeras. La mayor parte de la evidencia experimental y los estudios de biomarcadores indican una conexión entre la IL-17 y la inestabilidad de las placas de aterosclerosis que podría explicar en parte el riesgo aumentado de infarto de miocardio en los pacientes con psoriasis57.
La evidencia más directa del papel proaterogénico de la IL-17 procede de estudios muy recientes57. Van Es et al.58 trasplantaron ratones Ldlr−/− con médula ósea de ratones carentes de receptor de IL-17, observando una reducción de las lesiones inducidas por una dieta de tipo occidental en la aorta de los ratones trasplantados. Xie et al.59 demostraron que los ratones apoE -/- presentan un aumento en los niveles de citocinas Th17 (IL-17, IL-6) con una disminución en el número de linfocitos Treg y la correspondiente citosina TGF-β1 en comparación con ratones C57BL/6J (sin deleción) de la misma edad. En el mismo modelo de ratones con deleción de apoE, propensos al desarrollo de aterosclerosis, la administración de un anticuerpo bloqueador de la IL-17A producido en ratas reduce el desarrollo de lesiones ateroescleróticas y disminuye la vulnerabilidad de las placas, la infiltración celular, la activación endotelial y la secreción de citocinas60. La administración de un anticuerpo de rata anti-IL-17A en otro estudio también produjo una reducción en el tamaño de las placas en ratones apoE-/-, aunque no se observó una reducción en los niveles de IL-17A61. Por el contrario, la administración de un anticuerpo de ratón anti-IL-17A no alteró el tamaño de las lesiones pese a reducir los niveles de IL-17A62. En cualquier caso, el bloqueo de IL-17A no inhibiría la acción de otras isoformas de IL-17, ni tampoco de otras citocinas derivadas de los linfocitos Th17, cuyo papel es poco conocido62. Recientemente se ha descrito un incremento en el número de linfocitos T IL-17A+ en la aorta de ratones apoE-/− de edad avanzada, así como la reducción en el desarrollo de lesiones de aterosclerosis inducidas por la dieta occidental en estos ratones cuando se bloquea la IL-17A con receptor soluble de IL-1763.
Por otra parte, los ratones C57BL/6 con deleción IL-17A-/− desarrollan, al cabo de 12 semanas de alimentación rica en grasas, lesiones de aterosclerosis más pequeñas y con menos depósito de lípidos que sus congéneres sin deleción58. Aunque el papel exacto de la IL-17 en la aterosclerosis continúa siendo controvertido, los estudios más recientes han proporcionado evidencias bastante directas de su papel predominantemente proaterogénico, aunque probablemente sea muy complejo y dependiente tanto de la concentración local en las diferentes etapas de la formación de las placas como de las diferentes isomorfas de la citocina62,63. En los seres humanos, la expresión de IL-17A parece asociarse con una mayor inflamación y vulnerabilidad en las placas de aterosclerosis64. La expresión constitutiva de IL-17E por las células residentes en las placas de aterosclerosis, y la presencia adicional de linfocitos B IL-17E+ y neutrófilos IL-17A/F+ en las placas avanzadas y complicadas indica que la contribución de la familia de citocinas IL-17 es compleja y dependiente del estadio y actividad de la enfermedad65.
En cualquier caso, la evidencia científica actualmente disponible no permite afirmar que la administración de cualquier biológico se asocie con un riesgo aumentado de MACE en los pacientes con psoriasis moderada-grave, y existe creciente evidencia epidemiológica de que el adecuado tratamiento de la psoriasis y la inflamación asociada con la enfermedad puede reducir el riesgo de morbimortalidad cardiovascular, de por sí elevado en estos pacientes por el aumento en la prevalencia de los factores de riesgo tradicionales. Por otra parte, existe abundante evidencia epidemiológica que sugiere que la psoriasis moderada-grave constituye un factor de riesgo independiente de enfermedad y muerte de causa cardiovascular, especialmente en los pacientes jóvenes.
Sin duda, es fundamental evaluar adecuadamente el riesgo cardiovascular en estos pacientes al inicio del tratamiento y de forma periódica, para corregir los factores de riesgo tradicionales según los algoritmos terapéuticos vigentes. En los pacientes con psoriasis moderada-grave, que comparten con los afectos de artritis reumatoide un aumento en el riesgo cardiovascular debido al componente inflamatorio de la propia enfermedad, probablemente sea conveniente multiplicar por 1,5 la puntuación obtenida según Framingham o SCORE, al igual que se ha propuesto en los pacientes con artritis reumatoide66.
Se requieren estudios adicionales para establecer el papel de la presencia de artritis psoriásica o niveles de PCR elevados u otros indicadores de actividad inflamatoria en esta evaluación, así como el eventual efecto del correcto control de la psoriasis y el tratamiento administrado.
Conflicto de interesesEl Dr. Lluis Puig ha participado en ensayos clínicos patrocinados por Abbott, Janssen, Merck y Pfizer, y ha percibido honorarios como asesor o ponente por parte de Abbott, Janssen, Merck y Pfizer.