Los estudios epidemiológicos sobre incidencia de dermatitis alérgica de contacto en población pediátrica son escasos. Algunos trabajos consideran que se trata de una entidad infradiagnosticada, y que en muchos casos no se sospecha clínicamente, no realizándose pruebas epicutáneas. No obstante se han comunicado tasas prevalencia de hasta el 20% de sensibilización a alérgenos en la población pediátrica, por lo que probablemente debería ser tenida en cuenta como una posibilidad diagnóstica en este grupo de edad.
Material y métodoSe ha realizado un análisis retrospectivo de la base de datos de alergia cutánea del servicio de Dermatología del Hospital General seleccionando los casos diagnosticados en niños de entre 0 y 16 años durante los u¿ltimos 15 años (año 2000 hasta 2015). El estudio incluye variables epidemiológicas (edad, sexo, antecedentes de atopia) y clínicas (localización de las lesiones, baterías de alérgenos empleadas, alérgenos positivos y su relevancia).
ResultadosDe los 4.593 pacientes estudiados con pruebas epicutáneas en los u¿ltimos 15 años, 265 (6%) correspondían a niños de 0-16 años. Ciento cuarenta y cuatro pacientes (54,3%) mostraron positividad para al menos uno de los alérgenos parcheados. Los alérgenos más frecuentemente identificados fueron en orden decreciente: tiomersal, cloruro de cobalto, colofonia, parafenilendiamina, dicromato potásico, mercurio y níquel. La sensibilización fue considerada de relevancia presente en 177 casos (61,3%).
ConclusiónMás de la mitad de los niños estudiados mostraron sensibilización a uno o más alérgenos, con un porcentaje importante de sensibilizaciones relevantes. Todo niño con sospecha clínica de dermatitis alérgica de contacto debería ser remitido para realización de pruebas epicutáneas. Al no existir pruebas estandarizadas en este colectivo se requiere un alto nivel de sospecha clínica y un conocimiento de los alérgenos más frecuentemente implicados de cara a seleccionar los alérgenos a parchar.
Few epidemiological studies have investigated the incidence of allergic contact dermatitis in children. Underdiagnosis has been observed in some studies, with many cases in which the condition is not suspected clinically and patch tests are not performed. However, the prevalence of pediatric sensitization to allergens has been reported to be as high as 20%, and the diagnosis should therefore be contemplated as a possibility in this age group.
Material and methodsWe performed a retrospective analysis of the skin allergy database of the Dermatology Department of Consorcio Hospital General Universitario de Valencia. Children between 0 and 16 years of age diagnosed with allergic contact dermatitis in the previous 15 years (between 2000 and 2015) were included in the analysis. Epidemiological (age, sex, history of atopy) and clinical (site of the lesions, allergen series applied, positive reactions, and their relevance) variables were gathered.
ResultsPatch tests had been performed on 4,593 patients during the study period. Of these, 265 (6%) were children aged between 0 and 16 years. A positive reaction to at least one of the allergens tested was observed in 144 (54.3%) patients in that group. The allergens most frequently identified were the following (in decreasing order of frequency): thiomersal, cobalt chloride, colophony, paraphenylenediamine, potassium dichromate, mercury, and nickel. The sensitization was considered relevant in 177 (61.3%) cases.
ConclusionsMore than half of the children studied showed sensitization to 1 or more allergens, with a high percentage of relevant sensitizations. All children with a clinical suspicion of allergic contact dermatitis should be referred for patch testing. As no standardized test series have been developed for this age group, a high level of clinical suspicion and knowledge of the allergens most commonly involved are required when selecting the allergens to be tested.
Clásicamente, la dermatitis alérgica de contacto (DAC) ha sido considerada una enfermedad propia del adulto. Además, en la población pediátrica, la presencia de una dermatitis eczematosa tiende habitualmente a orientarse como una dermatitis atópica. Sin embargo en los últimos años se ha producido una concienciación de la importancia de la DAC en los niños1–3.
Los estudios epidemiológicos de DAC pediátrica revelan una incidencia creciente4–7. No obstante, los resultados de estos estudios son difíciles de comparar debido a la variación en la metodología de las pruebas, los alérgenos parchados, la demografía de la población estudiada y los criterios de selección de los niños remitidos para estudio.
El objetivo de nuestro estudio es determinar la prevalencia de DAC en la población pediátrica que acude remitida a la consulta de Alergia Cutánea de un hospital terciario en nuestro medio, así como conocer los alérgenos más frecuentes y las características clínicas y epidemiológicas de los niños con DAC.
Material y métodoSe han identificado todos los niños entre 0 y 16 años remitidos a la Unidad de Alergia Cutánea de nuestro servicio para estudio con pruebas epicutáneas. En todos los casos se realizó estudio con la batería estándar del Grupo Español de Investigación en Dermatitis de Contacto y Alergia Cutánea (GEIDAC) (Martitor®, Barcelona, España) así como con los productos propios aportados por el paciente y baterías adicionales en función de la sospecha clínica en cada caso. Los alérgenos se aplicaron en la espalda de los pacientes sobre piel aparentemente sana y se ocluyeron durante 48h. La lectura se realizó a las 48 y 96h. La reacción cutánea se valoró en función de los criterios del International Contact Dermatitis Research Group (ICDRG). Todos los datos clínicos y los resultados de las lecturas fueron almacenados prospectivamente en una base de datos informatizada. La prueba χ2 se realizó para comparar las diferentes proporciones en la población sensibilizada y no sensibilizada. Para comparar la edad en los diferentes grupos se empleó la prueba U de Mann-Whitney.
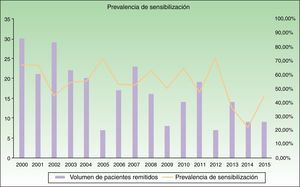
ResultadosSe analizaron los datos de 4.593 pacientes remitidos a la consulta de Alergia cutánea entre los años 2000 y 2015, de los cuales 265 (5,7%) eran niños entre 0 y 16 años. De estos, 144 (54,3%) mostraron positividad para al menos un alérgeno (tabla 1 y fig. 1).
Características epidemiológicas de los niños estudiados
| Total (n=265) | Parche positivo (n=144) | Parche negativo (n=121) | ||||
|---|---|---|---|---|---|---|
| Sexo, n (%) | Niños, 110 (41,5) | Niñas, 155 (58,5) | Niños, 59 (41) | Niñas, 85 (59) | Niños, 51 (42,1) | Niñas, 70 (57,9) |
| Rango de edad (años) | 1-16 | 2-16 | 1-16 | 2-16 | 2- 6 | 2-16 |
| Grupo de edad, n (%) | ||||||
| 0-2 años | 1 (0,4) | 0 (0) | 1 (0,7) | 0 (0) | 0 (0) | 0 (0) |
| 2-5 años | 7 (2,6) | 7 (2,6) | 2 (1,4) | 3 (2,1) | 5 (4,1) | 4 (3,3) |
| 5-10 años | 30 (11,3) | 40 (15,1) | 16 (11,1) | 21 (14,6) | 14 (11,6) | 19 (15,7) |
| 10-15 años | 58 (21,9) | 85 (32,1) | 32 (22,2) | 44 (30,6) | 26 (21,5) | 41 (33,9) |
| >15 años | 14 (5,3) | 23 (8,7) | 8 (5,6) | 17 (11,8) | 6 (5) | 6 (5) |
De los 144 niños sensibilizados, 113 (84%) presentaron parches positivos con relevancia presente. Se detectaron un total de 302 parches positivos con una media de 2,1 parches positivos por paciente.
La edad media±desviación estándar de los pacientes remitidos fue de 11,1±3,7 años, no hallando diferencias estadísticamente significativas en la edad de niños con y sin DAC.
De los 265 niños estudiados, 155 (58,5%) eran niñas y 110 (41,5%) niños. Entre los pacientes sensibilizados había 85 niñas (59%) y 59 niños (41%) y entre los pacientes con parche negativo había 70 niñas (57,9%) y 51 niños (42,1%). La prueba χ2 no mostró una relación significativa entre el sexo y el hallazgo de un parche positivo.
Respecto a la edad de presentación, no se encontraron diferencias estadísticamente significativas en la prevalencia de sensibilización entre los niños de 0-2 años, 2-5 años, 5-10 años, 10-15 años y >15 años.
Las reacciones positivas por localización se muestran en la tabla 2. La localización que se correlacionó más frecuentemente con un parche positivo fue el tronco, con 16 parches positivos (80%) en 20 pacientes con lesiones en tronco.
De los 265 niños estudiados, 70 (6,4%) presentaron antecedentes de atopia. Los niños sin antecedentes de atopia presentaron una prevalencia de sensibilización 1,3 veces superior a los niños con antecedentes de atopia. La prueba χ2 demostró una diferencia débilmente significativa (p=0,049) entre la ausencia de antecedentes personales de atopia y la DAC.
Los alérgenos más frecuentemente encontrados fueron, por orden, tiomersal (27 casos), colofonia (24 casos), parafenilendiamina (PPDA, 22 casos), metales (dicromato potásico, 21 casos; mercurio, 21 casos y níquel, 17 casos), fragancias (mezcla de perfumes i y ii, 11 casos; bálsamo de Perú, 6 casos) y gomas (mezcla mercapto, 12 casos; mezcla thiuram, 4 casos). Los alérgenos con más casos relevantes fueron la colofonia (100%), el ketoprofeno (100%) y la PPDA (86,4%). Los alérgenos con menos casos relevantes fueron el bálsamo de Perú (33,3%), el níquel (29,4%) y el tiomersal (22,2%). En la tabla 3 se enumeran los alérgenos más frecuentes y el número de casos con relevancia presente.
Alérgenos más frecuentes y su prevalencia en la población pediátrica estudiada. Se desglosan los casos de relevancia presente
| Orden | Alérgeno | Total, n (%) n=265 | Relevancia presente, n (%) |
|---|---|---|---|
| 1 | Tiomersal | 27 (10,19) | 6 (22,2) |
| 2 | Cloruro de cobalto | 24 (9,05) | 11 (45,83) |
| 3 | Colofonia | 24 (9,05) | 24 (100) |
| 4 | PPDA | 22 (8,3) | 19 (86,4) |
| 5 | Dicromato potásico | 21 (7,9) | 15 (71,4) |
| 7 | Mercurio | 21 (7,9) | 8 (38,1) |
| 6 | Níquel | 17 (6,41) | 5 (29,4) |
| 8 | Mezcla de perfumes (i+ii) | 13 (4,9) | 7 (53,9) |
| 10 | Mezcla mercapto | 12 (4,53) | 8 (66,7) |
| 9 | Bálsamo de Perú | 6 (2,65) | 2 (33,3) |
| 11 | Mezcla thiuram | 4 (1,5) | 2 (50) |
| 12 | Mezcla caína | 4 (1,5) | 0 (0) |
| 13 | Ketoprofeno | 4 (1,5) | 4 (100) |
| 14 | Peróxido de benzoilo | 3 (1,13) | 2 (66,7) |
| 15 | p-ter-butilfenol-formaldehido | 3 (1,13) | 1 (33,3) |
| 16 | Isoeugenol | 3 (1,13) | 2 (66,6) |
El tiomersal fue el alérgeno más frecuente, con 27 parches positivos, aunque la mayoría de los casos (87,8%) se consideraron de relevancia desconocida.
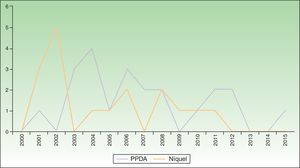
Se encontraron 17 casos de sensibilización al níquel, con una prevalencia de sensibilización 6 veces superior en favor del sexo femenino (p=0,01). Más de la mitad (58,8%) de los niños con sensibilización a níquel presentaron cosensibilización a cobalto. En el periodo 2010-2015 los casos de sensibilización al níquel han disminuido un 71% frente al periodo 2004-2009. En los últimos 3 años no se ha diagnosticado ningún caso de sensibilización al níquel (fig. 2).
Se encontraron 22 casos de sensibilización a PPDA, con un número de casos estable a lo largo del tiempo (fig. 2). Todos los casos se manifestaron tras la realización de un tatuaje temporal de henna negra.
De los 21 casos de sensibilización a cromo, 15 (71,4%) se localizaron en los pies, estando todos ellos relacionados con el calzado y considerándose de relevancia presente.
La sensibilización a mercurio se consideró de relevancia presente en 8 casos (38,1%). Once (52,3%) de los niños sensibilizados presentaron también sensibilización al tiomersal.
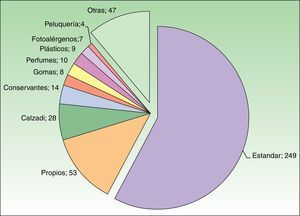
Las baterías adicionales más empleadas fueron la de calzado y la de conservantes (fig. 3). De los 302 parches positivos, 262 (87%) se diagnosticaron mediante la batería estándar y solo 40 (13%) correspondieron a alérgenos de baterías complementarias. En 53 casos se parcharon productos propios. La prueba con productos propios fue determinante en el diagnóstico de 17 casos que no se hubieran detectado sin parcharlos con el producto propio (fundamentalmente fotoprotectores y fármacos tópicos).
DiscusiónEn nuestro estudio la prevalencia de sensibilización en los niños remitidos a una consulta de alergia cutánea es del 54,3%. Este valor es similar al de otros estudios descritos en la literatura4–10. Sin embargo se trata de un parámetro muy variable, que depende de los criterios de derivación y de las características epidemiológicas y de exposición a alérgenos de la población estudiada.
A diferencia de nuestro trabajo, muchos estudios hallan una mayor prevalencia de DAC en la población femenina6,7. Se han sugerido factores hormonales y de exposición, pero sobre todo el mayor uso de bisutería y perforación del pabellón auricular en edades tempranas en el caso de alergia al níquel. En nuestro estudio, aunque no encontramos diferencias significativas en la prevalencia de sensibilización en niños y niñas, en el caso de la sensibilización al níquel sí que se encontró una prevalencia 6 veces superior en niñas, apoyando los datos publicados en otros trabajos. Probablemente esto justifica el predominio femenino en DAC pediátrica hallado en muchos estudios en los que el níquel es la causa más frecuente de DAC6,7.
La relación entre la atopia y la DAC es controvertida1,2,6. En nuestro trabajo encontramos una menor prevalencia de DAC en niños atópicos, con una débil significación estadística. Estos hallazgos coinciden con algunos estudios que describen una menor incidencia de alergia cutánea en los pacientes con atopia1,2,7.
Los alérgenos más frecuentes en nuestro estudio fueron los compuestos mercuriales, los metales presentes en bisutería, la PPDA, los productos presentes en el calzado y las fragancias. Estos alérgenos y su prevalencia son muy similares a los encontrados en la población adulta durante el mismo periodo (tabla 4).
Alérgenos más frecuentes encontrados en la población adulta entre 2000-2015 y su prevalencia
| n=4.328 | |
|---|---|
| Níquel | 979 (22,62%) |
| Cloruro de cobalto | 403 (9,31%) |
| Dicromato potásico | 314 (7,26%) |
| Parafenilendiamina | 239 (5,52%) |
| Tiomersal | 236 (5,45%) |
| Kathon | 214 (4,94%) |
| Bálsamo de Perú | 195 (4,5%) |
| Mezcla perfumes | 182 (4,2%) |
| Mercurio | 130 (3%) |
| Mezcla thiuram | 121 (2,78%) |
Los compuestos mercuriales han sido el grupo de alérgenos más frecuente en niños en nuestra serie. En el caso del tiomersal la mayoría de las reacciones fueron de relevancia desconocida. Esto está en consonancia con numerosos trabajos, en los que el tiomersal se describe como un alérgeno muy prevalente en la población general pero con un bajo número de sensibilizaciones relevantes1,7,8. Por este motivo se está valorando la retirada del tiomersal de la batería estándar. Otra forma de sensibilización a mercurio con incidencia en descenso es el contacto con termómetros de mercurio rotos o el uso de antisépticos basados en compuestos mercuriales.
La bisutería y metales presentes en vestido y calzado han sido la segunda causa más frecuente de sensibilización después del tiomersal. Esto está en consonancia con numerosas series pediátricas en las que el níquel ha sido el alérgeno más frecuente7,11,12. La cosensibilización a cobalto es frecuente en pacientes sensibilizados al níquel o al cromo13,14. Desde que se reguló a nivel europeo la presencia de níquel en productos de bisutería15, el número de casos de sensibilización al mismo ha disminuido notablemente.
Destaca el elevado número de reacciones positivas a la PPDA, siendo la tercera causa de DAC en nuestro medio. Al igual que en otros estudios, el mecanismo más frecuente de sensibilización fue la realización de un tatuaje temporal con henna negra16. El empleo de PPDA en cosméticos (con la excepción de tintes capilares) está prohibido por la Unión Europea desde 200917,18. En el periodo 2010-2015 se ha producido una reducción de los casos de sensibilización a PPDA frente al periodo 2004-2009 pero continúan produciéndose casos pese a la prohibición de su uso en cosméticos. La sensibilización a PPDA es particularmente importante por la posibilidad de reacciones agudas graves que pongan en peligro la vida, la posibilidad de secuelas a largo plazo y su ubicuidad en múltiples productos cotidianos así como su reactividad cruzada con fármacos del grupo–para- (antidiabéticos orales, anestésicos tópicos, sulfamidas)19–21. A pesar de la alerta sanitaria y de las iniciativas legislativas, se hacen necesarias más medidas a nivel legal y educativo para regular la exposición de la población pediátrica a la PPDA y en concreto la realización de tatuajes temporales con henna negra.
El calzado es una causa frecuente de DAC pediátrica22. Las causas más frecuentes de DAC por calzado en niños son el dicromato potásico (empleado para curtir el cuero natural) y la resina de paraterbutilfenol-formaldehido (empleada como adhesivo)5,7,13. El 1 de mayo de 2015 entró en vigor una normativa de la Comisión Europea que limita el uso de sales de cromo en productos de piel, por lo que es de esperar una disminución de los casos de DAC por cromo en los próximos años15,23.
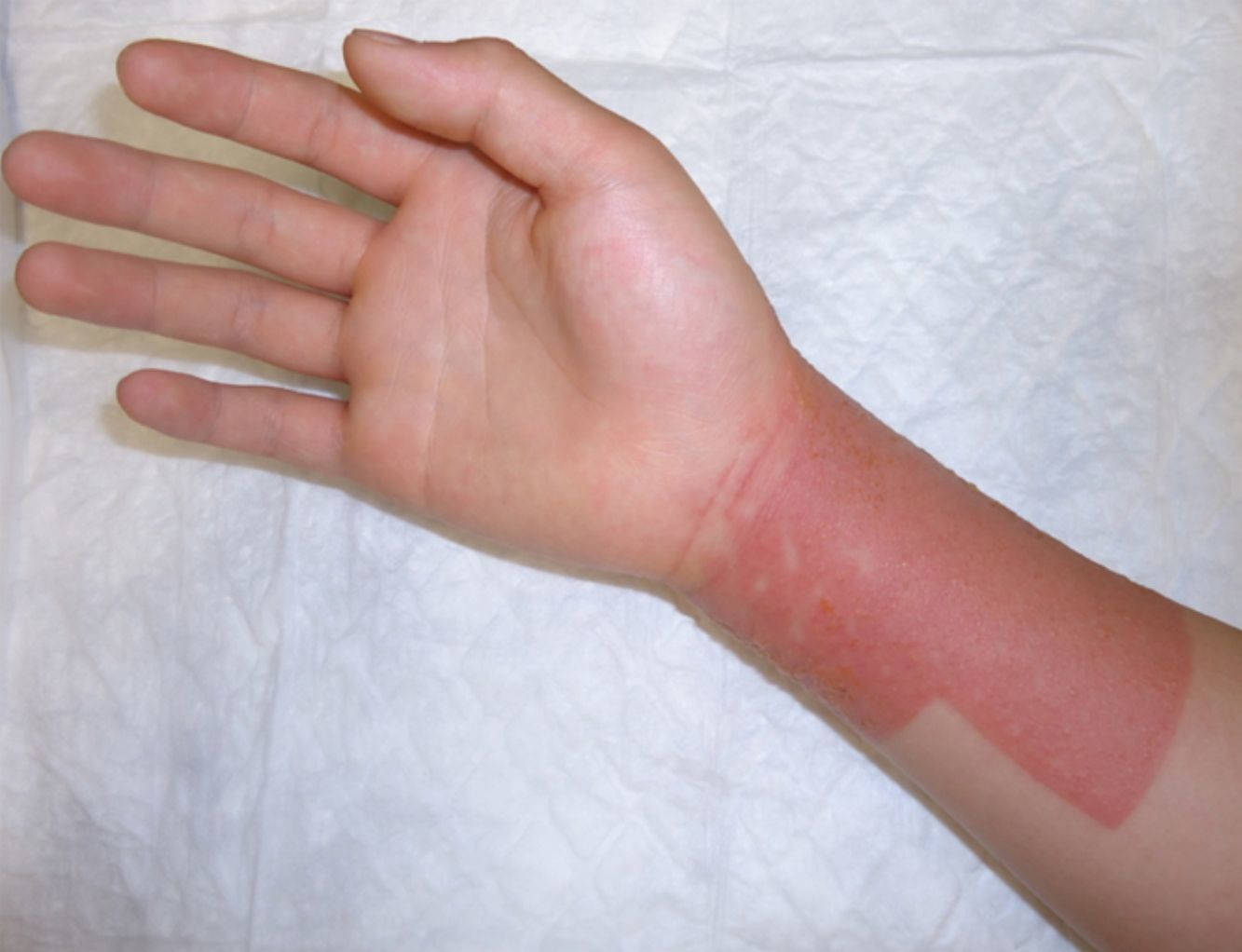
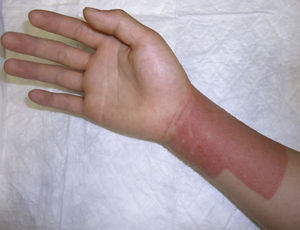
La colofonia es una resina presente en numerosos productos sanitarios adhesivos. Es una causa importante de DAC iatrogénica (fig. 4) aunque también pueden existir casos de DAC pediátrica por colofonia presente en zapatos de piel, pintalabios o incluso en instrumentos musicales24. La sensibilización a colofonia puede ser un marcador de alergia a fragancias25. En nuestra población todos los casos de alergia a colofonia estuvieron en relación con el uso de apósitos adhesivos, confirmando el importante papel iatrogénico de la misma.
La mayoría de las sensibilizaciones en nuestro estudio se han diagnosticado mediante la batería estándar. Recientemente la European Academy of Allergology and Clinical Immunology (EAACI) ha propuesto una batería estándar reducida dirigida a la población pediátrica (tabla 5)3. No obstante, nosotros, en consonancia con la mayoría de estudios epidemiológicos de DAC pediátrica, consideramos que la batería estándar del GEIDAC es la más útil para la exploración en niños. Esto se debe a que la batería reducida propuesta por la EAACI no incluye el cloruro de cobalto, la PPDA, el dicromato potásico, el mercurio y el bálsamo de Perú, estando todos ellos entre los 10 alérgenos más frecuentemente encontrados en nuestro trabajo. Además esta batería no incluye el parche con metilisotiazolinona aislada, una recomendación con cada vez más evidencia basada en trabajos que demuestran que el parche con mezcla metilisotiazolinona y metilcloroisotiazolinona es insuficiente6,26.
Batería recomendada por la EAACI para el estudio de DAC en niños
| Alérgenos recomendados como serie estándar en niños por la EAACI |
|---|
| Níquel, sulfato: 5% vas |
| Thiuram, mezcla: 1% vas |
| Mercapto, mezcla: 1% vas |
| Mercaptobenzotiazol: 2% vas |
| Fragancias, mezcla i: 8% vas |
| Fragancias, mezcla ii: 14% vas |
| Colofonia: 20% vas |
| Metilcloroisotiazolinona/Metilisotiazolinona: 100ppm acuosa |
| Lactonas sesquiterpénicas, mezcla: 0,1% vas. |
Los alérgenos más frecuentes causantes de DAC pediátrica en nuestro estudio son –como hemos comentado– alérgenos clásicos (tiomersal, metales, colofonia…) con cuadros clínicos bien conocidos. Para muchos de estos alérgenos se han establecido diversas medidas legislativas para limitar el riesgo de sensibilización, pudiendo ser esta la causa del número decreciente de casos remitidos para valoración en nuestro trabajo (fig. 1). Sin embargo en los últimos años se han descrito alérgenos emergentes con importancia creciente por su ubicuidad y frecuencia de casos de sensibilización así como por una menor regulación legal25–28. Es el caso de las fragancias y los conservantes presentes en cosméticos.
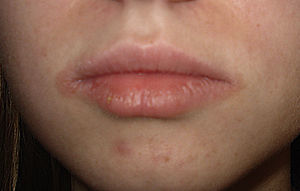
Las fragancias son un amplio grupo de compuestos químicos. Algunos estudios las posicionan como la segunda causa más frecuente de alergia de contacto en adultos en nuestro medio por detrás de los metales. Estos hallazgos concuerdan con nuestros resultados, en los que las fragancias supusieron la cuarta causa más frecuente de DAC tras el tiomersal, los metales y la PPDA. Es fundamental la realización de pruebas epicutáneas con una batería específica de fragancias en pacientes con una reacción positiva a marcadores de fragancias en la batería estándar (mezcla de perfumes i, mezcla de perfumes ii, colofonia y bálsamo de Perú) de cara a identificar las fragancias específicas a las que el paciente está sensibilizado y evitarlas. Es importante tener en cuenta que las fragancias no solo están presentes en perfumes y colonias, sino en una amplia gama de productos como barras labiales (fig. 5), maquillaje…
Entre los conservantes, la metilcloro y la metilisotiazolinona se han constituido como unos de los alérgenos más frecuentemente implicados en los casos de DAC en adultos en las últimas series publicadas28. En nuestro trabajo no hemos encontrado ningún caso de sensibilización a la metilcloro y la metilisotiazolinona en niños. No obstante, este alérgeno se encuentra presente en una amplia gama de cosméticos que se emplean con asiduidad en este grupo de edad (geles, champús, toallitas de limpieza, cremas hidratantes…)26,27. Algunos trabajos han detectado ya un volumen creciente de casos de alergia a la metilcloro y la metilisotiazolinona en niños y advierten que en un futuro cercano podría convertirse en uno de los alérgenos más frecuentes en esta población26,27.
Para finalizar, en lo que respecta a la legislación de alérgenos en la edad pediátrica, pese a que existe una estricta regulación de los alérgenos presentes en juguetes infantiles29, la regulación de los cosméticos destinados a niños es escasa. En 2012 se publicó una Resolución del Consejo de Europa con la intención de regular los productos cosméticos en niños menores de 3 años30. Sin embargo se limitan a directrices generales31, sin establecer sustancias que se deban evitar en niños añadidas a las ya prohibidas en la Directiva 76/768/EEC17 y el Reglamento CE 1223/200918. Se plantea así la necesidad de establecer medidas legislativas que protejan a la población pediátrica, particularmente vulnerable, de la exposición a potenciales alérgenos que actualmente están presentes en productos cosméticos habituales destinados a niños.
Como conclusiones, la DAC es una enfermedad frecuente en la población pediátrica y debe considerarse ante unas lesiones eczematosas sugestivas en un niño y una historia clínica compatible. Existen alérgenos clásicos con escasas sensibilizaciones relevantes o con una incidencia en descenso. Por otro lado hay alérgenos emergentes presentes sobre todo en cosméticos pediátricos y con una escasa regulación legal. Se debe estar alerta a la presencia de DAC por estos alérgenos emergentes con cuadros clínicos diferentes a los de los alérgenos «clásicos».
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.