El tumor glómico fue descrito por primera vez por Wood en 1812, siendo Masson quien le dio su nombre en 1924. Se trata de un tumor vascular benigno raro derivado del cuerpo glómico neuromioarterial. Clínicamente es característica la tríada de sensibilidad al frío, dolor paroxístico intenso y localización exquisita del punto doloroso. Aproximadamente el 80% de las lesiones se localiza en la extremidad superior y, de estas, la mayoría se sitúa en la zona subungueal. En el periodo 2005-2008 hemos tenido la oportunidad de ver 7 casos en nuestro Servicio, cuyo diagnóstico fue confirmado mediante el estudio histológico tras su extirpación. En este trabajo aprovechamos para revisar las características clínicas, las pruebas diagnósticas complementarias y las principales técnicas quirúrgicas descritas.
Glomus tumor was first described by Wood in 1812 and named as such by Masson in 1924. It is a rare benign vascular tumor of the neuromyoarterial glomus. The triad of cold intolerance, intense paroxysmal pain, and well-defined site of pain is characteristic of the tumor. Approximately 80% of lesions are found on the upper limbs, mostly under the nails. Between 2005 and 2008, 7 patients with this disease were seen in our department. Diagnosis was confirmed by histology after excision. We review the clinical features, complementary diagnostic tests, and main surgical techniques described.
El tumor glómico fue descrito por primera vez por Wood en 1812, siendo Masson quien le dio su nombre en 1924. Se trata de un tumor vascular benigno raro que deriva de las estructuras llamadas cuerpos glómicos 1,2. Estos son aparatos neuromioarteriales encargados de la regulación del flujo sanguíneo local y la termorregulación 3. Están localizados en la dermis de cualquier parte del tegumento, pero se concentran más en las manos y los pies 4,5. Hasta el 80 % se localizan en las extremidades superiores, siendo especialmente frecuentes en la región subungueal. Los tumores glómicos afectan con más frecuencia a pacientes de edad media, pero se han descrito en todas las edades. Es característica la tríada clínica de dolor paroxístico intenso, localización exquisita del punto doloroso y sensibilidad al frío 2,6. La presencia de estos síntomas es bastante sugestiva del diagnóstico, pero en muchos casos este se demora, por lo que no es infrecuente que los pacientes consulten por un intenso dolor subungueal de años de evolución. Durante el periodo 2005-2008 hemos tenido ocasión de ver 7 pacientes con tumores glómicos localizados en la zona subungueal, cuyo diagnóstico ha sido confirmado histológicamente tras su extirpación. Por ello, aprovechamos para hacer una revisión del manejo de este tipo de tumores.
EpidemiologíaLos tumores glómicos son poco frecuentes, constituyendo el 1-5 % de los tumores de la mano 6. El 25 al 75 % de estos se localiza en la zona subungueal 2,4, que es más frecuente en mujeres, siendo otras localizaciones más comunes en varones 5.
EtiopatogeniaAnatómicamente, los cuerpos glómicos a partir de los que se originan estos tumores consisten en una arteriola aferente, unos vasos anastomóticos (canales de Suquet-Hoyer), una vena colectora, el retículo intraglomerular (que contiene células glómicas, fibras nerviosas y células intersticiales) y una cápsula. Aunque la causa de los tumores glómicos es desconocida, algunos autores han propuesto que una debilidad en esta estructura puede llevar a una hipertrofia reactiva secundaria a un traumatismo, o bien que constituyan hamartomas en los que los componentes están hipertrofiados. Las células glómicas son células musculares lisas especializadas que derivan de los pericitos de Zimmermann y son particularmente densas alrededor de estos espacios vasculares dilatados. Además, también pueden encontrarse fibras nerviosas y mastocitos aumentados en número. Los cambios de temperatura llevan a una contracción de los miofilamentos de las células glómicas, lo que resulta en un aumento de la presión intracapsular que se transmite por las fibras nerviosas no mielinizadas, causando la percepción de dolor 6. No es raro que los pacientes relacionen la aparición de la lesión con un traumatismo previo en esa localización, pero no se ha podido comprobar la relación causal.
ClasificaciónLos tumores glómicos pueden clasificarse en dos variantes clinicopatológicas: solitarios o múltiples. Los primeros son los más frecuentes, suelen aparecer en la edad adulta y se localizan preferentemente en zonas acras, sobre todo en el lecho subungueal, como hemos comentado. La presencia de múltiples tumores glómicos digitales es rara y se ha descrito en varias ocasiones en pacientes con neurofibromatosis tipo 1.
Los tumores glómicos múltiples, también llamados glomangiomas o malformaciones glomovenosas por su apariencia angiomatosa, constituyen menos del 10 % de los casos. A diferencia de los solitarios, aparecen a una edad más temprana y habitualmente se heredan con un patrón autosómico dominante con expresividad variable y penetrancia incompleta. Se ha localizado el gen en el cromosoma 1p21-22 (gen de la glomulina). Estos tumores tienen un ligero predominio en varones y aparecen como nódulos azulados blandos, dividiéndose a su vez, según su distribución, en glomangiomas múltiples diseminados, glomangiomas múltiples localizados y glomangioma congénito en placa. Los tumores glómicos múltiples no suelen ser dolorosos, en contraposición con los solitarios 6-10.
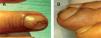
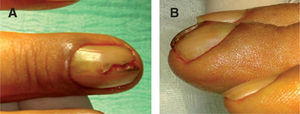
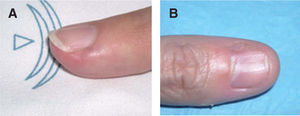
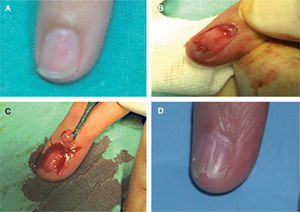
ClínicaClínicamente puede evidenciarse una masa visible o palpable en la región subungueal, una mácula o punto rojo-rosado o azulado, o un aumento de la curvatura o deformidad de la tabla ungueal 4,6. En ocasiones esta distrofia puede ser el único signo. Se han reportado casos imitando una distrofia media canaliforme, como hemos tenido ocasión de ver en uno de nuestros pacientes 11 (fig. 1).
La tríada sintomática clásica consiste en: dolor paroxístico, intolerancia al frío y localización exquisita del dolor en la zona del tumor. No siempre están presentes todos los síntomas, siendo el dolor el más constante.
DiagnósticoLa historia clínica y la exploración física son las claves del diagnóstico. Sin embargo, este en ocasiones es difícil, sobre todo en etapas precoces en las que la lesión es muy pequeña, no hallándose signo clínico alguno. Además, la tríada clásica característica puede no estar completa4. Esto explica la demora en el diagnóstico de estas lesiones, que también hemos podido comprobar tanto en nuestros pacientes como en los casos recogidos en la literatura 2,4 (hasta 15 años). El dolor, síntoma presente en la mayoría de los casos, hace que entre los diagnósticos diferenciales se incluyan otros tumores dolorosos que pueden localizarse en la región digital (neuroma, espiradenoma ecrino, leiomioma, ganglión o exóstosis) o entidades como causalgia, artritis gotosa o calcinosis 1,6. La confirmación diagnóstica se realiza mediante el estudio histológico.
En ausencia de la presentación clínica habitual (tríada)7 se han propuesto varias pruebas clínicas para ayudar al diagnóstico clínico, así como pruebas de imagen, de las cuales trataremos a continuación.
Pruebas clínicasTest de LoveEs sugestivo del diagnóstico. Se lleva a cabo utilizando una aguja o instrumento puntiforme para desencadenar dolor sobre la zona afecta, mientras que no se desencadena el dolor si se aplica el instrumento en una zona inmediatamente adyacente al punto doloroso. Esta prueba tiene una sensibilidad del 100 % y una especificidad del 0 % 4,6,7.
Signo de HildrethSe refiere a la desaparición del dolor al producir isquemia en la extremidad afecta tras colocar un torniquete. Esto pone de manifiesto la naturaleza vascular de la lesión. Su sensibilidad está entre el 77,4-92 % y la especificidad entre el 91-100 %4,7.
Prueba del fríoTambién se puede aplicar agua fría o alcohol etílico a la parte afecta para reproducir los síntomas. Tiene una sensibilidad y especificidad del 100 %4,7.
Prueba de transiluminaciónSe realiza en una habitación oscura proyectando luz a través del pulpejo. Se obtiene una imagen roja opaca de la zona donde está localizado el tumor y proporciona una idea estimada del tamaño. La sensibilidad está entre el 23-38 % y la especificidad es del 90 %7,12.
Pruebas de imagenIncluso cuando se ha diagnosticado clínicamente la lesión por la clínica y la exploración física (pruebas clínicas), es importante la localización preoperatoria del tumor, así como hacerse una idea de su tamaño, ya que es imprescindible la extirpación quirúrgica completa para evitar recidivas 13.
Para el diagnóstico preoperatorio se han utilizado varias pruebas de imagen. Las que se emplean son la radiografía simple, la ecografía y la resonancia magnética nuclear (RMN). Otras pruebas de imagen como la arteriografía, la escintigrafía y la termografía no están indicadas actualmente 14.
La radiografía puede detectar tumores grandes, pero la mayoría de las veces es normal en lesiones de pequeño tamaño. A veces puede verse adelgazamiento o erosiones de la cortical del hueso de la falange en lesiones de largo tiempo de evolución. Esto ocurre entre menos del 30 hasta el 60 %, según las series. Puede ser útil para diferenciar tumores glómicos de exóstosis subungueal, que es uno de los diagnósticos diferenciales más importantes 7,13.
La ecografía es una técnica no invasiva que puede usarse de forma preoperatoria para detectar la localización, el tamaño y la forma de tumores tan pequeños como de 3mm 13,15. Pueden verse como masas hipoecoicas bien circunscritas. La limitación se encuentra en las lesiones pequeñas, planas y en los artefactos que puede crear la uña y que no permiten diferenciar tumores glómicos de otras masas hipoecoicas, por lo que sería complementaria a un diagnóstico clínico.
Chen ha reportado que la ecografía con transductores de alta frecuencia es la técnica más útil cuando el tumor mide menos de 2mm y está en el área subungueal lateral 14. Recientemente se ha descrito la combinación de la ecografía con transductor de banda ancha de 5-14MHz en modo B y modo C combinada con la imagen en doppler color (CDI) e imagen de flujo B (BFI). Esta técnica no invasiva permite confirmar la localización, el tamaño y la profundidad del tumor, proporcionando una imagen tridimensional y el flujo vascular bien definido, lo que permite diferenciar los tumores glómicos de otros tumores subungueales hipoecoicos 16.
La RMN es una técnica no invasiva que ha aumentado la agudeza diagnóstica de los tumores glómicos; sin embargo, debido a su alto coste, no puede realizarse de rutina. Las lesiones pueden verse como imágenes ligeramente hipointensas o hiperintensas en T1 e imágenes hiperintensas en T2. Dependiendo del subtipo histológico puede ser más difícil el diagnóstico del tumor glómico y la señal a veces puede parecerse a la del lecho ungueal. La imagen en T1 se muestra mucho más intensa tras una inyección de gadolinio, con lo que la lesión puede verse más claramente. Puede ser particularmente útil en la detección de lesiones precoces, que son muy pequeñas 3 (incluso las lesiones de 2mm) y difíciles de diagnosticar tanto en el examen físico como mediante otras pruebas de imagen, así como para pacientes que experimenten recurrencia o resolución incompleta de los síntomas tras la cirugía 14.
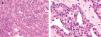
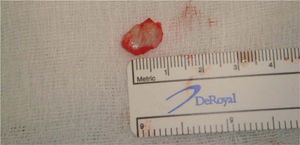
HistologíaCuando son tumores únicos la apariencia macroscópica es la de una tumoración pequeña de 0,1 a 0,3cm de diámetro (puede llegar hasta 3cm), encapsulada de color gris-rojizo (fig. 2).
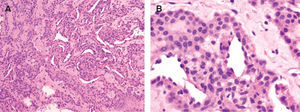
Los tumores glómicos están constituidos típicamente por tres componentes: células glómicas, estructuras vasculares y células musculares lisas. Por tanto, según el componente que predomine, pueden categorizarse como tumor glómico sólido (pocas estructuras vasculares y células musculares escasas), glomangioma (con componente vascular prominente) o glomangiomioma (con predominio del componente vascular y de células musculares lisas), (fig. 3). La variante más frecuente es el tumor sólido (75 %) seguido del glomangioma (20 %) y del glomangiomioma (5 %) 5.
El hecho de que las lesiones contengan pequeñas concentraciones de fibras nerviosas justifica el dolor localizado exquisitamente en un punto 4..
Inmunohistoquímicamente estos tumores se tiñen con actina y vimentina. Las células neoplásicas glómicas pueden teñirse con CD34 y actina de músculo liso 7.
TratamientoEl tratamiento de elección es la extirpación quirúrgica completa del tumor que supone su curación 2. El tiempo de recuperación suele ser de 2 a 4 semanas, pero en ocasiones el dolor tarda meses en desaparecer. Para aquellos pacientes que no pueden o no quieren operarse, se ha descrito que indometacina puede controlar el dolor en 10 días 6. Otros tratamientos descritos son el láser de colorante pulsado, el láser de argón y CO2 y la escleroterapia.
Las principales complicaciones del tratamiento quirúrgico son:
- 1.
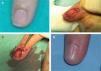
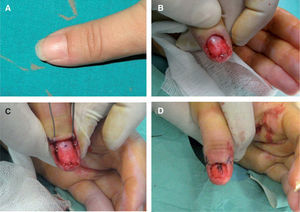
La recidiva, que se describe en el 5-15 % de los casos en algunas series. La recurrencia del dolor puede aparecer tras semanas o retrasarse durante años. Cuando la recidiva es precoz es más frecuente que sea por una extirpación incompleta del tumor 6,7, mientras que si es tardía suele deberse a la aparición de un segundo tumor (como pensamos que ha sucedido en una de nuestras pacientes) (fig. 4).
- 2.
La distrofia ungueal, que ocurre cuando existe un daño en la matriz ungueal (fig. 5). Sin embargo, también puede aparecer cuando se produce una adhesión del eponiquio a la matriz y por irregularidad de la superficie del lecho ungueal tras la cirugía 17. Esta complicación es más frecuente con la técnica quirúrgica transungueal. Posteriormente, se han introducido soluciones y otras técnicas para evitar esta complicación. A continuación discutiremos brevemente las principales técnicas quirúrgicas.
Es la técnica que tradicionalmente se ha realizado con mayor frecuencia 7.
Dentro de esta técnica hay dos subtipos:
- 1.
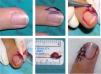
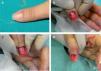
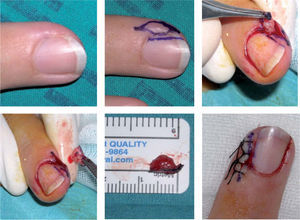
Si el tumor glómico se localiza en la zona subungueal más proximal («o se interviene a ciegas»): tras realizar una anestesia troncular digital se elimina toda la tabla ungueal y se realizan dos incisiones en la parte proximal de los surcos periungueales laterales a 90° respecto del eponiquio. Se levanta un colgajo de eponiquio, se realiza una incisión longitudinal en el lecho ungueal sobre la zona donde está localizado el tumor y éste se extirpa. Después se cierra el lecho ungueal con sutura reabsorbible de 6/0 y se sutura el colgajo de eponiquio 12 (figs. 6-8). Las indicaciones de esta técnica se restringen a tumores localizados en la región central subungueal 18,19 (más proximal) y a las intervenciones «a ciegas».
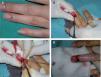
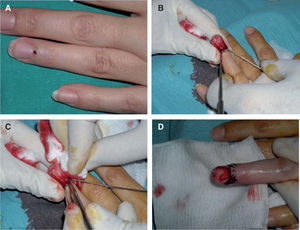
Figura 6.Extirpación quirúrgica «a ciegas» mediante el abordaje transungueal. A. Se señala el punto doloroso que se ha localizado mediante test de Love. B. Tras anestesia troncular se levanta un colgajo del eponiquio mediante dos incisiones laterales.
C. Se expone el tumor como una pequeña masa blanco-grisácea encapsulada localizada en la matriz que se diseca cuidadosamente.
D. Se suturan el lecho y las incisiones laterales.
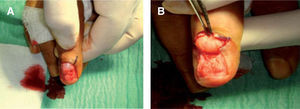
Figura 7.Abordaje transungueal para la extirpación del tumor glómico de la figura 1.
Las ventajas de este procedimiento es que se trata de una técnica sencilla, que permite una buena visualización de las lesiones de localización completamente subungueal 2 y cuando se interviene a ciegas. Parece que tiene un porcentaje de recurrencias similar a los otros abordajes 17.
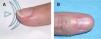
El principal inconveniente radica en la alta tasa de distrofia ungueal 14,17 (fig. 9). Como solución se ha propuesto la reposición de la uña en su lecho 17, que disminuye el porcentaje de distrofia ungueal postoperatoria. La reposición de la uña en el lecho previene la adhesión del eponiquio a la matriz, actúa como un apósito que favorece la reparación del lecho ungueal y disminuye el dolor cuando se realizan las curas, al estar la herida cubierta 17
- 2.
Si el tumor se localiza más distalmente en la región subungueal este se extirpa mediante una ventana en la tabla ungueal, mayor en diámetro que el tumor, colocando de nuevo el fragmento de tabla extirpado sobre el defecto
Las indicaciones de este procedimiento son tumores de pequeño tamaño y de localización subungueal distal. Como ventajas destacamos que es una intervención sencilla y menos traumática que la anterior, con apenas riesgo de deformidad si se vuelve a colocar el fragmento de tabla ungueal 17.
Tiene el inconveniente de que no es válida en las intervenciones «a ciegas», ya que no permite una buena visualización; tampoco lo es para los tumores de mayor y tamaño para los que se localizan en el pulpejo.
LateralPosteriormente se han propuesto técnicas de abordaje lateral, con lo que se evitan las incisiones en la matriz y el riesgo de distrofia ungueal subsiguiente:
- 1.
Lateral subperióstica. Se realiza una incisión dorsal a la línea lateral media 7,17,20. Se incide hasta la falange distal y se eleva un colgajo dorsal que contiene piel, lecho ungueal y matriz germinal. Tras visualizar y extirpar el tumor el colgajo se repone en su lugar original.
- 2.
Lateroungueal o laterodigital (Keyser-Littler). El abordaje también es lateral pero más alto, debajo del pliegue periungueal lateral. El ligamento interóseo de la falange distal, que da soporte lateral a la matriz y a la tabla ungueal se identifica y se retira, levantando la matriz sobre el ligamento y el periostio de la falange distal. Tras extirpar el tumor se repone el colgajo y se sutura 7.
Está indicada en tumores localizados en la región subungueal periférica y en el pulpejo18,19.
Posee las ventajas de que el abordaje lateral tiene menos incidencia de distrofia ungueal y una tasa de recurrencia parecida. El abordaje lateral subperióstico no necesita la disección y retracción del ligamento interóseo de la falange distal y los tiempos de recuperación postoperatorios son menores que en el abordaje transungueal (1-2 semanas con respecto a 4-6-semanas).
Su inconveniente radica en la menor exposición del lecho en tumores localizados íntegramente en la zona subungueal, sobre todo aquellos que son muy pequeños y se operan «a ciegas».
ConclusiónEl tumor glómico subungueal constituye una neoplasia benigna, poco frecuente, que a menudo llega al dermatólogo tras meses o años de sintomatología de dolor intenso que se hace insoportable para el paciente. La clínica típica, junto con la exploración física, son las claves para realizar el diagnóstico. Las pruebas de imagen pueden ayudar, sobre todo en el diagnóstico diferencial con otras lesiones y en el cálculo de las dimensiones y la localización de la lesión antes de su extirpación. Nosotros hemos practicado en todos los casos un abordaje transungueal, ya que en la mayoría de los casos se ha realizado una extirpación a ciegas al no poder localizar la lesión por las pruebas de imagen. La complicación postquirúrgica más frecuente es la distrofia ungueal, que es bien tolerada por el paciente, pero para la que proponemos la reposición de la tabla ungueal anteriormente descrita.
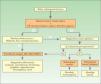
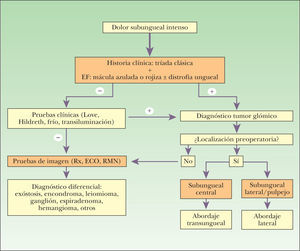
Queremos resaltar que ante un dolor intenso subungueal de origen incierto debe tenerse presente el diagnóstico de tumor glómico para evitar demoras en el tratamiento. Por último, proponemos un algoritmo para el manejo de los tumores glómicos (fig. 10).
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses