El carcinoma basocelular (CBC) es un tumor maligno frecuente y su incidencia ha aumentado en las últimas décadas. Investigaciones han demostrado la relación entre radiación ultravioleta (RUV), sistema inmune cutáneo y CBC. La función de las células de Langerhans (CL) en la respuesta inmune antitumoral ha motivado la investigación de su densidad y morfología frente a la RUV y al CBC. Sin embargo, los resultados publicados presentan discordancias debido a diferencias en la metodología científica.
ObjetivoEstudiar la densidad y morfología de las CL en la epidermis peritumoral comparada con la epidermis supratumoral mediante inmunohistoquímica y un programa computacional de imágenes digitales.
Material y métodosDoce casos de CBC fueron teñidos con CD1a. Se utilizó microscopia óptica y el programa computacional Image J para calcular las áreas epidérmicas sobre el tumor y adyacente a él. Se contabilizaron el número de CL de cada área y se determinaron y compararon las densidades celulares. Finalmente, se analizó la morfología de las CL en ambas áreas epidérmicas.
ResultadosLos resultados mostraron una menor densidad celular en la epidermis supratumoral respecto a la peritumoral (p<0,05). Las CL entre ambas áreas presentaron diferencias en el tamaño, forma celular y patrón dendrítico.
DiscusiónLa menor densidad y alteraciones estructurales de las CL supratumorales podrían dar lugar a variaciones de la respuesta inmune en el CBC. El uso de tecnología de análisis de imágenes digitales sería un método fiable en el estudio morfométrico de las CL.
Basal cell carcinoma (BCC) is a common malignant tumor and its incidence has risen in recent decades. Research has shown the relationship between ultraviolet (UV) radiation, the skin immune system, and BCC. The role of Langerhans cells (LC) in the immune response to tumors has prompted research into LC density and morphology in response to UV radiation and BCC. However, the data are inconsistent due to differences in research methodology.
ObjectiveTo study the density and morphology of LCs in the peritumoral epidermis of BCC using immunohistochemistry and image processing software and compare the results with those from the epidermis overlying the tumor.
Material and methodsTwelve samples from patients with BCC were prepared with a CD1a stain. Areas of epidermis overlying and adjacent to the tumor were defined using light microscopy and the Image J image processing software. The LCs in each area were counted and the cell densities were calculated and compared. Morphological features of LCs were also evaluated in each epidermal areas.
ResultsThe results showed a lower density of LCs in the epidermis overlying the tumor than in the peritumoral epidermis (p<0.05). There were also differences in the size, shape, and dendritic pattern of the LCs between the epidermal areas.
ConclusionsThe lower density and fewer morphological changes of LCs in the epidermis overlying BCC may give rise to alterations in the immune response to BCC. Digital image analysis is a reliable method for the morphometric evaluation of LCs.
El carcinoma basocelular (CBC) es el tumor maligno más frecuente que afecta al ser humano 1; comprende entre el 70–80 % de los tumores cutáneos en América del Norte 2,3. Estudios epidemiológicos han demostrado la relación existente entre la exposición a la radiación ultravioleta (RUV) y la posterior aparición del CBC 4-6. La RUV es el factor inductor de CBC más importante y estudiado y puede producir una serie de efectos, como daño directo al ADN celular, alteración de la inmunovigilancia cutánea e inflamación celular.
Las células de Langerhans (CL) son un constituyente clave en el funcionamiento del sistema inmune cutáneo, dada su capacidad de procesamiento de antígenos de distinta naturaleza, migración hacia tejidos linfoides y presentación antigénica a linfocitos T (LT). Las alteraciones funcionales y estructurales en las CL producidas por la RUV determinan su disfuncionalidad, afectando las diferentes fases de la respuesta inmune celular epidérmica.
Respecto al CBC, existen trabajos que analizaron las CL en la epidermis de estos tumores utilizando diversos marcadores inmunohistoquímicos como el anticuerpo monoclonal anti-T6, S100, Langerin y CD1a 7-10. Este último tendría la ventaja de que, además de ser un marcador de superficie específico de CL, también tendría un rol en la presentación antigénica a los LT 11. Los resultados de las publicaciones de CL en el CBC son discrepantes. Las diferencias observadas se deberían a la distinta metodología usada en los trabajos.
Algunos trabajos indican una disminución de la densidad de las CL en la epidermis sobre la masa tumoral al compararla con la epidermis perilesional o piel sana 7,10,12-14. Otras publicaciones no han encontrado diferencias cuantitativas en la medición de CL epidérmicas entre lesiones cutáneas benignas y malignas 15,16, o bien han descrito un aumento de la densidad de CL en la epidermis supratumoral en el CBC 17,18. Finalmente, la disfunción del sistema inmune cutáneo en relación a la RUV y CBC también ha sido inferida mediante el estudio morfológico de CL, describiéndose cambios en el tamaño celular y en el patrón dendrítico que reflejan su incapacidad como células presentadoras de antígenos 9,10,12,15.
El objetivo de este trabajo fue estudiar la densidad y morfología de CL en epidermis supratumoral del CBC y comparar dichos resultados con la epidermis peritumoral del mismo paciente.
Material y métodosCasos seleccionadosSe solicitaron al Instituto de Anatomía Patológica del Hospital Clínico de la Universidad de Chile muestras de CBC para evaluar la factibilidad de estudiar las CL mediante la tinción inmunohistoquímica con CD1a. De acuerdo al protocolo del Instituto de Anatomía Patológica, los tumores extirpados son fijados en formalina tamponada al 10 % y luego cortados perpendicularmente al eje mayor de la muestra cada 1mm, obteniendo un número de placas histológicas que abarca la totalidad de la muestra enviada.
Se solicitaron todos los casos informados como CBC de tipo histológico nodular entre los años 2000-2005.
Se seleccionaron los tumores de acuerdo a una serie de criterios de inclusión y exclusión. Los criterios de inclusión fueron:
- 1.
Tumores 100 % de tipo histológico nodular.
- 2.
El corte seleccionado contenía la mayor extensión del tumor.
- 3.
La muestra debía presentar una epidermis intacta tanto sobre la masa tumoral como la adyacente a ella.
- 4.
Los tumores seleccionados debían haber sido extirpados totalmente mediante cirugía de losanjo.
- 5.
Los tumores debían haber estado localizados en la cara.
- 6.
Los tumores debían ser de pacientes con similar actividad laboral y que habían vivido en la misma zona geográfica a lo largo de su vida.
Los criterios de exclusión fueron:
- 1.
Tumores que presentaron mezclas de tipos histológicos.
- 2.
Sujetos con una condición inmunosupresora tal como fototerapia, radioterapia, trasplante de órganos o terapia corticoidea crónica.
Doce casos fueron finalmente seleccionados para este estudio. Estos correspondieron a 7 varones y 5 mujeres, con una edad promedio de 63 años (desviación estándar [DE] ± 11,15), con rangos entre 42 y 82 años de edad.
Técnica de inmunohistoquímicaLas muestras fueron fijadas en formalina por 24 horas antes de ser incluidas en parafina. Cortes de 3μm de espesor de cada tumor fueron realizados y teñidos mediante la técnica inmunohistoquímica de estreptoavidina-biotina en tres pasos. La recuperación antigénica se realizó en una Digital Decloaking Chamber (Biocare Medical 2940 Camino Diablo, Suite 110, Walnut Creek, CA 94596) utilizando Reveal (Biocare Medical). Luego, la recuperación enzimática se realizó con pepsina (Carezyme II) (Biocare Medical) a temperatura ambiente.
Los cortes fueron incubados con el anticuerpo monoclonal CD1a, CLONE MTB1 (Novocastra monoclonal mouse) diluido en Revival Series Van Gogh Yellow Diluent (Biocare Medical) en una dilución 1:80 durante 2 horas. Como anticuerpo secundario se usó 4 plus Universal Immuneperoxidase Detection System, Biotinylated Secondary Antibodies (Biocare Medical) durante 20 minutos. Los preparados fueron finalmente incubados en 4 plus Universal Immuneperoxidase Detection System, Streptavin-Enzyme Conjugates (Biocare Medical) durante 20 minutos. Como cromógeno se utilizó NOVARED incubado durante 10 minutos.
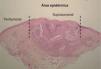
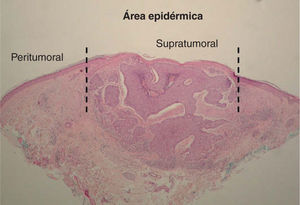
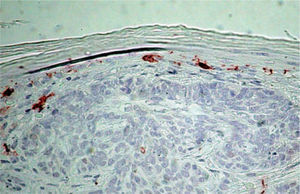
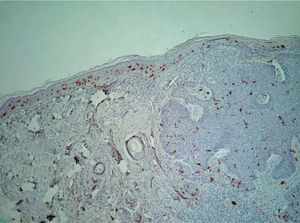
Determinación de la densidad de las células de LangerhansDeterminación del área epidérmicaSe definieron dos áreas epidérmicas a estudiar (fig. 1):
- 1.
Área supratumoral: área de la epidermis suprayacente a la masa tumoral.
- 2.
Área peritumoral: área de la epidermis hasta aproximadamente 2.500μm desde un extremo de la masa tumoral.
Cada caso fue fotografiado utilizando una cámara digital acoplada a un microscopio de luz, con un aumento de 100×.
Mediante el programa de análisis de imágenes digitales Image J se determinaron las áreas de estudio marcando la totalidad de ambas superficies epidérmicas, obteniéndose las medidas en unidad de píxeles.
Para poder expresar el área epidérmica en μm2 se estableció una relación entre las unidades de píxeles y μm2. Para esto se usó una cámara de Neubauer, a la cual se le fotografió (usando el mismo aumento) un área previamente determinada. Esta área fue luego analizada mediante el programa Image J, pudiéndose obtener de esta forma una relación píxeles2/μm2.
Cuantificación celularEn cada área epidérmica, utilizando un mayor aumento (400×) se contabilizaron como CL sólo aquellas en que se pudo identificar un núcleo teñido con dos o más dendritas en la totalidad de las áreas de estudio. Los tumores fueron codificados y el conteo se realizó de forma enmascarada por un solo observador (FM).
Cada conteo fue repetido 5 veces, determinando el promedio de células para cada caso en particular.
Análisis estadístico de los resultadosPara la comparación de la densidad de CL en las dos áreas a estudiar de cada caso, se utilizó la prueba «t» de Student para muestras pareadas, con un nivel de significación con valores de p < 0,05.
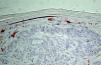
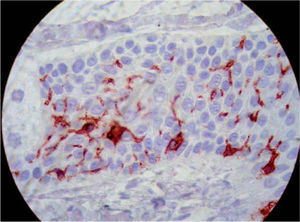
ResultadosComo se observa en las figuras 2 y 3, las CL en la epidermis supratumoral presentaban un aspecto morfológico distinto a las CL peritumorales. El cuerpo celular era grande, de forma redondeada o irregular y con dendritas menos numerosas, menos elongadas y con menor número de ramificaciones. En relación a la densidad, como se observa en la tabla 1, en cada tumor la densidad de CL fue menor en la epidermis supratumoral respecto a la epidermis peritumoral (p < 0,001).
Densidad de células de Langerhans en la epidermis supratumoral y peritumoral
| Tumor | Densidad de células de Langerhans (xlQ-5) células/μm2 | |
| Epidermis supratumoral | Epidermis peritumoral | |
| 1 | 11,26 | 12,99 |
| 2 | 6,8 | 28,45 |
| 3 | 23,94 | 32,44 |
| 4 | 3,91 | 12,16 |
| 5 | 9,81 | 20,89 |
| 6 | 18,71 | 26,42 |
| 7 | 11,61 | 13,21 |
| 8 | 8,61 | 20,45 |
| 9 | 12,52 | 24,30 |
| 10 | 18,32 | 33,86 |
| 11 | 15,09 | 16,50 |
| 12 | 15,33 | 37,52 |
| Promedio (± DE) | 12,99 (± 5,61) | 23,27 (± 8,67) |
DE: desviación estándar.
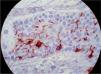
También se observaron CL intratumorales (fig. 4).
DiscusiónLas CL cumplen un papel central en la inmunovigilancia cutánea al participar en la respuesta inmunológica celular. La densidad epidérmica de CL se ha relacionado con reacciones inmunológicas epidérmicas como los fenómenos de sensibilización e inmunosupresión 18. Este último se ha asociado también a un mayor riesgo de desarrollar cáncer cutáneo 19,20. Uno de los factores más estudiados en la patogenia del CBC es la inmunosupresión cutánea local inducida por RUV; diferentes publicaciones han asociado este fenómeno con cambios cuantitativos, morfológicos y funcionales de las CL 8,15,16.
La mayor parte de las investigaciones de densidad de CL en CBC corresponden a estudios prospectivos en muestras obtenidas de secciones verticales congeladas 13-16 o bien de láminas epidérmicas 8,9. Ambos tipos de muestras serían útiles para realizar estudios cuantitativos y estructurales de CL 21. Las diferencias de densidad de CL epidérmicas en el CBC han sido estudiadas previamente. En los trabajos de Schreiner et al, Azizi et al, De Melo et al, Bergfelt et al y McArdle et al se compararon densidades de CL en áreas epidérmicas sobre el tumor y perilesional o piel sana contralateral 12,14-17. Sin embargo, no se especifica la extensión de área epidérmica adyacente al tumor o de piel sana que es analizada. Por otra parte, existen otros factores que es importante considerar al realizar estudios de densidad de LC (sobre todo en estudios comparativos), como son la edad cronológica, el grado y tipo de exposición de RUV 22,23, la ubicación topográfica 24 y la metodología utilizada 25.
En nuestro estudio utilizamos muestras de CBC fijadas en formalina e incluidas en parafina, lo que nos permitió hacer un estudio retrospectivo, disminuyendo la dificultad de obtención y los costes del procesamiento de la muestra. Asimismo, al comparar la densidad celular y la morfología de las CL de dos áreas epidérmicas adyacentes, se minimizaron factores de sesgo como la edad cronológica, la ubicación topográfica, el grado de fotoexposición y otros factores inmunosupresores.
Diferentes trabajos han cuantificado las CL en el CBC comparando densidades celulares epidérmicas 6,11-14,16,17. El área epidérmica en estas publicaciones se determinó eligiendo campos de estudio al azar, lo que a nuestro parecer conlleva cierta inexactitud en las mediciones debido a factores como la variación del grosor epidérmico de cada área y la disminución de CL de la epidermis peritumoral respecto a la supratumoral. En nuestro trabajo, utilizando tecnología digital, la determinación de las áreas supratumoral y peritumoral, así como también la cuantificación celular, fue realizada en la totalidad de la superficie epidérmica analizada, obteniendo una densidad de CL por área epidérmica más exacta. Observamos una disminución del número de CL de la epidermis peritumoral comparado con la epidermis supratumoral, lo que concuerda con los resultados de publicaciones previas 6,9,11-13. La disminución de la densidad de CL CD1a+ en el área supratumoral podría ser un indicador de la pérdida de la capacidad de presentación antigénica o de la migración celular a los ganglios regionales. Éstos podrían ser consecuencia de la capacidad de migración de las CL sometidas a RUV, apoptosis inducida por la RUV o las células tumorales, o bien por la pérdida de CD1a de las CL. Además, el menor grosor epidérmico en la epidermis supratumoral respecto a la peritumoral podría condicionar un mayor efecto de la irradiación UV sobre las CL. En las publicaciones en que no se encontró una disminución de la densidad de CL en la epidermis supratumoral del CBC, podría deberse a diferencias en la técnica histológica, los marcadores celulares y el tiempo de evolución del tumor 14,16,17. Es interesante destacar este último punto, ya que no existen trabajos que analicen la relación entre la densidad de CL en la epidermis supratumoral del CBC y el tiempo aproximado de evolución o el tamaño del tumor.
Utilizando microscopia óptica observamos que las CL CD1a+ presentaron diferencias morfológicas evidentes al comparar las áreas epidérmicas supratumoral y peritumoral. De forma similar a lo descrito por Bergfelt et al y Azizi et al, los cuerpos celulares de las CL en el área supratumoral adquirieron una forma redondeada o irregular, con dendritas cortas y poco ramificadas 11,14. Estos hallazgos podrían ser indicadores de la disfuncionalidad de las CL por el efecto supresor de las células tumorales. Varios aspectos interesantes de evaluar serían: si estos cambios morfológicos son progresivos en la evolución tumoral, relacionarlos con el tipo histológico y la agresividad del tumor y la potencial reversibilidad con el uso de imiquimod.
En conclusión, la alta prevalencia e incremento de la incidencia del CBC ha motivado el estudio de los mecanismos de desarrollo y comportamiento biológico del tumor. Se han logrado importantes avances en el conocimiento de la relación existente entre RUV, sistema inmunológico cutáneo y CBC. En este trabajo hemos pretendido contribuir al estudio de las CL en el CBC, identificando CL mediante una técnica inmunohistoquímica de menor coste, versátil y fiable. Mediante microscopia óptica y el uso de la tecnología digital hemos corroborado también la utilidad de estas técnicas en el estudio científico. A partir de esta experiencia se pueden proyectar estudios que aporten conocimientos del papel patogénico y potencial terapéutico de las CL en la patología cutánea.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.