El carcinoma anexial microquístico (CAM) es un tumor raro y agresivo que clínicamente se manifiesta como un nódulo subcutáneo localizado en las regiones de cabeza y cuello. Esta tumoración puede ser clínica e histológicamente confundida con otras lesiones cutáneas benignas o malignas, lo que con frecuencia conduce a un tratamiento inicial erróneo. La principal complicación del CAM es la alta morbilidad y la elevada tasa de recurrencia tras escisión local amplia. Estudios preliminares recientes han mostrado unas mayores tasas de curación mediante cirugía micrográfica de Mohs (CMM).
Material y métodosSe revisaron las historias clínicas de 6 pacientes consecutivos con CAM tratados mediante CMM en nuestro Servicio de Dermatología entre 1995 y 2007.
ResultadosTodos los casos se localizaron en la cabeza y el 100 % fue tumor primario. En el 70 % de los casos el tumor fue inicialmente mal diagnosticado de carcinoma basocelular. No se detectó invasión perineural en ninguno de los casos y la recurrencia estuvo ausente en todos los pacientes tras un periodo de seguimiento comprendido entre 1 y 12 años posteriores a la CMM.
ConclusionesLa ausencia de afectación perineural y de una importante atipia celular puede deberse al carácter primario de la tumoración. Ello justificaría la necesidad de un tratamiento definitivo radical inicial del tumor primario para evitar las complicaciones que implica una recidiva tumoral. La localización y la ausencia de recurrencia en todos nuestros casos tratados mediante CMM apoyan el uso de esta técnica como el tratamiento de elección para el CAM.
Microcystic adnexal carcinoma is a rare and aggressive tumor that manifests clinically as a subcutaneous nodule located on the head or neck. The tumor can be confused clinically and histologically with other benign and malignant skin lesions, often leading to inappropriate initial treatment. The chief concern with microcystic adnexal carcinoma is the elevated morbidity and the high rate of recurrence after wide local excision. Recent preliminary studies point to higher cure rates with Mohs micrographic surgery.
Material and methodsWe reviewed the medical histories of 6 consecutive patients with microcystic adnexal carcinoma who underwent Mohs micrographic surgery in our dermatology department between 1995 and 2007.
ResultsIn all cases, lesions were located on the head and were primary tumors. Seventy percent of the tumors were wrongly diagnosed initially as basal cell carcinoma. Perineural invasion was not detected in any patient, and all were free of recurrence after between 1 and 12 years of postoperative follow-up.
ConclusionsThe absence of perineural involvement and substantial cell atypia can be attributed to the lesions being primary tumors. This would provide a rationale for definitive radical treatment of the primary tumor from the outset to avoid the complications associated with recurrence. The site and the absence of recurrence in all our patients who underwent Mohs micrographic surgery support the use of this technique as the treatment of choice in microcystic adnexal carcinoma.
El carcinoma anexial microquístico (CAM) (carcinoma siringomatoso, siringoma maligno, carcinoma de los ductos sudoríparos desmoplásico)1-3 es una tumoración cutánea poco frecuente, de diferenciación dual folicular y glandular, que fue descrita por primera vez por Goldstein et al4 en 1982.
Se caracteriza por su naturaleza local agresiva, una elevada capacidad infiltrante, así como por un marcado neurotropismo. Todas estas características justifican una elevada tasa de recidiva a pesar de la aplicación de tratamientos agresivos.
Actualmente existe controversia en la elección de la mejor opción terapéutica para alcanzar la erradicación completa del CAM. La cirugía micrográfica de Mohs (CMM), por las ventajas terapéuticas y estéticas que posee, podría ser un tratamiento de elección en esta neoplasia. No obstante, la experiencia de uso de esta técnica en esta tumoración anexial es muy limitada.
Se aporta una serie de 6 casos de pacientes con CAM tratados mediante CMM realizados en el mismo centro dermatológico. Se analizarán los diversos parámetros clínicos y quirúrgicos de todos los pacientes, así como la existencia de recidiva en el seguimiento a largo plazo.
Material y métodosSe revisó la historia clínica y quirúrgica de 6 pacientes diagnosticados en el Servicio de Dermatología del Instituto Valenciano de Oncología entre 1995 y 2007. En cada caso el diagnóstico histopatológico fue confirmado por un anatomopatólogo mediante biopsias teñidas con hematoxilina-eosina.
Se obtuvieron las piezas quirúrgicas y se procesaron siguiendo la técnica micrográfica de Mohs, realizándose estadios de 0,5cm hasta que se obtuvo ausencia de afectación de los bordes quirúrgicos. La técnica se realizó de forma diferida en 4 de los casos y en fresco en los dos restantes. En aquellos realizados en fresco se procedió a la toma de un estadio adicional una vez se alcanzaron los bordes libres de enfermedad.
Se recogieron los siguientes datos de cada paciente: edad, sexo, localización, duración de la lesión, exposición a radiaciones ionizantes, lesión primaria o recurrente, dimensiones de la lesión en la exploración clínica preoperatoria, número de estadios de CMM que se precisaron para alcanzar bordes libres de enfermedad, defecto postoperatorio, periodo de seguimiento y existencia o no de recidiva durante el mismo.
Posteriormente se realizó una revisión de todos los casos de CAM tratados mediante CMM descritos en la literatura desde 1982 a 2007 utilizando el sistema de búsqueda
PubMed. De ellos se recogieron los siguientes parámetros: número de CAM tratados, dividiéndolos en casos primarios y recurrentes, porcentaje de recidiva, número medio de estadios quirúrgicos realizados y, por último, la media de seguimiento de los pacientes tratados.
ResultadosLos diversos parámetros clínico-quirúrgicos de los 6 pacientes se recogen en la tabla 1.
Características de los pacientes tratados mediante cirugía de Mohs en nuestro servicio
| Edad/sexo | Tiempo de evolución (años) | Motivo de consulta | Cáncer cutáneo previo | Localización | Exploración física | Diagnóstico de sospecha | N.° estadios(defecto quirúrgico) | Seguimiento (años)/recaída |
| 69/Hombre | 2 | Placa asintomática | No | Mejilla izquierda | Placa mal delimitada amarillenta pétrea 1 × 1,5cm | Tumor anexial | 2 (7 × 2cm) | 3/No |
| 61/Mujer | 14 | Placa indurada asintomática | No | Mentón derecho | Placa pétrea con depresión central de 2 × 2cm | Tumor anexial | 2 (5 × 5cm) | 2/No |
| 61/Mujer | 1 | Pápula amarillenta indurada | CBC | Surco nasogeniano derecho | Pápula marfileña con telangiectasia 1 × 1cm | CBC | 2 (3 × 3cm) | 1 /No |
| 52/Mujer | 3 | Lesión cicatricial | No | Mejilla derecha | Pápula amarillenta de 2 × 1cm | CBC | 1 (3 × 3cm) | 1 /No |
| 81/Mujer | 1 | Nódulo semiduro | CBC | Mejilla izquierda | Pápula indurada amarillenta de 0,5 × 0,6cm | CBC | 1 (1,5 × 1,5cm) | 12/No |
| 48/Mujer | 11 | Nódulo amarillento indurado | CBC | Ala nasal derecha | Pápula indurada de 1 × 1cm | CBC | 2 (2 × 2cm) | 9/No |
CBC: carcinoma basocelular.
El grupo tratado estaba formado por 5 mujeres y un hombre, con edades comprendidas entre 48 y 90 años, con una media de edad de 69 años. Todas las tumoraciones analizadas fueron primarias, y ninguno de los pacientes había sido sometido previamente a radioterapia en la zona de la lesión. Hasta un 50 % de los casos había presentado previamente uno o más carcinomas basocelulares en la región facial. En todos los pacientes la tumoración asentaba en la cara (tres en mejilla, dos en surco nasogeniano y uno en mentón), localizándose en el hemilado derecho en un total de 4 casos. El tamaño de la lesión clínica osciló entre 0,5 × 0,6cm y 2 × 2cm.
El número medio de estadios requeridos para alcanzar márgenes libres de enfermedad fue de 1,4 y el tamaño del defecto quirúrgico resultante osciló entre 1 × 1cm y 4 × 3cm.
Las pruebas complementarias realizadas en todos los pacientes, que incluyeron una analítica (hemograma, perfil hepático y renal y estado de coagulación) y una radiografía de tórax, se encontraron dentro de los límites de la normalidad.
El periodo de seguimiento osciló entre 1 y 12 años, con una media de 5 años, con ausencia de recidiva en la totalidad de los casos.
DiscusiónEl CAM es una tumoración anexial maligna que aparece con mayor frecuencia en mujeres de edades que oscilan entre los 50 y los 69 años3,5-10. Existe una mayor predisposición al desarrollo de este tumor en las razas caucásica y asiática11, con raros casos descritos en la población afroamericana2,6,12,13.
Se consideran varios factores de riesgo para el desarrollo de esta neoplasia, que incluyen la exposición a la radiación ultravioleta y/o ionizante, así como la existencia de una inmunosupresión de base3.
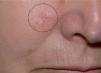
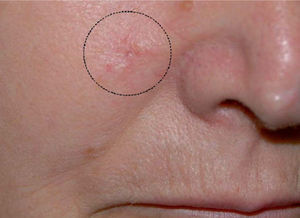
El CAM se manifiesta clínicamente como una placa, nódulo o pseudoquiste de consistencia pétrea, asintomático, de crecimiento lento y progresivo, que se presenta con un tamaño medio de 2cm en el momento del diagnóstico (fig. 1)14. La presencia de escozor, parestesia o dolor en la zona de la tumoración orienta a la posible existencia de afectación perineural, que en este tipo de tumoración varía entre un 1814 y un 59 % de los casos14.
El CAM se localiza en la cabeza y el cuello hasta en un 83 % de los casos11,15. De ellos, un 73 % se localiza en la cara, fundamentalmente afectando al área palpebral16,17 y al surco nasogeniano.
El retraso medio entre la aparición de la lesión y el establecimiento del diagnóstico histopatológico es variable según el sexo del paciente. Así, mientras en el sexo femenino el retraso medio del diagnóstico es de un año, en el sexo masculino alcanza hasta 5 años11. En nuestro estudio el retraso osciló entre 6 meses y 14 años, no pudiendo precisarse alguna relación según el sexo ya que la población era mayoritariamente femenina.
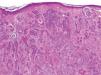
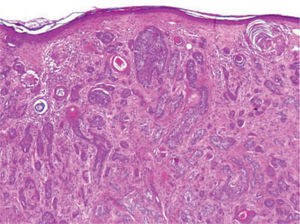
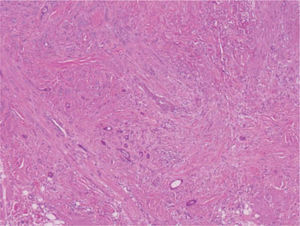
Se trata de una tumoración con una alta capacidad de penetración en profundidad18, que frecuentemente invade el tejido celular subcutáneo y el músculo esquelético subyacente, habiéndose descrito afectación del pericondrio, del periostio, de la adventicia de los vasos sanguíneos, e incluso afectación ósea19. Histológicamente se caracteriza por una epidermis respetada asociada a una dermis papilar y reticular superficial ocupadas por pequeños quistes con queratinización ítsmica y del infundíbulo folicular (fig. 2). En la dermis reticular media y profunda destaca la existencia de múltiples islotes de células basaloides, que muestran vacuolización intracitoplasmática y en determinadas áreas conforman ductos con lúmenes bien definidos, tapizados por células aplanadas organizadas en una o dos capas (fig. 3)20,21.
La infiltración perineural, fenómeno descrito en menos del 5 % de los tumores de cabeza y cuello22-24, supone un fenómeno relativamente frecuente en el CAM, detectándose en el análisis histológico de entre un 17,523 a un 59 % de los pacientes según las series25. Dicho fenómeno aparece fundamentalmente en carcinomas anexiales recidivados (hasta el 87,5 % de los casos)18, siendo poco frecuente en el carcinoma anexial primario; este dato resalta la importancia de un tratamiento inicial óptimo como método para reducir el porcentaje global de CAM con infiltración perineural. En nuestro estudio ninguno de los casos mostró infiltración perineural, lo que puede ser debido a que todas las neoplasias tratadas en nuestra serie fueron primarias.
El CAM se trata de una tumoración de difícil diagnóstico tanto desde el punto de vista clínico como histológico26. De hecho, entre un 25 y un 53 % de los casos, según diferentes series, fueron mal diagnosticados clínicamente, de manera que el diagnóstico inicial más común fue el de carcinoma basocelular esclerodermiforme5,11. A la dificultad del diagnóstico clínico se suman en muchos casos también errores en el diagnóstico histopatológico, lo que se debe a que las biopsias tomadas por rebanado imposibilitan estudiar el patrón estratificado característico del CAM27. En nuestro estudio, 4 de los 6 casos fueron clínicamente diagnosticados de carcinoma basocelular, y en uno de ellos el estudio histopatológico apoyó este diagnóstico. Sin embargo, en este caso se había realizado una biopsia por rebanado y la posterior biopsia mediante un punch confirmó el diagnóstico de CAM. Así pues, ante una lesión esclerodermiforme localizada en un área fotoexpuesta, resulta imprescindible la obtención de una muestra de tejido que alcance el tejido celular subcutáneo.
El principal problema del CAM es su comportamiento local agresivo, que se manifiesta por su gran capacidad infiltrativa y su alta frecuencia de afectación perineural28, lo que conlleva una alta frecuencia de recidiva local tras una exéresis quirúrgica convencional, que alcanza el 40-60 % de los casos28-30. La afectación a distancia es excepcional en esta tumoración anexial. Unicamente se han descrito 5 casos con afectación en la cadena linfática locorregional ipsilateral (4 casos)31 o contralateral (un caso)32. Por otro lado, la afectación sistémica es excepcional, habiéndose comunicado casos aislados en pulmón33, hueso30 e hígado34.
Las opciones terapéuticas aplicadas en esta tumoración incluyen la radioterapia y la cirugía, tanto en forma de exéresis simple como en forma de cirugía de control de márgenes. La radioterapia ha sido utilizada en el tratamiento del CAM tanto de forma aislada como de manera coadyuvante al acto quirúrgico34,35. A partir de los diversos resultados obtenidos se pueden establecer las siguientes conclusiones:
- 1.
La radioterapia no debe utilizarse como una opción terapéutica aislada de un CAM primario, ya que se ha demostrado que en este caso no solo resulta ineficaz, sino que es capaz de inducir la conversión en una variante tumoral de mayor agresividad clínica e histológica35,36.
- 2.
La aplicación de radiación ionizante se puede plantear como tratamiento coadyuvante a la exéresis quirúrgica de un CAM con márgenes libres de enfermedad en determinadas situaciones, que incluyen: casos recidivados, casos con infiltración perineural, vascular o linfática, así como aquellos que infiltren músculo o hueso15,37,38.
La cirugía convencional precisa la obtención de un amplio margen de seguridad tanto en superficie como en profundidad para que el riesgo de una exéresis incompleta sea mínimo. Sin embargo, la definición de «un amplio margen» es bastante imprecisa, por lo que la evaluación de los resultados obtenidos mediante cirugía convencional en diversos trabajos resulta imposible de realizar. Por otra parte, el análisis de la pieza quirúrgica obtenida mediante esta técnica quirúrgica sólo permite la valoración de un 0,2 % de los márgenes, lo que conlleva una recurrencia de hasta un 40-60 %5 de casos en los primeros tres años tras el tratamiento.
La CMM permite conseguir una mayor selectividad en el volumen de tejido extirpado, reduciendo al máximo la exéresis de piel sana, con lo que se alcanza un mejor resultado estético, un dato importante teniendo en cuenta la tendencia de este tipo de tumoración a aparecer en la región facial39. A su vez, la forma de obtención de la pieza y su análisis permite valorar casi el 100 % de los márgenes tanto laterales como profundo de la lesión20, con lo que el riesgo de recurrencia mediante esta técnica varía entre un 05 y un 12 %2,6,40-43, dejando un defecto posquirúrgico que alcanza hasta 4 veces el tamaño de la lesión clínica inicial5,44-46.
En la literatura existe un número escaso de series de pocos pacientes tratados mediante cirugía de Mohs (tabla 2). En nuestra serie ningún paciente presentó signos de recidiva en el control periódico postexéresis, que osciló entre 12 meses y 12 años, con una media de seguimiento de 5 años. El defecto quirúrgico alcanzó de dos a cuatro veces el tamaño de la lesión clínica inicial.
Pacientes con carcinoma anexial microquístico tratados mediante cirugía de Mohs descritos en la literatura
| Autor | N.° de casos | Recurrencia | N.° medio de estadios | Media de seguimiento (meses) |
| Fleischmann et al46, 1984 | 1 | No | NS | 7 |
| Cooper y Mills2, 1984 | 1 (recurrente) | Sí | NS | 8 |
| Nickoloff et al8, 1986 | 1 | No | 4 | 13 |
| Hamm et al40, 1987 | 3 (2 recurrentes) | No | NS | 19 |
| Mayer et al36, 1988 | 3 (2 recurrentes) | Sí (1 caso) | NS | NS |
| Chow et al44, 1989 | 1 | No | NS | NS |
| Birkby et al47, 1989 | 1 (recurrente) | No | NS | 18 |
| Wallace y Bernstein48, 1991 | 1 caso | No | NS | 18 |
| Futran et al49, 1992 | 1 caso | No | NS | 1,5 |
| Sebastien et al18, 1993 | 1 (recurrente) | No | NS | 16 |
| Burns et al50, 1994 | 10 (4 recurrentes) | No | NS | 25 |
| McAlvany et al51, 1994 | 1 | No | 1 | 32 |
| Hazen y Bass52, 1994 | 1 (recurrente) | Sí | NS | 42 |
| Hesse et al45, 1995 | 1 | No | NS | 24 |
| Barlow et al27, 1996 | 2 | No | 1,5 | 24 |
| Billingsley et al7, 1996 | 4 (3 recurrentes) | No | NS | 31,4 |
| Park y Parry12, 1998 | 1 | No | 3 | 6 |
| Friedman et al32, 1999 | 11 (2 recurrentes) | No | 3,5 | 60 |
| Chiller et al5, 2000 | 25 (3 recurrentes) | Sí (3 casos) | NS | 38 |
| Snow et al53, 2001 | 13 (3 recurrentes) | No | NS | 60 |
| Abbate et al54, 2003 | 6 (2 recurrentes) | No | NS | 23,3 |
| Khachemoune et al55, 2005 | 4 | No | 4 | 12 |
| Leibovitch et al14, 2005 | 20 (4 recurrentes) | No | 2 | 60 |
NS: dato no recogido en el informe quirúrgico.
La recurrencia tumoral adquiere un valor importante en el CAM, ya que, comparado con el CAM primario, las recidivas se presentan con mayores dimensiones, lo que supone la necesidad de un número superior de estadios y un mayor defecto quirúrgico secundario, e histológicamente muestran una mayor atipia celular con una tasa de infiltración perineural superior (hasta el 80 % de casos). En nuestra serie, los 6 casos presentaron una tumoración anexial primaria que histológicamente mostraba una leve atipia celular y ausencia de infiltración perineural.
Con todo ello se concluye que la CMM debería considerarse como el tratamiento de elección para este tipo de tumores.
Actualmente no está establecido el intervalo de seguimiento ni las pruebas complementarias necesarias en el control de este tipo de pacientes. Dado el mayor riesgo de recidiva tumoral en los primeros tres años posresección de la lesión, se aconseja un seguimiento cada 3-6 meses. Tras estos tres primeros años se debería realizar un control anual de por vida, ya que se han descrito recidivas tumorales hasta 30 años tras la exéresis inicial de la lesión.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.