INTRODUCCION
El carcinoma anexial microquístico es una neoplasia rara, localmente invasiva, que crece adoptando un patrón infiltrativo, pero que carece de atipia citológica. Está constituida por una proliferación de células basaloides que, en focos, forma quistes córneos y, en otras zonas, posee una estructura ductal. Se presenta un caso de carcinoma anexial microquístico en el que este último componente estaba formado por células claras de citoplasma vacuolizado. Este hallazgo se ha publicado en un cierto porcentaje de carcinomas anexiales microquísticos y podría considerarse una variante de ésta, ya de por sí rara, neoplasia.
DESCRIPCION DEL CASO
Una mujer de 58 años de edad, sin antecedentes personales de interés, consultó por una lesión de aproximadamente un año de evolución, localizada en dorso nasal, que le provocaba molestias en forma de escozor, sobre todo con la exposición solar y la sensibilidad al tacto. La lesión había mostrado un crecimiento progresivo. A la exploración se apreciaba una placa eritematosa infiltrada que se extendía por dorso y punta nasal, alcanzando aproximadamente 2,5 cm de diámetro. El resto de la exploración física practicada y los estudios analíticos se encontraban dentro de la normalidad.
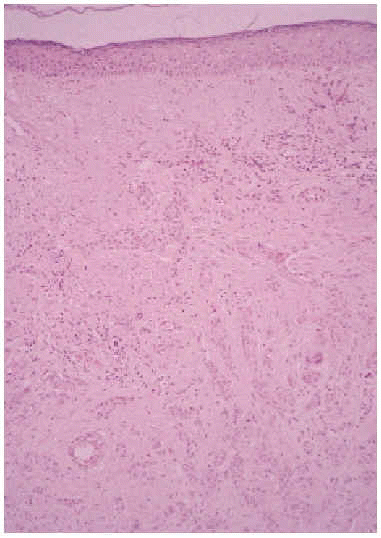
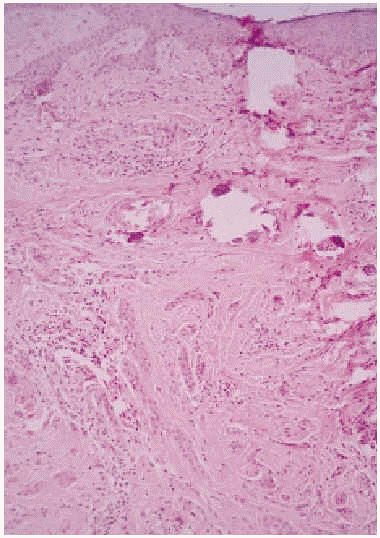
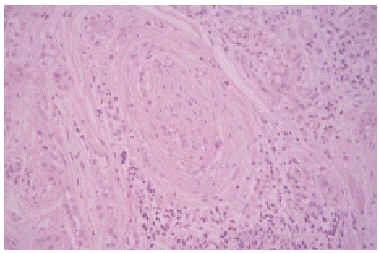
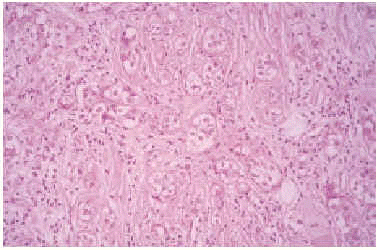
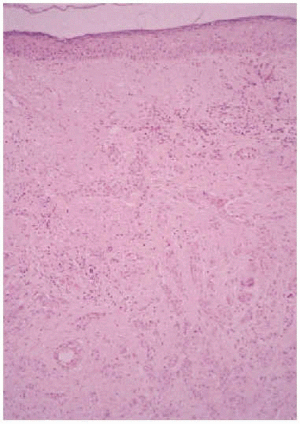
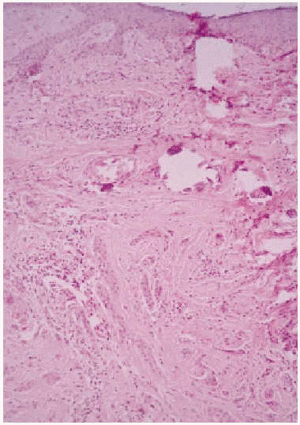
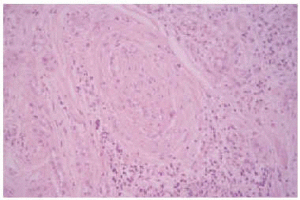
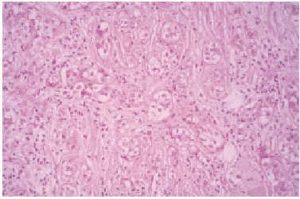
Se realizó una biopsia de la lesión y el estudio histopatológico mostró una proliferación de células basaloides formando nidos y cordones sin conexión con la epidermis e inmersas en una estroma densa, fibrosa e hialinizada (fig. 1). En la dermis superficial se apreciaban ocasionales microquistes de queratina con calcificación (fig. 2). Las células epiteliales se distribuían formando nidos y cordones, tenían una marcada diferenciación ductal y patrón infiltrativo, y afectaban al tejido celular subcutáneo, el músculo estriado mostrando también invasión del espacio perineural (fig. 3). Las células eran de pequeño tamaño, con ligero pleomorfismo, núcleos ovoides con nucléolo evidente y con citoplasma claro, a veces marcadamente vacuolado y contenían focalmente un material PAS (ácido peryódico de Schiff) positivo diastasa resistente (fig. 4).
Fig. 1.--Nidos y cordones celulares en dermis, sin conexión con la epidermis, inmersos en una estroma densa y fibrosa (HE, x10).
Fig. 2.--Quistes de queratina calcificados en dermis superficial (HE, x10).
Fig 3.--Invasión del espacio perinerural (HE, x20).
Fig 4.--Células con citoplasma claro a veces marcadamente vacuolado. Focalmente contienen material PAS positivo diastasa resistente (PAS-diastasa, x20).
Las células epiteliales expresaban inmunorreactividad para los antígenos carcinoembrionario (CEA), de membrana epitelial (EMA) y la citoqueratina de alto peso molecular 34 BE-12. La positividad para EMA era uniforme tanto en las células basaloides como en las áreas de células claras, pero en el caso de la citoqueratina de alto peso molecular 34 BE-12 y del CEA la positividad era uniforme en el citoplasma de las células basaloides mientras que, en las células claras, el citoplasma estaba sin teñir y la positividad se situaba en la membrana celular. La inmunorreactividad para citoqueratinas 7 y 20, p 53 y receptores de estrógenos y progesterona fue negativa.
Con el diagnóstico de carcinoma anexial microquístico la paciente fue remitida a un servicio de cirugía plástica, donde se le realizó una extirpación amplia cerrando el defecto mediante colgajo medio frontal. El informe anatomopatológico de esta pieza indicaba que no afectaba los bordes de resección y la paciente, 6 meses después de dicha intervención, se encuentra sin signos de recidiva.
DISCUSION
El carcinoma anexial microquístico es una neoplasia rara, localmente agresiva, reconocida como una entidad clinicopatológica independiente por Goldstein et al1. Produce una placa indurada, cuya localización casi exclusiva han sido la cabeza y el cuello2, aunque se ha descrito en otras localizaciones como el antebrazo3. Clínicamente aparece como una placa indurada que con frecuencia produce síntomas en forma de dolor o parestesias. Estos síntomas son indicativos de la alta frecuencia de invasión perineural la cual es la responsable de la dificultad de conseguir el control quirúrgico y de la alta incidencia de recidivas4.
Histológicamente está constituido por una proliferación pobremente circunscrita y asimétrica de queratinocitos basaloides1,5 o con aspecto más escamoso6 que forman quistes córneos, que pueden estar calcificados1, y en otros focos formando ductos y estructuras glandulares. Todo ello está inmerso en una estroma desmoplásica que invade con frecuencia los espacios perineurales y el músculo estriado subyacente1,2,7. Aunque todas estas neoplasias tienen quistes córneos y estructuras ductales, el porcentaje de cada uno de estos componentes varía de un tumor a otro1,3. Citológicamente la característica más importante es la ausencia de atipia y mitosis en las células epiteliales1,3 y es el carácter infiltrativo el que da al tumor su apariencia maligna3.
La presencia de células claras en los tumores anexiales dérmicos es un hallazgo raro y puede ser observado en tumores con diferenciación sebácea, ecrina o folicular8. El mecanismo de producción de estas células claras, en la mayor parte de los casos permanece desconocido, aunque en algunos se atribuye a la acumulación intracitoplasmática de glucógeno, lípidos y mucina, o a una distorsión artefacta8. En los casos de tumores anexiales con células claras cargadas de glucógeno, como ocurre en el siringoma de células claras, se ha encontrado una asociación con la presencia de diabetes mellitus9. Nuestra paciente no tenía antecedente de diabetes y el material no parecía corresponder a glucógeno, ya que el PAS positivo era resistente a diastasa.
Se han descrito carcinomas anexiales microquísticos formados por células epiteliales con citoplasma pálido y vacuolizado6. LeBoit y Sexton2 encuentran en 8 de 17 casos que las células poseen un citoplasma claro. También la neoplasia denominada carcinoma ecrino siringoide de células claras10 sería similar a nuestro caso, ya que los tumores más diferenciados de carcinoma ecrino siringoide formarían un espectro continuo con el carcinoma anexial microquístico. No obstante, en este caso, las células claras estaban cargadas de glucógeno al contrario que el nuestro10. Asimismo, se ha descrito la presencia de carcinomas anexiales microquísticos con células claras y vacuolizadas, pero con diferenciación sebácea2,11 cuando se demuestra por las tinciones apropiadas la presencia de contenido lipídico intracitoplasmático, lo cual requiere cortes por congelación, o bien por la presencia de áreas que se asemejan a los conductos sebáceos revestidos por una cutícula eosinofílica y espiculada12. Esta cutícula es tan específica que permite realizar el diagnóstico de esteatocistoma en ausencia del componente sebáceo de la pared del quiste13. En nuestro caso de carcinoma anexial microquístico, las células con citoplasma claro eran vacuolizadas, pero no formaban conductos sebáceos.
El diagnóstico diferencial se plantea con el tricoepitelioma desmoplásico, el tricoadenoma y el siringoma1. Difiere del tricoepitelioma desmoplásico y del siringoma por su crecimiento invasivo profundo. Por tanto, la distinción puede plantear formidables problemas si se trata de biopsias que incluyan sólo la parte más superficial de la lesión2,14, debido a la carencia de atipia citológica y lo infrecuente de la actividad mitótica6. La presencia de estructuras ductales permite la diferenciación con el tricoepitelioma desmoplásico y el tricoadenoma1. El CEA puede ser una herramienta de valor en los casos difíciles15,16. Muestra positividad en las zonas con diferenciación ductal y es negativo en las zonas con quiste de queratina y en los tumores con diferenciación folicular6,17. También puede ser de utilidad en esta distinción la presencia de células de Merkel en el tricoepitelioma dermoplásico y no en el carcinoma anexial microquístico18.
La diferenciación de este tumor es objeto de un arduo debate; por un lado, la mayor parte de los autores coincide en que tiene una diferenciación folicular evidente, otros autores encuentran en los quistes de queratina estructuras foliculares con pelos tipo lanugo1 y otros encuentran gránulos de tricohialina como evidencia de diferenciación hacia la raíz de la vaina interna2. Es la naturaleza de las estructuras ductales la que genera mayor discusión, ya que los conductos apocrinos y ecrinos tienen unos rasgos morfológicos e inmunohistoquímicos similares11. La diferenciación sería ecrina para algunos autores1,6,7,19, pero dado que se describen casos que muestran conductos con células que presentan secreción por decapitación2 y casos con conductos con diferenciación sebácea2,11 sería más racional considerar la diferenciación como apocrina debido a la unión anatómica y embriológica de la unidad foliculosebaceoapocrina11.
Dado que las recurrencias de esta neoplasia son frecuentes1,5,20 se ha recomendado que la cirugía controlada microscópicamente sería el tratamiento de elección6,21. La malignidad de la lesión sería solamente local, si bien se ha descrito algún caso que sufrió metástasis ganglionares22. Se ha utilizado la radioterapia de forma coadyuvante1, pero el tumor parece ser poco radiosensible y se han publicado casos en los que apareció un carcinoma anexial microquístico en zonas donde se había aplicado previamente radioterapia6,23,24.