Diversos estudios han demostrado el valor pronóstico de la técnica de la biopsia del ganglio centinela (BGC) y el índice mitótico (IM) en el melanoma. Sin embargo, la relación entre ambos factores no está bien establecida.
ObjetivosEl objetivo principal del estudio es describir y analizar la relación entre el resultado de la BGC y el IM en los pacientes con melanoma atendidos en nuestro centro.
MétodoEn total se incluyeron 139 pacientes en los que se realizó la BGC de forma consecutiva entre mayo de 2001 y mayo de 2009. La relación entre el IM y el resultado de la BGC se ha realizado mediante el test χ2 y el test exacto de Fischer.
ResultadosSe detectó una correlación no significativa entre estas 2 variables con p=0,071. En el subgrupo de pacientes que tenían un espesor de Breslow entre 4 y 1mm el resultado fue una asociación estadísticamente significativa entre el IM y el resultado de la BGC con p=0,034. La odds ratio para tener un ganglio positivo teniendo un IM<1 en este subgrupo es de 0,838 (IC 95%: 0,758-0,926).
DiscusiónNuestro resultado apoya la utilización del IM como factor predictivo del resultado de la BGC en melanomas de espesor intermedio y apoya la necesidad de estudiar la relación entre estos factores para melanomas finos y gruesos.
The prognostic value of sentinel lymph node (SLN) biopsy findings and mitotic activity in melanoma has been confirmed in the literature, but the relation between them has not been well established.
ObjectivesThe main objective was to describe and analyze the correlation between SLN biopsy results and the mitotic rate in patients treated for melanoma in our hospital.
MethodsA total of 139 consecutive patients who underwent SLN biopsy between May 2001 and May 2009 were included. The relation between the mitotic rate and SLN status was analyzed with the χ2 test and the Fischer exact test.
ResultsThe correlation between the 2 variables was nonsignificant (P =.071) in the patient series overall, but a significant association was found in the subgroup of patients with tumors of Breslow thickness between 1 and 4mm (P =.034). The likelihood (odds ratio) of SLN positivity with a mitotic rate of less than 1 mitosis/mm2 in this subgroup was 0.838 (95% CI, 0.758-0.926).
ConclusionsOur findings support use of the mitotic rate to predict SLN status in melanoma tumors of intermediate thickness. Our study also shows the need for further investigation of the relation between these 2 variables in thin and thick tumors.
Diversos estudios han demostrado que el estado de los ganglios linfáticos regionales es el factor pronóstico independiente más importante en la supervivencia de los pacientes con melanoma1–3 y, aunque ningún estudio aleatorizado ha demostrado que la resección ganglionar precoz de los ganglios positivos mejore la supervivencia, se acepta que la correcta estratificación es la base para la elección de la actitud terapéutica y establecer el pronóstico2. En 1990, Morton et al. describieron la técnica de la biopsia del ganglio centinela (BGC)4,5. Actualmente está considerada el procedimiento más sensible y específico para la detección de micrometástasis de melanoma en los ganglios linfáticos regionales, con menor morbilidad y efectos secundarios que la linfadenectomía electiva2,6–8.
El índice mitótico (IM) se ha mostrado como el segundo factor pronóstico más potente en el tumor primario, tras el espesor de Breslow9. En el nuevo sistema de estadificación de la AJCC de 2009 el IM ha sustituido al nivel de invasión de Clark en melanomas con grosor menor o igual a 1mm7. Aunque el IM es una variable cuantitativa discreta con valor mínimo de 0, no se han encontrado otros puntos de corte superiores a 1 mitosis/mm2 que indiquen un aumento del riesgo de metástasis10. La relación entre el resultado de la técnica de la BGC y el IM no está bien establecida11,12.
Nuestra hipótesis de trabajo se establece sobre la base de que deben existir correlaciones significativas entre el resultado de la BGC y el IM, así como entre el resultado de la BGC y otros factores pronósticos establecidos en la estadificación del melanoma.
ObjetivosEl objetivo principal del estudio es describir y analizar la relación entre el estado de GC (positivo o negativo) y el IM en los pacientes con melanoma atendidos en nuestro centro. Como objetivos secundarios nos planteamos: a) determinar si los pacientes con un GC positivo atendidos en nuestro centro presentan una supervivencia menor que los pacientes que tienen un resultado negativo, y b) determinar si existe relación entre la positividad del GC en los pacientes atendidos en nuestro centro y otras variables con valor pronóstico probado como son el espesor de Breslow, el nivel de Clark, la ulceración, la regresión, la edad y el sexo.
MétodoÁmbito del estudioEl estudio se ha realizado en el Servicio de Dermatología del Consorcio Hospital General Universitario de Valencia (CHGUV), un hospital terciario que atiende a 378.138 habitantes.
Diseño del estudioRealizamos un estudio de cohortes, con un diseño observacional analítico longitudinal con carácter ambidireccional, puesto que se recogieron datos retrospectiva y prospectivamente.
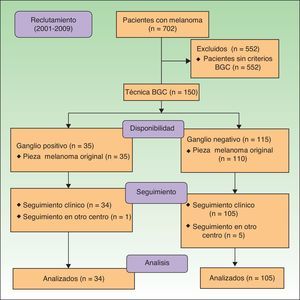
Población del estudioSe seleccionaron retrospectivamente de la base de datos (BBDD) de melanoma del Servicio de Dermatología del CHGUV los pacientes diagnosticados de melanoma a los que se realizó la BGC entre mayo de 2001 (año de comienzo de realización de la técnica en este centro) y mayo de 2009, respectivamente, seleccionando así un total de 150 pacientes. En todos los pacientes la información clínica e histológica correspondiente al momento del diagnóstico se recogió en la BBDD de forma prospectiva antes de la BGC. Se seleccionó solo a los pacientes que cumplieran con los siguientes criterios de inclusión: a) pacientes con melanoma de ≥ 1mm de espesor o melanomas de ≥ 0,76 y ≤ 1mm de espesor que además presentaban signos histológicos de regresión o ulceración; b) pacientes en los que se calculó el IM mediante revisión directa de la pieza histológica del melanoma primario; c) pacientes en los que la BGC fue realizada en nuestro centro, y d) pacientes en los que se realizó seguimiento en nuestro centro. Se excluyeron del estudio los pacientes con melanoma múltiple, melanoma extracutáneo, los menores de 16 años y aquellos en los que no fue posible reevaluar la pieza histológica original (fig. 1).
El análisis histológico del melanoma primario fue revisado retrospectivamente en el año 2011 por un mismo dermatopatólogo con experiencia en lesiones pigmentarias para eliminar la variabilidad interobservador en función de las recomendaciones de las guías clínicas existentes7; en el caso de la regresión se consideró presencia de la misma cuando en más del 50% de la lesión había infiltrado inflamatorio y existía de forma simultánea, aunque fuera en menor grado, fibrosis. En el informe dermatopatológico se incluyeron de forma sistemática el diagnóstico, el espesor tumoral (Breslow) en milímetros, la presencia o ausencia de ulceración, el IM, la afectación de márgenes, el nivel anatómico de afectación (niveles de Clark)7, el subtipo histológico, la presencia de regresión, la categoría T y la presencia de crecimiento vertical13.
Técnica de la biopsia del ganglio centinela3,14La BGC se realizó con la inyección del radionúclido tecnecio 99 (Nancol, Molypharma S.A.) intradérmicamente en la zona peritumoral de forma preoperatoria, el mismo día de la intervención y su detección mediante la gammacámara y posterior sonda gamma intraoperatoria (Navigator GPS, Dynasil Corp.).
Análisis histológico del ganglio centinelaEl GC se biseccionó a lo largo del pedículo vascular para su fijación en formalina y una vez fijado el tejido se procedió a la realización de cortes seriados con el microtomo con un espesor de 3μm incluyéndose 3 cortes de cada porción para hematoxilina-eosina (HE) y otro para Melan-A. Se consideró ganglio positivo todo aquel que presentó células de melanoma detectables con HE o Melan-A (Menarini Diagnostics S.R.L.), sin un umbral mínimo.
SeguimientoSe realizó el seguimiento de todos los pacientes incluidos en el estudio, independientemente del tratamiento posterior. En el seguimiento se registraron todas las recaídas ocurridas, tanto las metástasis a distancia como las recurrencias locales y de ganglios linfáticos regionales. Se registraron además las muertes ocurridas por melanoma y por causas distintas de melanoma. El seguimiento concluyó en febrero de 2012.
Análisis estadísticoLas variables edad, espesor de Breslow e IM se han categorizado para su análisis estadístico. La comparación de las características clínicas y datos dermatopatológicos entre el grupo de pacientes que presentaron GC positivo y los que presentaron GC negativo se ha realizado mediante el test χ2 y el test exacto de Fischer. Para controlar los posibles factores de confusión se realizó un análisis de regresión logística por pasos, con el criterio de entrada valor de p inferior a 0,20 para el modelo inicial y criterio de permanencia en el modelo final p inferior a 0,05. Las curvas de tiempo libre de enfermedad y mortalidad total se calcularon mediante el método del producto de Kaplan-Meier y se realizó el long-rank test para detectar diferencias entre las curvas. Se realizó análisis multivariado de supervivencia para el tiempo libre de enfermedad y la mortalidad total incorporando las variables estadísticamente significativas con el test long-rank (p<0,05) al modelo de regresión de Cox, con el fin de detectar los factores predictores de supervivencia independientes en los pacientes con melanoma de nuestra muestra. Las covariables individuales del modelo se expresan con la hazard ratio (HR) y su intervalo de confianza (IC) del 95%. El nivel de significación bilateral se determinó mediante un valor de p inferior a 0,05. El análisis estadístico se realizó con el paquete de software estadístico para ciencias sociales IBM SPSS Statistics 20 para MAC (IBM, Estados Unidos).
ResultadosDescripción de la muestraSe incluyeron un total de 139 pacientes en los que se pudo evaluar la pieza histológica del melanoma original. En la tabla 1 se resumen las características epidemiológicas y clínicas de los pacientes. La edad media en el momento de la realización de la BGC fue de 53,34±16,05 años (rango 18-85 años), con un ligero predominio de los varones en nuestra muestra (77 hombres, 55,4%) frente a las mujeres (62 pacientes, 44,6%).
Características clínicas y epidemiológicas de la población de estudio
| Hombre | Mujer | Valor p | |
| Grupo de edad | 0,073 | ||
| ≤ 60 años | 59,7 (46) | 74,2 (46) | |
| > 60 años | 40,3 (31) | 25,8 (16) | |
| Color pelo-fototipo | 0,307 | ||
| Rubio | 13 (10) | 24,2 (15) | |
| Rojo | 5,2 (4) | 4,8 (3) | |
| Castaño | 81,8 (63) | 71 (44) | |
| Localización | 0,000 | ||
| Cabeza | 0 (0) | 3,2 (2) | |
| Tronco | 70,1 (54) | 25,8 (16) | |
| MMSS | 15,6 (12) | 22,6 (14) | |
| MMII | 14,3 (11) | 48,4 (30) | |
MMII: miembros inferiores; MMSS: miembros superiores.
Nota: Se expresan los porcentajes y el número de pacientes entre paréntesis.
El GC resultó positivo en el 24,5% de la muestra (34 pacientes) y negativo en el 75,5% restante (105 pacientes). En la tablas 2 y 3 se resumen las características clínicas e histológicas de los pacientes con GC positivo y negativo.
Características clínicas de los pacientes en función del estado del ganglio centinela
| GC+ | GC− | Valor p | |
| Grupo de edad | 0,83 | ||
| ≤ 60 años | 23,9 (22) | 76,1 (70) | |
| > 60 años | 25,5 (12) | 74,5 (35) | |
| Sexo | 0,209 | ||
| Hombre | 28,6 (22) | 71,4 (55) | |
| Mujer | 19,4 (12) | 80,6 (50) | |
| Color pelo | 0,017 | ||
| Rubio | 41,7 (10) | 58,3 (15) | |
| Rojo | 42,9 (3) | 57,1 (4) | |
| Castaño | 18,7 (20) | 81,3 (87) | |
| Tipo anatomoclínico | 0,484 | ||
| LMM | 0 (0) | 100 (3) | |
| MES | 21,3 (19) | 78,7 (70) | |
| MMN | 32,1 (9) | 67,9 (19) | |
| MLA | 27,8 (5) | 72,2 (13) | |
| otros | 100 (1) | 0 (0) | |
| Lesión preexistente | 0,530 | ||
| NM adquirido | 19,4 (7) | 80,6 (29) | |
| NM displásico | 0 (0) | 100 (2) | |
| NM congénito | 0 (0) | 100 (2) | |
| No lesión | 27,3 (27) | 72,7 (72) | |
| Localización | 0,253 | ||
| Cabeza | 0 (0) | 100 (2) | |
| Tronco | 31,4 (22) | 68,6 (48) | |
| MMSS | 19,2 (5) | 80,8 (21) | |
| MMII | 17,1 (7) | 82,9 (34) | |
| Síntomas en MM | |||
| Hemorragia | 0,035 | ||
| Sí | 35,6 (16) | 64,4 (29) | |
| No | 19,1 (18) | 80,9 (76) | |
| Dolor | 0,418 | ||
| Sí | 0 (0) | 100 (2) | |
| No | 24,8 (34) | 75,2 (103) | |
| Aumento volumen | 0,194 | ||
| Sí | 26,2 (32) | 73,8 (90) | |
| No | 11,8 (2) | 88,2 (15) | |
| Cambio color | 0,464 | ||
| Sí | 28,3 (13) | 71,7 (33) | |
| No | 22,6 (21) | 77,4 (72) | |
GC: ganglio centnela; LMM: lentigo melanoma maligno; MES: melanoma de extensión superficial; MLA: melanoma lentiginoso acral; MM: melanoma; MMII: miembros inferiores; MMN: melanoma nodular; MMSS: miembros superiores; NM: nevo melanocítico.
Nota: Se expresan los porcentajes y el número de pacientes entre paréntesis.
Características histológicas de los pacientes en función del resultado del ganglio centinela (GC)
| GC+ | GC− | Valor p | |
| Niveles de Clark | 0,048 | ||
| iii | 17,4 (15) | 82,6 (71) | |
| iv | 36,6 (15) | 63,4 (26) | |
| v | 33,3 (4) | 66,7 (8) | |
| Categoria Breslow | 0,044 | ||
| 0-2mm | 17,6 (13) | 82,4 (61) | |
| > 2mm | 32,3 (21) | 67,7 (44) | |
| Índice mitótico | 0,071 | ||
| < 1/mm2 | 5,9 (1) | 94,1 (16) | |
| ≥ 1/mm2 | 27,0 (33) | 73 (89) | |
| Ulceración histológica | 0,000 | ||
| Ausente | 13,1 (13) | 86,9 (86) | |
| Presente | 52,5 (21) | 47,5 (19) | |
| Regresión | 0,909 | ||
| Presente | 24,1 (13) | 75,9 (39) | |
| Ausente | 25,0 (21) | 75,0 (64) | |
| Tipo celular | 0,840 | ||
| Fusiforme | 20 (1) | 80 (4) | |
| Epiteloide | 25,6 (22) | 74,4 (64) | |
| Mixto | 0 (0) | 100 (1) | |
| Nevoide | 0 (0) | 100 (3) | |
| Atípico | 23,8 (10) | 76,2 (32) | |
| Satelitosis | 0,554 | ||
| Ausentes | 23,4 (29) | 76,6 (95) | |
| Presentes | 30,8 (4) | 69,2 (9) | |
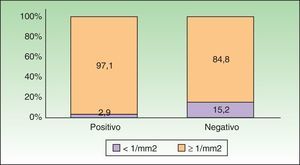
El 97,1% (33 pacientes) de los pacientes con GC positivo presentó un IM ≥ 1 y solo el 2,9% (1 paciente) tuvo un IM < 1. Entre los pacientes con GC negativo, el 15,2% (16 pacientes) tuvo un IM < 1 y el 84,8% (89 pacientes) un IM ≥ 1 (fig. 2). Mediante el análisis estadístico univariante con la prueba del test estadístico exacto de Fischer se detectó una correlación no significativa entre estas 2 variables con p=0,071. En el subgrupo de pacientes con Breslow entre 1 y 4mm se detectó una asociación estadísticamente significativa bilateral mediante el test estadístico exacto de Fischer entre el IM y la presencia de afectación metastásica del GC con p=0,034. En este subgrupo todos los pacientes (n=25) con metástasis en el GC tenían un IM ≥ 1/mm2 y ningún paciente con un IM ≤ 1/mm2 tenía un GC positivo. Entre los pacientes con GC negativo, el 16,2% (n=12) tuvo un IM < 1/mm2 y el 83,8% (n=62) un IM ≥ 1/mm2. La OR para tener una GC positivo teniendo un IM<1/mm2 en este subgrupo fue de 0,838 (IC 0,758-0,926).
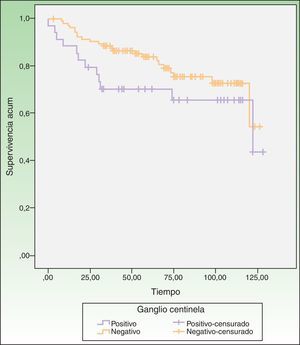
Biopsia del ganglio centinela y supervivenciaLa mediana de seguimiento de los pacientes fue de 122 meses. La media de tiempo libre de enfermedad fue de 101,17 meses (rango intercuartílico 93,59-108,75). En los pacientes con GC positivo la tasa de supervivencia a los 5 años fue del 70,2% (IC 95%: 54-85%) y en los pacientes con CG negativo fue del 79% (IC 95%: 70-87%). A lo largo del seguimiento, 35 pacientes fallecieron y 3 recayeron, 12 con ganglio positivo (el 35,3% de los pacientes con ganglio positivo) y 23 con ganglio negativo (el 21,9% de pacientes con ganglio negativo) (tabla 4). Las curvas de Kaplan-Meier muestran menor tiempo de supervivencia entre los pacientes con GC positivo, aunque la diferencia no fue estadísticamente significativa (long-rank: p = 0,153) (fig. 3).
Variables y mortalidad en el análisis univariado
| Factor | N.o de muertes | % muertes | Tiempo de supervivencia | IC tiempo | p (long-rank) |
| Edad | 0,001 | ||||
| ≤ 60 | 15 | 16,3 | 111,45 | 103,91-118,99 | |
| > 60 | 20 | 42,6 | 80,04 | 64,88-95,22 | |
| Sexo | 0,009 | ||||
| H | 26 | 33,8 | 91,23 | 80,43-102,04 | |
| M | 9 | 14,5 | 112,97 | 103,91-122,03 | |
| Ulceración | 0,002 | ||||
| Sí | 18 | 45 | 84,05 | 68,67-99,43 | |
| No | 17 | 17,2 | 107,38 | 99,44-115,32 | |
| Regresión | 0,796 | ||||
| Sí | 13 | 25 | 98,67 | 85,98-11,36 | |
| No | 22 | 25,3 | 101,90 | 92,61-111,19 | |
| Breslow | 0,007 | ||||
| 0-2 | 11 | 14,9 | 109,72 | 101,02-118,42 | |
| > 2 | 24 | 36,9 | 90,42 | 78,47-102,36 | |
| Clark | 0,000 | ||||
| iii | 18 | 20,9 | 104,73 | 95,25-114,22 | |
| iv | 9 | 22 | 103,77 | 92,82-114,72 | |
| v | 8 | 66,6 | 53,45 | 32,60-74,29 | |
| Ganglio | 0,153 | ||||
| + | 12 | 35,3% | 91,03 | 73,78-108,28 | |
| − | 23 | 21,9% | 103,30 | 95,26-111,34 | |
| IM | 0,230 | ||||
| < 1/mm2 | 2 | 11,8 | 97,76 | 85,78-109,75 | |
| ≥ 1/mm2 | 33 | 27 | 99,42 | 91,18-107,67 | |
H: hombres, IM: índice mitótico, M: mujeres.
Nota: El evento muerte se recoge en número total y porcentaje. El tiempo hasta el evento se expresa mediante la media en meses con intervalo de confianza (IC) del 95%. Las relaciones estadísticamente significativas se han marcado en negrita.
El análisis univariado del estado del GC con factores pronósticos de valor establecido en nuestra muestra demostró asociación estadísticamente significativa con el espesor de Breslow (p=0,044), el nivel de Clark (p=0,048) y la ulceración (p=0,00). Las variables regresión, sexo y edad no mostraron una asociación estadísticamente significativa con la presencia de GC positivo (p=0,909, p=0,209 y p = 0,88, respectivamente) (tablas 2 y 3). En el análisis multivariado la única variable que se mantuvo estadísticamente significativa fue la presencia de ulceración (p=0,000); esta aumentó 7,039 veces la probabilidad de un GC positivo (tabla 5).
Análisis multivariado de factores pronósticos establecidos y ganglio centinela
| Ganglio centinela | p | OR | Intervalo de confianza al 95% para OR | |
| Límite inferior | Límite superior | |||
| Breslow | 0,721 | 0,823 | 0,284 | 2,388 |
| Clark | 0,526 | 1,275 | 0,602 | 2,699 |
| Ulceración | 0,000 | 7,039 | 2,681 | 18,482 |
| Regresión | 0,864 | 1,083 | 0,435 | 2,700 |
| IM | 0,145 | 5,062 | 0,572 | 44,837 |
| Edad | 0,340 | 0,697 | 0,332 | 1,463 |
| Sexo | 0,145 | 0,497 | 0,194 | 1,273 |
IM: índice mitótico; OR: odds ratio.
La indicación de la BGC se basa en estudios que demuestran que el estado del GC es el factor pronóstico independiente más potente para la supervivencia y tiempo libre de enfermedad15,16, pero no existe evidencia que demuestre que esta técnica tenga un impacto en la supervivencia del paciente17–19, y se asocia a una morbilidad de un 10% que incluye linfedema, seromas, infección y tromboflebitis20. De acuerdo con las indicaciones vigentes, el 80% de los pacientes a los que se les ha practicado la BGC tiene un GC negativo. Nuestros resultados de la BGC, con una presencia de enfermedad metastásica ganglionar del 24% están en consonancia con otros estudios, lo que hace pensar que tanto la indicación como los métodos utilizados en nuestra serie para su detección y análisis fueron adecuados. Además de los efectos secundarios, existe un coste asociado a la BGC que podría evitarse en el 80% de los pacientes en los que el GC es negativo si se mejoraran los criterios de selección de este procedimiento19.
El IM del melanoma primario ha demostrado ser un potente factor pronóstico independiente en la supervivencia de los pacientes con melanoma. Datos de la AJCC Melanoma Staging Database muestran una correlación negativa entre el aumento del IM y la supervivencia. La AJCC ha incluido el IM≥1/mm2 del melanoma primario como T1b en la clasificación TNM por su asociación a una menor supervivencia, pero no hay suficientes datos para determinar el riesgo de micrometástasis ganglionares en los pacientes con un IM≥1/mm26.
En nuestro estudio la mayoría de los pacientes con GC positivo (97,1%) tuvieron un IM≥1/mm2 pero las diferencias no fueron estadísticamente significativas en comparación con los pacientes con GC negativo (84,8% con IM≥1/mm2). Esta ausencia de significación puede ser explicada por varios motivos: la distribución de la muestra; el tamaño muestral, y el umbral de detección para el IM. En nuestro estudio se ha escogido el nivel establecido por la AJCC (≥ 1 mitosis/mm2) para la estadificación del melanoma. Este umbral ha demostrado relación con la supervivencia, pero no con el resultado de la BGC. Otros estudios que han encontrado relación entre la BCG y el IM han utilizado otros valores distintos al de la AJCC como punto de corte (bajo: 0-1/mm2; medio 2-5/mm2; alto ≥ 5/mm2; ≥ 6/mm2)19,21,22, del espesor del melanoma primario. Nuestra muestra ha incluido melanomas desde 0,75mm hasta más de 4mm de Breslow. Se ha señalado que el IM pierde su valor predictivo a medida que aumenta el espesor del tumor, siendo solo un marcador de agresividad en tumores finos21, mientras que los de Breslow menor de 1mm han mostrado resultados variables en la BGC22,23.
El análisis del subgrupo de pacientes con Breslow entre 1 y 4mm para evitar el posible factor de confusión asociado a los melanomas de gran espesor21 y un posible sesgo de selección en los melanomas finos mostró una correlación estadísticamente significativa entre el IM y el resultado de la técnica del BCG con el test estadístico exacto de Fischer (p=0,034). Nuestro resultado apoya la utilización del IM como factor predictivo del resultado de la BGC en melanomas de espesor intermedio (1-4mm de Breslow) y apoya la necesidad de estudiar la relación entre estos factores23,24.
Biopsia del ganglio centinela y otros factores pronósticos establecidosAdemás de estudiar la relación entre el resultado de la BGC y el IM, analizamos la relación del mismo con otros factores pronósticos establecidos6,7. Nuestros resultados mostraron relación en el análisis univariado entre el resultado de la BGC y el aumento de espesor de Breslow, el nivel de Clark y la presencia de ulceración. La edad, el sexo y la presencia de regresión no mostraron relación estadísticamente significativa con el resultado de la BGC.
El espesor de Breslow es considerado como el principal factor predictivo del resultado de la BCG y está incluido como el principal criterio para la realización de la misma6,7. Se recomienda la realización de la técnica cuando el Breslow es superior a 1mm porque se considera que hay un riesgo superior a un 10% de tener afectación ganglionar. Por debajo de ese espesor el riesgo de afectación ganglionar disminuye al 3%1–3 y solo se considera si hay otros factores pronósticos negativos asociados. En nuestro estudio los pacientes con un Breslow > 2mm mostraron un mayor porcentaje de metástasis ganglionares estadísticamente significativo frente a los que tenían un Breslow < 2mm en el análisis univariado (p=0,044). Escogimos para el análisis 2mm como punto de corte por ser estadísticamente el mejor para crear 2 grupos. Este resultado es consistente con otros estudios publicados que muestran relación entre el aumento del espesor del melanoma primario y la presencia de metástasis ganglionares12,16,25, aunque las medidas escogidas para el análisis difieren entre estudios.
En el análisis estadístico multivariado, el espesor de Breslow, reconocido como uno de los factores predictivos más reproducibles11,19,21,24,25, no mostró una relación estadísticamente significativa. Este resultado podría explicarse porque muchas variables histológicas como el espesor de Breslow, los niveles de Clark y la ulceración están correlacionadas entre sí y actúan como factores de confusión11.
El valor pronóstico del nivel de Clark para la presencia de GC positivo ha sido controvertido en otros estudios11,19,21,22,24. En nuestra serie encontramos una relación entre el aumento del nivel y la presencia del GC positivo en el análisis univariado (p=0,048), pero todos tenían un Clark igual o mayor de iii, lo que podría haber influido en el resultado. Al analizar los estudios publicados se observa que los niveles de corte del índice de Clark utilizados son muy variables, haciendo la comparación de los resultados dificultosa, por lo que no existe un nivel de Clark establecido como el óptimo para predecir la presencia de GC positivo.
La presencia de ulceración en nuestro estudio se asocia de manera muy significativa a la presencia de GC positivo tanto en el análisis uni como en el multivariado (p=0,000). Muchos autores han encontrado esta asociación en las series publicadas18,22 y la ulceración está asociada negativamente con la supervivencia en todos los subgrupos de Breslow del melanoma18, lo que ha hecho que esté incluida en la clasificación TNM de la AJCC desde su sexta edición9. En contraste con estos datos, Sondak et al.11 no encuentran asociación entre la presencia de ulceración y el resultado positivo del GC, lo que atribuyen a las distintas posibles causas de la ulceración y al error que puede inducir su presencia al medir el Breslow. En nuestro estudio se incluyó para la técnica de la BGC a los pacientes con Breslow > 0,75mm y la presencia de ulceración según recomendación de la AJCC6. Nuestro resultado apoya la realización de la BCG en los pacientes que presentan ulceración, aunque el Breslow sea menor de 1mm.
Las variables edad, sexo y regresión no fueron significativas en el análisis univariado. La edad ha sido un tema debatido en los resultados del GC11,19,21,24. Algunos autores han detectado una menor afectación ganglionar en los pacientes de mayor edad pese a tener menor tiempo libre de enfermedad y supervivencia11,26. Estas diferencias podrían explicarse por una disfunción linfática asociada a la edad como muestra el estudio de Conway et al. en el que encuentran una disminución del flujo y captación de radiocoloide con el incremento de edad27. La relación entre el sexo y el resultado de la BGC no está establecida, habiendo estudios que muestran mayor número de GC positivos en varones11,17,22 y otros que no la encuentran11,19,21,24. En nuestro estudio encontramos un mayor porcentaje de hombres con GC positivo (28,6 hombres frente a 19,4% en mujeres), pero este resultado no fue estadísticamente significativo.
La regresión histológica está presente entre un 10 y 35% de todos los melanomas, pero su ponderación no está estandarizada28. Está compuesta por cantidades variables de tejido fibroso, linfocitos, neoformación vascular y melanófagos que sustituyen al melanoma primario. Su medición da lugar a resultados dispares porque depende de la definición de la misma y de la subjetividad del dermatopatólogo. En nuestro estudio no hallamos relación significativa entre la presencia de regresión y la positividad de la BGC28.
El resultado de la BGC es considerado el factor pronóstico más específico y sensible para el tiempo libre de enfermedad y la mortalidad2. En nuestro estudio, la tasa de supervivencia libre de enfermedad a los 5 años en los pacientes con GC positivo fue de 67 frente a un 82% en los pacientes con GC negativo, diferencia no significativa estadísticamente (p=0,132); la tasa de supervivencia a los 5 años fue del 70,2% para los pacientes con GC positivo y del 79% en los que el GC fue negativo, diferencia no estadísticamente significativa (p=0,153). Aunque estos resultados sí que muestran una mayor supervivencia en los pacientes con GC negativo, la ausencia de significación puede estar influida por varios motivos: el tratamiento posterior que reciben los pacientes con GC positivo. Según la AJCC la presencia de metástasis en el GC sitúa al paciente en un estadio iii, y el tratamiento estándar de esta etapa es el vaciamiento ganglionar terapéutico. En nuestro estudio la presencia de GC positivo hizo que se considerara enfermedad regional avanzada y los pacientes recibieron tratamiento oncológico adyuvante, como interferón alfa a dosis altas, en el caso de considerarse necesario. Esta diferencia en el tratamiento finalmente aplicado a los pacientes con GC positivo puede haber influido en la ausencia de diferencia significativa de mortalidad y tiempo libre de enfermedad respecto a los pacientes con GC negativo; el tamaño muestral de nuestra serie, no pudiendo descartar que la tendencia observada de un mejor pronóstico de los pacientes con GC negativo pueda ser significativa con un tamaño muestral superior; el espesor de los melanomas analizados: Morton et al.3 encontraron diferencias en la supervivencia pero escogieron para el análisis el subgrupo de pacientes con melanomas entre 1,2 y 3,5mm de espesor. El motivo por el que Morton et al. escogieron este nivel de corte para el análisis fue el resultado de los estudios preliminares que señalaban que en este subgrupo de pacientes la diferencia entre la linfadenectomía electiva o tras la detección clínica de afectación ganglionar sí que afectaría a la supervivencia29. Nuestros resultados apoyan la utilización de la BGC como procedimiento para determinar el pronóstico y la clasificación del melanoma, pero hacen falta más estudios para establecer su valor terapéutico.
ConclusionesLa relación entre el IM y el estado del GC no está bien establecida. Nuestro resultado no muestra relación entre ambas variables cuando incluimos los melanomas < 1mm en el análisis por lo que coincidimos con Attis y Vollmer30 en que el IM no debería de realizarse de rutina al ser una técnica laboriosa. Creemos que en los tumores de menos de 1mm hay otros parámetros que pueden ayudar a seleccionar correctamente a los pacientes candidatos a la BGC (ulceración, nivel de invasión) y en los tumores con espesor ≥ 1mm ya se tiene la indicación de la técnica. Apoyamos los criterios de la sexta edición de la clasificación de la AJCC en los que no se considera el IM para seleccionar a los pacientes candidatos para la realización de la BGC.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.