La Medicina Regenerativa es un campo emergente que combina la investigación básica y la experiencia clínica con el objetivo de proporcionar los elementos necesarios para reemplazar in vivo tejidos y órganos dañados, estimulando además la capacidad regenerativa intrínseca del organismo. Se esperan grandes avances en este campo en los próximos años, debido a las potenciales propiedades regenerativas de las células madre embrionarias y adultas, y más recientemente de las células madre pluripotentes inducidas.
La bioingeniería cutánea surgió motivada principalmente por la necesidad crítica de dar cobertura permanente a grandes quemados, y posteriormente se ha empleado también en el tratamiento de úlceras crónicas. Nuestro equipo ha desarrollado un modelo preclínico humanizado basado en el trasplante de piel bioingenierizada a ratones inmunodeficientes que posibilita el estudio de procesos fisiológicos y patológicos cutáneos, así como la evaluación de estrategias terapéuticas de intervención dermatológica, incluyendo protocolos de terapia génica y celular e ingeniería tisular.
Regenerative Medicine is an emerging field that combines basic research and clinical observations in order to identify the elements required to replace damaged tissues and organs in vivo and to stimulate the body's intrinsic regenerative capacity. Great benefits are expected in this field as researchers take advantage of the potential regenerative properties of both embryonic and adult stem cells, and more recently, of induced pluripotent stem cells. Bioengineered skin emerged mainly in response to a critical need for early permanent coverage of extensive burns. Later this technology was also applied to the treatment of chronic ulcers. Our group has established a humanized mouse model of skin grafting that involves the use of bioengineered human skin in immunodeficient mice. This model is suitable for the study of physiologic and pathologic cutaneous processes and the evaluation of treatment strategies for skin diseases, including protocols for gene and cell therapy and tissue engineering.
La regeneración continua de la epidermis tiene lugar a expensas de la proliferación de una subpoblación de células especializadas del estrato basal, que son las células madre de la epidermis (CME)1. La comprensión de la biología fundamental de las CME y de los mecanismos que rigen su multipotencialidad, unida al conocimiento de la base genética de distintas enfermedades cutáneas, son claves para el desarrollo de posibles estrategias terapéuticas de aplicación clínica. De hecho, gran parte del éxito de las terapias de ingeniería tisular cutánea más novedosas basadas en protocolos de terapia génica y/o celular radica en el mantenimiento funcional del compartimento stem. En este sentido, en los últimos 15 años se han realizado grandes avances enfocados a la identificación, aislamiento y caracterización de las CME2,3.
La posible utilización terapéutica de células somáticas derivadas de las células madre embrionarias es un tema candente en relación con la Medicina Regenerativa. Aunque las biopsias de piel son la fuente regular de los queratinocitos y de las CME, estudios recientes apuntan a la generación de queratinocitos a partir de células madre embrionarias humanas4. Por otro lado, también se ha conseguido derivar células pluripotenciales a partir de queratinocitos adultos5. El avance en este campo es realmente vertiginoso, y habrá que estar muy atento en los próximos años para poder trasladar de una forma realista todos estos avances biológicos y moleculares al día a día de la clínica.
La bioingeniería cutánea en la clínicaHasta la fecha, el tratamiento estándar para las quemaduras graves y extensas se basa en el injerto de piel obtenida de una zona no lesionada del propio paciente (técnica conocida como autoinjerto), consiguiéndose una regeneración cutánea permanente6,7. Esta estrategia funciona de manera eficiente siempre que el daño no sea demasiado extenso y que el paciente disponga de suficiente piel en buen estado. Por lo general, el autoinjerto se obtiene de la misma zona en varias ocasiones, permitiendo que dicho sitio donante regenere entre tomas. Este procedimiento es lento, doloroso y además de difícil aplicación en pacientes con quemaduras en más del 50-60% de la superficie corporal. La necesidad crítica de dar cobertura permanente a estos pacientes ha sido clave en el desarrollo de la bioingeniería cutánea y constituye una alternativa eficaz a los autoinjertos de piel, ya que disminuye el dolor y las potenciales complicaciones en los sitios donantes, además de minimizar el problema de disponibilidad de una superficie sana suficientemente extensa en el paciente. Así, distintos tipos de piel bioingenierizada han surgido durante los últimos 20 años, que si bien se emplearon inicialmente para dar solución a pérdidas cutáneas agudas, posteriormente se han utilizado para diversas aplicaciones, como en el tratamiento de heridas crónicas8.
El equivalente cutáneo ideal debería ser fácil de manipular, resistente y barato, además de ser capaz de recrear la fisiología de la piel normal y no inducir rechazo inmunológico en el receptor. En general, los tres conceptos clave para la bioingeniería cutánea son: a) la fuente de células; b) la capacidad de regeneración de las mismas; y c) la matriz o andamiaje empleado9. En un principio, los sustitutos cutáneos empleados estaban constituidos sólo por láminas de queratinocitos, y posteriormente, se demostró que la inclusión de un bio-molde o andamio que hiciera las veces de tejido conectivo podía mejorar la resistencia mecánica de los mismos, reducir las cicatrices y, sobre todo, favorecer la persistencia in vitro e in vivo de CME funcionales10–13.
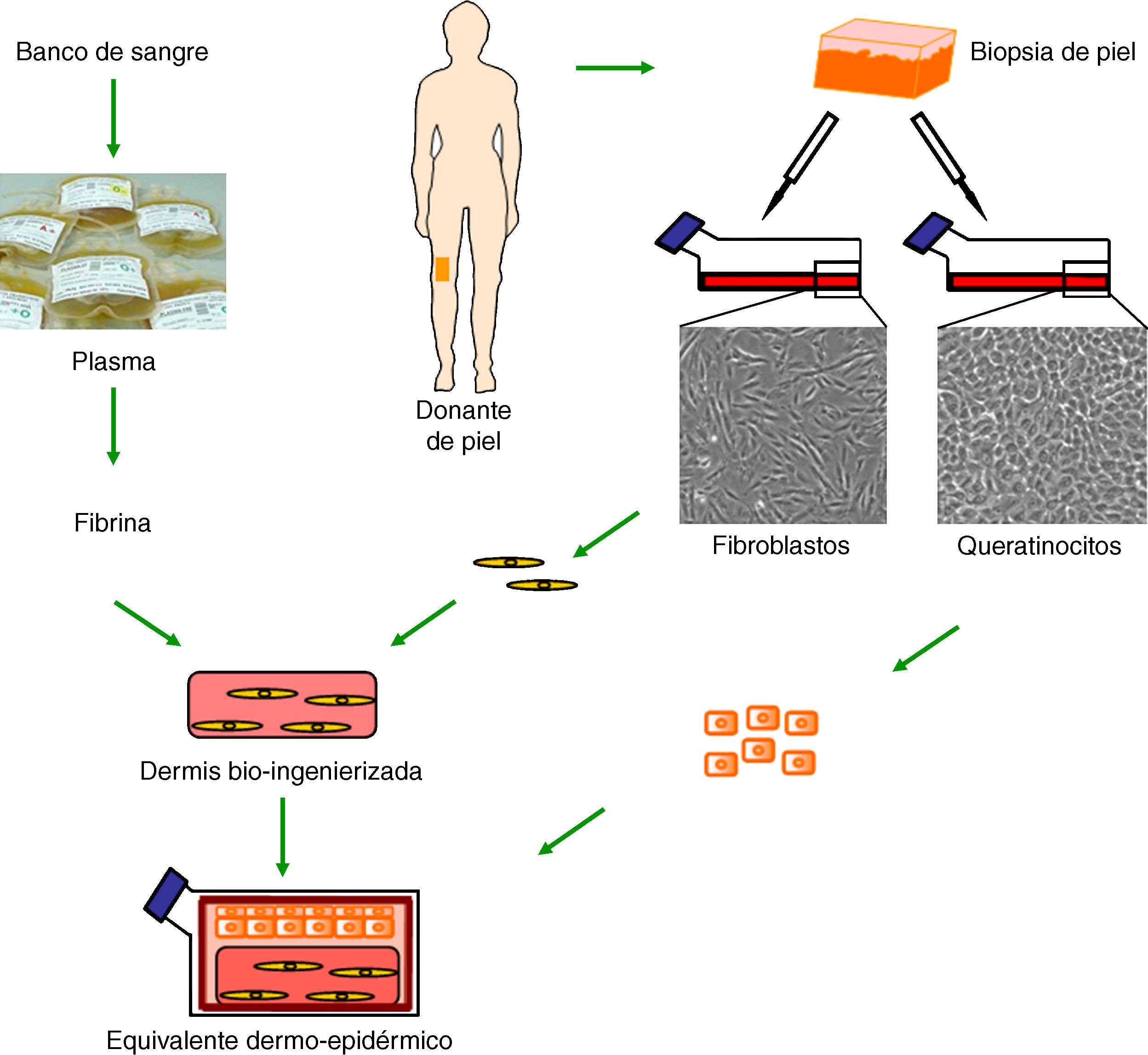
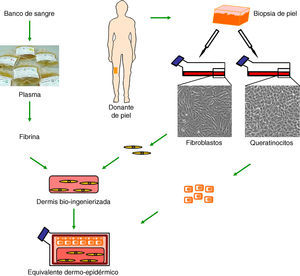
Aunque todavía no se ha conseguido el sustituto cutáneo «perfecto», nuestro equipo ha desarrollado un equivalente dermo-epidérmico que reúne muchas de las características deseadas y que ha demostrado su utilidad en la clínica para la regeneración cutánea13–15. Esta piel bioingenierizada consta de una dermis compuesta por fibroblastos humanos viables sobre la que se siembran los queratinocitos, que constituyen la epidermis (fig. 1). La particularidad de este sustituto reside en el uso de fibrina como molde tridimensional en el que se encuentran embebidos los fibroblastos. Esta matriz de fibrina, rica además en factores de crecimiento y citoquinas, simula in vitro el proceso de cicatrización, en donde tras un daño tisular se deposita una matriz temporal de tipo fibrinoso que dispara el proceso de reparación, permitiendo la migración de células tanto de origen epitelial como mesenquimal. De esta forma, la fibrina no sólo constituye un reservorio de diferentes factores, sino que además proporciona un andamiaje tridimensional adecuado que promueve la migración, proliferación y diferenciación de células del lecho receptor13,16. Asimismo, los fibroblastos dérmicos humanos ensamblados en dicha matriz se comportan como un fuerte inductor de la proliferación de los queratinocitos, siendo posible prescindir del uso de células coadyuvantes de ratón (capa feeder)14. Esto disminuye la superficie de piel inicial necesaria para generar grandes superficies de equivalente cutáneo injertable, siendo posible sembrar densidades muy bajas de queratinocitos. Adicionalmente, la óptima resistencia y estabilidad mecánica que confiere la matriz de fibrina facilitan el transporte de estos sustitutos de piel, así como su manipulación en el quirófano.
Generación de equivalentes dermo-epidérmicos humanos. Tras el establecimiento de cultivos primarios de fibroblastos y queratinocitos, obtenidos a partir de biopsias de piel de donantes, los fibroblastos se disponen tridimensionalmente en una matriz rica en fibrina procedente de plasma sanguíneo, y sobre esta dermis artificial bioingenierizada se siembran los queratinocitos, que constituyen el componente epidérmico.
Todas estas propiedades contrastan con las ofrecidas por otros biomateriales como el colágeno, que se utiliza en diversos equivalentes dérmicos tales como Apligraf®17. En estos casos, la matriz de colágeno, característica de una piel quiescente, es incapaz de inducir señales de regeneración como lo hacen la fibrina o el plasma coagulado, y por lo tanto se necesita sembrar los queratinocitos a densidades cercanas a la confluencia.
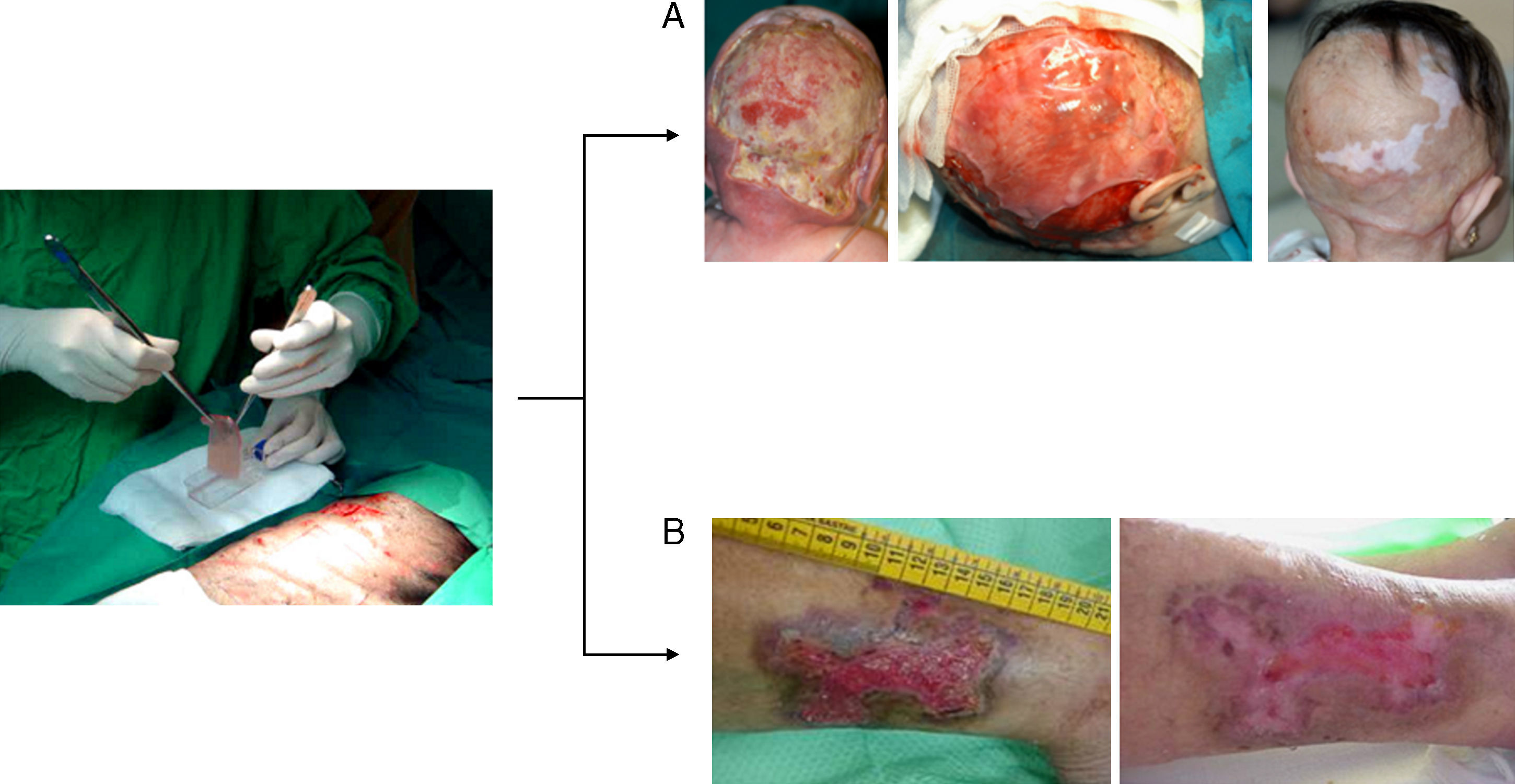
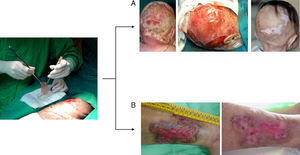
El equivalente cutáneo desarrollado por nuestro equipo ha sido empleado con éxito en la clínica en su versión autóloga para la regeneración tisular permanente en distintas situaciones (grandes quemados, fascitis necrotizante, extirpación de nevus gigantes y enfermedad injerto contra huésped)13,15,18 y en su versión alogénica para el tratamiento de úlceras crónicas19 (fig. 2). Esta última aplicación ha ganado importancia en las últimas décadas debido al aumento de la expectativa de vida de la población en el mundo industrializado, así como al incremento de estados comórbidos, como la diabetes y las enfermedades vasculares. Así, la existencia de un mercado potencial del 2,1% de la población total en los países desarrollados ha desembocado en el diseño de varios productos celulares con potenciales beneficios en la clínica20.
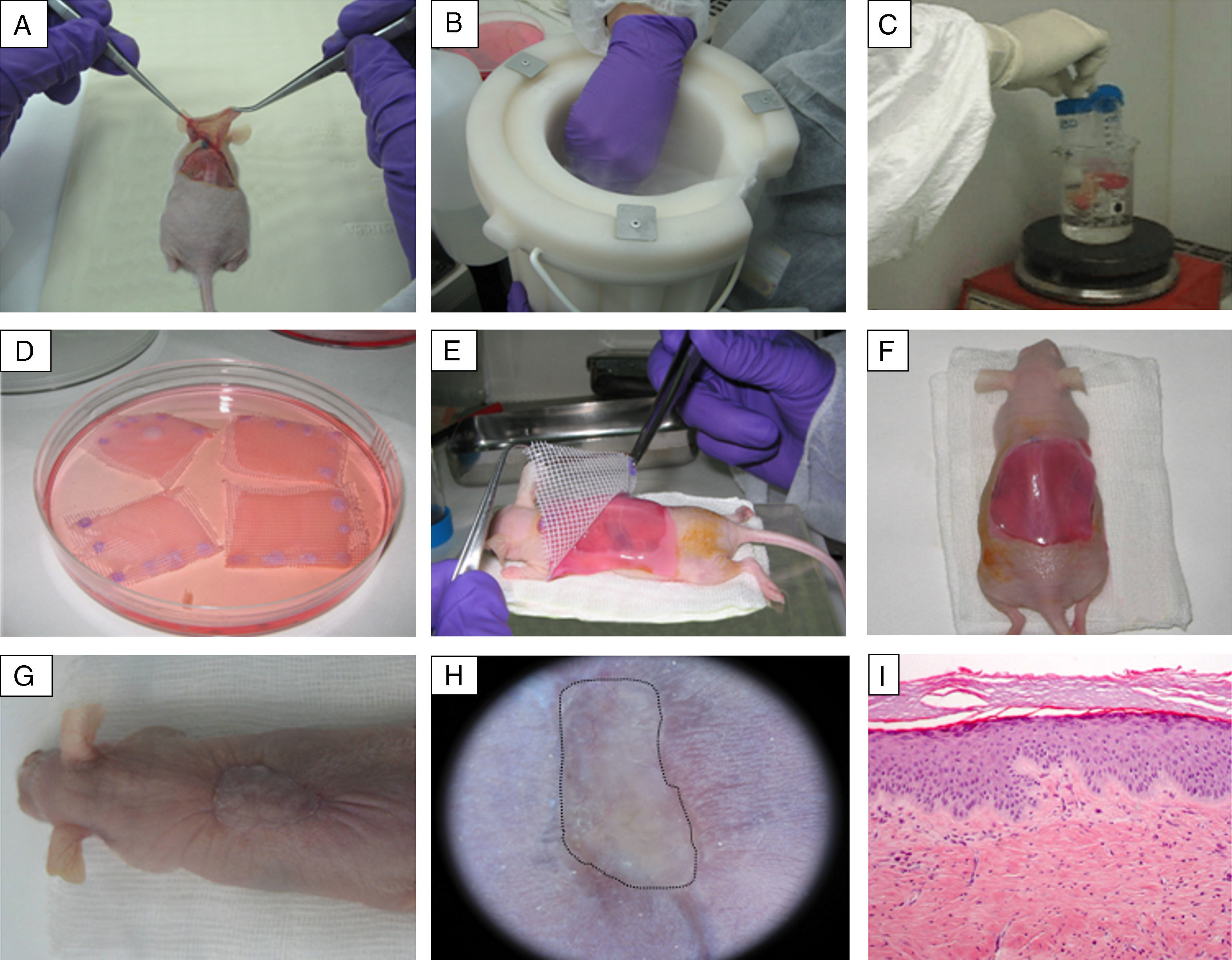
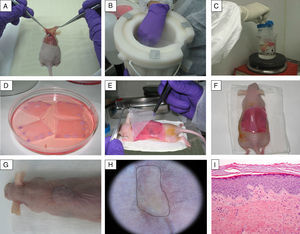
Aplicaciones preclínicas de la bioingeniería cutánea: desarrollo del modelo de ratón humanizado en pielEl modelo de ratón humanizado en piel generado en nuestro laboratorio se basa en el trasplante de equivalentes dermo-epidérmicos generados por ingeniería tisular a partir de fibroblastos y queratinocitos de donantes previamente expandidos in vitro (fig. 3). La piel humana regenerada recapitula las principales características arquitectónicas y funcionales de la piel humana nativa21. Por otro lado, la persistencia del trasplante durante un período mayor que el ciclo de recambio de la epidermis en condiciones fisiológicas (aproximadamente 4 semanas), así como la correcta diferenciación de los estratos epidérmicos, son muestras evidentes de la preservación de CME funcionales in vivo en la piel humana regenerada en el ratón22. Asimismo, la producción de un gran número de animales portadores de un área significativa de piel humana establemente regenerada a partir de una pequeña biopsia obtenida de un único donante, junto con la homogeneidad experimental conseguida, son las principales ventajas que ofrece este modelo23.
Generación de un modelo de ratón humanizado en piel. (A-C) Tras realizar una herida en el lomo del animal previamente anestesiado, la piel del ratón así retirada se desvitaliza mediante ciclos de congelación en nitrógeno líquido/descongelación por inmersión en agua en ebullición. Esta piel desvitalizada se coloca cubriendo el equivalente dermo-epidérmico, constituyendo así un vendaje biológico que protege a dicho equivalente cutáneo durante el proceso de toma y que se desprende de forma natural por sí sola en torno a las 2-3 semanas. (D-H) El equivalente dermo-epidérmico se trasplanta ortotópicamente a la herida generada. (G-I) Tras 14 semanas se muestra el aspecto de los ratones portadores de piel humana regenerada (delimitada por puntos), que se distingue clínica e histológicamente (H&E, 10×) de la piel murina.
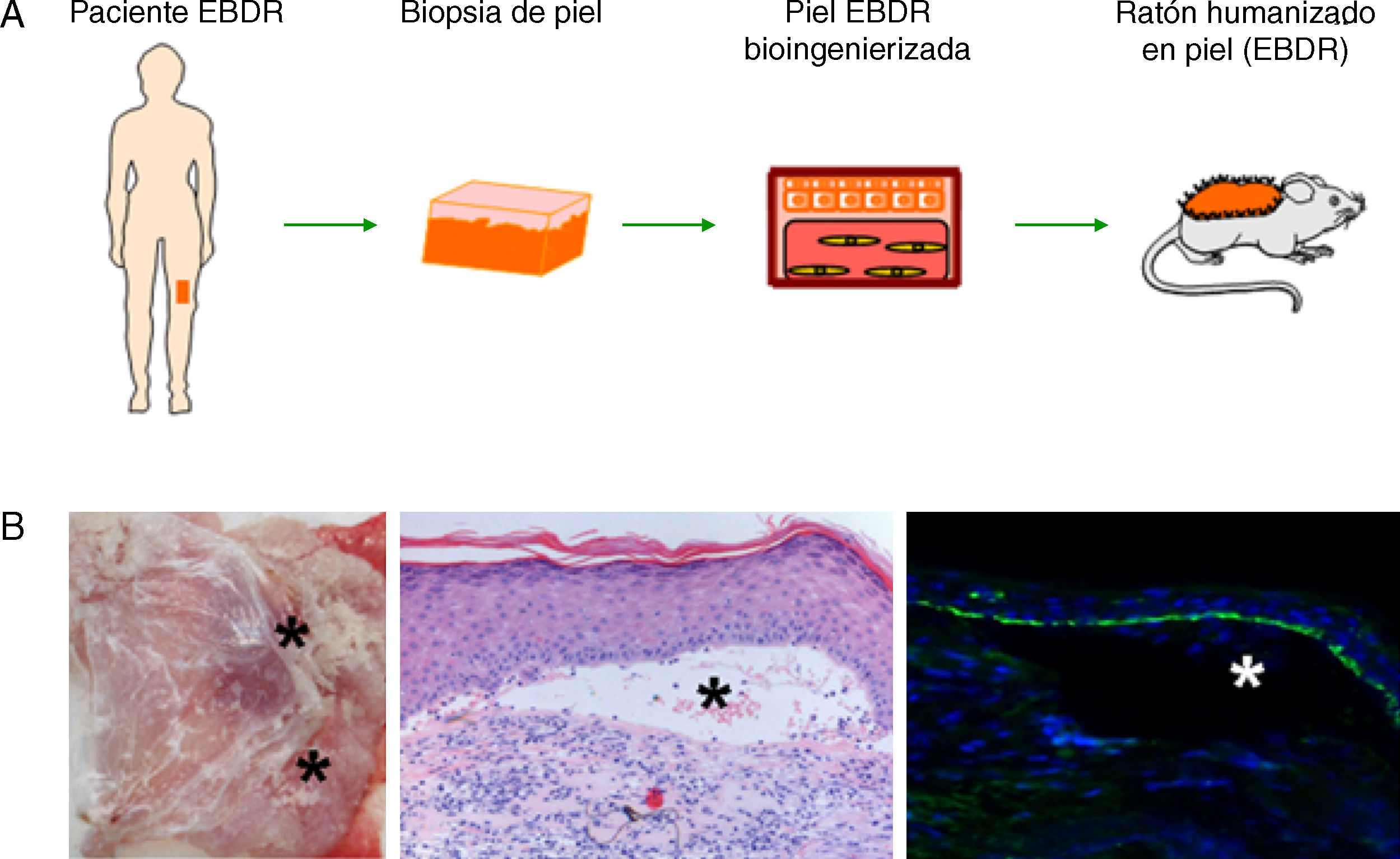
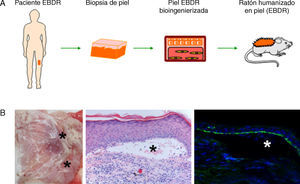
El trasplante de piel bioingenierizada ha dado lugar al desarrollo de diversos modelos humanizados que han permitido el estudio de diversos procesos fisiológicos cutáneos, como por ejemplo la cicatrización. Este sistema in vivo reproduce fielmente la cicatrización humana desde un punto de vista funcional y estructural, como se ha comprobado mediante el análisis de una amplia variedad de parámetros tales como la proliferación celular, la reepitelización, la diferenciación epidérmica, la remodelación dérmica y la reorganización de la membrana basal24. Además, este modelo ha demostrado ser una plataforma preclínica de gran valor para evaluar estrategias de terapia celular y génica en el campo de la dermatología y, en concreto, de la regeneración tisular18,25–27. Por otro lado, este sistema de piel bioingenierizada permite la inclusión de células provenientes de pacientes, de manera que tras el trasplante a ratones inmunodeficientes la piel humana regenerada es capaz de recapitular el fenotipo clínico e histológico del paciente. Esta aproximación de deconstrucción-reconstrucción ha demostrado ser exitosa para la modelización de diversas enfermedades raras monogénicas hereditarias, tanto recesivas como dominantes, con sintomatología y consecuencias generalmente devastadoras y sin tratamiento efectivo (fig. 4). Entre las genodermatosis estudiadas se encuentran enfermedades que presentan fragilidad cutánea como la epidermólisis bullosa28–30, caracterizada por la formación de ampollas cutáneas, espontáneas o inducidas tras un traumatismo mínimo, o patologías cutáneas que desembocan en procesos neoplásicos como el xeroderma pigmentoso, cuyos pacientes presentan mutaciones en enzimas de reparación del ADN31. Por otro lado, se ha abordado el estudio de diversas enfermedades genéticas que presentan afectación en el patrón de proliferación y diferenciación, como la paquioniquia congénita32, o el síndrome de Netherton33, respectivamente. Asimismo, nuestro equipo, en colaboración con diversos grupos europeos, ha conseguido corregir células de pacientes de algunas de estas patologías mediante diversas aproximaciones de terapia génica33–35.
Desarrollo de modelos humanizados de enfermedades cutáneas raras o de baja prevalencia. (A) La piel humana regenerada en ratones inmunodeficientes a partir de células obtenidas de pacientes con epidermólisis bullosa distrófica recesiva (EBDR) recapitula el fenotipo severo de dicha patología (B) como se comprueba clínica e histológicamente por la presencia de ampollas (H&E, 20×) (que se señalan con asteriscos) y la localización de colágeno VII en el techo de las mismas (colágeno VII, 20×).
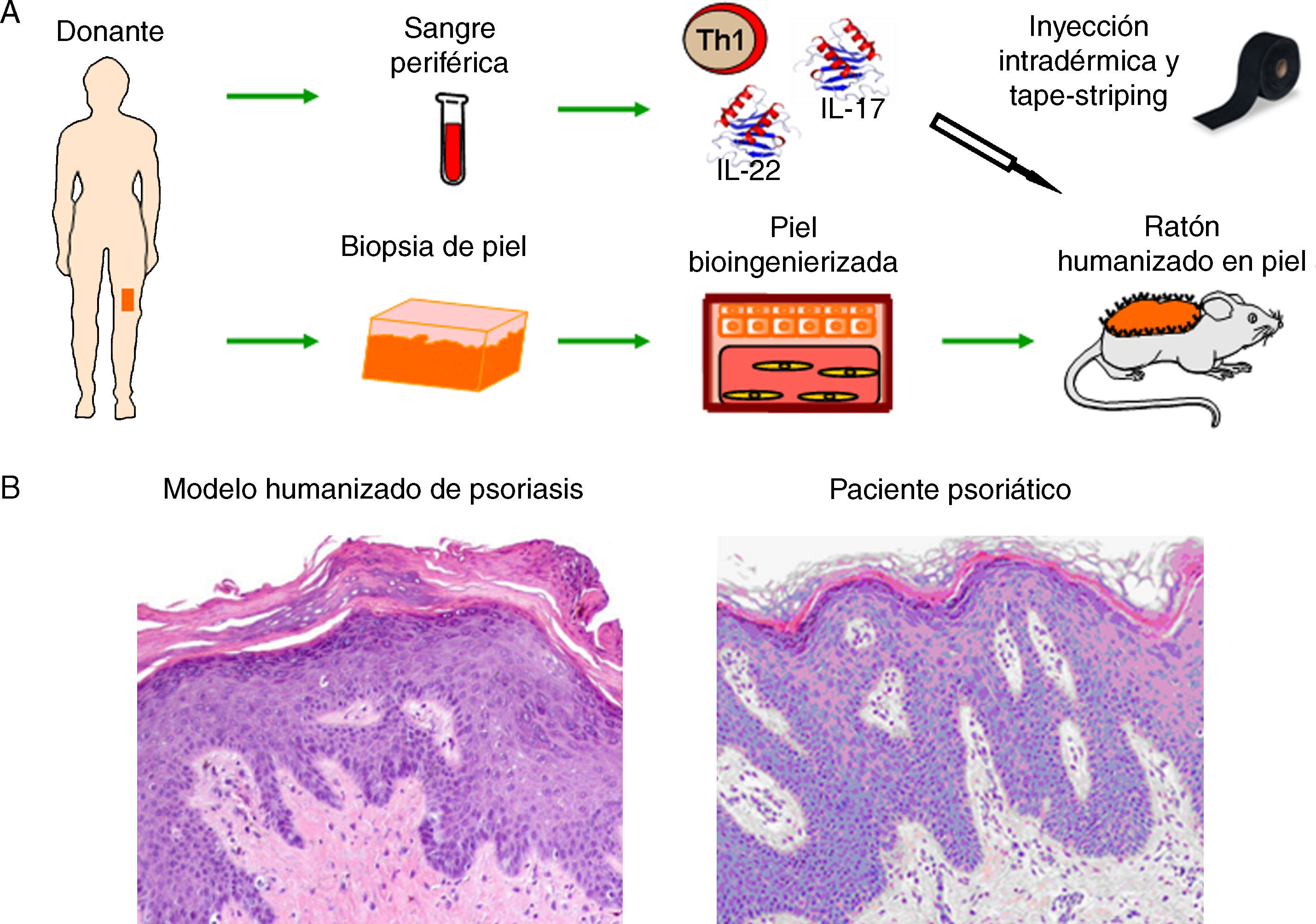
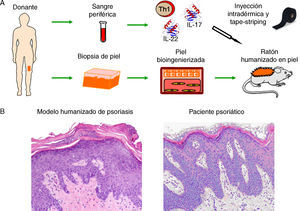
Recientemente, nuestro grupo ha conseguido modelizar también una enfermedad de alta prevalencia como la psoriasis36. En este nuevo modelo humanizado, la incorporación del componente inmune al sistema ha sido clave para la recreación del fenotipo clásico de placa psoriásica (fig. 5). Este modelo nos permitirá continuar esclareciendo el papel de la epidermis y del sistema inmune en esta patología cutánea tan compleja.
Modelización de enfermedades cutáneas de alta prevalencia. (A) Modelo humanizado de psoriasis basado en la inyección intradérmica, en la piel humana regenerada, de subpoblaciones de células T diferenciadas a un fenotipo T1 junto con la inyección de citoquinas de tipo Th17, (IL-17 e IL-22) seguido de la eliminación/perturbación mecánica del estrato córneo mediante tape-striping. (B) El modelo recapitula las principales características fenotípicas de la enfermedad tales como elongación y fusión de los puentes interpapilares, paraqueratosis, aumento de la vascularización y capilares dilatados, entre otras (H&E, 20×).
Los sistemas desarrollados a partir de piel obtenida por bioingeniería tisular, como los descritos en el presente artículo, presentan diversas ventajas como son el crecimiento y mantenimiento funcional de los queratinocitos, incluido el compartimento stem, gracias a la utilización de un molde tridimensional de fibrina que preserva la potencialidad y funcionalidad de las CME. Asimismo, dicha matriz asegura la viabilidad de los fibroblastos embebidos, que son capaces de desencadenar señales celulares y favorecer por tanto procesos clave en la regeneración tisular. Esta piel bioingenierizada desarrollada por nuestro grupo no sólo ha permitido el desarrollo de una plataforma preclínica sólida de modelos humanizados que están siendo empleados para valorar estrategias innovadoras tales como la terapia génica y/o celular, sino que además se presenta como una alternativa clínicamente relevante en el campo de la regeneración cutánea aplicable a diversas patologías.
En el futuro cercano pretendemos alcanzar una mayor comprensión de los marcadores moleculares implicados en la regeneración y reparación tisular, así como descifrar los mecanismos que rigen la pluripotencialidad de CME humanas. Este conocimiento nos conducirá a la modelización de enfermedades cutáneas de mayor complejidad que las descritas hasta ahora, así como a la mejora de los productos derivados de la ingeniería tisular, con el fin de desarrollar sustitutos cutáneos en los que sea posible regenerar apéndices epidérmicos tales como folículos pilosos o glándulas sebáceas.
FinanciaciónEste trabajo ha sido financiado por el Ministerio de Ciencia e Innovación (SAF2007-61019 y SAF 2010-16976), por el Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER) y por el Ministerio de Sanidad (Plan de Terapias Avanzadas, TRA 0160).
Conflicto de interesesLos autores declaran que no tener ningún conflicto de intereses.
Queremos agradecer a nuestros técnicos Almudena Holguín, Nuria Illera, María Luisa Retamosa, Blanca Duarte, Isabel de los Santos y Federico Sánchez. A los investigadores Marta Carretero, Natividad Cuadrado, Marta García, María José Escámez y Fernando Larcher por su trabajo y dedicación. A nuestro equipo del Centro Comunitario de Sangre y Tejidos de Asturias, Álvaro Meana, Sara Llames y Eva García, por su inestimable participación. A nuestros dermatólogos (Antonio Torrelo, Ángela Hernández, Raúl de Lucas) y cirujanos (Juan Carlos López, Purificación Holguín, Javier Enríquez de Salamanca, Eva López, Sebastián Mir-Mir y José María Lasso). A las asociaciones de pacientes de epidermólisis bullosa (DEBRA –Spain) y de paquioniquia congénita (International Pachyonychia Congenita Consortium [IPCC]).
Los autores del presente trabajo desean manifestar su agradecimiento a todos los pacientes y sus familias, que tanto nos han enseñado a lo largo de estos últimos años. Ellos son el legítimo motor de nuestro trabajo.