En estas revisiones se pretende abarcar las diversas funciones de la biopsia cutánea, ciertas nociones básicas acerca de la elección del área a biopsiar y de la forma de procesar la muestra, así como las diversas complicaciones de la cirugía dermatológica de una manera breve. Además, se ofrece una guía del método a elegir para la realización de la biopsia en función tanto del diagnóstico de sospecha, como de algunas localizaciones que ofrecen mayores dificultades. Por último se analizan diversos artefactos que pueden dificultar la interpretación de las lesiones ofreciendo pautas para evitarlos en lo posible. Con esta guía básica pretendemos mejorar la rentabilidad de la biopsia y resaltar la importancia de realizar una correcta correlación clínico-histológica.
The aim of these reviews is to describe the reasons for performing skin biopsy, to provide indications for the choice of area to be biopsied and the preparation of the sample, and to summarize the various complications of dermatologic surgery. In addition, we present a guide for selecting the biopsy technique based on the suspected diagnosis and on the area to be biopsied. Finally, the various artifacts that can complicate interpretation of results are described, together with the methods used to prevent their appearance insofar as is possible. The aim of this guide is to improve the diagnostic yield of biopsies and to highlight the importance of a correct clinical-histological correlation.
La piel no sólo es fácilmente accesible al análisis del clínico, sino también a la realización de pequeñas cirugías, cuya correcta realización no es un acto mecánico1. La biopsia ocupa un lugar central en el diagnóstico médico, especialmente en Dermatología, por el fácil acceso al órgano estudiado, y por la valiosa información obtenida de los exámenes histopatológicos1. La biopsia cutánea pone en la mano del dermatopatólogo entrenado herramientas precisas y muchas veces sencillas para diagnosticar y tratar diversas dermatosis, en especial neoplasias. Aunque la mayoría de las biopsias cutáneas son de buena calidad, las que son realizadas de forma inadecuada suponen para el dermatopatólogo un desafío diagnóstico. Por tanto, la realización de una adecuada biopsia cutánea es un proceso diagnóstico complejo, jalonado por algunos pasos que requieren el mayor cuidado, desde la elección de la técnica de biopsia más adecuada, pasando por un adecuado montaje y trabajo con el instrumental, hasta finalizar con el análisis microscópico realizado por un dermatopatólogo competente2.
Al dermatólogo clínico le corresponde la responsabilidad de establecer sus indicaciones, informar correctamente al paciente sobre la intervención, obteniendo su consentimiento, y, finalmente, extirpar una pieza representativa de tejido. A pesar de esto, frecuentemente se reciben biopsias excesivamente pequeñas3, con alteraciones superficiales debidas a la electrocoagulación, con defectos secundarios a un uso inapropiado de las pinzas o artefactadas por haberse secado antes de introducirse en un medio de fijación adecuado.
Además, el dermatólogo clínico muchas veces elige una localización o una técnica quirúrgica inadecuadas o incluso omite la más mínima información clínica, lo que dificulta la realización de un diagnóstico adecuado3,4.
Otro problema importante, frecuentemente infravalorado, es que el clínico a menudo está poco acostumbrado a interpretar los hallazgos histopatológicos, en especial en el contexto de las dermatosis inflamatorias5. La nomenclatura dermatopatológica utilizada y la existencia de patologías conocidas bajo diversos términos hacen que, a veces, no haya un correcto entendimiento entre el dermatólogo clínico y el dermatopatólogo. Es esencial, por tanto, un sólido conocimiento de la Dermopatología que permita aprovechar al máximo las posibilidades que ofrece una biopsia de piel. Así, un estudio que comparaba la consecución de un diagnóstico específico en biopsias de dermatosis inflamatorias realizadas por servicios no dermatológicos respecto a las realizadas por dermatólogos, observó que los datos de la lesión y la elección de la zona a biopsiar son más adecuados cuando las biopsias las realizan dermatólogos (77% de diagnósticos específicos frente a 41%)6.
En Estados Unidos algunos dermatólogos cuentan con médicos o enfermeras para la realización de biopsias, y se ha observado cierta tendencia al envío de biopsias cada vez de menor tamaño y de profundidad no adecuada a la sospecha diagnóstica3. Por ello, para evitar retrasos diagnósticos y terapéuticos, los dermatólogos son los especialistas más adecuados para realizar la biopsia6.
Con estos problemas en mente y aunque no existen unas guías de consenso para la elección del tamaño y método de realización de las biopsias cutáneas7, a continuación se resumen, desde un punto de vista dermatopatológico, los principios y conceptos que consideramos importantes en la realización de una biopsia cutánea. Los puntos a tratar en esta primera parte son:
- 1.
Funciones de la biopsia cutánea: el papel de la información clínica, consideraciones técnicas del procedimiento.
- 2.
La biopsia: procesamiento de la muestra.
- 3.
Complicaciones de la cirugía dermatológica.
- 4.
Elección de la zona a biopsiar.
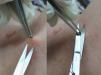
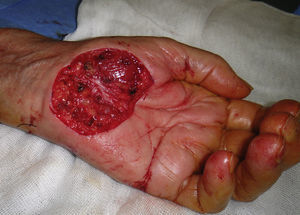
La principal función de una biopsia cutánea es facilitar el correcto diagnóstico de una dermatosis. En el caso de las neoplasias cutáneas, es la mejor técnica de diagnóstico, y en neoplasias malignas, además, puede proveer de datos de importancia pronóstica (Breslow en melanoma) y que modifiquen el abordaje terapéutico, como es la presencia o no de bordes de extirpación libres (fig. 1). En las dermatosis inflamatorias también es una prueba diagnóstica muy útil que permite confirmar o excluir diversos diagnósticos diferenciales clínicos.
Aparte del estudio histológico con tinciones convencionales se pueden emplear otros métodos como la inmunofluorescencia directa (IFD), la microscopia electrónica, las tinciones inmunohistoquímicas (IHQ), el cultivo tisular, la realización de reacción en cadena de la polimerasa (PCR) o de técnicas de hibridación «in situ» marcadas con sondas fluorescentes (FISH)8.
La realización de biopsias cutáneas también responde a cuestiones médico-legales en las que el diagnóstico dermatopatológico apoya la sospecha clínica9, y puede fortalecer la relación entre médico y paciente, restableciendo la confianza de este al documentar correctamente su dermatosis.
Por último, en ocasiones se requieren biopsias cutáneas como control del tratamiento realizado y para documentar científicamente la evolución, respuesta al tratamiento y posibles efectos colaterales del mismo.
Información clínicaParece natural que los dermatólogos clínicos doten al dermatopatólogo de suficiente información clínica, aunque por desgracia no siempre es así. Con la falta de tiempo habitual durante la práctica diaria, frecuentemente se transmite poca información.
En una queratosis seborreica o en los nevus intradérmicos extirpados por motivos cosméticos este problema no es importante. En cambio, en las dermatosis inflamatorias y en el caso de neoplasias infrecuentes la situación es completamente distinta6; el conocimiento de datos como la edad y el género del paciente, la localización de la biopsia, la descripción clínica y la cronología, sintomatología de la lesión y diversos tratamientos locales o sistémicos, previos o concomitantes, es necesario para la realización de un correcto diagnóstico diferencial que permita concretar el diagnóstico más probable mediante una correcta correlación clínico-histopatológica4.
En ciertas situaciones, además, tener acceso al resultado de las biopsias previas es una valiosa ayuda. Esto es especialmente cierto para las recidivas o persistencias de nevus melanocíticos o de otras neoplasias cutáneas extirpadas incompletamente; pero también con cierta frecuencia, en pacientes con exantemas generalizados o eritrodermia existen alteraciones histológicas en biopsias previas (psoriasis vulgar, pitiriasis rubra pilaris, dermatitis seborreica, dermatitis atópica, micosis fungoide, etc.) indispensables para realizar un correcto tratamiento.
Algunas patologías previas del paciente, como en el caso de los trasplantados, deben ser referidas, aunque parezcan irrelevantes, pues se asocian a ciertas dermatosis.
Adjuntar imágenes clínicas puede proporcionar al dermatopatólogo información muy útil, especialmente cuando se envía la muestra histológica a otro centro10.
Consideraciones técnicas (procedimiento de biopsia)Unos conocimientos básicos de Dermatopatología son imprescindibles para la correcta elección de la zona a biopsiar y del método a emplear.
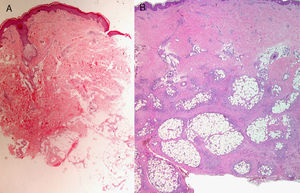
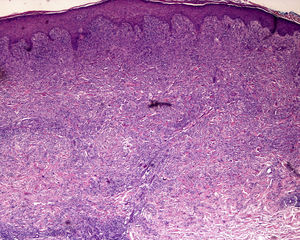
Hay que conocer el nivel al que se encuentra la dermatosis: epidermis, dermis, subcutáneo, etc., así como las características especiales de algunas zonas del tegumento (tabla 1). Esta consideración no resulta banal ya que con frecuencia se reciben biopsias superficiales de la región palmoplantar (en las que únicamente se observa estrato córneo, dado el mayor grosor del mismo en estas regiones), del cuero cabelludo (sin alcanzar tejido subcutáneo por lo que no se puede valorar el bulbo piloso) o de miembros inferiores (alcanzando únicamente dermis en pacientes con sospecha clínica de paniculitis) (fig. 2)3.
Localización de algunas dermatosis frecuentes
| Epidermis y dermis papilar | Nevus melanocítico; lentigo solar; queratosis seborreica; pápulas fibroepiteliales; verruga vulgarCarcinoma basocelular superficial; melanoma in situ; micosis fungoide; queratosis actínica; enfermedad de Paget (mamaria y extramamaria)Dermatitis de contacto (alérgica, irritativa); dermatitis atópica; dermatitis seborreica; psoriasis vulgar; escabiosis; liquen ruber plano; pitiriasis rosada de Gibert; dermatosis vesiculoampollosas |
| Dermis papilar y reticular | Nevus melanocítico; neurofibroma; hemangioma; glomangioma/tumor glómico; nevus sebáceo (hamartomas del folículo sebáceo); quistes folicularesCarcinoma basocelular (sólido, esclerodermiforme); melanoma; carcinomas espinocelularesDermatitis fotoalérgica; dermatitis fototóxica: erupción polimorfa solar; esclerodermia; morfea; nódulos escabióticos; vasculitis leucocitoclástica; lupus eritematoso cutáneo; urticaria; granuloma anular |
| Dermis reticular y subcutánea | Nevus azul; lipoma; dermatofibroma; quiste epidermoide o triquilemalMelanoma; linfoma cutáneo; dermatofibrosarcoma protuberans; metástasis (melanoma, carcinoma de mama, etc.)Paniculitis; sarcoidosis; nódulos reumatoides; vasculitis nodular; panarteritis nudosa; tromboflebitis; granuloma anular subcutáneo |
A) Hematoxilina-eosina, x2. Sospecha clínica: eritema nudoso. Ligeros infiltrados linfocíticos perivasculares. Se observa escaso tejido adiposo que no permite alcanzar un diagnóstico específico. B) Hematoxilina-eosina, x4. Lesión desarrollada de eritema nudoso con paniculitis septal, inflamación granulomatosa y fibroplasia.
Para la realización de la biopsia cutánea se pueden emplear distintos métodos que vamos a comentar ordenadamente:
- 1.
Corte tangencial con tijera.
- 2.
Curetaje mediante el uso de una cuchara quirúrgica o «cureta».
- 3.
Biopsia por afeitado.
- 4.
Biopsia en sacabocados (mediante el uso de bisturí circular o «punch»).
- 5.
Biopsia «en ojal» o elíptica (incisional o excisional, en función de que se extirpe la lesión parcial o totalmente).
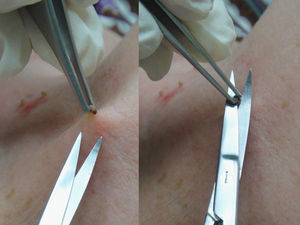
Es un procedimiento óptimo para la extirpación de lesiones superficiales, en especial si son pedunculadas, tales como los fibromas péndulos (pólipo, acrocordón o papiloma fibroepitelial) o las queratosis seborreicas (fig. 3). Con esta técnica raramente es necesario el uso de anestesia local y la profundidad de la herida quirúrgica se limita habitualmente a dermis papilar.
CuretajeEn Dermatología es una técnica que puede ser útil para la extirpación de lesiones superficiales, que afecten únicamente a la epidermis. Entre dichas lesiones se encontrarían queratosis seborreicas, nevus epidérmicos, verrugas vulgares, moluscos contagiosos, queratosis actínicas y epiteliomas basocelulares superficiales. En múltiples lesiones de pequeño tamaño puede servir para realizar un adecuado diagnóstico dermatopatológico, aunque la fragmentación de la pieza o la extirpación incompleta de la lesión en casos de neoplasias puede dar lugar a problemas médico-legales.
Puede realizarse tras crioanestesia (con aerosol de cloroetilo o de nitrógeno líquido) o con anestésicos locales. Se mantiene la lesión entre el índice y el pulgar de la mano contralateral manteniendo suficiente presión como para realizar un corte nivelado. Si se realiza un corte demasiado profundo por debajo de la dermis papilar la herida quirúrgica puede curar dejando cicatriz11. Las bases para su correcta ejecución son mantener estable e inmóvil la lesión junto con la adecuada flexibilidad y movilización de la mano efectora. Ésta debe sujetarse bien como una pluma estilográfica y girarla con los dedos («técnica de la estilográfica») o apretarla contra la palma de la mano con cuatro dedos ejecutando luego un movimiento de las articulaciones metacarpofalángicas. Ejercitar sobre una patata la técnica permite afinar la profundidad del corte12.
Esta técnica está formalmente contraindicada en el caso de sospecha de lesión melanocítica y en lesiones de apariencia neoplásica y diagnóstico clínico incierto.
AplanamientoConsiste en la realización de movimientos finos tangenciales a la superficie de la lesión a extirpar13, ya sea mediante el empleo de una hoja de bisturí (montada o no en un mango de bisturí) o bien mediante el uso de una cureta desechable.
Para evitar la retracción del tejido al introducirlo en formol, que puede dificultar la posterior interpretación, la pieza puede extenderse sobre un pequeño trozo de papel de filtro, antes de fijarla.
Esta técnica está indicada en lesiones superficiales, por ello, se emplea en aquellas habitualmente exofíticas en las que se obtiene un resultado cosmético muy bueno14 sin requerir la realización de sutura.
Esta técnica de biopsia no debe utilizarse en enfermedades inflamatorias y también está formalmente contraindicada en lesiones sospechosas de melanoma.
Biopsia en sacabocadosEl bisturí circular, más conocido como «punch», tiene diámetros variados comprendidos entre 2 y 8mm. El empleo de los de menor diámetro (2mm) debería ser la excepción y reservarse para biopsias diagnósticas de zonas cosméticamente delicadas como la región facial. Suele ser suficiente el empleo de un «punch» de 4mm de diámetro15. El uso de diámetros menores supone un desafío diagnóstico para el dermatopatólogo, por lo que algunos autores proponen el uso de «punch» de al menos 6mm, especialmente en caso de preverse la necesidad de realización de métodos diagnósticos adicionales de microbiología y/o IFD que requieran la división de la muestra8,11.
Habitualmente se realiza tras la inyección de un anestésico local manteniendo el sacabocados perpendicularmente a la piel a biopsiar y empleando dos dedos para pellizcarla en dirección paralela a las líneas de tensión de la misma. El corte se realiza aplicando presión al sacabocados mientras se gira el mismo, con lo que se obtiene un fragmento de piel cilíndrico. La pieza quirúrgica puede entonces extraerse mediante tracción ligera o con ayuda de unas tijeras para separar su base. La herida quirúrgica resultante se puede suturar, aunque en algunos casos, especialmente tras el uso de sacabocados de pequeño diámetro, se puede plantear el cierre de la herida quirúrgica por segunda intención.
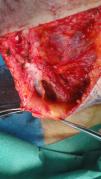
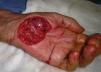
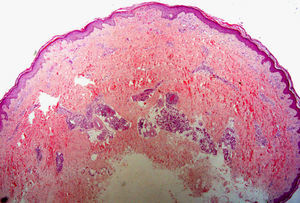
Biopsia «en ojal» o elípticaSu principal indicación es la escisión completa de neoplasias, tanto benignas como malignas. Otras dermatosis en las que esta técnica resulta especialmente útil son las paniculitis, las alopecias cicatriciales y las vasculitis (especialmente aquellas en las que se afectan vasos de mayor tamaño, como la panarteritis nudosa o la tromboflebitis, en las que una biopsia demasiado superficial puede llevar a un diagnóstico erróneo16) (fig. 4). También es de utilidad en algunas dermatosis caracterizadas clínicamente por la presencia de úlceras en las que resulta considerablemente útil tener la posibilidad de comparar piel sana con piel afecta por la dermatosis.
Es recomendable marcar los límites de la biopsia empleando un marcador estéril. Posteriormente se puede realizar la incisión, en perpendicular a la superficie cutánea, tras la inyección de anestésico local en la zona, y se debe alcanzar al menos tejido celular subcutáneo17. La anchura de la extirpación no debe exceder un tercio de su longitud y el ángulo de ambos cortes a los polos del huso no debe sobrepasar los 30°, con el fin de prevenir una excesiva tensión al cerrar la herida. Además, su dirección debe intentar seguir las líneas de tensión de la piel y respetar en lo posible las unidades estéticas18. Aparte de estas consideraciones básicas, para el uso de técnicas quirúrgicas tales como colgajos o injertos remitimos a la literatura especializada.
La biopsia: la muestraLa extracción de la pieza debe realizarse con cuidado mediante pinzas o una aguja hipodérmica para evitar dañarla. Su fijación para posterior tinción con hematoxilina-eosina se realizará en formol al 10% (que se corresponde con formaldehído al 4% en agua) y requiere habitualmente de 24 horas, si bien este tiempo puede variar en función del grosor del tejido.
Si es posible se emplearán recipientes transparentes, ya que así, además de servir de medio de transporte, se podrá controlar el contenido del mismo.
La relación entre el formol empleado y el volumen de la muestra es idealmente de 20:1, y como mínimo de 5:11. Por ello, para mantener las adecuadas proporciones es necesario que en cada hospital o consulta existan recipientes de tamaños variados. Además, con la finalidad de evitar confusiones debe emplearse un recipiente por cada biopsia y este debe estar correctamente rotulado.
En las biopsias de extirpación de tumores siempre se examina si son completas y si alcanzan bordes. Para ello es útil marcar una cara de la preparación, procedimiento que normalmente se realiza utilizando un punto de hilo localizado en el polo craneal. Al hacerlo, ha de procurarse que la hebra ensartada quede floja ya que si aprieta demasiado, al retirar el hilo es frecuente causar artefactos, que dificultan la valoración de esa zona. Una vez retirado el hilo, la pieza es marcada en el laboratorio y después cortada transversalmente en niveles. De esta forma, podremos identificar la localización precisa en caso de persistencia de la lesión.
En el caso de muestras para inmunofluorescencia, se dividirá la pieza en dos partes. Una se procesará como se ha comentado anteriormente, fijándose en formol. La otra porción se introducirá envuelta en gasa humedecida con suero salino fisiológico en un recipiente adecuado. Únicamente es necesario mantener la pieza húmeda, por lo que no se requiere llenar el envase de suero. Cuando el transporte desde el lugar de toma de la muestra al laboratorio en que se va a realizar la inmunofluorescencia dure más de 24 horas, se recomienda enviar las muestras en un recipiente mayor, isotérmico, con hielo seco. Otra alternativa sería el uso de medio de Michel (solución de sulfato amónico, N-etilmaliemida y sulfato de magnesio tamponada con citrato potásico), que permite mantener la muestra en buenas condiciones hasta 10 días19.
Para realizar el diagnóstico por cortes congelados, como sucede cuando se realiza la cirugía micrográfica de Mohs, se utiliza un medio hidrosoluble especial que preserva el tejido. El más comúnmente usado es el medio OCT® (compuesto de glicoles y resinas solubles en agua), en el cual la pieza es embebida, para posteriormente ser congelada y cortada mediante el criostato.
Para estudio de microscopia electrónica se ha de fijar la muestra en solución de Karnovsky al 0,5% (glutaraldehído al 0,5%, paraformaldehído al 2% en tampón de cacodilato 0,2M a pH 7,3) durante 2 horas con posterior fijación en tetróxido de osmio en la misma solución tampón20. Este tipo de técnica requiere una posterior deshidratación de la muestra que debe ser cortada en secciones muy finas y teñida con sustancias como el acetato de uranil y que puede emplearse, por ejemplo, para el inmunofenotipado de amiloidosis en biopsias de grasa abdominal20.
En la toma de muestras para estudio microbiológico se debe emplear un recipiente estéril y enviar la muestra con una gasa envuelta en solución de suero salino fisiológico, es decir en una solución no bacteriostática. Las muestras para cultivo de virus pueden enviarse en medio líquido de transporte y, en caso de duda, conviene contactar con el Servicio de Microbiología.
El paciente y las complicaciones de la cirugía dermatológicaUn paciente bien informado es un paciente más colaborador. Por ello cada paciente debe ser informado sobre la indicación de la biopsia, la técnica quirúrgica a emplear y los posibles efectos secundarios que conlleva.
En cirugía dermatológica, las complicaciones no suelen suponer un riesgo vital, aunque también pueden producirse reacciones anafilácticas o arritmias, por lo que conviene tener conocimientos básicos de técnicas de reanimación21.
La mayoría de complicaciones se engloban en: hemorragias, infección, así como riesgo de cicatrices poco estéticas y de alteraciones de la pigmentación. Por ello conviene tener en cuenta en la anamnesis la recogida de antecedentes que puedan predisponer a estas alteraciones, tales como malnutrición, edad avanzada, enfermedades metabólicas o genodermatosis, ingesta de determinados fármacos, hábitos tóxicos o procedimientos terapéuticos previos21.
En cuanto al tipo de técnica, la realización de biopsias cutáneas con la técnica del aplanamiento o afeitado creemos que debe ser discutida, especialmente en el caso de neoplasias melanocíticas, considerando las ventajas cosméticas y las posibles desventajas médicas.
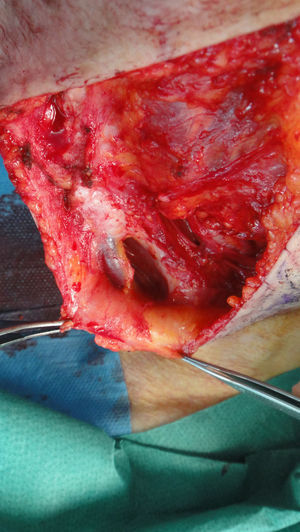
La posibilidad de dañar estructuras anatómicas sensibles como grandes vasos, nervios o cápsulas articulares puede considerarse en algunos casos como una contraindicación relativa14. Hay que ser especialmente cuidadoso en caso de cercanía a grandes vasos, pulsátiles, tanto en tronco como en región cefálica (fig. 5). Además hay que tener en cuenta siempre la presencia de estructuras en profundidad a la zona de biopsia (paquetes vasculonerviosos e, incluso, líquido cerebroespinal) (fig. 6). Por todo ello, es esencial tener un conocimiento anatómico detallado del área a intervenir21.
El uso de alcohol es normalmente suficiente para desinfectar ya que disminuye la flora cutánea en un 75% tras su aplicación durante un minuto. Es efectivo principalmente en gérmenes grampositivos. La povidona yodada, de inicio de efecto más lento que el del alcohol1, tiene un mayor espectro antibacteriano ya que actúa tanto sobre gérmenes grampositivos como sobre algunos gramnegativos. La clorhexidina también es efectiva contra gérmenes grampositivos y gramnegativos. De inicio de efecto rápido y sostenido a lo largo de varias horas, debe evitarse su uso en la zona periocular por tratarse de un producto irritante. No obstante es el más eficaz para la prevención de la infección como antiséptico en el campo quirúrgico22.
Por último, pueden emplearse varios antisépticos en combinación.
AnestesiaSe puede conseguir una adecuada anestesia de la zona mediante la infiltración de anestésicos como lidocaína (a la que se puede añadir adrenalina a concentración 1:100.000 con la finalidad de alargar el efecto local de la lidocaína y disminuir simultáneamente la cuantía del sangrado), mepivacaína o bupivacaína. También puede emplearse anestesia local con el uso de criógenos o bien anestésicos tópicos (mezcla eutéctica de prilocaína y lidocaína, lidocaína al 4%, etc.).
Ninguno de estos productos está exento de riesgos; así, con el uso de EMLA® se han publicado casos de eritema, urticaria de contacto, dermatitis irritativa y, más raramente, de metahemoglobinemia y púrpura23.
Antibioterapia profilácticaLa infección local de la herida se encuentra entre los factores que pueden retrasar la cicatrización. El uso de antibioterapia profiláctica prequirúrgica como profilaxis de endocarditis no está recomendada en pacientes en los que se va a realizar cirugía sobre piel limpia no inflamada en ningún caso22. Sí se recomienda en pacientes de alto riesgo (prótesis valvulares, historia previa de endocarditis, cardiopatía compleja cianótica) cuando se actúa en superficies mucosas, en la zona centrofacial y genital o previamente a la realización de cirugía de Mohs en fresco22.
Dada la flora cutánea habitual se deben cubrir fundamentalmente gérmenes grampositivos (estafilococos y estreptococos). La cefalexima (2g antes y 500mg vía oral a las 6 horas si está indicado) es de primera elección aunque se puede emplear también amoxicilina (2g vía oral) o cloxacilina (2g vía oral). En alérgicos se puede utilizar eritromicina (1g vía oral antes y 500mg después), azitromicina (500mg vía oral), claritromicina (500mg vía oral) o clindamicina (600mg vía oral)22. Conviene emplearlos entre 30 y 60 minutos antes de la intervención22. Para pacientes con implantación de prótesis reciente (período menor de 2 años) o de otros dispositivos la decisión de administrar profilaxis antibiótica debe ser individualizada tomada de manera conjunta (dermatólogo y cirujano correspondiente)22.
Se han encontrado tasas de infección similares en pacientes que empleaban bacitracina o mupirocina tópica que en los que empleaban vaselina24.
En el caso de usar antibioterapia oral, se debería restringir su uso a pacientes en los que se realicen colgajos o injertos en área nasal, cierres a tensión, actuación sobre lesiones ya infectadas21 y en zonas con mayor riesgo de infección o con consecuencias funcionales importantes en caso de darse esta, como la mano22.
Anticoagulación y antiagregaciónEl uso de anticoagulantes orales o la existencia de enfermedades sistémicas que produzcan coagulopatía, trombocitopenia o inmunosupresión deben ser considerados. Igualmente, la presencia de diabetes con angiopatía, edema de miembros inferiores o insuficiencia venosa crónica, especialmente en biopsias de miembros inferiores.
De la reciente revisión de Bassas et al se puede considerar que la warfarina no debería ser suspendida antes de una intervención quirúrgica dermatológica, aunque se debe planificar adecuadamente la técnica quirúrgica, realizar una hemostasia meticulosa y un seguimiento posquirúrgico adecuado25. En pacientes tratados con warfarina y candidatos a cirugías cutáneas serían permisibles INR entre 2,5 y 325,26.
El uso de antiagregantes como el ácido acetil salicílico (AAS) y otros inhibidores de la ciclooxigenasa ha sido menos estudiado, y aunque parece que el uso combinado de clopidogrel y AAS aumenta el riesgo de complicaciones en cirugía de Mohs27, parece que tampoco sería necesario suspenderlos25,28.
Elección de la zona a biopsiarCada enfermedad inflamatoria de la piel tiene diferentes fases que se suceden con una determinada cronología. Por tanto, las biopsias no sólo se realizan en el momento del brote agudo, aunque éstas suelen dar más información, ya que en las lesiones más evolucionadas a menudo se encuentran cambios inespecíficos que no contribuyen al diagnóstico o incluso lo dificultan. El paciente no siempre acude en el momento de aparición de las lesiones y la biopsia a veces debe diferirse6.
Sí hay cosas evitables, como biopsiar lesiones sospechosas de mastocitosis cutánea tras la realización del signo de Darier, ya que en ese caso, los mastocitos degranulados son poco evidentes incluso mediante el empleo de IHQ.
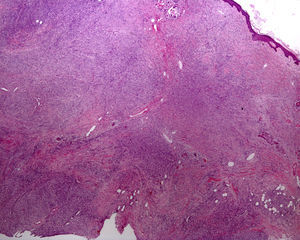
Muchas veces la lesión inicial de una dermatosis ampollosa (penfigoide ampolloso, pénfigo vulgar, dermatitis herpetiforme, etc.) es una lesión urticarial que se manifiesta con la presencia de un patrón de «espongiosis eosinofílica» en la epidermis y en la dermis papilar. Este patrón también puede observarse en otras entidades: eccema alérgico de contacto, eccema numular, exantema medicamentoso, picaduras de artrópodos, escabiosis, urticaria, incontinencia pigmenti o eritema tóxico de Leiner29,30. Es importante saber que tras el tratamiento de dermatitis con corticosteroides tópicos es más difícil la presencia de granulocitos eosinófilos, con lo que el diagnóstico de estas entidades se complica. En las enfermedades ampollosas, el lugar de clivaje de la ampolla es útil para el diagnóstico específico. Cuando se realizan biopsias más tardías, a veces se observan únicamente erosiones y ulceraciones, así como cambios reparativos o secundarios a la colonización bacteriana. En ciertas enfermedades los hallazgos histológicos son variables en función del momento de realización de la biopsia (vasculitis leucocitoclástica, xantogranuloma juvenil [fig. 7] o pitiriasis liquenoide y varioliforme aguda) y pueden ser inespecíficos al inicio de la enfermedad (fig. 8). Por ello puede ser necesaria la realización de varias biopsias para alcanzar un diagnóstico preciso. En las lesiones de morfología anular como el granuloma anular, las dermatomicosis, el eritema crónico migrans, el eritema anular centrífugo, el lupus eritematoso cutáneo, las poroqueratosis y otras, la biopsia debe realizarse en el borde activo de la lesión (fig. 9).
En las eritrodermias, conocidas en la literatura inglesa como dermatitis exfoliativa, alcanzar un diagnóstico etiológico es difícil tanto desde el punto de vista clínico como desde el histológico. La anamnesis debe incluir la ingesta de fármacos y sustancias, así como presencia de dermatosis previas. En la exploración física exhaustiva se debe incluir la palpación de masas, megalias y adenopatías. Aun así, en más de la mitad de los casos se puede alcanzar el diagnóstico realizando varias biopsias, aunque el diagnóstico final suele alcanzarse mediante una combinación de parámetros histopatológicos y clínicos31.
Siempre que sea posible, se deben biopsiar lesiones representativas localizadas en tronco o en región proximal de las extremidades, ya que las biopsias realizadas en la zona distal de miembros inferiores presentan prácticamente siempre infiltrados inflamatorios leves y cambios de dermatitis de estasis sobreimpuestos y, en dicha localización, el cierre de la herida quirúrgica es más lento32.
En el diagnóstico preciso de las lesiones de paniculitis la biopsia cutánea juega un papel esencial. Son necesarias biopsias incisionales profundas para asegurar la presencia de una cantidad suficiente de tejido adiposo. En caso de realizar una biopsia en sacabocados ésta deberá tener un mínimo de 6mm de diámetro. Para su interpretación hay que tener en cuenta la localización o distribución del infiltrado (predominantemente lobular o septal), la celularidad predominante en el mismo y la presencia o no de vasculitis33,34.
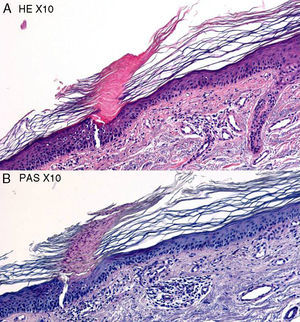
En las alteraciones de la pigmentación, especialmente en las hipopigmentaciones postinflamatorias o en el vitíligo, conviene realizar biopsias «a caballo» entre la zona afectada y la piel sana. Así, los cambios presentes en la piel afecta contrastan con la piel sana presente en el mismo corte. El uso de tinciones especiales como la de Masson-Fontana y de técnicas inmunohistoquímicas (S-100, Melan-A, por ejemplo) permite afinar el diagnóstico. Además, en estos casos siempre debería realizarse una tinción de PAS para descartar infecciones micóticas, principalmente la pitiriasis versicolor, a través de la visualización de su agente causal (fig. 10). Igualmente, en casos de cambios de coloración en pacientes previamente tratados con antifúngicos también es recomendable la realización de una tinción de PAS para facilitar la búsqueda de esporas e hifas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.