Sra. Directora:
Con el incremento de las terapias inmunosupresoras, debido a procedimientos como el trasplante renal o la poliquimioterapia intensiva para el tratamiento de las neoplasias, en los últimos años se ha incrementado notablemente las infecciones oportunistas por hongos1,2. Aspergillus es un hongo filamentoso oportunista ubicuo, que se encuentra con frecuencia en el suelo, en sustancias orgánicas en descomposición e incluso en restos alimentarios2. Suele incrementarse su número en condiciones de movilización de polvo, de manera que es especialmente abundante durante las obras de construcción y mantenimiento, principalmente en hospitales2. Por este motivo, es importante evitar la exposición de los pacientes con inmunosupresión y riesgo de infección a lugares en obras y con humedad. Aspergillus puede producir infecciones graves con afectación primaria o secundaria de la piel3. Presentamos un caso clínico de aspergilosis cutánea con morfología ampollar.
Un paciente de 56 años en seguimiento por mieloma múltiple IgA desde los últimos 4 años, estadio IIIA, es valorado por presentar lesiones cutáneas indoloras nodulares de más de 1cm y una gran ampolla de reciente aparición en el codo izquierdo. El paciente había recibido múltiples tratamientos para su neoplasia incluyendo quimioterapia con bortezomib 1,3mg/m2 cada 4 días 4 ciclos en total, ciclofosfamida 500mg en 3 días espaciados una semana y durante 4 días, y dexametasona 40mg cada 2 días durante 12 días, así como radioterapia y autotrasplante de progenitores hematopoyéticos. En 2015 presentó una nueva recaída, por lo que se decidió intentar un alotrasplante de intensidad reducida (mini-ALO con terapia de acondicionamiento reducida FLUMEL-ATG, consistente en melfalán 70mg/m2, fludarabina 30mg/m2/d, bortezomib 1,3mg/m2 y timoglobulina 2mg/m2) con incremento de la dosis de quimioterapia con melfalán, infundiendo hasta 150mg/m2.
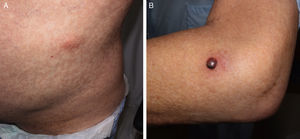
Cuarenta días después del trasplante fue valorado por dermatología al presentar de forma súbita nódulos subcutáneos eritematosos e indoloros en la cara anterior de los muslos, de aproximadamente 3cm de diámetro, en ambas extremidades inferiores, así como en el flanco izquierdo abdominal (fig. 1A). Una de las lesiones, localizada en la cara lateral del codo izquierdo, presentaba una ampolla tensa de 1,5cm de tamaño, de contenido sanguinopurulento, con nivel hidroaéreo (fig. 1B). No refería otra sintomatología en la anamnesis. Coincidiendo con esta clínica había presentado una elevación progresiva del galactomanano sérico hasta llegar a un índice de antigenemia de 0,9, con niveles previos indetectables.
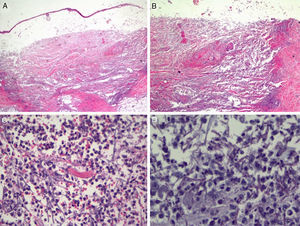
Teniendo en cuenta la clínica y el contexto del paciente se procedió a realizar una biopsia cutánea para estudio histopatológico y microbiológico. El primero, realizado de la lesión en el codo, evidenció una ampolla subepidérmica de contenido purulento y un infiltrado subyacente de abundantes leucocitos polimorfonucleares produciendo gran destrucción tisular, con desvitalización de estructuras, desestructuración de haces colágenos y borramiento de los anejos (fig. 2A). A mayor detalle, con tinción de PAS, se podía observar estructuras lineales septadas y bifurcadas en ángulo agudo a 45° en todo el espesor de la dermis hasta llegar a las porciones más superficiales del tejido celular subcutáneo, de aproximadamente 3μm de diámetro y de hasta 80μm de longitud en algunos cortes, compatibles con hialohifomicosis (fig. 2B). El estudio microbiológico en medio de agar Sabouraud demostró crecimiento de Aspergillus flavus con sensibilidad a voriconazol y equinocandinas, objetivado mediante ETEST® (Biomérieux Lab, Estados Unidos).
Estudio histológico de la pústula por biopsia incisional. A. Gran ampolla subepidérmica con gran destrucción tisular subyacente abarcando la dermis y el tejido celular subcutáneo (tinción de hematoxilina y eosina ×2, magnificación ×20). B. Se observa un infiltrado neutrofílico denso con destrucción del colágeno dérmico y vasculitis asociada (tinción de hematoxilina y eosina ×10, magnificación ×100). C. Detalle en el que se observan neutrófilos infiltrando densamente la dermis y rodeando estructuras filamentosas discretamente perceptibles (tinción de hematoxilina y eosina ×20, magnificación ×200). D. A mayor detalle y con tinción de PAS se visualizan estructuras lineales tabicadas y en ángulo agudo compatible con el diagnóstico clínico y microbiológico de aspergilosis cutánea (tinción de PAS ×40 magnificación ×400).
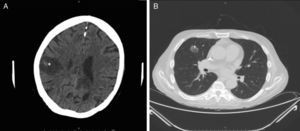
Se procedió a iniciar tratamiento antifúngico intensivo con voriconazol a dosis de 400mg de carga, con mantenimiento posterior de 200mg cada 12horas y anidulafungina (200mg intravenosos de carga, con pauta posterior de 100mg cada 24h). A los 3 días el paciente comenzó con un cuadro de hemiparesia derecha. Se realizó estudio de extensión con tomografía computarizada (TC) de tórax, evidenciándose lesiones cavitadas en el lóbulo pulmonar superior derecho no conocidas previamente (fig. 3A) y una TC cerebral (fig. 3B) donde se observaron 2 lesiones avasculares frontales compatibles con ictus secundario a proceso infeccioso. Se decidió secuenciar el tratamiento a anfotericina B (400mg intravenosos cada 24h ajustado por peso). No obstante, a los 7 días comenzó con un cuadro de disnea grave dependiente de oxígeno, afasia y deterioro del estado general. Una nueva TC craneal mostró múltiples imágenes similares a la previa, pero en todo el parénquima cerebral. El paciente falleció 2 días después de esta nueva presentación clínica. Por voluntad de la familia no se realizó necropsia, no pudiéndose recuperar tejido cerebral para correlación microbiológica.
Estudio radiológico del paciente tras 3 días de evolución de las lesiones. A. Corte de TC craneal en el que se objetiva una lesión avascular en la región parietal derecha parasagital, con puntos hemorrágicos internos e importante efecto masa intracraneal, compatible con cerebritis (*). B. Corte de TC-body a nivel torácico en el que se objetiva un nódulo cavitado en segmento anterior de lóbulo superior derecho, compatible con aspergiloma (+).
Aspergillus sp. es una familia de hongos eumicetos, generalmente presentes en el ambiente y con potencial patogénico oportunista en pacientes inmunosuprimidos2,3, especialmente en aquellos con un recuento bajo de neutrófilos4. Las especies responsables con mayor frecuencia son Aspergillus fumigatus y Aspergillus flavus3. Aspergillus sp. se encuentra de manera ubicua en el suelo y en la vegetación2. Aunque la afectación pulmonar es la más frecuente5, el hígado, el cerebro y la piel pueden verse también comprometidos3, presentándose la última situación en el 5-27% de los pacientes con aspergilosis invasiva3,6. La aspergilosis cutánea puede ser primaria o secundaria2,7. La clave diagnóstica la da la localización y la extensión de las lesiones, siendo generalizada en esta última2,3,7. La aspergilosis cutánea secundaria suele tener como foco primario el pulmonar1, siendo otros focos como los senos paranasales o el tracto respiratorio superior más infrecuentes. Por el contrario, la aspergilosis primaria se suele adquirir mediante la inoculación directa en un foco cutáneo a través de heridas producidas con objetos contaminados, vías endovenosas1 en zonas accesibles para venopunción en extremidades superiores e incluso apósitos en zonas de piel maceradas y para fijar catéteres en pacientes que requieran procedimientos invasivos8.
Clínicamente se suele manifestar como pápulas y máculas eritematosas que evolucionan a nódulos5, con formación posterior de úlceras con necrosis central3,7. Es infrecuente la presentación en forma de ampollas, presentando ocasionalmente contenido purulento, como en el caso aquí expuesto4. El diagnóstico por procedimientos habituales se hace con examinación por KOH o técnicas similares, así como la biopsia cutánea, que debe hacerse incisional y con profundidad suficiente2,7; esta mostrará presencia de hifas septadas de 3-5μm de diámetro y de entre 50-100μm de longitud, en ángulo de 45° sin vesiculación en tinciones de PAS o Gomori e intensa afectación e infiltrado polimorfonuclear de toda la pared, con necrosis angiocéntrica en muchos casos4. Se debe realizar detección de galactomanano sérico si se sospecha infección por Aspergillus9. Su elevación progresiva superando niveles de 0,5 en muestras seriadas, especialmente en pacientes inmunosuprimidos, orienta al diagnóstico de aspergilosis broncopulmonar invasiva o aspergilosis sistémica9. La PCR para Aspergillus es confirmatoria de infección. El tratamiento consiste en la administración de anfotericina B (dosis de 5mg/kg cada 24h), en combinación con equinocandinas (dosis de 50-100mg/día) o voriconazol (dosis de 200mg/12h)10. Es importante desbridar las lesiones que tengan aspecto necrótico e intentar restablecer la inmunidad del paciente cuanto antes2,7.
En resumen, presentamos un caso de aspergilosis cutánea secundaria con presentación en forma de pústula en un paciente inmunosuprimido.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos la colaboración de la Dra. Carmen Moreno de Anatomía Patológica, así como la del Servicio de Radiodiagnóstico del Hospital Ramón y Cajal.