INTRODUCCION
Los champús, jabones y productos de higiene íntima se han considerado causas infrecuentes de dermatitis de contacto alérgica porque son preparados que se eliminan con el aclarado, y su permanencia en la piel es muy breve. Los alérgenos que contienen suelen tener poca capacidad sensibilizante y, en todo caso, suelen tolerarse bien incluso en sujetos sensibilizados, como se ha descrito con las isotiazolinonas (Kathon CG) 1 o el metildibromoglutaronitrilo (Euxyl K400) 2, debido a su baja concentración y su escaso tiempo de contacto. Una excepción a esta regla es la cocamidopropil betaína (CAPB), agente tensoactivo no iónico que ha sido causa relativamente frecuente de dermatitis de contacto alérgicas a champús y otros productos que se eliminan con el aclarado en Europa y Estados Unidos en los últimos 20 años 3,4.
El presente trabajo muestra la experiencia de los autores en la dermatitis de contacto a CAPB, y apoya la teoría de que uno de sus constituyentes, la 3-dimetilaminopropilamina (DMAPA), es su fracción alergénica principal.
PACIENTES Y MÉTODOS
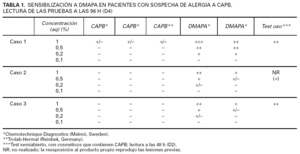
En los últimos 2 años, un total de 228 enfermos fueron incluidos en nuestra base de datos y sometidos a estudio con pruebas epicutáneas. Los criterios de selección de los enfermos fueron: la presencia de una dermatitis cuya presentación clínica fuese sospechosa de una causa alérgica de contacto, o la de aquellos cuadros eczematosos de aspecto clínico dudoso o no concluyente con una localización compatible (dorso de manos, zonas expuestas, párpados, etc.), o una evolución desfavorable. A todos los pacientes se les parcheó la serie estándar del Grupo Español de Investigación en Dermatitis de Contacto (GEIDC), más otras series específicas en función de la sospecha clínica (el proveedor de los alérgenos fue Chemotechnique Diagnostics, Malmö, Sweden). Concretamente, 77 enfermos fueron testados con la batería de cosméticos y conservantes. Todos los enfermos de este grupo fueron estudiados y seguidos por un mismo facultativo, y las lecturas se efectuaron los días 2, 4 y 7 (D2, D4 y D7). La relevancia de las pruebas se estableció mediante la realización de tests de uso semiabierto con los productos propios sospechosos, más el seguimiento oportuno para constatar la mejoría clínica tras la evitación del o de los alérgenos. Aquellos pacientes que mostraron positividad a la CAPB o la DMAPA fueron además retestados con varias muestras de CAPB y DMAPA de distinto origen y en diferentes concentraciones, como se muestra en la tabla 1. Por otro lado, se aplicaron parches con DMAPA y CAPB al 1 % en agua de forma aleatoria a más de 25 pacientes, sin que se observara ninguna reacción. Tampoco se ha tenido constancia de pruebas irritativas a estos alérgenos en ninguno de los demás individuos estudiados con la serie de cosméticos. El índice MOAHLFA (acrónimo de male, occupation, atopy, hand eczema, leg, face, age>40) para la serie estudiada fue, en números enteros, 43-16-12-51-4-11-60. La dermatitis alérgica a cosméticos fue el diagnóstico principal final en 25 de los 228 enfermos (11 %); en 3 enfermos (1,3 % del total) se diagnosticó una sensibilización a DMAPA-CAPB.
Caso 1
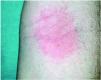
Una mujer de 58 años, ama de casa, consultó por un eczema subagudo recurrente de párpados, de carácter moderado, de 4 años de evolución, que se agravaba esporádicamente, sin relación aparente con ningún desencadenante. Las pruebas epicutáneas con las series estándar, cosméticos, peluquería y propios (cosméticos) revelaron únicamente una reacción positiva fuerte a la DMAPA, que se mantenía hasta las 168 h (D2++, D4++, D7++). No se encontró reacción a la CAPB, ni a la dietanolamina de coco (cocamido-DEA), ni a la oleoamidopropil dimetilamina. La prueba de uso semiabierta con DMAPA 1 % en agua (aq) y el champú habitual de la paciente, que contenía CAPB, dieron lugar a reacciones positivas fuertes a las 48 h. La evitación de todos los cosméticos con CAPB fue curativa. La repetición de las pruebas con distintas concentraciones de DMAPA y CAPB reprodujo fielmente los hallazgos previos (fig. 1). La tabla 1 resume los resultados de estas pruebas. La paciente fue diagnosticada definitivamente de DCA a DMAPA presente en la CAPB comercial.
Fig. 1.--Caso 1. Mujer de 58 años con un eczema subagudo de párpados. Resultado de las pruebas con distintas muestras de cocamidopropil betaína y dimetilaminopropilamina en concentraciones decrecientes, a las 96 horas (D4). Se observa una dudosa reacción a CAPB (A) y reacciones fuertemente positivas a DMAPA (B).
Caso 2
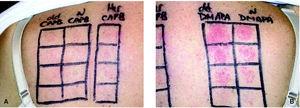
Un varón de 36 años, con un eczema crónico diseminado, de intensidad moderada, de 6 meses de evolución, realizaba trabajo administrativo y no tenía antecedentes de atopia, pero sí de intolerancia a los metales. Las pruebas, realizadas con las series estándar, cosméticos, perfumes, textiles, calzado y propios, demostraron sensibilizaciones muy fuertes a níquel y cromo (D2++; D4+++, D7+++) y débiles a cobalto y DMAPA (D2+, D4+, D7+). El interrogatorio posterior a las pruebas permitió identificar un gel dermoprotector para el aseo diario que contenía CAPB, y cuya evitación permitió la mejoría clínica del enfermo. La reexposición accidental al producto le ocasionó un rebrote de lesiones en las flexuras. La ampliación de las pruebas confirmó la sensibilización a DMAPA y la anergia a CAPB pura (fig. 2, tabla 1). Fue diagnosticado finalmente de eczema alérgico a CAPB-DMAPA (relevancia actual probable), más una sensibilización muy fuerte, de relevancia pasada, a los metales (su relevancia actual no se pudo establecer).
Fig. 2.--Caso 2. Varón de 36 años que padece un eczema diseminado crónico. La segunda lectura de las pruebas (D4) revela una reacción positiva a DMAPA (B), pero no a CAPB (A).
Caso 3
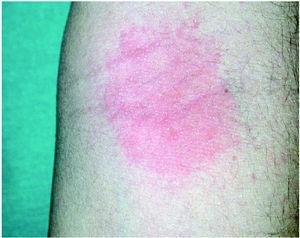
Una mujer de 24 años, peluquera desde hace siete, y con antecedentes de dermatitis atópica infantil y polinosis, padecía una dermatitis crónica recalcitrante de manos, que afectaba más al dorso que a la palma, y que relaciona directamente con su trabajo. La enferma lavaba el pelo a sus clientas numerosas veces al día, a menudo sin guantes, y realizaba trabajo húmedo la mayor parte de su jornada laboral. Las pruebas (estándar, cosméticos, peluquería, panadería y propios) detectaron sensibilización a DMAPA, que se hizo más evidente a las 168 h (D2-, D4+, D7++). Se observaron también reacciones irritantes al persulfato amónico y a la hidroquinona. La CAPB fue, de nuevo, negativa. La paciente trajo a la consulta varios champús que manipulaba habitualmente y todos contenían CAPB. El test de uso semiabierto dio una reacción positiva fuerte a las 48 h (fig. 3). La baja laboral durante 2 semanas mejoró notablemente sus lesiones, pero la recaída tras el alta médica fue inmediata, y le ha sido imposible, mientras trabaja, alcanzar la remisión clínica. La sensibilización a DMAPA se confirmó al repetir las pruebas con DMAPA y CAPB (tabla 1). Su diagnóstico final fue de eczema crónico irritativo de manos de origen profesional en paciente de base atópica, agravado definitivamente por una sensibilización alérgica a CAPB-DMAPA.
Fig. 3.--Caso 3. Test de uso semiabierto con champú que contenía CAPB, a las 48 horas. Reacción vesiculosa (++) en la zona de aplicación.
DISCUSION
Desde su comercialización en la década de 1970, la CAPB ha sido uno de los agentes tensoactivos más vendidos en el mundo. Su éxito se debe a que posee una capacidad irritante mínima que, paradójicamente, se asocia a un gran poder formador de espuma, que no se altera con las variaciones del pH, dado su carácter anfótero. Tiene además propiedades espesantes y antiestáticas, así como cierta actividad antimicrobiana. Se encuentra en champús y acondicionadores de cabello y en todo tipo de detergentes y jabones, incluidos algunos de los llamados jabones sintéticos 5.
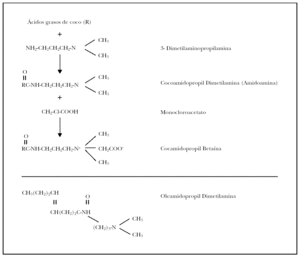
La CAPB se elabora a partir de la reacción química entre los ácidos grasos extraídos del aceite de coco y la DMAPA, que rinde cocamidopropil dimetilamina (cocoamida o amidoamina); ésta se deja reaccionar con monocloroacetato de sodio, para dar lugar a CAPB más cloruro sódico (fig. 4) 5,6. Dependiendo de la calidad de su fabricación, el producto final puede contener cantidades variables de los reactivos e intermediarios implicados en su síntesis. Las impurezas mejor conocidas, además de monocloroacetato, cloruro sódico y glicolatos, son DMAPA en cantidades muy bajas, de 3 a 200 partes por millón (ppm) y amidoamina (del 0,3 al 3,0 % de concentración residual) 5-7.
Fig. 4.--Síntesis de la cocamidopropil betaína. Se muestra la estructura química de esta molécula y la de sus intermediarias. Abajo, estructura de la oleamidopropil dimetilamina, otra sustancia tensoactiva químicamente relacionada y que también se elabora con DMAPA.
El primer caso de dermatitis de contacto alérgica a la CAPB se publicó en 1983 8. A pesar de formar parte de cosméticos que se enjuagan, la CAPB ha sido una causa relativamente frecuente de dermatitis de contacto en nuestro medio en la década de 1990 9-11. Los productos para el cuidado del cabello han sido los causantes de la mayoría de las reacciones, que tienden a afectar al cuero cabelludo, la cara o el cuello de sus usuarios, y a las manos en los profesionales de la peluquería 3,5. La CAPB se parchea al 1 % en agua y a esta concentración es un irritante marginal, por lo que son posibles las reacciones irritativas en las pruebas epicutáneas. Por tanto, es necesario establecer la correlación clínica de una prueba positiva para determinar su relevancia 12.
En los últimos años las alergias a la CAPB parecen ser cada vez menos frecuentes. Esto puede deberse, al menos en parte, a la entrada en el mercado de numerosos agentes tensoactivos no iónicos nuevos (decilglucósido, anfoacetatos, etoxilatos y otros), que ha sido ingente en la última década. Por otro lado, se ha propuesto que la CAPB suministrada por los fabricantes de alérgenos ha perdido capacidad diagnóstica, debido a su gran pureza 13.
La naturaleza del alérgeno en la CAPB ha sido objeto de debate desde hace más de 10 años 9. Diversos investigadores han llevado a cabo diferentes estudios, con resultados en cierto modo contradictorios. En 1995, Angellini et al 10 testaron a 30 pacientes con reacciones alérgicas evidentes a la CAPB 1 % aq convencional (Firma®, Florencia, Italia) con las sustancias utilizadas en su síntesis y con una muestra de CAPB de otro origen, de mayor pureza (Tego Italiana®, Milán). Todos los pacientes reaccionaron a la DMAPA 1 % aq, y ninguno reaccionó a los otros intermediarios, mientras que sólo 16 (53 %) lo hicieron a la CAPB más pura. Los autores dedujeron que la DMAPA podría ser un alérgeno importante en la alergia a la CAPB. De hecho, la DMAPA ya había demostrado ser un sensibilizante potente en el test de maximización de cobayas. En estudios posteriores 14,15, estos investigadores probaron que la CAPB purificada era incapaz de desencadenar reacciones alérgicas, apoyando la hipótesis de que la alergia podría imputarse a las impurezas más que a la molécula tensoactiva en sí misma 14. Además, mezclando DMAPA con otros tensoactivos, fueron capaces de obtener reacciones positivas en las pruebas del parche con DMAPA en sujetos sensibilizados con concentraciones de 10 a 100 veces menores que la habitual (DMAPA al 1 % en agua). Los autores concluyeron que el agente tensoactivo podría crear un efecto «transportador» transepidérmico, que potenciaría mucho la capacidad sensibilizante de la DMAPA, incluso en cantidades mínimas 15.
Pigatto et al 5 seleccionaron a 15 sujetos con pruebas positivas a CAPB 1 % aq, y los parchearon de nuevo con una marca diferente, más pura, de CAPB, y con DMAPA en distintas concentraciones. Todos los pacientes reaccionaron a DMAPA, y ninguno a la CAPB más pura. Al mismo tiempo, el análisis cromatográfico de las muestras de CAPB reveló que la mezcla inicial, con la que este autor había diagnosticado a los pacientes (Firma®, Florencia) contenía 200 ppm de DMAPA, mientras que la nueva muestra de CAPB (Sigma-Aldrich®, Milán) contenía una concentración de DMAPA por debajo del nivel de detección del analizador. Además, detectó DMAPA en los cosméticos sospechosos de sus pacientes, en concentraciones de 50 a 150 ppm, por lo que concluyó que la DMAPA era la responsable de la alergia a CAPB.
Otros trabajos han planteado la hipótesis de que la alergia a la CAPB podría deberse a la amidoamina, y no a la DMAPA. Fowler y et al 7 testaron a 9 pacientes alérgicos a CAPB con los posibles contaminantes: DMAPA (0,1 % pet), amidoamina (0,1 % aq), monocloroacetato (0,1 % aq). Ningún paciente mostró reacción a DMAPA ni a monocloroacetato, pero 6 de los 9 pacientes reaccionaron a la amidoamina. Entonces se estudió de nuevo a los pacientes con una CAPB libre de amidoamina, y ningún paciente mostró una prueba positiva. Estos autores concluyeron que la amidoamina y no la DMAPA es la responsable de la sensibilización a CAPB, y criticaron de Angelini et al 10 que hubieran usado en sus pruebas epicutáneas una concentración de amidoamina muy baja (0,05 %), incapaz de desencadenar una reacción positiva en sujetos sensibilizados. Angelini y Rigano 16 rebatieron esta crítica argumentando que Fowler había usado igualmente concentraciones muy bajas de DMAPA (0,1 %) y además en un vehículo inapropiado (vaselina o petrolato) y que no habían verificado la ausencia de DMAPA como contaminante en sus muestras de amidoamina, por lo que no podían asegurar que la DMAPA no fuera la responsable de las reacciones positivas a amidoamina.
Por otro lado, McFadden et al 17 estudiaron a 7 pacientes con reacciones alérgicas a CAPB. Obtuvieron reacciones positivas a la amidoamina en 3 de 4 sujetos testados, y a la DMAPA en tres de seis. Con esta muestra tan pequeña concluyeron que la amidoamina es un sensibilizante más importante que la DMAPA en la alergia a CAPB.
En un estudio de 2003, de nuevo el grupo de Angelini 13 intentaron aclarar el papel de la amidoamina purificada en la alergia a la CAPB. Para ello sometieron a 10 pacientes con alergia a CAPB (Firma®, Florencia) a pruebas con DMAPA y con amidoamina totalmente depurada en varias concentraciones, y encontraron que todos los enfermos reaccionaron a la DMAPA (1 % aq) y a la amidoamina (0,5 y 0,25 % aq). Las pruebas epicutáneas a la CAPB de mayor pureza (Chemotechnique) fueron negativas en los 10 enfermos. Los autores argumentan que las reacciones alérgicas a CAPB pueden atribuirse tanto a la DMAPA como a la amidoamina, que están presentes en cantidades variables en la CAPB comercial. La reacción simultánea no sería casual, y podría deberse, según explican, a reactividad cruzada entre ambas moléculas, pues de hecho la amidoamina es una sustancia anfifílica que tiene afinidad por la queratina, y en la piel podría experimentar una hidrólisis enzimática de su enlace amida y liberar DMAPA. La estructura química de la amidoamina parece conferirle poca capacidad sensibilizante, como ya han defendido en otros estudios 15. Sin embargo, en la DMAPA destaca la presencia de una amina dimetilada unida a una cadena corta de átomos de carbono (fig. 4), una estructura a menudo encontrada en moléculas con potencial sensibilizante. Según este estudio, la habilidad de la DMAPA para desencadenar reacciones alérgicas se incrementaría notablemente por el efecto transportador de los agentes tensoactivos en los que esta molécula se encuentra normalmente disuelta, incluyendo la amidoamina. Por tanto, es posible que estas impurezas tengan un efecto sinérgico en el desarrollo y posterior perpetuación de la sensibilización alérgica. La prueba del parche con CAPB dejaría de ser útil en el diagnóstico.
Finalmente este grupo ha demostrado además que las sensibilizaciones a otros tensoactivos que se elaboran con DMAPA como intermediaria, como ocurre con la oleamidopropil dimetilamina, también se deben a la presencia de restos de DMAPA o amidoamina en el producto final, que son los responsables de la sensibilización 18,6.
Los pacientes de nuestra serie presentaron pruebas claramente positivas a la DMAPA 0,5 y 1 % aq, mientras que no mostraron reacción a ninguna de las concentraciones de las diferentes muestras de CAPB. La amidoamina no se testó debido a que no pudo obtenerse de los proveedores habituales de alérgenos epicutáneos. También ha supuesto una limitación a este estudio que la DMAPA sólo sea suministrada por un laboratorio (Chemotechnique). En los 3 pacientes la alergia a la CAPB comercial fue confirmada mediante tests de uso o la reexposición al producto sospechoso, y la posibilidad de que las reacciones a la DMAPA fueran irritativas fue descartada por la intensidad creciente y la duración de dichas reacciones, que llegó más allá del séptimo día en los 3 casos; paralelamente, la DMAPA no produjo reacciones irritativas en ninguno de los demás pacientes testados.
Los resultados de esta serie invitan a sospechar de la implicación de la DMAPA, y nos hacen cuestionar la utilidad de la CAPB 1 % aq que actualmente utilizamos en la batería de cosméticos como prueba diagnóstica de la alergia a la CAPB comercial, al menos en el caso de los alérgenos de los laboratorios que hemos utilizado (Chemotechnique y Hermal). Es posible que si no se parchea la DMAPA 1 % aq algunos casos de alergia a la CAPB se estén perdiendo, debido a la pureza del alérgeno que estamos parcheando. La negatividad de los 3 pacientes a la oleaminopropil dimetilamina habla también a favor de la pureza de los alérgenos que elabora el proveedor.
Esta serie ilustra la dificultad de identificar los alérgenos en sustancias complejas de pureza variable. Los autores estamos actualmente testando DMAPA como marcador de la alergia a CAPB, y acabamos de adquirir CAPB al 1 % aq de otro proveedor (Martí Tor, Barcelona), con intención de probarlo en estos 3 pacientes. Si aceptamos que la CAPB carece en sí misma de alergenicidad, deberíamos animar a los fabricantes a que suministren a la industria cosmética productos de máxima pureza, para prevenir la sensibilización a contaminantes residuales como la DMAPA o la amidoamina. Sin embargo, estas sustancias son intermediarias frecuentes en la fabricación de otros muchos constituyentes de cosméticos, y mientras no se impongan límites oficiales de concentraciones máximas permitidas, la exposición de la población a estos sensibilizantes seguirá siendo elevada y los casos de alergia seguirán existiendo.
Correspondencia:
Marcos Hervella.
Unidad de Dermatología. Hospital García Orcoyen.
Santa Soria, 22.
31200 Estella. Navarra. España.
marcoshervella@telefonica.net
Recibido el 30 de agosto de 2005.
Aceptado el 30 de enero de 2006.