INTRODUCCION
La tularemia es una zoonosis bacteriana causada por Francisella tularensis. El nombre del microorganismo fue dado en reconocimiento a los estudios realizados por Edward Francis y a que fue descrita por primera vez en roedores en el condado de Tulare de Utah (EE.UU.)1-4. En 1914, Wherry y Lamb publicaron el primer caso en seres humanos5. Esta bacteria se ha aislado en numerosas especies animales y en aguas o terrenos contaminados, aunque el reservorio más importante y conocido son los lagomorfos (liebres y conejos)1,6-8.
La vía de transmisión al hombre más importante es la cutaneomucosa, por contacto con animales infectados, aunque es posible el contagio por inhalación o ingestión de animales infectados y por picaduras de artrópodos. Estas formas de transmisión determinan distintas formas clínicas: ulceroglandular, glandular, oculoglandular, orofaríngea, intestinal, neumónica y tifoídica. La forma ulceroglandular es la más frecuente de todas, y cursa, en el contexto de un síndrome infeccioso general, con una úlcera cutánea en el punto de inoculación acompañada de adenopatías en los ganglios de drenaje1,6,9-12.
En España era una enfermedad muy poco conocida hasta el año 1997. A finales de este año se inició un brote de tularemia en relación con la manipulación de liebres procedentes de Castilla y León, y en verano del año siguiente apareció otro brote, menos importante, relacionado con el contacto de cangrejos de río en la provincia de Cuenca. A partir de ese momento, la tularemia se ha incluido entre las enfermedades de declaración obligatoria en España y se han establecido medidas especiales de vigilancia, debido a la alta probabilidad de que se haya establecido una enzootia de esta infección y, por lo tanto, de que exista el riesgo de aparición de nuevos casos8,12-16. Hay que recordar, además, que esta bacteria ha adquirido recientemente especial importancia, al estar incluida entre los patógenos de interés en el bioterrorismo. Se considera un arma biológica con posibilidad de ocasionar un gran impacto en la salud pública debido a su fácil diseminación, rápido desarrollo, capacidad para producir alta mortalidad y dificultad diagnóstica por su inespecificidad clínica y por las dificultades en la identificación y cultivo de microorganismos9,17,18.
MATERIAL Y MÉTODOS
Se han revisado retrospectivamente los casos de tularemia acaecidos en España, mediante el estudio de la literatura médica al respecto y la información obtenida del Servicio de Vigilancia Epidemiológica del Centro Nacional de Epidemiología, que recogió los casos notificados por las distintas comunidades autónomas.
RESULTADOS
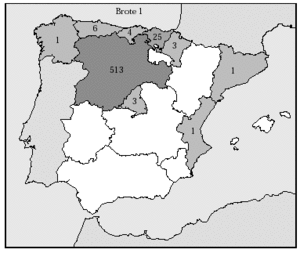
Tan sólo hemos encontrado 2 casos aislados de tularemia en nuestro país que hayan sido publicados, el primero de ellos en 198119,20. Se trataba, por lo tanto, de una enfermedad extremadamente infrecuente y poco conocida8. Sin embargo, desde finales de diciembre de 1997 hasta la actualidad, han aparecido dos brotes de tularemia en España, con 575 casos (tabla 1; fig. 1), a los que hay que añadir la notificación de un nuevo caso aislado en el año 200012,13. En todos los casos, el patógeno causante ha sido la subespecie Francisella tularensis palearctica.
Fig. 1.--Número de casos notificados durante el brote 1 en las distintas comunidades autónomas.
DISCUSION
Agente etiológico
F. tularensis es un cocobacilo gramnegativo que se comporta como un microorganismo aerobio estricto y que no crece en los medios de cultivo ordinarios8,9. Es resistente al frío (no se inactiva por congelación) y puede persistir durante semanas o meses en el barro, agua o cadáveres de animales en descomposición. Sin embargo, sí que es destruido por los desinfectantes habituales y por el calor (30 min a 56 °C)6,8.
Se han descrito diversos biogrupos de F. tularensis, que difieren en su dotación genómica, patogenicidad, características bioquímicas y epidemiología1,7,8. Los más importantes para el hombre son dos: el tipo A (F. tularensis tularensis) y el tipo B (F. tularensis palearctica). El primero es el más virulento y se encuentra fundamentalmente en Norteamérica, aunque recientemente se ha aislado también en Europa21). El tipo B es menos virulento y es el que se aísla en Europa, Asia y, en menor medida, en Norteamérica1,6,8.
Epidemiología
La tularemia está ampliamente distribuida en el hemisferio norte, aunque predomina en Estados Unidos (la media de casos notificados anualmente es de 124)1,2,7, Japón, Rusia, países escandinavos, Balcanes, Turquía y Grecia8. Su reservorio es muy amplio: F. tularensis se ha aislado en más de 100 especies animales, incluyendo mamíferos, aves, peces, anfibios e insectos11. Los más importantes, para la subespecie europea, son los roedores, los lagomorfos (liebres) y ciertos artrópodos, fundamentalmente las garrapatas, que actúan como vectores y como un importante reservorio interepizoótico22-24. La prevalencia de la infección en los animales reservorio depende fundamentalmente de su densidad, que sufre variaciones cíclicas según las condiciones óptimas para su proliferación25. En liebres y pequeños roedores la mortalidad es muy alta, y mueren por lo general a los pocos días de la infección. También es posible encontrar esta bacteria en aguas y terrenos contaminados por animales muertos o por sus excrementos7,8,11.
La vía de transmisión más importante es el contacto directo con un animal infectado; como puerta de entrada actúan generalmente las pequeñas heridas o erosiones originadas al manipular el animal. Otras posibilidades de transmisión son la ingestión de carne mal cocinada o de agua contaminada, la inhalación de partículas (especialmente importante en el empleo de la F. tularensis como arma biológica) y la picadura de insectos, sobre todo de garrapatas2,7,8,26,27.
Debido a estos patrones de transmisión, la tularemia suele presentar una distribución bimodal: los casos derivados del contacto con animales son más frecuentes en otoño e invierno, durante la temporada de caza, mientras que los ocasionados por picaduras de artrópodos son más frecuentes en primavera y verano, que es cuando las garrapatas muestran mayor actividad12,14,26.
Manifestaciones clínicas
El espectro clínico de esta zoonosis comprende desde formas asintomáticas hasta graves cuadros neumónicos o sepsis fatales, así como afectación cutánea y ganglionar, en las que nos detendremos con mayor detalle, y por la posible afectación orofaríngea y digestiva. Las distintas formas clínicas descritas, que suelen aparecer tras un período de incubación de 2 a 10 días, son las siguientes1,2,6,11,13:
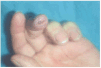
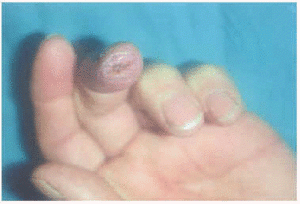
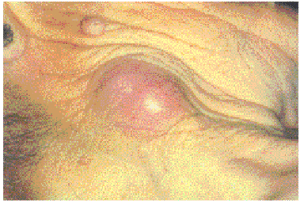
Ulceroglandular (úlcera cutánea con linfadenopatía regional). Es la forma de presentación clínica más frecuente, con una incidencia que oscila según las series entre el 21 y el 87 % de los casos. Se inicia como una o varias lesiones eritematosas, sensibles a la palpación o pruriginosas, localizadas en las zonas de contacto con el animal (por lo general en los dedos de las manos). Estas lesiones evolucionan a lo largo de los días hacia la formación de una úlcera de bordes bien definidos con posterior formación de costra6 (fig. 2). Esta úlcera puede persistir durante varios meses si no se instaura un tratamiento eficaz. Es casi constante la presencia de una o varias adenopatías acompañantes, en los territorios de drenaje de la zona afectada. Suelen ser dolorosas y a veces de gran tamaño (fig. 3), y en su evolución es frecuente la fluctuación con posterior fistulización al exterior, aunque en ocasiones persisten semanas o meses incluso con la instauración precoz del tratamiento4,6,11.
Fig. 2.--Lesión ulcerocostrosa en el pulpejo del tercer dedo de la mano (zona de contacto con una liebre infectada).
Fig. 3.--Gran adenopatía dolorosa laterocervical.
Ante la presencia de esta sintomatología, es necesario realizar el diagnóstico diferencial con otros síndromes linfocutáneos, entre los que destacarían la esporotricosis y otras micosis profundas inoculadas traumáticamente, infecciones por micobacterias, leishmaniasis, carbunco, nódulo de Orf y fiebre por arañazo de gato6,10. Los antecedentes de riesgo, junto a la presencia de fiebre y adenopatías dolorosas en ocasiones muy llamativas, orientará el diagnóstico hacia la tularemia, que deberá confirmarse mediante estudio microbiológico.
Glandular (linfadenopatía regional sin úlcera). Entre el 5 y el 10 % de los casos no se encuentra la puerta de entrada, y se llega al diagnóstico tras el estudio de uno o varios ganglios linfáticos afectados6,11,13.
Oculoglandular (conjuntivitis con linfadenopatía preauricular). Descrita en el 1 % de los casos, por penetración del microorganismo a través de la conjuntiva al frotarse con las manos o vía aerosol. Junto a una adenopatía dolorosa preauricular, submandibular o cervical, casi siempre presente, aparece una conjuntivitis purulenta dolorosa, con edema palpebral y, en ocasiones, úlceras corneales e incluso ceguera6.
Orofaríngea (estomatitis, faringitis o amigdalitis y linfadenopatía cervical). Forma poco frecuente (0-12 %) relacionada con la ingesta de agua o alimentos contaminados. Cursa con odinofagia, faringitis o amigdalitis purulenta y adenopatías regionales11.
Intestinal (cuadro de dolor abdominal, vómitos y diarrea). La inoculación por vía digestiva puede originar úlceras intestinales asociadas con diarrea, dolor abdominal, náuseas, vómitos y hemorragia digestiva, junto a la presencia de adenopatías mesentéricas4,6.
Neumónica (enfermedad pleuropulmonar primaria). Es una forma grave que aparece entre el 7 y el 20 % de los casos y que afecta fundamentalmente a personas con riesgo profesional (ganaderos, personal de laboratorio, etc.)11. También se considera como la forma clínica de tularemia más importante en el bioterrorismo9,18,31. Conviene tener en cuenta que, además de una forma primaria de tularemia neumónica, el resto de formas clínicas de tularemia pueden complicarse con una afectación pulmonar11 (hasta en el 10-15 % de los casos de tularemia ulceroglandular existe una diseminación hematógena pulmonar)6. Los síntomas más frecuentes son la tos y el dolor torácico, aunque también son posibles el derrame pleural, las adenopatías hiliares y los nódulos pulmonares11. En general, debe considerarse una tularemia pulmonar ante la presencia de toda neumonía atípica en un paciente con antecedentes de riesgo7.
Tifoídica (enfermedad febril sin signos o síntomas localizados precozmente). Con una frecuencia que oscila entre el 3 y el 30 %, posiblemente sea la forma de más difícil diagnóstico, ya que aparece como un cuadro general inespecífico que hay que incluir en el diagnóstico diferencial de la fiebre de origen desconocido6,11.
Además de las formas clínicas descritas, hay que destacar la importancia que tiene para el dermatólogo la presencia de otras lesiones cutáneas que pueden aparecer como consecuencia de la infección por la F. tularensis. Según las series, el porcentaje de lesiones cutáneas secundarias a esta infección oscila entre el 8 y el 35 %4,14,28,29. Lo más frecuente es la aparición de un exantema maculopapuloso o vesiculopapuloso que suele ser pruriginoso, más intenso en las áreas próximas a la lesión primaria, y que suele aparecer generalmente en la segunda semana de la enfermedad. También es muy frecuente el desarrollo de un eritema nudoso, sobre todo en la forma pulmonar de tularemia, y es posible la aparición de un eritema multiforme, que característicamente suele afectar más al tronco que a las extremidades. Otras enfermedades cutáneas descritas son las lesiones acneiformes, urticariales, purpúricas, por una vasculitis leucocitoclástica cutánea, y la afectación de la mucosa oral4,6,14, 28-32.
Diagnóstico
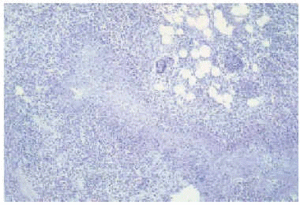
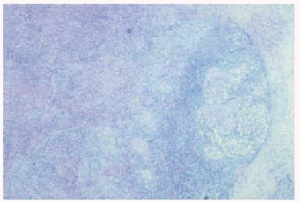
Ante la sospecha clínica y epidemiológica de tularemia, es obligado realizar un estudio microbiológico, ya que no existen alteraciones analíticas típicas y el estudio histopatológico tampoco es concluyente. El hemograma puede ser normal o mostrar una leucocitosis con linfocitosis, y es frecuente el aumento de las enzimas hepáticas14,29,33. En lo que respecta a sus características histológicas existe una relación con el estadio clínico de la lesión cutánea primaria. Las lesiones agudas muestran infiltrado inflamatorio inespecífico, predominantemente neutrofílico, mientras que las lesiones subagudas o crónicas se caracterizan por una respuesta granulomatosa, que va desde la presencia de células epitelioides y células gigantes hasta la formación de granulomas tuberculoides e incluso, en lesiones muy evolucionadas, de granulomas de tipo sarcoideo30,34,35 (fig. 4). Un patrón histológico similar se encuentra también en los ganglios linfáticos afectados34 (fig. 5).
Fig. 4.--Granuloma necrosante en empalizada, con presencia de células gigantes en la periferia.
Fig. 5.--Anatomía patológica de un ganglio linfático afectado, en la que se aprecia una arquitectura distorsionada por la presencia de agregados epitelioides con población linfática periférica que constituyen un patrón granulomatoso.
Para lograr el diagnóstico microbiológico se dispone de varios métodos, de los cuales sólo dos se consideran criterios diagnósticos de confirmación: el aislamiento de F. turalensis en una muestra clínica o la seroconversión en muestras recogidas en la fase aguda y convaleciente de la enfermedad8-40. Las muestras empledas pueden ser exudados, aspirados o biopsias ganglionares, material de lesiones o de úlceras cutáneas, líquido pleural, orina y sangre. Se considera un microorganismo muy contagioso, por lo que la manipulación de las muestras debe realizarse con precaución y siguiendo las normativas establecidas al respecto36.
Tratamiento
La estreptomicina se considera el fármaco de elección para tratar todas las formas clínicas de tularemia, y alcanza unas tasas de curación de hasta el 97 %4,8,14. Las dosis recomendadas oscilan entre 7,5 y 10 mg/kg cada 12 h por vía intramuscular durante 7-14 días11. Como fármacos alternativos se ha empleado la gentamicina, con unas tasas de curación del 86 y el 6 % de recidivas, y las tetraciclinas con tasas mayores de curación (88 %), pero también de recidivas (12 %)8,12. Otros antimicrobianos útiles son el cloranfenicol y la tobramicina con unas tasas de curación del 77 y 50 % y el 2 y 0 % de recidivas, respectivamente12. Más recientemente se han publicado diversos estudios que apoyan el empleo de las quinolonas como fármacos muy eficaces incluso en casos graves de tularemia, recomendándose como alternativa para aquellos pacientes que no requieran terapia parenteral o que presenten intolerancia a otros tratamientos1,10,41-43.
El elevado porcentaje de fracasos terapéuticos que reflejan algunas series parece estar relacionado fundamentalmente con el retraso diagnóstico. Como indicaciones para realizar un nuevo ciclo antibiótico se consideran el mantenimiento o reaparición de la fiebre, el aumento de tamaño o reaparición de adenopatías y la persistencia de la sintomatología con elevación de los reactantes de fase aguda14. En ocasiones puede ser necesario también el drenaje de adenopatías fluctuantes, tomando especiales precauciones para evitar el contagio durante la manipulación del material infectado.
En cuanto al pronóstico, a pesar del grave potencial de esta infección, la mortalidad global es relativamente baja, incluso sin tratamiento (3-7 %), sobre todo en la biovariedad palearctica, que es la existente en Europa. Entre los factores de mal pronóstico cabe destacar la edad elevada, las enfermedades crónicas intercurrentes, el retraso diagnóstico y terapéutico o el tratamiento inadecuado y las formas pulmonar y tifoidea. Una vez pasada la enfermedad suele quedar inmunidad de por vida9,11,12,14.
Prevención
Las medidas de prevención se han establecido fundamentalmente en dos aspectos:
1. Actuación sobre los reservorios. Realización de una estrecha vigilancia epizootológica sobre las poblaciones de animales susceptibles, con estudios de morbimortalidad y seroprevalencia, así como el control y regulación de las poblaciones de roedores y de movimientos de animales.
2. Control sobre los mecanismos de transmisión8,11,13:
a)Evitar la manipulación de animales sospechosos (en caso de que sea necesario emplear guantes y mascarilla).
b)Garantizar la cocción de las carnes para consumo (la congelación no destruye la bacteria).
c)No beber agua sospechosa de vehicular la enfermedad o, si es necesario beberla, clorarla previamente.
d)Eludir las picaduras de artrópodos.
En la actualidad se dispone de una vacuna intradérmica con bacterias atenuadas que confiere una inmunidad duradera. Se consideran candidatas a la vacunación las personas que puedan entrar en contacto con animales infectados, como cazadores, guardabosques y veterinarios, así como el personal de laboratorio que maneje muestras clínicas sospechosas8,11,12. Conviene recordar, por útimo, que la tularemia no se contagia por vía interpersonal, por lo que no son necesarias las medidas de aislamiento, aunque sí se recomiendan ciertas medidas de precaución especialmente en pacientes con heridas abiertas11,12.
CONCLUSIONES
En España han aparecido recientemente dos brotes de tularemia, una enfermedad infecciosa que era prácticamente desconocida en nuestro país. A partir de ahora, y en vista de la evolución de brotes que surgieron en otros países, existe una alta probabilidad de que esta infección se haga endémica, por lo que es necesario estar prevenidos y conocer bien esta enfermedad2,31,36. Habrá que pensar en ella en particular si existen antecedentes epidemiológicos compatibles en cuadros de fiebre prolongada de origen desconocido, faringitis con cultivos negativos y mala respuesta a betalactámicos y neumonías atípicas. Desde el punto de vista dermatológico, la sospecha se establecerá fundamentalmente ante un síndrome linfocutáneo, destacando la presencia de lesiones ulcerosas en la puerta de entrada y la importancia de las adenopatías dolorosas y a veces muy llamativas que acompañan a esta infección.