El avance en el conocimiento de la biología y la terapéutica de las anomalías vasculares (AV) han hecho que sean un motivo frecuente de consulta en las consultas de dermatología en la actualidad, y que se hayan creado unidades multidisciplinares para el abordaje de los pacientes con AV complejas.
Aunque el diagnóstico de la mayoría de las AV es clínico, a menudo su estudio completo requiere pruebas complementarias de imagen para determinar su naturaleza, extensión y pronóstico. La primera prueba de imagen que se solicita por su rapidez e inocuidad es la ecografía (US).
En esta revisión se busca resumir y actualizar los conceptos clave en la ecografía de las AV para su mejor comprensión para los clínicos o especialistas en imagen que tratan a estos pacientes.
Advances in our understanding of the biology and therapy of vascular anomalies have made this condition a common reason for consulting a dermatologist. In addition, multidisciplinary units have been created to manage patients with complex vascular anomalies. Although most vascular anomalies are diagnosed based on clinical findings, a thorough evaluation often requires additional imaging tests to determine the nature, extension, and prognosis of these lesions. Because it is fast and noninvasive, ultrasound is usually the first imaging test ordered. In the present review, we provide a state-of-the-art synthesis of key concepts in the ultrasound examination of vascular anomalies so that they are more accessible to clinicians and medical imaging specialists involved in the management of these lesions.
Desde la publicación en 1999 del grupo de Dubois1 de las características ecográficas de los «tumores vasculares de partes blandas» ha habido numerosos avances en este campo de la dermatología:
- 1)
La adopción definitiva de la clasificación de las anomalías vasculares (AV) que se actualiza anualmente por la International Society for the Study of Vascular Anomalies2.
- 2)
La descripción de las mutaciones en síndromes que acompañan a estas AV3.
- 3)
El uso generalizado del propranolol como tratamiento de primera línea de los hemangiomas4.
- 4)
El avance en el tratamiento mediante láser vascular y otras fuentes de luz5.
- 5)
La creación de unidades multidisciplinares para el tratamiento integrado de estas anomalías6.
La ecografía suele ser la primera prueba diagnóstica que se realiza a los pacientes con AV por su inocuidad, rapidez y disponibilidad en los distintos centros, tanto en atención primaria como en atención especializada7.
Por ello es necesario que los equipos multidisciplinares que tratan a estos pacientes entiendan claramente los conceptos que se utilizan en ecografía de las AV, sus aplicaciones y limitaciones.
Generalidades en la exploración ecográfica de las anomalías vascularesDesde el punto de vista hemodinámico las AV se clasifican en anomalías de alto flujo y anomalías de bajo flujo8,9.
Esta diferenciación es importante desde el punto de vista diagnóstico y terapéutico, ya que el tratamiento mediante fármacos, cirugía, los distintos tipos de láseres, escleroterapia, etc. estará condicionado por las características hemodinámicas de la lesión (tabla 1).
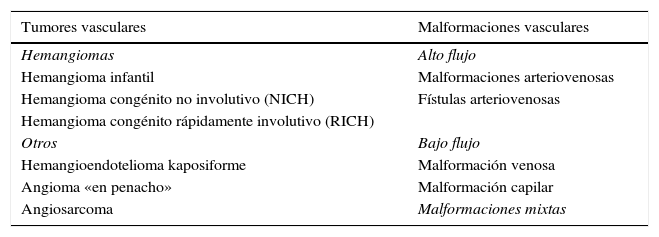
Clasificación de Mulliken Glowacki modificada
| Tumores vasculares | Malformaciones vasculares |
|---|---|
| Hemangiomas | Alto flujo |
| Hemangioma infantil | Malformaciones arteriovenosas |
| Hemangioma congénito no involutivo (NICH) | Fístulas arteriovenosas |
| Hemangioma congénito rápidamente involutivo (RICH) | |
| Otros | Bajo flujo |
| Hemangioendotelioma kaposiforme | Malformación venosa |
| Angioma «en penacho» | Malformación capilar |
| Angiosarcoma | Malformaciones mixtas |
En la caracterización ecográfica de las AV es fundamental tanto la exploración en modo B (escala de grises) como la caracterización en modo doppler.
La exploración en modo B permite identificar el perfil de las lesiones; por ejemplo las lesiones de aspecto ecográfico sólido se suelen corresponder con tumores vasculares, mientras que las malformaciones están constituidas por elementos de aspecto canalicular.
La exploración doppler de las AV debe ser siempre realizada mediante modo doppler color o power doppler, así como en modo doppler pulsado o espectral.
El doppler color aporta información sobre la presencia de flujo sanguíneo. La exploración mediante doppler pulsado nos informa sobre las características hemodinámicas de los vasos que componen la anomalía.
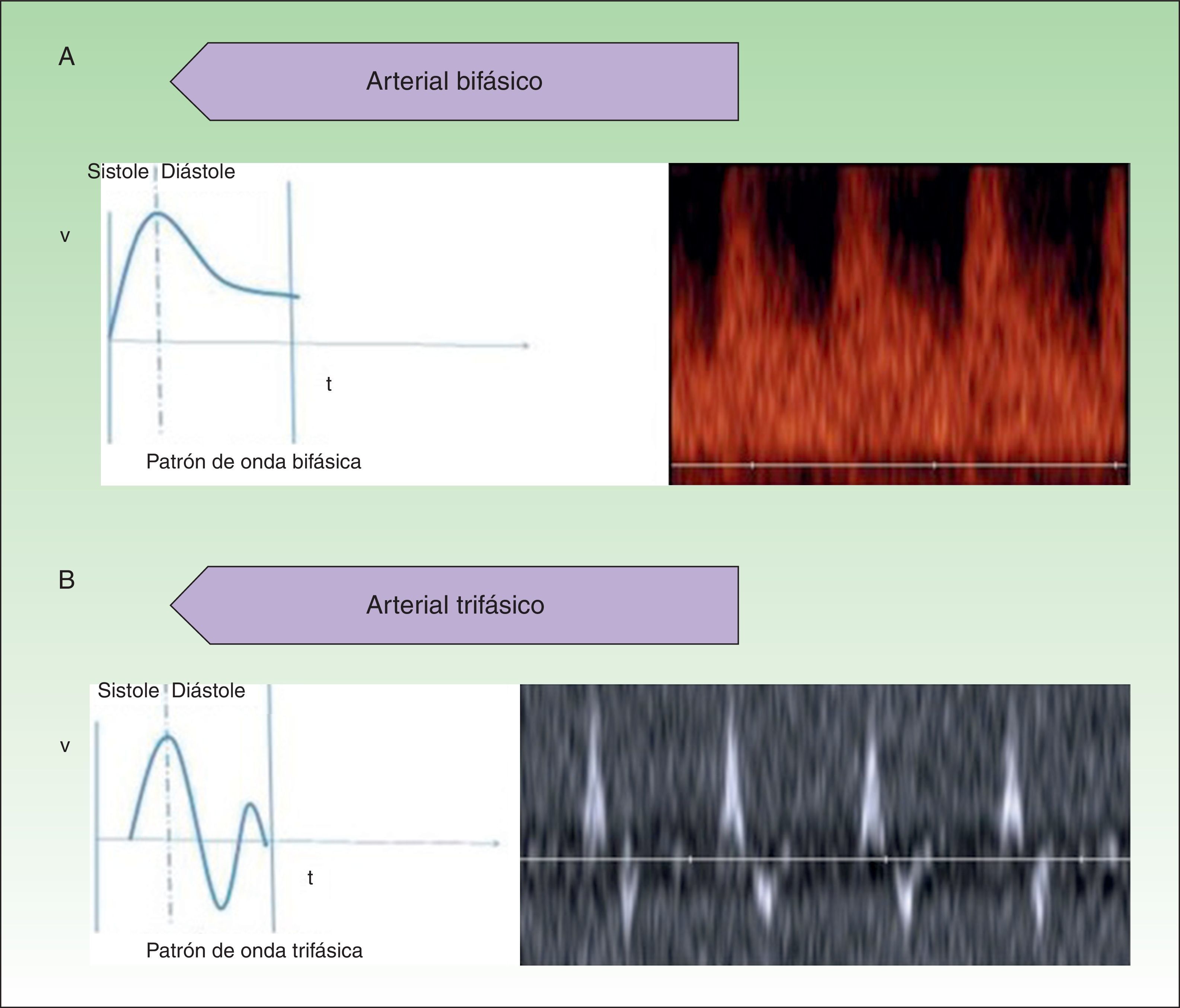
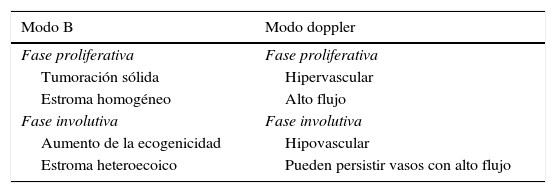
Denominamos AV de alto flujo a las que presentan un espectro doppler arterial, ya sea de alta resistencia o de baja resistencia (fig. 1).
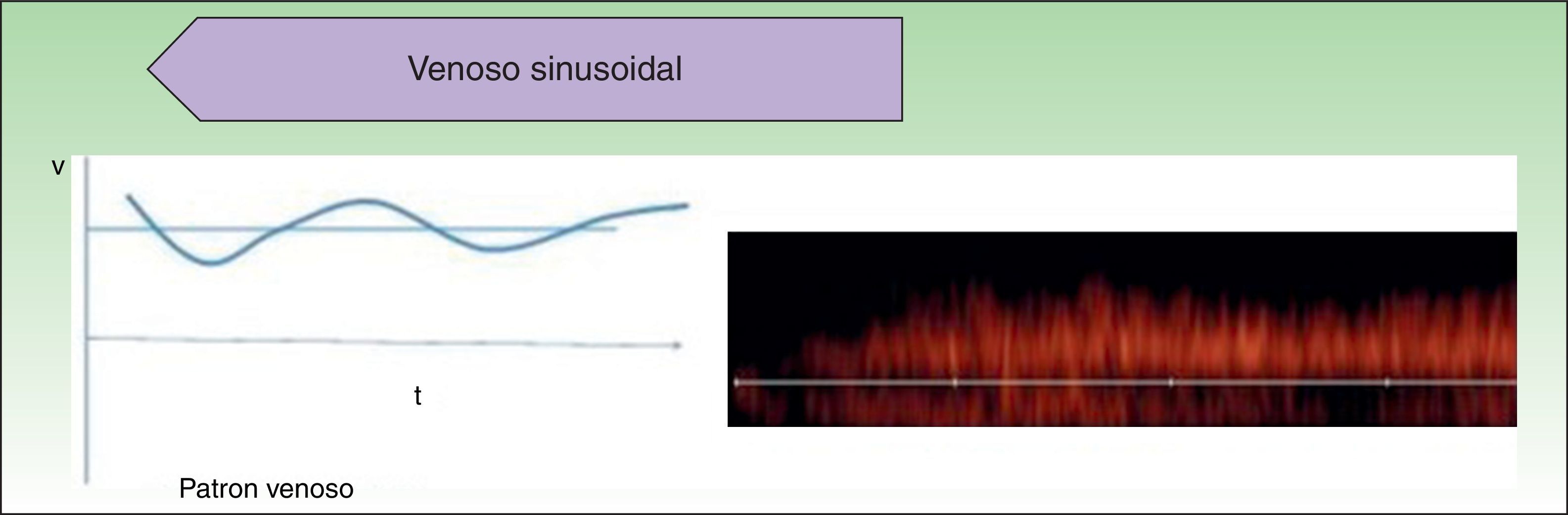
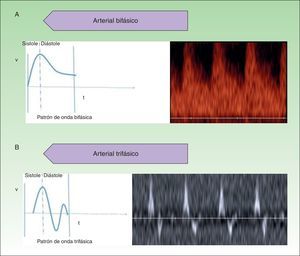
Las AV de bajo flujo corresponden a anomalías en las que encontramos espectros hemodinámicos fásicos (como el que encontramos en los vasos venosos) o ausencia de flujo (fig. 2).
Se debe explorar al menos 3 ciclos hemodinámicos para poder establecer su perfil espectral y determinar la velocidad pico sistólica de las lesiones para caracterizarlas completamente9.
El parámetro hemodinámico más frecuentemente evaluado en las lesiones vasculares es el índice de resistencia (IR), que es el cociente de la diferencia de la velocidad máxima sistólica y la velocidad mínima diastólica entre la velocidad máxima sistólica10. Este parámetro aporta información sobre la resistencia vascular del lecho vascular estudiado.
HemangiomasHemangiomas infantilesLos hemangiomas infantiles (HI) son los tumores vasculares más frecuentes en la edad pediátrica, con una incidencia del 4% al 10% de la población11. Son más frecuentes en niñas de raza blanca y la mayoría son esporádicos. Por lo general no están presentes al nacimiento y evolucionan en 3 fases características: una fase proliferativa que dura los primeros 6 meses de vida, seguida de una fase de estabilización durante el primer año y una fase involutiva que se extiende hasta los 5 a 7 años.
Son lesiones benignas con una evolución favorable y la mayoría no requieren tratamiento. Sin embargo, un 10% de los casos pueden presentar complicaciones como ulceración, alteraciones funcionales o de riesgo vital, como son angiomas que afectan la vía aérea.
Para estos casos el propranolol, un agente bloqueador beta no selectivo, se ha convertido en el tratamiento de primera elección12. Dentro de los mecanismos de acción que se han señalado vasoconstricción, inhibición de la angiogénesis y apoptosis de las células endoteliales13.
Por lo general, el diagnóstico del HI es clínico, pero en ocasiones debido a la localización o la extensión a estructuras vitales se necesita un estudio complementario como son la ecografía (US), tomografía computarizada (TC) o resonancia magnética (RM)14.
Tanto la TC como la RM nos dan información anatómica que incluye la delimitación precisa de los bordes, el tamaño y la cercanía a estructuras adyacentes. Sin embargo, adolece de ciertos inconvenientes como la necesidad de sedación en niños, la necesidad de medios de contraste, que emiten radiación y tienen un alto coste. La TC es un método fidedigno para evaluar estructuras óseas y erosivas. La RM es considerada el método de primera elección en el estudio de hemangiomas faciales segmentarios para descartar el síndrome de PHACES15.
La ecografía es un método no invasivo, que se puede realizar en la consulta ambulatoria, de forma inmediata y que no necesita sedación, aunque algunos autores están incorporando la sedación con hidrato de cloral en su práctica diaria para disminuir artefactos al realizar el estudio doppler16,17. Spierer et al. establecieron el diagnóstico de 20 pacientes con HI periorbitarios sin la necesidad de realizar otro estudio de imagen, señalando la ecografía como el método de elección para evaluar HI en niños18.
Ecografía de los hemangiomas infantilesLa ecografía es actualmente el método de elección en la evaluación del HI, porque nos permite observar el tamaño, grosor, las características internas del angioma y su vascularización, así como estructuras anatómicas adyacentes18.
Los HI presentan diferentes patrones ecográficos (tabla 2) dependiendo de la fase clínica en que se encuentren. En fase proliferativa, en modo B, se observa una tumoración sólida bien definida, hipoecoica, con un estroma homogéneo, lobulado. En el doppler color se caracterizan por ser lesiones hipervasculares, con una densidad de vasos>5 vasos/cm2 con un shift sistólico alto >2kHz y un IR bajo19.
Características ecográficas de los hemangiomas
| Modo B | Modo doppler |
|---|---|
| Fase proliferativa | Fase proliferativa |
| Tumoración sólida | Hipervascular |
| Estroma homogéneo | Alto flujo |
| Fase involutiva | Fase involutiva |
| Aumento de la ecogenicidad | Hipovascular |
| Estroma heteroecoico | Pueden persistir vasos con alto flujo |
En la fase involutiva, sin embargo, el estroma hipervascularizado de la fase proliferativa es reemplazado por tejido fibroadiposo, por lo que cambia su ecogenicidad, siendo en su mayoría hiperecoicos y heterogéneos. En la mayor parte de los casos existe una disminución del flujo doppler color, pero puede persistir un flujo sistólico alto comparado con la piel normal.
El tratamiento con propranolol es eficaz en todas las fases de crecimiento del HI, pero es más eficaz si se instaura durante la fase proliferativa. Bingham et al. reportaron la efectividad de propranolol en 24 pacientes, donde al final del tratamiento observaron ecográficamente una disminución del tamaño del HI en un 70% cuando el tratamiento se daba en fase proliferativa, frente un 30% de disminución cuando se daba en fase involutiva20.
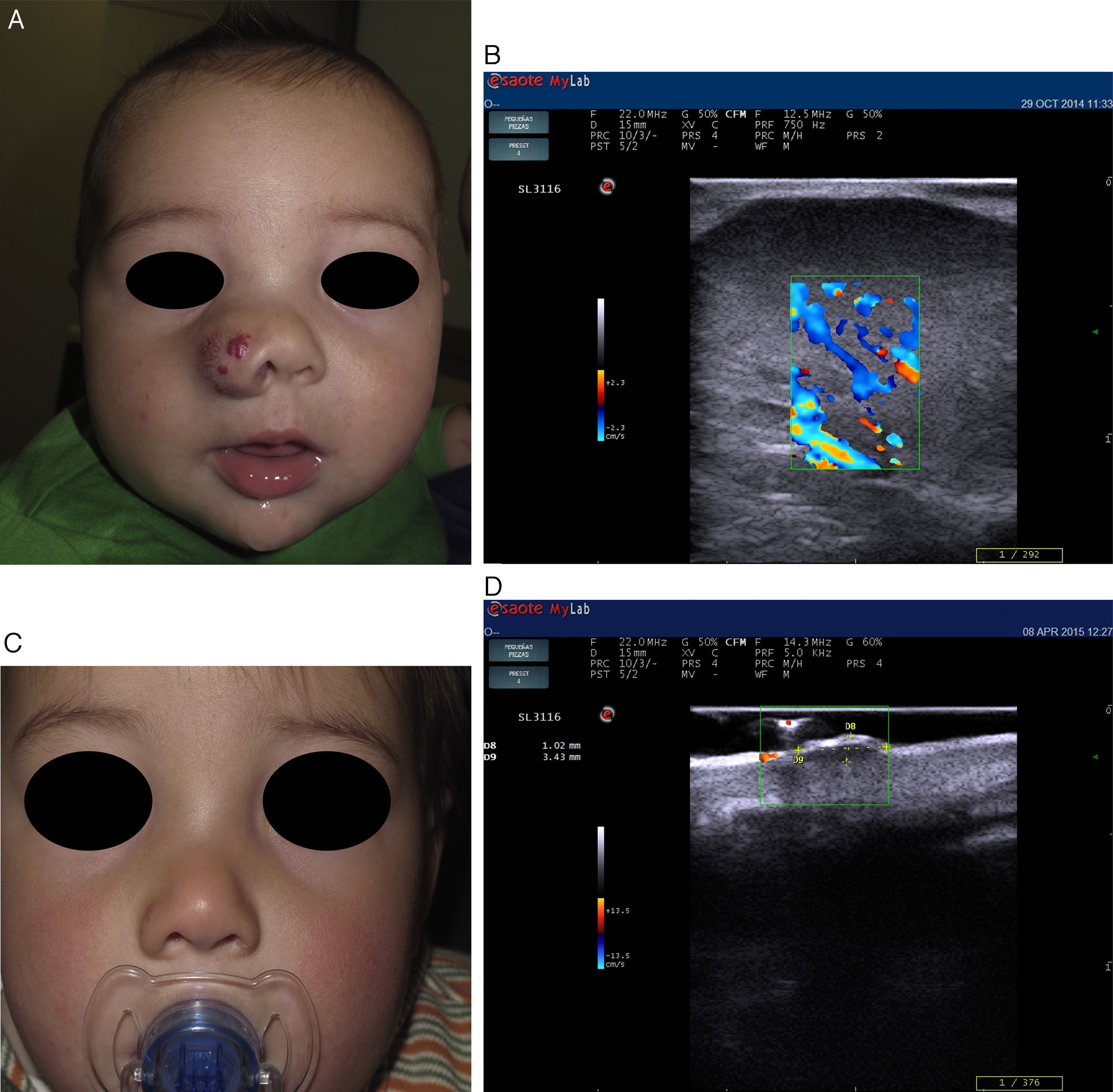
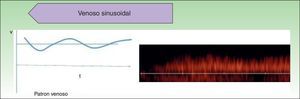
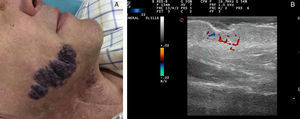
Recientes publicaciones señalan la ecografía cutánea como el método de primera elección para la evaluación objetiva de eficacia del tratamiento con propranolol en los HI complejos21 (fig. 3). Sans et al.19 evaluaron mediante ecografía el grosor máximo del HI y el IR al inicio y a los 60 días de tratamiento, observando una disminución del grosor asociado a un incremento del IR21,22.
Hemangioma infantil en el ala nasal tratado con propranolol (cortesía de la Dra. E. Baselga). A. Clínica de la lesión pretratamiento. B. Eco doppler del hemangioma en fase proliferativa; nótese abundate vascularización. C. Mejoría clínica del hemangioma nasal. D. Disminución de la vascularización y del grosor de la lesión.
Por lo general, la duración mínima del tratamiento con propranolol debe extenderse al menos durante 6 meses para evitar el recrecimiento de la tumoración23,24.
Shi et al.17 evaluaron las características ecográficas de cada fase de los HI para decidir cuándo suspender el tratamiento con propranolol. Las evaluaciones se llevaron a cabo al inicio, a los 3 meses y a los 6 meses de tratamiento. La suspensión del tratamiento se realizaba a los 6 meses si ya no se observaba flujo interno o si era normal. Si todavía se encontraba flujo seguían el tratamiento hasta que no encontraran señales de flujo o al llegar a los 11 meses de tratamiento.
Chang et al. presentan una cohorte más amplia con 679 niños, en los que también se tomó como referencia la disminución de grosor del HI para suspender el tratamiento25. Estos autores suspendían el tratamiento cuando la evaluación doppler color mostraba estabilidad durante 2 meses.
Ecografía de las malformaciones vascularesLas malformaciones vasculares constituyen un grupo de enfermedades poco frecuentes que afectan a un 0,5% de la población. Se producen por errores innatos en el desarrollo embriológico de los vasos sanguíneos.
Malformaciones vasculares de bajo flujoMalformaciones venosasLas MV son lesiones formadas por venas anómalas, que mantienen distintos grados de comunicación con las venas adyacentes.
Clínicamente se presentan como tumoraciones azuladas, blandas y depresibles, de temperatura similar al resto de la piel y que aumentan de tamaño con las maniobras de Valsalva. Pueden aparecer en cualquier localización, siendo las más frecuentes las localizadas en las extremidades, la cabeza y el cuello. Aunque generalmente son asintomáticas, en su evolución pueden sufrir complicaciones como inflamación y episodios de trombosis26.
Las MV típicas son solitarias, pero pueden aparecer en formas cutáneas y viscerales múltiples. La presencia de MV multifocales sugiere trastorno o síndrome hereditario. En pacientes con MV extensas de las extremidades y en el síndrome de Klippel-Trenaunay pueden encontrarse anomalías del sistema venoso profundo en el 47% de los casos. Estos hallazgos obligan a realizar un estudio del sistema venoso profundo antes de realizar un tratamiento27.
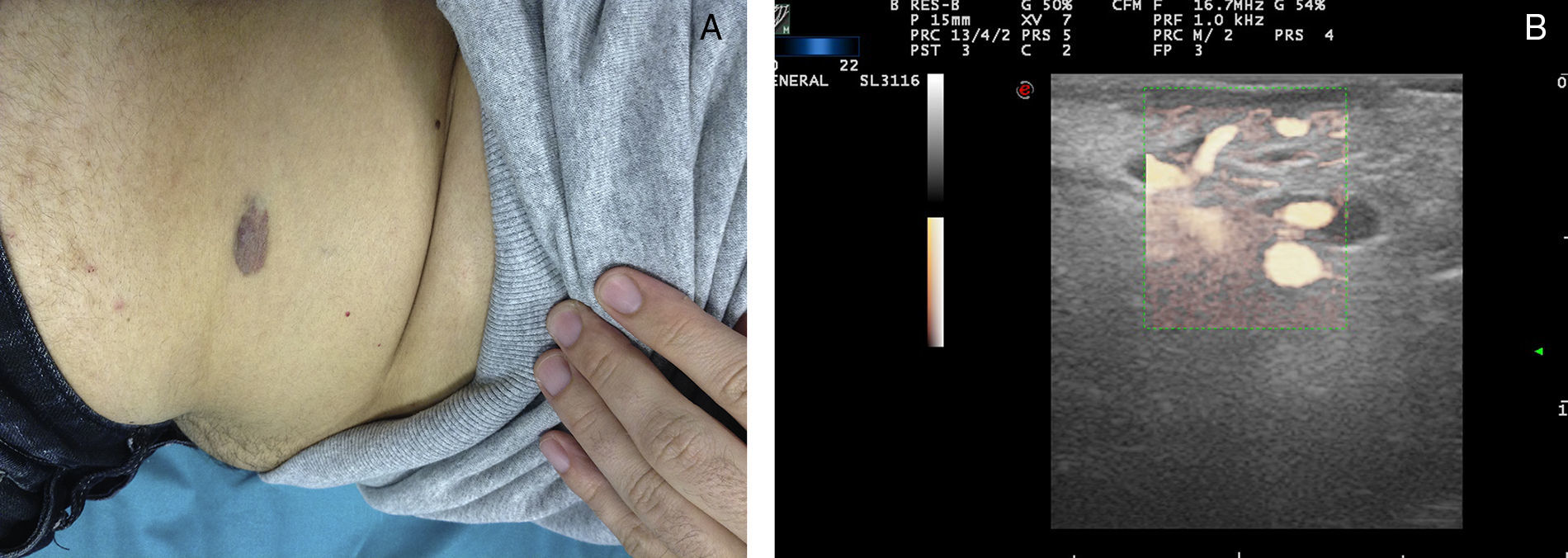
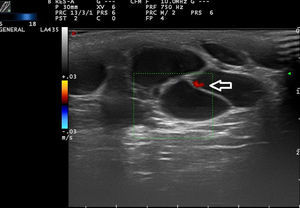
Ecografía de las malformaciones venosasSe presentan como estructuras anecoicas o hipoecoicas en modo B. De forma típica las MV tienen poco estroma fibroso, pero las paredes de las cavidades aisladas oscilan entre septos muy finos o muy gruesos, lo que hace que hasta el 80% de las MV tengan un patrón mixto de cavernas hipoecogénicas y septos hiperecogénicos28 (fig. 4), con presencia ocasional de flebolitos.
En ocasiones, las MV se rellenan de un material trombótico, en estos casos en la ecografía se parece a un tumor de partes blandas con ecogenicidad mixta, lo que lo hace difícil de diferenciar de los hemangiomas y otros tumores de partes blandas29 (tabla 3).
Características ecográficas de las malformaciones venosas
| Modo B | Modo doppler |
|---|---|
| Lesión mal delimitada | Flujo venoso lento (bajas velocidades muchas veces de difícil captación) |
| Múltiples cavidades hipoecoicas o heterogéneas | Espectro venoso monofásico |
| Compresibles | No se encuentran ondas arteriales y/o venosas arteriolizadas |
| Aumenta de tamaño con maniobras de Valsalva | |
| Presencia de flebolitos |
Respecto a la exploración en modo doppler color, las MV presentan flujos bajos y lentos que se hacen más evidentes con maniobras de Valsalva o de compresión-descompresión. Las MV suelen presentar un espectro fásico venoso y no se encuentran en su interior flujos arteriales o venosos arterializados, que son más característicos de las malformaciones arteriovenosas.
Malformaciones vasculares capilares o venularesDenominamos malformaciones capilares (MC) a aquellas en las que los vasos predominantes son las arteriolas o las vénulas poscapilares, es decir, vasos de pequeño grosor y flujo lento.
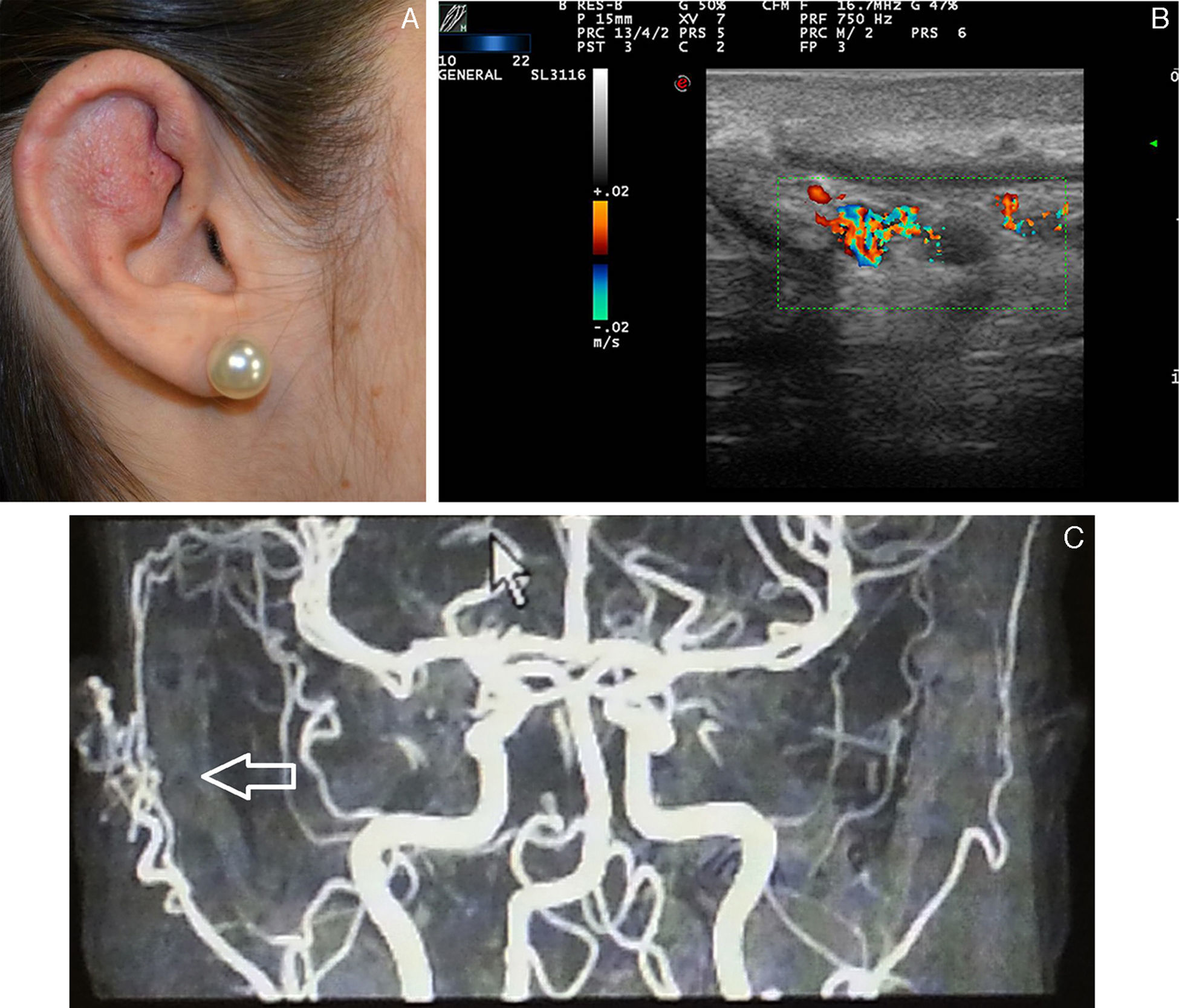
La mancha en vino de Oporto se presenta en el 0,4% de los recién nacidos, sin diferencias entre los sexos. En el 83% de los casos aparece en la cabeza y el cuello, y curiosamente afecta más a la hemifacies derecha que a la izquierda. Estas MC se sobreelevan y oscurecen con la edad, adquiriendo un aspecto en empedrado. Cuando afectan a la segunda rama del nervio trigémino se extienden a la mucosa gingival y maxilar, favoreciendo la separación de los dientes y un aumento del volumen del labio afecto30.
El diagnóstico es clínico, sin embargo cuando la malformación capilar está localizada en la cara se debe realizar una RM para descartar el síndrome de Surge Weber. En un estudio reciente de 289 pacientes con MC en la región facial 15 (5%) fueron diagnosticados de síndrome se Surge Weber. Este riesgo se incrementa aún más si la MC está localizada en la primera rama del trigémino (7-28%)31.
Ecografía de las malformaciones capilaresEcográficamente las malformaciones capilares se presentan en modo B como áreas hipoecoicas dérmicas poco expresivas (fig. 5). Respecto al modo doppler se puede presentar un aumento de flujo doppler en su interior respecto a la dermis adyacente (tabla 4)32.
Troilius et al.32 presentan un estudio en el que se evalúa ecográficamente a 55 pacientes con mancha en vino de Oporto. El objetivo del mismo era evaluar la profundidad de la malformación capilar y correlacionar esta con la respuesta al tratamiento con láser colorante pulsado, que es el tratamiento de elección en estos pacientes.
Dado que la penetración del láser colorante pulsado oscila entre 0,65mm, determinar por lo tanto el grosor de la malformación capilar puede ser un factor predictivo de la respuesta5.
Dentro de los síndromes que asocian malformaciones capilares, son de especial interés los síndromes autosómicos dominantes por mutaciones de la vía RAS/MAPK33. Estos síndromes asocian MC cutáneas multifocales asociadas a malformaciones vasculares y fístulas arteriovenosas en otros territorios34.
Kim et al.31 han descrito recientemente la presencia de un flujo arterial en las MC detectado mediante eco doppler, y se ha planteado la hipótesis de que podría ser una manifestación de una MAV subyacente.
Se han descrito malformaciones linfáticas en individuos con mutaciones de RASA-1. En este caso la ecografía cutánea también podría ser útil en el diagnóstico34,35.
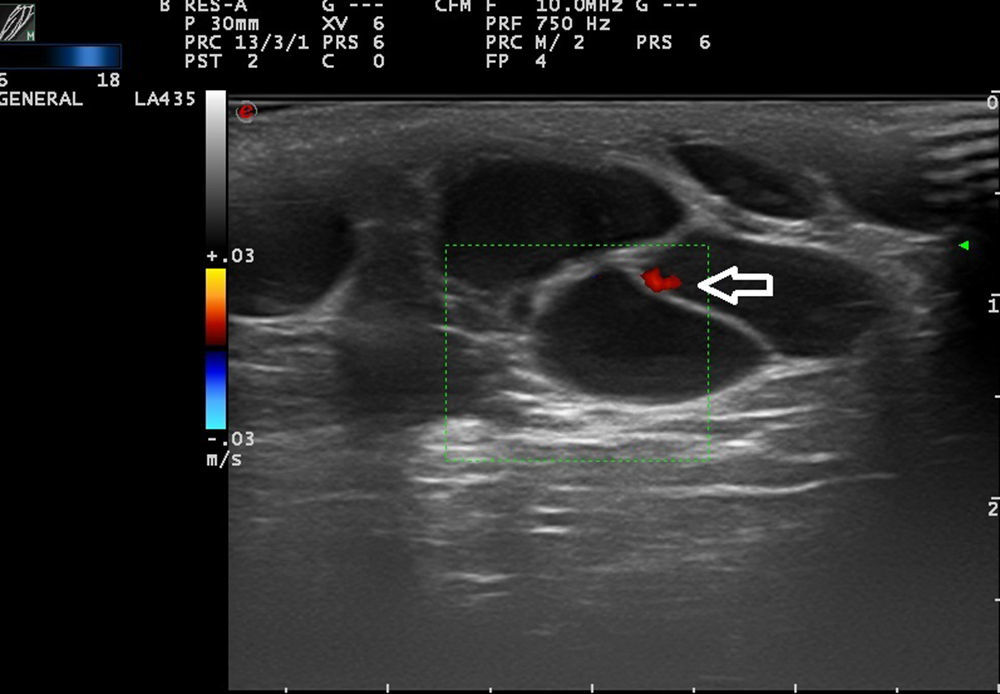
Malformaciones linfáticasLas malformaciones linfáticas (ML) son alteraciones en la embriogénesis de los vasos linfáticos. Se clasifican según el tamaño en microquísticas (menores de 2cm) y macroquísticas (mayores de 2cm) y según su localización en axiales y extraaxiales36.
Ecografía de las malformaciones linfáticasLas ML presentan una morfología muy característica. Están constituidas por cavidades quísticas que comparten tabiques hiperecoicos. En su interior presentan un contenido anecoico, salvo que haya habido un fenómeno hemorrágico intralesional. En este caso podemos encontrar un contenido hiperecoico con señales hiperecoicas en su interior (tabla 5).
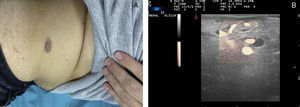
Desde el punto de vista hemodinámico, en general, en las ML no se observa flujo doppler y, de observarse, se localiza en los septos (fig. 6).
El diagnóstico diferencial debe establecerse con otras anomalías vasculares de bajo flujo, que pueden presentar un aspecto ecográfico similar. En estos casos son necesarios otros métodos como la RM para su caracterización anatómica completa y su relación con otras estructuras.
El tratamiento más generalizado para este tipo de malformaciones es la escleroterapia con agentes como las tetraciclinas o el etanol. Estos procedimientos se suelen realizar mediante control ecográfico y fluoroscópico37,38.
Malformaciones vasculares de alto flujo: malformaciones arteriovenosasLas malformaciones arteriovenosas (MAV) en la infancia son raras, en comparación con las lesiones de bajo flujo. Las MAV cutáneas, aunque siempre están presentes desde el nacimiento, es raro que presenten sintomatología de forma congénita o en los primeros años de vida.
Clínicamente se manifiestan como máculas rosadas que simulan una malformación capilar anodina. En este estado suelen ser asintomáticas y permanecen de ese modo hasta la adolescencia, y algunas lesiones perduran así durante toda la vida. Algunas se hacen más prominentes, con vasos más dilatados, presentando vibración y el latido (frémito).
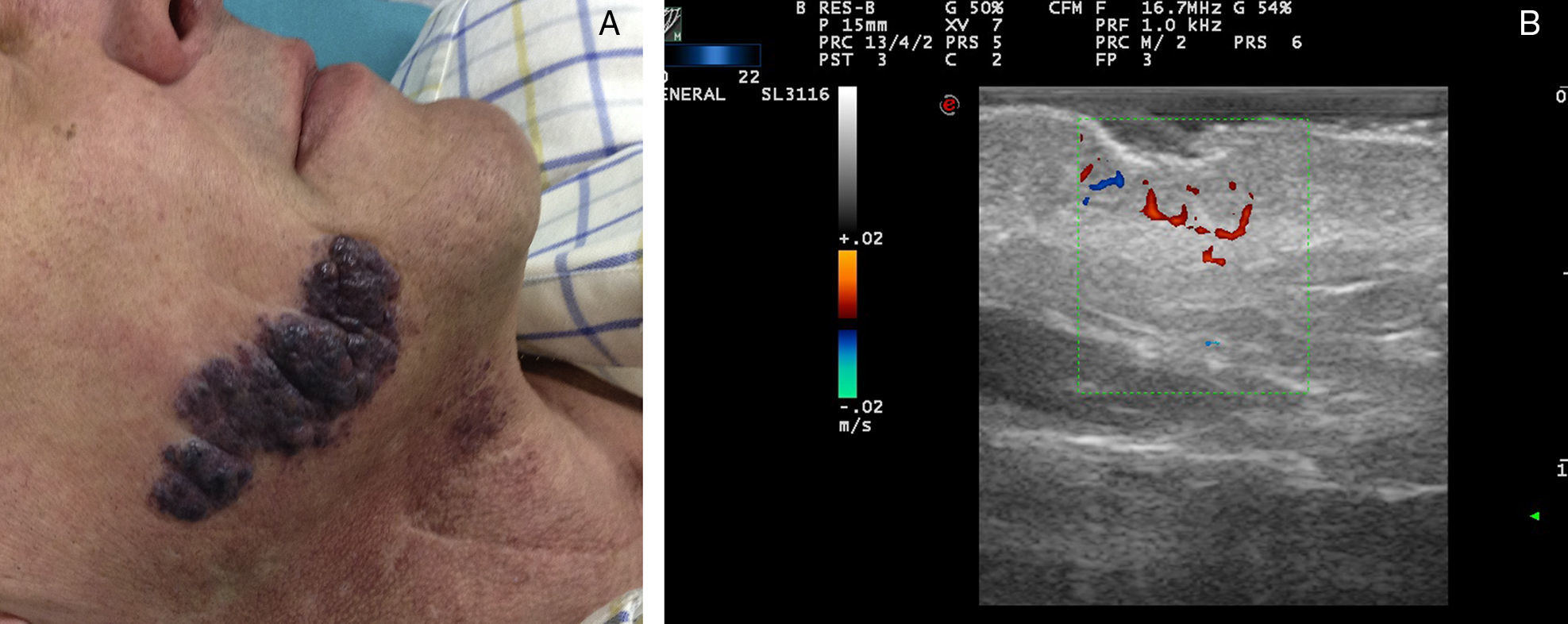
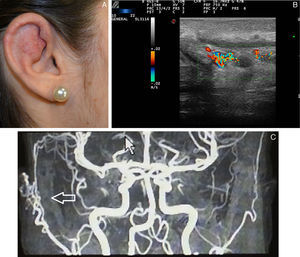
Ecografía de las malformaciones arteriovenosasLa ecografía es el primer método complementario de diagnóstico en este tipo de lesiones38. En modo B nos encontramos vasos tortuosos, dilatados y mal delimitados, que a diferencia de los hemangiomas no presentan aspecto de masa tumoral36 (fig. 7).
En el estudio doppler nos encontramos vasos con alto flujo que no se suelen visualizar en las malformaciones venosas y las linfáticas (tabla 6).
Características ecográficas de las malformaciones arteriovenosas
| Modo B | Modo doppler |
|---|---|
| Superficiales en el tejido celular subcutáneo con engrosamiento de la piel suprayacente | Shunts arteriovenosos |
| Vasos predominantemente en el centro de la lesión | Arterias aferentes: flujo de alta velocidad |
| Patrones | Venas eferentes con flujo arteriolizado |
| Nido de conductos anecoicos | |
| Pseudoquiste anecoico | |
| Mixto con un estroma hiperecoico y canales vasculares anecoicos de distinto tamaño y diámetro |
La técnica que mejor nos permite visualizar las MAV es la RM con contraste. Sin embargo, en ocasiones esta técnica no nos permite evaluar el drenaje venoso y se hace necesario realizar una arteriografía37.
Ecografía de otras anomalías vascularesLa ecografía de otras anomalías vasculares ha sido menos estudiada y sus características se extraen de casos clínicos aislados en publicaciones.
Hemangioendotelioma kaposiforme y angioma en penachoEl hemangioendotelioma kaposiforme y el angioma en penacho parecen ser formas polares del mismo espectro tumoral, siendo el hemangioma en penacho más superficial y el hemangioendotelioma kaposiforme una forma más profunda39.
Debido a su capacidad proliferativa puede producir fístulas arteriovenosas que pueden conducir a fenómenos de atrapamiento vascular con anemia hemolítica, destrucción de plaquetas y coagulopatía de consumo (fenómeno de Kassabach-Merrit)40.
Ecográficamente, en los casos con expresión cutánea o mucosa podemos encontrar descritas lesiones de aspecto sólido, hipercoicas de alto flujo41.
La presencia de fístulas arteriovenosas en estas lesiones no se relaciona necesariamente con la presencia de fenómeno de Kassabach-Merrit42, como se recoge en la serie de 9 casos del Hospital General de Valencia. Así, a pesar de presentar fístulas arteriovenosas en varios de sus casos, en ninguno se objetivó este fenómeno de manera analítica.
AngiosarcomaLas descripciones ecográficas de los angiosarcomas son mamarias43, siendo estas anecdóticas en los angiosarcomas primarios cutáneos. La variante mamaria del angiosarcoma presenta características ecográficas variables y se pueden observar tanto como lesiones hipoecoicas con contornos lobulados, o menos frecuentemente pueden presentar una ecogenicidad mixta con áreas hiperecoicas y bordes espiculares44.
ConclusionesLa primera prueba diagnóstica necesaria en la evaluación de las anomalías vasculares que debe solicitar e interpretar a día de hoy el dermatólogo que coordine el manejo multidisciplinar de las mismas es la ecografía.
Aun cuando no realice personalmente la técnica, debería conocer:
- 1)
Qué estudio ecográfico ha sido realizado (modo B, doppler color y espectral).
- 2)
Qué datos compatibles con la anomalía vascular sospechada se deben encontrar en el informe ecográfico (por ejemplo, presencia de canales o flebolitos en las malformaciones venosas).
- 3)
Qué limitaciones tiene la ecografía para diferenciar estas lesiones de otras similares (por ejemplo, en las malformaciones capilares).
- 4)
Qué otras técnicas de imagen son complementarias al estudio ecográfico (TAC, RM, radiografía convencional).
El conocimiento ecográfico del dermatólogo supondrá probablemente una mejor comunicación con el radiólogo y un mejor diagnóstico y tratamiento para los pacientes con anomalías vasculares.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.