La fototerapia y los tratamientos sistémicos clásicos (metotrexato, acitetrina, ciclosporina), junto con las denominadas terapias biológicas (etanercept, infliximab, adalimumab, ustekinumab), permiten al dermatólogo disponer de un arsenal terapéutico amplio que aumenta las posibilidades de control de pacientes con psoriasis grave y/o extensa. La acitretina sigue siendo de gran utilidad tanto en monoterapia como combinada con otros fármacos sistémicos (clásicos o «biológicos»), o en terapia secuencial. Se distingue por no ser inmunosupresor directo y mantener respuestas a muy largo plazo, lo que le confiere un papel relevante en el tratamiento de la psoriasis, que no siempre ha sido reconocido en las diversas guías terapéuticas de esta enfermedad.
Se presenta una guía de uso de acitretina consensuada por los miembros del Grupo de Psoriasis de la Academia Española de Dermatología y Venereología, en la que se exponen de forma detallada aspectos de la farmacología del fármaco, sus indicaciones y contraindicaciones, su eficacia antipsoriásica, los efectos adversos asociados al fármaco, las acciones a tener en cuenta para aumentar la seguridad de su uso, y se propone diversas estrategias terapéuticas de aplicación en la práctica clínica habitual. El objetivo global es facilitar los criterios de indicación y manejo de la acitretina en pacientes con psoriasis.
Phototherapy, classic systemic treatments (methotrexate, acitretin, and ciclosporin), and biologic agents (etanercept, infliximab, adalimumab, and ustekinumab) constitute a broad therapeutic arsenal that increases the likelihood of achieving control of severe and extensive disease in patients with psoriasis. Acitretin continues to be a very valuable tool in both monotherapy, in which it is combined with other systemic treatments (classic or biologic), and in sequential therapy. Thanks to its lack of a direct immunosuppressive effect and its ability to achieve a long-term response, acitretin has an important role in the treatment of psoriasis, although this has not always been acknowledged in relevant treatment guidelines.
We present consensus guidelines for the use of acitretin in psoriasis drawn up by the Psoriasis Group of the Spanish Academy of Dermatology and Venereology. These guidelines provide a detailed account of acitretin, including pharmacological properties, indications and contraindications, adverse effects, and factors that should be taken into account to enhance the safe use of this drug. They also propose treatment strategies for use in routine clinical practice. The overall aim of these guidelines is to define the criteria for the use and management of acetretin in psoriasis.
En los últimos 10 años el tratamiento de la psoriasis ha experimentado un cambio sustancial gracias a la aparición de los fármacos biológicos, que han incrementado el arsenal de medicamentos para el tratamiento sistémico de la enfermedad. Dentro de los medicamentos sistémicos la acitretina (ACI) posee un mecanismo de acción diferente a los demás, lo que le confiere una posición única dentro de la estrategia terapéutica de la psoriasis. Esta es la principal razón por la que, a pesar de los más de 35 años trascurridos desde su síntesis y 25 de su comercialización en España, la ACI conserva su vigencia en la terapéutica de la psoriasis, tanto en monoterapia como asociada a fototerapia y otros fármacos sistémicos, en especial como rescate o en combinación con los biológicos, como demuestran las recientes revisiones de las que ha sido objeto1–5.
Los retinoides (RT) son un grupo de compuestos hormonales no esteroideos relacionados con el retinol. Son mediadores intracrinos y paracrinos involucrados en una amplia gama de procesos biológicos esenciales en los vertebrados, que incluyen la embriogénesis, morfogénesis y organogénesis, regulación del crecimiento celular, la diferenciación celular, la apoptosis y la regulación inmune6–8. Los RT producen sus efectos mediante la unión a proteínas citoplasmáticas, que determinan su distribución intracelular, y la unión y/o activación de diversos receptores nucleares, pertenecientes a la superfamilia de los reguladores de la transcripción inducibles por ligandos, que incluye a los receptores de la vitamina D3 (VDR), los esteroides y las hormonas tiroideas. Se conocen 2 clases de receptores nucleares de RT: el receptor del ácido retinoico (RAR) y el retinoid X receptor (RXR), cada uno de los cuales está formado por 3 tipos y varias isoformas. En la piel normal la concentración de RXR es 5 veces superior a la de RAR. Antes de unirse a los elementos de respuesta nuclear, que determinan la transcripción de los diversos genes dependientes de RT, los receptores nucleares de RT activados se unen formando homodímeros (RAR/RAR, RXR/RXR) o heterodímeros (RAR/RXR, RAR/VDR o RXR/VDR); los genes diana sensibles a los RT con efecto terapéutico responden predominantemente a los heterodímeros RXR/RAR9. El desarrollo de los diferentes RT disponibles ha cursado paralelo al descubrimiento de la especificidad de acción dependiente de los distintos receptores intranucleares, en busca de reducir la toxicidad y aumentar la especificidad de acción8,10–12.
La introducción de los RT en la década de los 70 para valorar su utilidad en oncología cutánea13 pronto se extendió a otros procesos proliferativos en Dermatología14. Su utilidad en la terapia antipsoriásica deriva de sus efectos sobre la queratinización, proliferación e inflamación celular15–17,12,18 y la regulación inmunológica19,20.
En 1972 se desarrolló el etretinato, un RT monoaromático que por su actividad antiproliferativa y diferenciadora de tejidos, particularmente los epiteliales, consiguió un importante impacto en la terapéutica sistémica de la psoriasis y otros trastornos de la queratinización9,21,22.
La aplicación del etretinato, como primer RT para la psoriasis, supuso toda una revolución terapéutica, añadiendo una nueva e interesante opción al limitado arsenal terapéutico de la enfermedad grave, que hasta entonces solo disponía básicamente del metotrexato y de la PUVA-terapia. También lo fue metodológicamente, ya que por primera vez se empleó el psoriasis area and severity index (PASI) para valorar su eficacia en los ensayos clínicos23.
El gran poder de teratogenicidad que tienen todos los RT, incluido el etretinato, junto a su larga vida media, limitaban mucho su uso en mujeres en edad reproductiva. Por este motivo, en 1997 el etretinato fue sustituido por su metabolito activo, la ACI, que tenía una eficacia similar y una vida media menor, y por tanto era esperable una menor duración de sus efectos teratógenos, expectativa que no llegó a cumplirse.
La presente revisión se centra en la utilidad de la ACI exclusivamente en la psoriasis, a pesar de que es un fármaco utilizado para el tratamiento de muchas otras dermatosis. Por ello hemos creído de interés elaborar una guía de uso consensuada entre varios miembros del Grupo de Psoriasis de la Academia Española de Dermatología y Venereología.
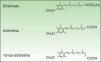
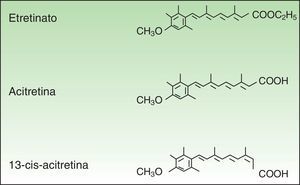
FarmacologíaLa ACI (C21H26O3, PM 326.42934 [g/mol]) (fig. 1) es un RT monoaromático de segunda generación, forma ácida libre y metabolito activo del etretinato, su precursor. Presenta la ventaja sobre su precursor de poseer una vida media mucho más corta.
Pese a su similitud estructural, las propiedades fisicoquímicas de ambos productos son muy diferentes, y la ACI ha venido a mejorar las características farmacocinéticas, de eficacia y de seguridad del etretinato, hasta el punto de que en la actualidad lo ha sustituido por completo.
Mecanismo de acciónLa ACI actúa modulando la proliferación de los queratinocitos epidérmicos. Los RT ejercen en los tejidos hiperproliferativos, como la placa de psoriasis, una acción antiproliferativa, mientras que en los tejidos sanos inducen la proliferación24. En la lesión de psoriasis esto se traduce en una disminución del grosor, de la descamación y del eritema de la placa. Sin embargo, algunos trabajos atribuyen a los RT un papel en la modulación de la respuesta linfocitaria T25, la inhibición de la quimiotaxis y la activación de los leucocitos polimorfonucleares26. La ACI no se considera un fármaco citotóxico ni inmunosupresor, a diferencia de los demás medicamentos sistémicos usados para el tratamiento de la psoriasis.
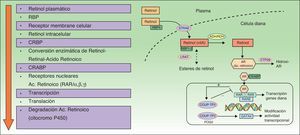
La ACI se une al receptor nuclear RAR o RXR, activando cualquiera de sus subtipos (α, β y γ) y modulando la trascripción de genes que codifican varias proteínas implicadas en la patogenia de la psoriasis27. Aunque los RT actúan de forma principal al unirse con receptores del núcleo de la célula, también actúan de forma indirecta antagonizando diferentes factores de transcripción, al competir con proteínas coactivadoras necesarias para la activación de genes sobre los que no tienen acción los RT10,28,29 (fig. 2). Además de ese mecanismo directo de transcripción positiva, la ACI ejerce otra acción indirecta, reprimiendo algunos genes que regulan la proliferación, la angiogénesis y la inflamación en la psoriasis12,30.
Mecanismo de acción de los retinoides.
ADH: alcohol deshidrogenasa; COUP-TFII: chicken ovalbumin upstream promoter-transcription factor ii; CRBP: cellular retinol binding proteins; CYP: citocromo P 450 familia 26; FOG2: friend of GATA; GATA4: guanina, adenina, timina, adenina; LRAT: lecitin retinol acetil transferasa; RAR: retinoic acid receptors; RARE: retinoic acid response elements; RBP: retinol binding proteins; RDH: retinal dehidrogenasa; RXR: retinoid X receptors; STRAT6: stimulated by retinoic acid 6.
Aunque no se conoce con exactitud la acción concreta que se deriva de la transcripción o represión inducida por la ACI, se dispone de varias hipótesis que orientan hacia 2 áreas de acción: por una parte, modificando el metabolismo y la acción de los RT endógenos29,31 y, por otra, ejerciendo una regulación inmunológica global sobre las células y moléculas inflamatorias que intervienen en la psoriasis19,31,32, y más específica sobre las células Th1/Th1718,20,33. Estos mecanismos de acción permiten explicar que la ACI sea capaz de revertir las alteraciones patológicas y manifestaciones clínicas de la placa de psoriasis18,34–37.
Absorción y distribuciónLa biodisponibilidad media absoluta de la ACI es del 59% (rango: 36-95%). La dosis absorbida es lineal en función de la dosis hasta los 50mg/d, siendo irregular a partir de la misma. Así mismo, la cantidad y rapidez de su absorción puede ser de 2 a 5 veces mayor cuando se administra junto con alimentos38,39.
La ACI que se absorbe es transportada ligada a proteínas plasmáticas (95%), en su mayoría albúmina, y el resto ligado a HDL, LDL y VDL38,40. Se distribuye de forma rápida y generalizada en el organismo, sin que se acumule en ningún tejido en especial. Es unas 50 veces menos lipofílica que el etretinato, por lo que no tiende a acumularse en el tejido adiposo41.
MetabolismoLa ACI se metaboliza principalmente en el hígado, dando lugar a 2 metabolitos: la 13-cis-isoacitretina y el etretinato. La cantidad de 13-cis-isoacitretina que se forma es independiente de la dosis, formulación, o de si la toma se acompaña con ingesta de comida. Tras la toma diaria de ACI se alcanzan concentraciones estables de ACI y 13-cis-ACI aproximadamente a las 3 semanas.
Se ha comprobado que de forma natural, y por un proceso de reesterificación variable en cada individuo, se produce etretinato a partir de la ACI42. La cantidad de etretinato que se produce es muy pequeña, si bien se ve potenciada en presencia de etanol, mediante la acción de una enzima hepática que cataliza la etil-esterificación de la ACI a etretinato17,43. La acumulación del etretinato en el tejido graso y también en el hígado, el riñón, el cerebro y los testículos es 50 veces mayor que la de ACI, por lo que pueden mantener la actividad RT incluso durante largo tiempo después de suspender la toma de ACI.
Una vez ejercida su acción en la célula diana la ACI y el etretinato no utilizados son degradados a metabolitos polares por la acción enzimática del complejo citocromo P450 (CYP 26)10,44.
Vida mediaLa ACI y el etretinato son 2 moléculas muy similares, siendo su única diferencia química que el etretinato es la forma etilesterada de la ACI. Esta pequeña diferencia química les confiere grandes variaciones en cuanto a su perfil farmacocinético. Esto se debe a que el etretinato a diferencia de la ACI no tiene carga iónica, lo que le proporciona una gran lipofilia y una acumulación importante en la grasa corporal. La ACI, por el contrario, tiene carga iónica negativa, y por esto se acumula menos en la grasa corporal, tiene una mayor tasa de aclaramiento y menor volumen de distribución corporal, por lo que su vida media es mucho más corta, 50h de la ACI frente a 120 días del etretinato45–47, siendo esta precisamente la razón primaria por la que etretinato fue sustituido por ACI en la práctica clínica.
Sin embargo, la hidrólisis que se produce de forma natural en el organismo humano para convertir el etretitano en ACI puede ser revertida cuando hay un consumo importante de alcohol46. De este modo se han hallado niveles de etretinato en plasma de pacientes que solo tomaban ACI, que al depositarse en la grasa y prolongar su vida media conserva durante más tiempo el poder teratógeno del fármaco.
Tras su absorción la ACI alcanza su concentración plasmática máxima entre las 0,9 y 4,6h, su vida media de absorción se sitúa entre las 0,2 y 1,7h y su vida media de distribución entre las 1,2 y 3,5h. Tras suspender la toma de ACI su vida media de eliminación varía entre las 16,5 y las 111,1h (media: 47,1h±29,8 DE), y la de su metabolito (13-cis-ACI) varía entre las 36,5 y las 249,4h (media 119,4±73,4 DE)46.
ExcreciónLos conjugados del metabolismo de la ACI y de su metabolito la 13-cis-ACI se eliminan por vía renal (34 al 54%) y fecal a través de la bilis (16 al 53%). La ACI es eliminada en unas 49h (rango: 33 a 96h), su metabolito 13-cis-ACI en unas 63h (rango: de 28 a 157h) y etretinato en unos 120 días (rango alto de hasta 168 días).
Se excreta en trazas en la leche materna (30-40ng/ml)48, por lo que se calcula que el neonato solo recibiría el 1,5% de la dosis materna. También se puede encontrar en el líquido seminal, a una concentración exigua (12,5ng/ml, por 10ml de material eyaculado).
FarmacogenéticaActualmente se reconocen más de 20 genes que regulan el metabolismo de los RT, 6 genes que codifican para receptores nucleares involucrados en la señal de transducción y otros muchos que codifican reguladores de esta vía49. El estudio y conocimiento de las variaciones genéticas e isoformas de cada uno de ellos puede orientar en el futuro a un mejor conocimiento del mecanismo de acción concreto de los RT, y en concreto de la ACI.
IndicacionesLa ficha técnica recoge como indicaciones: la psoriasis extensa grave, resistente a otros tipos de terapia, la pustulosis palmo-plantar, la ictiosis congénita grave y la enfermedad de Darier grave (ficha técnica de Neotigason®). El papel de la ACI como fármaco antipsoriásico de utilidad en la práctica clínica es firme, y deriva de 2 de sus características farmacológicas: que no es un fármaco inmunosupresor y que su acción terapéutica, aunque de aparición lenta, se mantiene a muy largo plazo, en terapia continua. Por su capacidad de regulación de la queratinización, la ACI debe considerarse en aquellas formas de psoriasis en las que el componente descamativo predomina sobre el inflamatorio o el infiltrativo.
La ACI es un fármaco de primera elección para la psoriasis pustulosa50–52, especialmente la palmo-plantar53, y para el establecimiento de estrategias de tratamiento de la psoriasis a largo plazo, en rotación, secuenciación o combinación.
Aunque tradicionalmente se le ha asignado la indicación como fármaco de primera línea para el tratamiento de la eritrodermia psoriásica, conviene reseñar que esta indicación se hizo por comparación con el etretinato54,55, asumiendo que la equivalencia de eficacia comprobada entre etretinato y ACI en el tratamiento de la psoriasis vulgar sería similar en la eritrodermia45,56. Este aspecto no se ha estudiado de forma directa, o se dispone de resultados muy escasos36 que permitan afirmarlo. No obstante, hoy día se dispone de fármacos de primera línea con mayor rapidez de acción y eficacia (como la ciclosporina, por ejemplo), por lo que consideramos que no debe mantenerse la ACI como fármaco de primera línea en esta forma de psoriasis.
Por su mecanismo de acción no inmunosupresor la ACI se recomienda como primera línea de tratamiento sistémico en pacientes con melanoma, neoplasias sólidas, linfoproliferativas y en pacientes con infección por el VIH57,58. La ACI no está indicada en el tratamiento de la artritis psoriásica53.
ContraindicacionesLa ACI está absolutamente contraindicada en el embarazo y en pacientes con alergia al producto o a alguno de sus componentes. Tiene contraindicación relativa en mujeres en edad de gestación, en periodo de lactancia, en pacientes con insuficiencia hepática o renal, en pacientes con dislipidemia mal controlados y en pacientes en tratamiento con tetraciclinas, en los que es necesario valorar precisamente el riesgo-beneficio para su indicación. La tabla 1 resume las contraindicaciones del uso de ACI.
Contraindicaciones de uso de la acitretina
| Relativas |
| Insuficiencia hepática leve (ajustar dosis) |
| Insuficiencia renal leve (ajustar dosis) |
| Consumo de alcohol (hepatotoxicidad, reesterificación a etretinato) |
| Interacción medicamentosa (aumento toxicidad) |
| Medicación organotóxica concomitante (aumento toxicidad) |
| Infecciones activas (valorar agravamiento infección por toxicidad ACI) |
| Dislipidemia mal controlada |
| Síndrome metabólico |
| Paciente no colaborador/no cumplidor |
| Edad pediátrica o avanzada (¿menor tolerancia a toxicidad?) |
| Absolutas |
| Embarazo (desde un mes antes de iniciar tratamiento y hasta 2 años de suspenderlo) |
| Insuficiencia hepática grave |
| Insuficiencia renal grave |
| Alergia a componentes |
El preparado comercial de ACI (Neotigason®) tiene 2 presentaciones: cápsulas de 10mg y 25mg en cajas de 30 unidades.
Los excipientes no activos de la cápsula lo forman: glucosa, ascorbato sódico, gelatina, celulosa, óxido de hierro negro (E 172), óxido de hierro amarillo (E 172), óxido de hierro rojo (E 172), dióxido de titanio (E 171) y gelatina.
PosologíaLa ACI se administra por vía oral, preferiblemente con las comidas (aumenta su absorción). La dosis de ACI no se ajusta por peso (contrariamente a lo que se hacía con el etretinato, motivo por el que quizás sigue apareciendo en alguna guía)59 y su rango terapéutico óptimo en monoterapia se sitúa entre los 25 y los 50mg/d60,61. Puede administrarse en dosis única o en 2 tomas al día. Con dosis superiores (50 a 75mg/d) se puede conseguir mayor eficacia terapéutica, pero la aparición de efectos adversos obliga habitualmente a reducir dosis o suspender el tratamiento61–63, y de hecho no se dispone de ensayos clínicos con dosis superiores a 75mg/d. Dosis inferiores a 25mg/d pueden tener su indicación en terapia combinada.
Un estudio reciente que analiza los datos de 2 ensayos clínicos pivotales concluye que las diferencias de eficacia entre la dosis de 25mg/d y la de 50mg/d no compensa los efectos secundarios que se dan con la dosis más elevada, por lo que recomienda la de 25mg/d como la dosis de mantenimiento64,65.
Dado que existe una variación interindividual respecto a su farmacocinética, eficacia y perfil de reacciones adversas, no es posible estandarizar una dosis, por lo que hay que establecer una posología individualizada ajustando el mejor resultado clínico posible a la menor aparición de acontecimientos adversos66.
Aunque en la ficha técnica del producto sigue figurando que está contraindicado utilizarlo durante más de 6 meses, la experiencia de años de uso y varios estudios retrospectivos no han encontrado un aumento sustancial de los efectos adversos del fármaco en la terapia a más largo plazo (ficha técnica de Neotigason®).
Para la psoriasis en placas se recomienda iniciar el tratamiento con ACI a dosis de 10-20mg/d. La dosis inicial se mantendrá durante 4 semanas. Después se evaluará la respuesta terapéutica, y se irá aumentando la dosis en busca de la que consiga mayores efectos terapéuticos con menores efectos adversos (dosis mínima eficaz). En general, la dosis de mantenimiento en la mayoría de series oscila entre 25 y 50mg/d. La psoriasis blanquea más rápido si iniciamos el tratamiento a dosis más altas, pero también aumentan los efectos adversos mucocutáneos, con el riesgo de que algunos pacientes no toleren el tratamiento y lo dejen. El inicio a dosis alta, de 1mg/kg/d, actualmente solo se recomienda para el tratamiento de ataque de la psoriasis pustulosa generalizada.
En algunos pacientes el inicio del tratamiento conlleva un empeoramiento inicial de la psoriasis, con aumento del eritema y la extensión de las lesiones que luego se resuelve61.
EficaciaLa ACI ha demostrado ser un fármaco eficaz en el tratamiento de la psoriasis, tanto en monoterapia como en combinación34–36,45,56,67. Los ensayos realizados sobre su eficacia y la experiencia acumulada la sitúan en el grupo de fármacos antipsoriásicos sistémicos de menor eficacia, si bien no hay ensayos que comparen ACI con otros fármacos antipsoriásicos. La eficacia de la ACI y la mayoría de sus efectos adversos son dependientes de la dosis utilizada, muy variables individualmente y requiere un tiempo de 3 a 6 meses para alcanzar su respuesta máxima38,53,61,62,68,69.
Psoriasis en placasExisten escasos ensayos que hayan valorado la eficacia a corto plazo de la psoriasis. En un estudio en el que se valoraba la eficacia a las 8 semanas en 3 grupos terapéuticos incrementales (10, 25 y 50mg) se comprobó una eficacia-medida en reducción media del PASI del 61, 79 y 86%, respectivamente, frente a un 30% del grupo placebo54.
Los estudios disponibles en cuanto a la eficacia del fármaco son muy variables en diseño y objetivos. En su conjunto, dosis iniciales de entre 40 y 50mg/d permitieron alcanzar resultados de PASI 50 entre el 66 y el 85% y de PASI 75 en el 34-52% a las 8-12 semanas. Dosis superiores —de hasta 70mg/d— se asociaron a efectos secundarios que dificultaron la tolerancia36,45,67,70.
La experiencia clínica demuestra que la ACI es un fármaco ideal para la terapia de mantenimiento a largo plazo, porque permite mantener la respuesta clínica obtenida sin decaimiento significativo de su actividad. En un estudio en el que se valoró la eficacia de ACI a los 12 meses de tratamiento se comprobó que de los 37 que completaron el estudio, de un total de 63 pacientes, el 89% mantenían mejoría PASI 50 y el 78,4% PASI 7536.
Psoriasis pustulosaLa ACI para la psoriasis pustulosa generalizada se utiliza a dosis de 0,5 a 1mg/kg/d, obteniéndose en general una rápida respuesta clínica con blanqueo de las lesiones en 10 días. Después debe disminuirse lentamente la dosis hasta llegar a una dosis de mantenimiento de 10mg/d. Las recidivas al suspender el tratamiento no son frecuentes, y en estos casos la reintroducción del fármaco mantiene la misma eficacia. Probablemente la ACI es el fármaco de primera elección en esta forma de psoriasis, y los estudios realizados demuestran que es efectiva en el 84% de los pacientes tratados50,71.
También se considera entre los tratamientos de primera elección para la psoriasis pustulosa palmo-plantar en monoterapia o en combinación con la fototerapia72.
Psoriasis unguealEn la literatura hay muchos casos aislados que demuestran la eficacia de la ACI en el tratamiento de la psoriasis ungueal. En un estudio abierto de 36 pacientes con psoriasis ungueal moderada y grave tratados con ACI a la dosis de 0,2 a 0,3mg/kg/d durante 6 meses se pudo observar una buena respuesta. La reducción media del NAPSI fue del 41%; en 9 pacientes (25%) se consiguió la desaparición total de las lesiones y 6 (11%) no mejoraron nada, lo que motivó a los autores a sugerir esta pauta de ACI a dosis bajas como una alternativa terapéutica para la psoriasis ungueal, asumible por su buena tolerancia y pocos efectos secundarios73. Por el contrario, en un reciente estudio abierto con 30 pacientes con psoriasis ungueal tratados con ACI a dosis de 0,3mg/kg/d durante el primer mes y 0,5mg/kg/d los 3 meses siguientes, no se consiguió mejorar la afectación ungueal74.
Toxicidad y reacciones adversasGeneralidadesLa mayor parte de los efectos secundarios de la ACI son dosis-dependiente y, por lo general, son bien tolerados a las dosis recomendadas. Las reacciones adversas (clínicas y analíticas) se asocian con menor frecuencia a las dosis bajas (25mg/d) que a las altas (50mg/d)65,68. Sin embargo, la dosis tóxica de ACI está muy próxima a la dosis terapéutica, y por esta razón la mayoría de los pacientes experimentan algunos efectos secundarios durante el período inicial, mientras se está ajustando la dosis. Dichos efectos normalmente son reversibles en cuanto se reduce la dosis o se interrumpe el tratamiento, si bien pueden provocar el abandono del tratamiento.
Los efectos adversos más característicos asociados al uso de ACI se recogen en la tabla 2.
Efectos adversos más frecuentes asociados a la acitretina
| Muy frecuentes | Infrecuentes | Muy infrecuentes |
| • Queilitis | • Xerostomía | • Pancreatitis |
| • Alopecia | • Epistaxis | • Agudización enfermedad inflamatoria intestinal |
| • Peeling (PP) | • Eritema difuso | • Agranulocitosis |
| Frecuentes | • Paroniquia | • Leucopenia |
| • Rinitis | • Piel hiperestésica | • Miopatía |
| • Xerosis | • Piel «pegajosa» | • Pseudotumor cerebri |
| • Distrofia ungueal | • Xeroftalmía | • Depresión |
| • Prurito | • Artralgias, mialgias | • Síndrome ácido retinoico |
| • Hiperostosisa | • Reducción visión nocturna | |
| • Cefalea | • Hepatitis tóxica | |
| • Náuseas | • Edema facial y extremidades | |
| • Dolor abdominal | • Eritema multiforme | |
| • Hiperlipidemia | • Vasculitis | |
| • Fotosensibilidad | • Galactorrea, ginecomastia | |
| • Fibrosis pulmonar | ||
| • Teratogenicidadb |
Estos son los efectos adversos más frecuentes75. Son dependientes de la dosis y reflejan una disminución de la producción de sebo, una disminución del grosor de la capa córnea y una alteración de la función barrera de la piel. La sequedad labial y la queilitis se presentan en más del 75% de los casos. Les siguen en frecuencia la descamación —peeling— generalizada, pero especialmente palmo-plantar (hasta el 50%); rinitis y epistaxis por sequedad de la mucosa nasal (hasta el 30%); xerosis generalizada (incluidas xerolfalmia, xerostomía76 [ficha técnica de Neotigason®]). Con menor frecuencia puede aparecer: fragilidad ungueal, formación de granulomas piogénicos periungueales y desarrollo de la denominada «dermatitis retinoide» (placas eritematodescamativas, o con pápulas foliculares y/o vesículas, de predominio en la cara, los antebrazos, el tórax anterior, los flancos y el dorso de las manos; con histopatología de dermatitis aguda inespecífica)77, que debe distinguirse de un rebrote de la psoriasis69. En algunos pacientes se produce fotosensibilidad secundaria al adelgazamiento de la capa córnea.
La aparición de estos síntomas habitualmente solo requiere un tratamiento sintomático mediante hidratación y corticoides tópicos, o la reducción transitoria de la dosis de ACI.
Durante las primeras semanas de tratamiento puede observarse un aumento de la caída del cabello, que en ocasiones condiciona una alopecia difusa y transitoria por efluvio telogénico (hasta el 25%). En estos casos es necesario plantearse una disminución rápida de la dosis del fármaco, ya que si no lo hacemos es muy probable que el paciente tenga una mala adherencia al tratamiento. La caída del cabello suele recuperarse a las 6-8 semanas de bajar la dosis. También se han descrito cambios en la textura y color del cabello durante el tratamiento con ACI78.
HepáticaLa ACI es hepatotóxica cuando se utiliza a largo plazo. En un tercio de los pacientes puede apreciarse elevaciones de aspartato alanina aminotransferasa (ALT), aspartato aminotransferasa (AST) y lactato deshidrogenasa (LDH), que suele ser transtoria o reversible tras la reducción de dosis o suspensión del tratamiento76. La persistencia de su elevación o de niveles excesivamente altos debe hacer descartar la posibilidad de una hepatitis tóxica aguda (rara, en el 0,26% de pacientes)66 y también reversible tras la suspensión del fármaco. Anecdóticamente se ha descrito algún caso de evolución fatal de la hepatitis tóxica aguda por ACI a cirrosis79.
La toxicidad hepática de la ACI puede verse facilitada por la asociación de ingesta de alcohol, obesidad, diabetes o la concomitancia con ciertos fármacos hepatotóxicos. De todos ellos es la ingesta de alcohol la que puede tener un mayor impacto en la terapia con ACI, puesto que influye y modifica directamente el metabolismo de los RT, pudiendo ser el factor que extreme la gravedad de la hepatotoxicidad asociada a ACI80, por lo que se recomienda suprimir la ingesta de alcohol durante el tratamiento.
MetabólicaUno de los efectos adversos más frecuentes de la terapia con ACI, junto con la mucositis, es la alteración del perfil lipídico. Dependiendo de la dosis utilizada puede comprobarse un aumento de triglicéridos hasta en un 66% de pacientes, de colesterol en un 33%, o una disminución de HDL hasta en un 40% de pacientes81,82. Generalmente la elevación de los triglicéridos da lugar a niveles entre 2 y 3 veces el límite superior de la normalidad, y raramente alcanza los niveles de riesgo de pancreatitis y de xantomas eruptivos69,81,82.
Tanto el riesgo de alteración lipídica como el de pancreatitis aumentan con la concomitancia de antecedentes familiares de hipertrigliceridemia, ingesta de alcohol, obesidad o diabetes81,82.
En pacientes diabéticos la toma de ACI puede modificar la tolerancia a la glucosa, provocando desajuste de su control glucémico, por lo que se debe controlar con frecuencia los niveles de glucemia, en especial durante las primeras semanas de tratamiento. Sin embargo, no se ha descrito un riesgo mayor de diabetes en pacientes no diabéticos76.
Neurológica. Pseudotumor cerebriEl pseudotumor cerebri o hipertensión intracraneal benigna se ha relacionado en raras ocasiones con el uso de RT sistémicos83. Se manifiesta con cefalea, alteraciones visuales, náuseas o vómitos. Se recomienda advertir al paciente de que ante la presencia de alguno de estos síntomas consulte a su médico. Se procederá a un examen oftalmológico urgente y si se observa edema de papila se suspenderá inmediatamente el tratamiento con ACI.
Este síndrome se asoció inicialmente al uso de ACI concomitantemente con tetraciclina o minociclina82,84, pero también es posible con ACI en monoterapia76.
OftalmológicaLa xeroftalmía y la irritación ocular son relativamente frecuentes, y pueden requerir el uso de lágrimas artificiales, que pueden ser más necesarias en ancianos (xeroftalmía fisiológica) y en personas que usan lentillas. En algunos casos la sequedad ocular es muy intensa e impide el uso de lentes de contacto durante el tratamiento. Otros efectos adversos mucho menos frecuentes son la pérdida de pestañas y la disminución de la agudeza visual nocturna. La aparición de diplopía y visión borrosa puede ser secundaria a edema papilar e indican la suspensión inmediata de la ACI76 (ficha técnica de Neotigason®).
OsteomuscularLa toma continuada de ACI se asocia con frecuencia a la aparición de artralgias y mialgias, que habitualmente son leves y controlables con analgésicos orales. Para intentar prevenirlos se recomienda no realizar ejercicio físico intenso durante el tratamiento.
Aunque en los primeros estudios de seguimiento de pacientes en tratamiento con etretinato y ACI se refirió la posibilidad de su asociación con hiperostosis idiopática difusa85, la experiencia acumulada durante las décadas transcurridas desde su utilización como antipsoriásico ha puesto en evidencia que ese efecto es excepcional53 (menos del 1% de los pacientes), y más bien relacionado con el agravamiento de una hiperostosis preexistente86. Tampoco se relaciona con una mayor predisposición a las fracturas óseas87. Con los datos disponibles y la evidencia práctica acumulada en la actualidad no parece tener sentido ligar el uso de ACI a ningún riesgo óseo, y por lo tanto no aconsejamos realizar pruebas complementarias, ni previas ni durante su uso, para valorar el estado óseo del paciente, salvo que haya enfermedad ósea previa que así lo aconseje52,53,88.
Síndrome de ácido retinoicoEl síndrome de ácido retinoico (SAR) es una complicación potencialmente letal del tratamiento de la leucemia promielocítica aguda con ácido trans-retinoico89,90. Las características clínicas de este síndrome son: fiebre, infiltrados pulmonares asociados a distrés respiratorio, derrame pleural y pericárdico, aumento de peso inexplicable, ascitis, alteración de la contractilidad miocárdica, insuficiencia renal o hepática, hipotensión episódica y, en algunos casos, coma. Estos síntomas suelen ir asociados a una leucocitosis. El cuadro se presenta a los 7-10d después de iniciar el tratamiento y se trata con corticoides a altas dosis. Aunque es excepcional con el uso de ACI hay que tenerlo en cuenta porque se ha descrito algún caso91–93.
TeratogenicidadLa ACI es un fármaco con potencial teratógeno muy elevado (x en la clasificación de riesgo fetal de la Food and Drug Administration [FDA]) y provoca malformaciones fetales características similares a las que aparecen en la hipervitaminosis A (embriopatía retinoide)94.
La toma de cualquier dosis durante el embarazo puede provocar abortos espontáneos y graves malformaciones fetales como: meningomielocele, meningoencefalocele, malformaciones óseas, malformaciones cardiovasculares, disminución del volumen craneal, dismorfia facial, así como malformaciones en el timo, siendo mayor el riesgo cuando se administra entre la tercera y la sexta semana de gestación94,95.
La ACI no debe usarse en mujeres embarazadas o que quieran quedarse embarazadas durante el tratamiento, o hasta 2 años después de suspenderlo según la European Medicines Agency (EMA) (ficha técnica de Neotigason®) y 3 años según la FDA (ficha técnica de Soriatane®). Tampoco debería prescribirse en las mujeres que el facultativo no vea capaces de seguir una correcta contracepción durante y después del tratamiento.
Síntomas psiquiátricosEn un estudio de 1997 sobre la seguridad de la ACI se afirma que su uso se relaciona con el desarrollo de depresión entre el 1-10% de los casos (ficha técnica de Soriatane®). No obstante, la presencia de algunas deficiencias metodológicas del estudio, así como el hecho de que solo haya un caso dudoso en la literatura de asociación entre ACI y depresión96, plantean dudas de si realmente esta asociación existe, o la depresión que pueda padecer el paciente es debida a la enfermedad cutánea por la que se le prescribe tratamiento con ACI. Sin embargo, y a pesar de que tampoco se haya podido demostrar la relación del tratamiento con otro RT como la isotretinoína con depresión y suicidio, la FDA ha obligado a incluir una nota que advierte del riesgo de depresión y suicidio en el prospecto del medicamento97.
SeguridadLa ACI es un fármaco seguro si se realiza una correcta indicación, selección del paciente, ajuste de dosis, control periódico y se evitan los potenciales riesgos de toxicidad, en especial, el embarazo en mujeres66,69. En las tablas 3 y 4 se exponen las condiciones y situaciones especiales para el uso seguro de ACI.
Medidas para aumentar la seguridad de uso de acitretina
| Selección adecuada del candidato |
| Realizar un cribado de salud protocolizado previo al inicio de tratamiento |
| Disponer de las fichas técnicas de otros medicamentos que tome y revisarlas |
| Indicación precisa tras valorar contraindicaciones |
| Dosificación ajustada de forma escalonada (signo guía=queilitis) |
| Control protocolizado de seguimiento |
| Garantizar/comprometer disponibilidad del paciente para las revisiones y analíticas |
| Accesibilidad al equipo sanitario |
Valoración para el uso de acitretina en escenarios comprometidos
| Indicado | Valorar riesgo/beneficio | No indicado | |
| Obesidad | ✓ | ||
| Diabetes mellitus tipo 2 | ✓ | ||
| Síndrome metabólico/dislipidemia | ✓ | ||
| ICC moderada-grave | ✓ | ||
| Vacunas vivas | ✓ | ||
| Enf. desmielinizante | ✓ | ||
| Enf. granulomatosa activa | ✓ | ||
| Embarazo | ✓ | ||
| Lactancia | ✓ | ||
| <18 años/>65 años | ✓ | ||
| Riesgo infecciones | ✓ | ||
| VIH/sida | ✓ | ||
| Hepatopatía crónica | ✓ | ||
| Portador VHB (asintomático) | ✓ | ||
| Portador VHC (asintomático) | ✓ | ||
| Insuficiencia renal | ✓ | ||
| Artritis psoriásica | ✓ | ||
| Melanoma | ✓ | ||
| Neoplasia linforreticular | ✓ | ||
| Carcinoma sólido | ✓ |
ICC: insuficiencia cardiaca congestiva; sida: síndrome de la inmunodeficiencia adquirida; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VIH=virus inmunodeficiencia humana.
Adaptada de Strober et al.58.
Antes de tomar el medicamento el paciente debe estar muy bien informado de sus efectos adversos más frecuentes, puesto que pueden ser causa de mala adherencia precoz. Así mismo, es conveniente comentar con el paciente la posible lentitud de respuesta y el motivo por el que se ha decidido prescribirlo en lugar de otros fármacos. Una buena información y una decisión terapéutica compartida favorecerán la adherencia terapéutica.
En caso de uso en mujeres se les debe advertir de la obligatoriedad de evitar el embarazo durante el tratamiento y hasta por lo menos 2-3 años después de acabar el mismo.
Se debe indicar al paciente la conveniencia de hidratar con frecuencia la piel y las mucosas, y utilizar fotoprotección solar y gafas que filtren la radiación ultravioleta.
Se le debe informar de que antes de tomar algún otro medicamento comunique que está en tratamiento con ACI, para evitar toxicidades (hepatotoxicidad, síndrome hipervitaminosis A).
Se debe comentar con el paciente la necesidad y el compromiso de realizar revisiones y estudios complementarios periódicos, para garantizar la seguridad y posibilitar el uso a largo plazo.
Cribado basal y seguimiento del pacienteAntes de iniciar tratamiento con ACI se debe realizar una historia clínica completa (antecedentes, enfermedades concomitantes, medicaciones que toma, examen físico, historia de la evolución de la psoriasis, tipo de psoriasis y terapias previas). En la mujer se debe descartar el embarazo y establecer un programa de anticoncepción de una duración mínima de 2 años según la ficha técnica europea y de 3 años según la ficha técnica norteamericana. Se ha de solicitar un hemograma y una bioquímica basal, que incluya función hepática, renal y perfil lipídico69.
Tras el inicio del tratamiento es conveniente valorar de nuevo a las pocas semanas la función hepática y el perfil lipídico. El momento de su repetición dependerá de los riesgos que asocie el paciente o de la concomitancia de otros medicamentos que puedan añadir hepatotoxicidad o alteración lipídica. En nuestra opinión, bastaría con repetir a las 4 y 8 semanas, para luego seguir revisiones habituales de seguimiento. En la práctica habitual estas alteraciones no son tan frecuentes, por lo que el control puede espaciarse a cada 6 meses.
Salvo en pacientes en los que sea evidente la toxicidad ósea, no se recomienda estudios de control radiológico53.
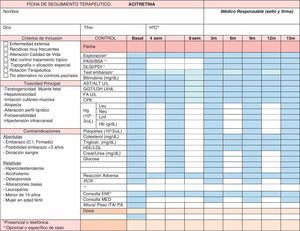
Las revisiones clínicas y analíticas de seguimiento se deben realizar cada 3-6 meses69 (tabla 5). Se adjunta ejemplo de ficha de seguimiento terapéutico (fig. 3).
Cribado de pacientes candidatos a tratamiento con acitretina
| Historia clínica |
| Tipo de psoriasis |
| Perfil evolutivo |
| Artritis/artralgias |
| Respuesta tratamientos previos |
| Contraindicaciones/riesgos |
| Estudios basales |
| Valoración física y dermatológica |
| Función hepática |
| Función renal |
| Perfil lipídico |
| Glucemia |
| Infecciones virales |
| Evitar/descartar concepción |
| Estudios de seguimiento |
| Revaloración física y dermatológica |
| Función hepática |
| Función renal |
| Perfil lipídico |
| Glucemia |
| Línea de contacto fácil y directa con la consulta de enfermería dermatológica |
La indicación de ACI en pacientes con riesgo cardiovascular debe ser muy sopesada, por el riesgo de hipertrigliceridemia asociado al fármaco y, por lo tanto, el aumento de riesgo de aterosclerosis. De indicarse, siempre es aconsejable asociar tratamiento hipolipidemiante98 e instaurar o potenciar un estilo de vida que permita reducir los factores de riesgo cardiovascular69.
El uso de ACI en pacientes con síndrome metabólico debe sopesarse individualmente, por el riesgo de aumentar el síndrome y el riesgo cardiovascular asociado, y porque la toxicidad hepática de la ACI se ve favorecida por la obesidad y la diabetes. La alteración del perfil lipídico obliga a hacer un ajuste de dosis a la baja, asociar fármacos hipolipidemiantes, o incluso llegar a su suspensión.
La hipertriglicediremia y la hiperglucemia se pueden manejar aumentando el ejercicio físico, con cambios en la dieta, disminuyendo la ingesta de alcohol, o con el uso de fármacos.
Se ha descrito un aumento de eficacia de la ACI en pacientes con diabetes mellitus tipo 2 en tratamiento con pioglitazona99, derivado de los efectos antiinflamatorio y antiangiogénico que tiene este hipoglucemiante oral100. La pioglitazona es un antidiabético oral de segunda línea, de elección en pacientes obesos que no pueden recibir metformina, por lo que dicha combinación en un paciente con psoriasis debe contar con la colaboración del endocrinólogo, si bien puede ser una circunstancia ocasional aprovechable en pacientes que asocien ambas enfermedades.
Uso en pacientes con insuficiencia hepáticaPuesto que la ACI tiene potencial hepatotóxico, existe una contraindicación relativa en pacientes con insuficiencia hepática. De utilizarse en tales casos habrá que ajustar la dosis y la pauta a los parámetros enzimáticos de función hepática, evitando elevaciones por encima de 4-5 veces el límite superior de la normaliad de la ALT.
No se requiere en ningún caso la práctica de biopsia hepática, puesto que no se ha demostrado relación entre acumulación de dosis de ACI y fibrosis o cirrosis hepática101. La asociación de ingesta habitual de alcohol, obesidad y diabetes son factores que agravan la acción hepatotóxica de la ACI, por lo que suponen un riesgo aumentado de su uso, obligando a hacer una vigilancia más estricta de la función hepática, o a contraindicar formalmente su uso.
Uso en pacientes con insuficiencia renalLa ACI está también contraindicada en pacientes con insuficiencia renal (ficha técnica de Neotigason®). Las concentraciones plasmáticas de ACI son menores en casos de insuficiencia renal grave. Conviene saber que la ACI no se elimina por diálisis.
Interacciones farmacológicasEl uso concomitante con otros fármacos o sustancias con efectos adversos similares puede lógicamente potenciar los efectos adversos de la ACI, o por el contrario, alterarse la función del fármaco asociado por la acción de la ACI. Siempre que se indique ACI en un paciente han de registrarse los medicamentos que el paciente toma, antes o durante el tratamiento con ACI.
Es importante recordar que la ingesta de alcohol aumenta la hepatotoxicidad de ACI y la reesterificación de ACI a etretinato, con el aumento de riesgo de teratogenicidad76 (ficha técnica de Neotigason®). Mención especial merece la disminución del efecto anticonceptivo de los medicamentos a base de progestágenos microdosis, por lo que no deben emplearse estos preparados (mini-pills) como mecanismo de prevención de embarazo durante el tratamiento. Sí que pueden usarse los anticonceptivos con combinación de estrógeno-progesterona, ya que no interfiere con ellos102. En la tabla 6 se resumen las interacciones más relevantes.
Interacciones farmacológicas de la acitretina
| Alcohol |
| Aumenta hepatotoxicidad |
| Aumenta re-esterificación de ACI a etretinato (teratogenicidad) |
| Tetraciclinas |
| Aumenta fotosensibilidad |
| Riesgo de hipertensión intracraneal |
| Minociclina |
| Riesgo de hipertensión intracraneal |
| Vitamina A (>4.000-5.000 UI/d) |
| Hipervitaminosis |
| Corticoides |
| Alteración lipídica |
| Riesgo de hipertensión intracreaneal |
| Metotrexato |
| Potencia hepatotoxicidad |
| Elevación niveles de metotrexato |
| Ciclosporina |
| Alteración perfil lipídico |
| Aumenta riesgo cardiovascular |
| Fenitoína |
| Aumentan los niveles sanguíneos de fenitoína |
| Antidiabéticos orales |
| Fluctuaciones en la glucemia |
| Glibenclamida |
| Reducción efecto hiopoblucemiante de la glibenclamida |
| Anticonceptivos progestágenos (en minidosis) |
| Reducción del efecto anticonceptivo |
La ACI no es un fármaco inmunosupresor directo, por lo que puede administrarse en pacientes que vayan a someterse a inmunizaciones, ya sea con toxinas, agentes atenuados o vivos.
Uso en pacientes oncológicos e inmunosuprimidosLa ACI es adecuada para el tratamiento de pacientes con psoriasis que padecen algún cáncer o están inmunodeprimidos, debido a que no es un agente inmunosupresor y, porque los RT han demostrado tener un efecto de quimioprevención en la leucemia promielocítica103, en el precáncer y el cáncer cutáneo104–106 y en el hepatocarcinoma107. Por estos motivos puede indicarse como tratamiento sistémico de primera elección en pacientes psosiásicos que asocien melanoma, neoplasias sólidas y linfoproliferativas58 y en pacientes infectados por el VIH57,58.
Uso en el embarazo y relación con la fertilidadPor su potencial teratógeno y riesgo de provocar malformaciones graves en el feto (independientemente de la dosis y del tiempo de exposición) su uso está contraindicado en el embarazo76.
Antes de su administración se debe asegurar la anticoncepción al menos desde un mes antes del inicio y hasta después de haber transcurrido 2-3 años después de terminar el tratamiento. El tiempo de anticoncepción en la ficha técnica europea es de 2 años, y se ha calculado en función del conocimiento de que el 98% del posible etretinato formado a partir de la ACI se elimina en ese tiempo. La extensión a los 3 años que figura en la ficha técnica en Estados Unidos (un año más del cálculo basado en la semivida del fármaco) se añade para aumentar el margen de seguridad, pero sin base farmacológica.
Si se prescribe en mujeres con capacidad de procrear es necesario establecer un correcto programa de anticoncepción iniciado al menos un mes antes de comenzar el tratamiento, durante todo el tratamiento y durante los 2 años siguientes a su terminación. Dichas medidas contraceptivas deben adoptarse también en el caso de series repetidas de tratamientos. Estas precauciones deberán ser tomadas incluso por mujeres que, debido a un historial de infertilidad, no adoptan normalmente medidas contraceptivas. El consumo de alcohol está terminantemente prohibido en las mujeres en edad gestacional durante el tratamiento y en los 2 meses siguientes a la suspensión del mismo. En tales casos hay que constatar fehacientemente que la mujer entiende y asume los riesgos potenciales, firmando un consentimiento informado para el uso de ACI.
Los pacientes en tratamiento con ACI tampoco podrán donar sangre mientras tomen el tratamiento y hasta un año después de finalizarlo para evitar el riesgo de teratogenicidad en una potencial receptora de la transfusión; en cualquier caso, un estudio reciente que siguió el embarazo de 18 mujeres que recibieron de forma accidental una transfusión de sangre de personas que estaban en tratamiento con ACI, no detectó alteraciones en el curso del embarazo ni malformaciones fetales108.
En los pacientes varones la ACI no se ha relacionado con alteraciones en la espermatogénesis, ni en las características de los espermatozoides109. No hay descritos casos de malformaciones fetales en embarazos en el periodo en que el padre tomaba ACI. La presencia de metabolitos de ACI en el fluido seminal de varones en tratamiento con ACI parece que conlleva poco riesgo para el feto. De todos modos los datos son escasos y se suele evitar la terapia con ACI en varones que quieran tener hijos110.
Uso en la lactanciaLa ficha técnica contraindica su uso en mujeres en periodo de lactancia, a pesar de que las cantidades excretadas en leche materna y las que puedan llegar al neonato son muy pequeñas48. Esta contraindicación se fundamenta en el temor inicial que existía con ese fármaco respecto a la producción de alteraciones óseas y en estudios realizados en animales con dosis muy elevadas, en los que se producían alteraciones en el hueso diafisario y esponjoso de las crías. Sin embargo, dado que los riesgos óseos se han minimizado y relativizado con el tiempo, y las dosis empleadas en los ensayos eran muy superiores a las recomendadas para uso humano, la ACI puede usarse en el periodo de lactancia sopesando el riesgo-beneficio en cada caso111.
Uso en niñosEl uso de ACI en niños también tiene una contraindicación, basada en los datos de tratamiento prolongado con etretinato en edad infantil (cambios óseos, incluyendo cierre epifisario prematuro, hiperostosis esquelética y calcificación extraósea). Asumiendo que dichos cambios podrían aparecer también con la ACI, aunque no se haya demostrado, la ficha técnica desaconseja su uso en niños (ficha técnica de Neotigason®). Sin embargo, con los datos disponibles tras más de 2 décadas de uso, creemos que dicha contraindicación es relativa, y que puede utilizarse en casos concretos donde el equilibrio entre el riesgo y el beneficio sea favorable.
Respecto a la dosis se recomienda empezar con 0,5mg/kg/d (en niños sí se ajusta la dosis por peso, con dosis mínima posible por la disponibilidad comercial del preparado de 10mg), y aumentar escalonadamente según la respuesta y los posibles efectos adversos. Excepcionalmente se superarán los 35mg/d (ficha técnica de Neotigason®). Tras la consecución de la respuesta clínica se debe reducir a una dosis de mantenimiento, lo más baja posible, para evitar en lo posible los efectos adversos a largo plazo.
Uso en ancianosPara este grupo de edad las indicaciones y pautas son las estándar. No obstante, hay que tener en cuenta que los ancianos son más proclives a la xerosis cutáneo-mucosa y a la insuficiencia hepática y renal, por lo que los efectos adversos pueden aparecer a dosis más bajas. Es conveniente ajustar la dosis a la baja, sobre todo al principio del tratamiento, y hacer un seguimiento más estrecho del paciente.
Uso en pacientes sometidos a intervenciones quirúrgicasSu uso no está contraindicado en pacientes sometidos a cirugía, si bien habrá que tener en cuenta la conveniencia de reducir dosis o incluso la suspensión temporal del fármaco, para evitar complicaciones posquirúrgicas asociadas a sus efectos adversos (tabla 2).
SobredosificaciónLos efectos de una sobredosis accidental o deliberada de ACI son similares a los signos de toxicidad aguda de vitamina A, que se caracterizan por cefaleas intensas, náuseas o vómitos, somnolencia, irritabilidad y prurito. Dichos síntomas disminuyen sin necesidad de tratamiento. Debido a la absorción variable del producto, el lavado gástrico puede estar indicado en las primeras horas tras su ingesta excesiva (ficha técnica de Neotigason®).
Estrategia terapéutica de la acitretina en la psoriasisDosis inicial y escalado de dosisEl inicio del tratamiento para conseguir una respuesta rápida suele ser contraproducente, por la aparición de efectos adversos que acaban limitando su uso38. El objetivo fundamental debe ser el de alcanzar la dosis que cada paciente pueda tolerar para mantenerla en el tiempo y esperar la eficacia a largo plazo (valorar objetivo terapéutico a los 3-6 meses del inicio del tratamiento).
Aunque el rango terapéutico habitual de ACI se sitúa entre los 25 y 50mg/d, es preferible empezar por dosis bajas de 10-25mg/d61 y a partir de ahí hacer tentativas de aumento de 10mg cada 2 semanas, hasta llegar a la dosis a la que el paciente presente efectos adversos que aconsejen no aumentar más la dosis53,65. Un buen signo guía es la aparición de queilitis, como expresión de correcta biodisponibilidad de la ACI en cada individuo16. Conviene tener presente que la variabilidad individual de este fármaco hace que dosis bajas de ACI puedan resultar eficaces64. Así pues, el escalado de dosis en ACI es la estrategia óptima para su correcta utilización, pues permite obtener la mejor respuesta terapéutica con la menor frecuencia de aparición de efectos adversos68. Con él se alcanza la tolerancia gradual del paciente a los potenciales y frecuentes efectos adversos que asocia ACI y evita la utilización de dosis mayores que pueden ser innecesarias en algún caso, o limitantes de su uso en otros53,61.
El escalado terapéutico lleva tiempo, y el intentar abreviarlo conduce habitualmente a la retirada del medicamento, sin darle opción para demostrar su eficacia a largo plazo. Esta es la clave para el correcto manejo de la ACI en la práctica clínica, que se contrapone a la rapidez y energía a la que nos tienen acostumbrados otros fármacos antipsoriásicos.
Dosis de ajuste y de mantenimientoTras conseguir alcanzar de forma escalonada la dosis óptima y si se consigue respuesta eficaz adecuada, la ACI permite habitualmente disminuir ligeramente la dosis para mejorar su tolerancia. Nuevamente este ajuste requiere una actuación individualizada y una estrategia de descenso escalonado. En muchos casos es posible mantener la eficacia conseguida con dosis bajas (de 10 a 25mg/d; o de 25mg/48h) a muy largo plazo66.
Terapia combinadaSe dispone de datos de la utilidad de la combinación de ACI con tratamiento tópico, fototerapia, tratamientos sistémicos clásicos y biológicos, tanto como fármaco inicial al que se le asocia el segundo, o como fármaco asociado a un tratamiento inicial previo112,113.
En un reciente estudio que analizaba los datos de prescripción de ACI del National Ambulatory Medical Care Survey (NAMCS), se pudo observar que en el 62% de los casos se prescribió medicación concomitante; corticosteroides tópicos (51%), calcipotrieno (31%), medicamentos biológicos (6%), ciclosporina (5%), metotrexato (5%) y tazaroteno (2%)114. En la tabla 7 se resumen las distintas opciones de combinación terapéutica de la ACI.
Estrategias clásicas de combinación de la acitretina
| Inicio con ACI, se añade segundo fármaco |
| ACI+metotrexato |
| Se pueden dar dosis completas de los 2 fármacos |
| Se puede interrumpir bruscamente ACI |
| Vigilar hepatotoxicidad |
| ACI+ciclosporina |
| Se pueden dar dosis completas de los 2 fármacos |
| Se puede interrumpir bruscamente ACI |
| Vigilar alteración perfil lipídico |
| ACI+fototerapia |
| ACI a dosis habituales, reducir dosis fototerapia al 50% |
| Suprimir ACI cuando el placiente blanquee |
| Inicio con otro fármaco, se añade ACI |
| Metotrexato+ACI |
| Ir reduciendo MTX en 2-3 meses hasta 7,5mg/sem |
| Introducir ACI a dosis completa |
| Vigilar hepatotoxicidad |
| Ciclosporina+ACI |
| Dosis completa de ciclosporina |
| Asociar ACI a dosis bajas diarias (o cada 48h) |
| Ir aumentando gradualmente dosis de ACI, según clínica |
| Tras conseguir respuesta, ir reduciendo ciclosporina gradualmente en 3-4 meses |
| Mantener ACI |
| Vigilar alteración perfil lipídico |
| Fototerapia+ACI |
| Reducir dosis de fototerapia al 50% una semana antes de introducir ACI |
| ACI a dosis de 10-25mg/d |
| Ir aumentando dosis de fototerapia según respuesta y fototoxicidad |
| Aumentar ACI hasta dosis aceptable (máximo habitual 25mg/d) |
| Mantener ACI y fototerapia hasta aclaramiento |
| Biológicos+ACI |
| Mantener dosis de anti-TNF |
| Asociar ACI a dosis bajas |
| Escalonar dosis ACI según respuesta |
Adaptada de Lebwohl et al.112
La eficacia terapéutica de la ACI aumenta cuando se combina con calcipotriol tópico70,115,116 y corticoides tópicos112,117. La combinación con calcipotriol (1,25-dihidroxivitamina D3) ofrece especial interés, ya que este fármaco también tiene acción al inducir la transcripción de ciertos genes28,118,119.
Combinación con fototerapiaLa asociación de RT orales y fototerapia es probablemente la más reconocida y aceptada. Inicialmente el beneficio de la combinación se demostró con la asociación etretinato-PUVA120,121, pero por la equivalencia clínica de ambos fármacos sus resultados se pueden extrapolar a la ACI. Además, la combinación de ACI con UVB (ReUVB), UVA (ReUVA), o PUVA (RePUVA) también ha demostrado que consigue aumentar la eficacia que tienen ambos tratamientos por separado, reduce el número de sesiones de fototerapia y la dosis de ACI mejorando su tolerabilidad52,66,122–124. El potencial anticancerígeno de los RT también añadiría seguridad al tratamiento combinado respeto a la monoterapia.
La eficacia, medida como blanqueaminento, de la combinación ACI-UVB (74%) es buena y superior a la conseguida en monoterapia con ACI (42%) o UVB (35-41%)66,125,126. También ha quedado demostrada la mayor eficacia de ACI-PUVA respecto a la monoterapia de ambos127. Las combinaciones ACI-UVB y ACI-PUVA tienen similar eficacia en el tratamiento de la psoriasis128. Actualmente se prefiere la combinación de ACI con UVB, en especial el UVB de banda estrecha, a la terapia RePUVA, por no presentar la primera los efectos adversos derivados de los psoralenos.
Cuando se decide terapia combinada como elección inicial la pauta aconsejada es la de administrar ACI a dosis bajas (por ejemplo 25mg/d) desde 2 semanas antes de iniciar la fototerapia. En casos en que el paciente ya esté en fototerapia UVB y no se alcance objetivo terapéutico se puede asociar 25mg/d de ACI, a la par que se recomienda reducir la dosis de UVB en un 30-50% la primera semana de combinación (para evitar eritema) para posteriormente aumentar la dosis de fototerapia de forma gradual hasta conseguir tolerancia y respuesta terapéutica69. Una vez alcanzado el blanqueamiento de las lesiones se recomienda realizar durante un mes tratamiento de mantenimiento a la misma dosis, para después disminuir la dosis de ACI o la frecuencia de las sesiones de fototerapia129.
Combinación con fármacos sistémicos clásicosLa combinación de ACI con otros fármacos inmunosupresores utilizados en la psoriasis solo está avalada por la publicación de casos aislados y series de casos. Solo las combinaciones de tratamiento sistémico que incluyan la ACI no utilizarán 2 fármacos inmunosupresores, y por tanto no potenciarán los riegos de la inmunodepresión.
La combinación de ACI con metotrexato resulta eficaz130, especialmente en la psoriasis pustulosa131. Si tras iniciar con ACI a dosis habituales no se consigue respuesta terapéutica en el plazo de objetivo terapéutico establecido (habitualmente de 3 a 6 meses), se puede asociar el metotrexato a dosis habituales, en administración semanal. Una vez conseguida la mejoría se puede suspender uno de los 2 fármacos y continuar con el otro130, o mantener la combinación con dosis más bajas de cada uno.
Dado que ambos fármacos son hepatotóxicos habrá que realizar una vigilancia más estrecha de la función hepática. No obstante, este riesgo de hepatotoxicidad que inicialmente motivó la contraindicación formal de esta asociación en la propia ficha técnica del producto (ficha técnica de Neotigason®), no suele ser un inconveniente en la práctica clínica en nuestra experiencia ni en la de otros112, y su tolerancia es buena132.
La combinación de ACI con ciclosporina también se ha utilizado eficazmente en el tratamiento de la psoriasis, pero con una eficacia discutible respecto a la monoterapia133,134, que nosotros también corroboramos en nuestra experiencia clínica. Además, un uso continuado de esta asociación aumenta el riesgo de incremento de los niveles de colesterol y triglicéridos, y el de potenciar la toxicidad de la ciclosporina, ya que la ACI inhibe el citocromo P-450, que es la principal vía de inactivación de la ciclosporina. La utilización conjunta de ACI y ciclosporina tiene más utilidad como solapamiento transitorio en el contexto de una terapia secuencial (ver más adelante), o en casos seleccionados de eritrodermia psoriásica135,136.
Combinación con tratamiento biológicoLa combinación de ACI con los nuevos inmunosupresores selectivos (biológicos) también puede ser una alternativa terapéutica, especialmente en aquellos casos en los que no se acaba de controlar del todo la psoriasis con un biológico y la actividad antipsoriásica, pero no inmunosupresora, puede sumar el pequeño grado de eficacia necesario para el control completo de la enfermedad (pacientes que asocian enfermedad inflamatoria intestinal y psoriasis, pacientes con psoriasis generalizada pero que no acaban de blanquear palmas y plantas, pacientes con psoriasis tratados previamente con PUVA y ciclosporina que reciben tratamiento con un biológico, con el fin de reducir el riesgo de cáncer cutáneo no melanoma asociado a la inmunosupresión, etc.)137–139.
Recientemente han aparecido series de casos de pacientes que han respondido a la combinación de fármacos biológicos con ACI137,138,140,141. Se trataba de pacientes en los que la eficacia de la monoterapia con un medicamento biológico era subóptima y la adición de ACI mejoraba la eficacia. Estos datos sugieren que se puede mejorar la eficacia sin añadir toxicidad adicional, dada la ausencia de efecto inmunosupresor de la ACI. Por otro lado también permite reducir la dosis del biológico manteniendo la respuesta con el objeto de ahorrar biológico, por razones de seguridad y sobre todo de coste.
Un reciente trabajo retrospectivo y abierto valora la adición de un medicamento biológico a una serie de pacientes con pobre respuesta al tratamiento con ACI138. Como era de esperar el trabajo demuestra la eficacia, y pone de manifiesto la utilidad de la ACI en la era de la terapia biológica. La ACI puede ser otro fármaco a considerar en una estrategia de combinación, ante la falta de eficacia óptima o decaimiento de un biológico, teniendo en cuenta que aporta eficacia demostrada, un gran margen de seguridad a largo plazo y, de forma distintiva, un mecanismo de acción diferente al de la inmunosupresión de los biológicos, ciclosporina o metotrexato. La tendencia hasta ahora, influenciada quizás por la práctica de los reumatólogos, es la de asociar preferentemente el metotrexato, aun en ausencia de artritis, como combinación de primera elección.
Terapia secuencialLa secuenciación terapéutica se establece como una estrategia de manejo indefinido de la psoriasis para evitar el uso crónico de inmunosupresores o de fármacos con toxicidad organoespecífica acumulativa. Es una terapia de continuación con un segundo fármaco, una vez que se ha conseguido el objetivo terapéutico con el fármaco inductor, para ahorrar fármaco en el tiempo16,142.
La ACI es un candidato idóneo para las estrategias de secuenciación gracias a su capacidad de mantener la eficacia a largo plazo y no ser un inmunosupresor directo, ya que su respuesta tardía puede ser complementada con otro fármaco antipsoriásico más rápido y eficaz, pero del que se deba evitar alcanzar su dosis máxima acumulada, o incluso como estrategia económica. La idea es que una vez conseguida la mejoría se mantendría con ACI, preferiblemente a dosis bajas66,143.
Una estrategia secuencial clásica consiste en blanquear a un paciente psoriásico con ciclosporina («fase de aclaramiento») para, primeramente, asociar de forma escalonada la ACI («fase de transición») mientras se consigue la dosis de tolerancia y posteriormente suspender la ciclosporina para dejar la ACI en monoterapia mantenida a largo plazo («fase de mantenimiento»)142. Una extensión de esta estrategia es la de asociar UVB-PUVA ocasionalmente en caso de puntuales pérdidas de eficacia posteriores manteniendo la ACI en monoterapia66 (tabla 8).
Terapia secuencial ciclosporina-acitretina
| Fase 1 |
| Inducción con CyA |
| Iniciar CyA (5mg/kg/d) |
| Mantener CyA (5mg/kd/d) |
| Fase 2A |
| Conseguir blanqueamiento |
| Introducir ACI a dosis bajas y escalonar hasta dosis máxima tolerada |
| Fase 2B |
| Mantener blanqueamiento |
| (>6- 7 meses) |
| Reducir lentamente CyA (hasta llegar a dosis<1mg/kg/d) |
| Mantener dosis de ACI |
| Fase 3A |
| Consolidar blanqueamiento con monoterapia ACI |
| Suspender CyA |
| Mantener dosis ACI |
| Fase 3B |
| Blanqueamiento a largo plazo Ajuste de fluctuaciones |
| Mantener dosis ACI |
| Asociar fototerapia según necesidad |
La interrupción brusca de la ACI no produce rebote de la enfermedad144, por lo que puede suspenderse en cualquier momento, bien cuando se utiliza en monoterapia bien en cualquiera de las posibles combinaciones. El tiempo de remisión de la psoriasis tras un periodo prolongado con respuesta terapéutica puede ser de 2-6 meses.
Por estas características, ausencia de antigenicidad o resistencias conocidas, siempre que no se le exija respuesta clínica rápida, es un fármaco adecuado para la terapia intermitente, aunque no haya sido valorada en ensayos clínicos.
ConclusionesLa ACI es un RT sintético de segunda generación efectivo en el tratamiento sistémico de la psoriasis, tanto en monoterapia como en estrategias terapéuticas de combinación o secuenciación. Aunque su vida media es mucho menor que la del etretinato, y no tiende a acumularse en ningún tejido en particular, su uso está contraindicado en gestantes y en mujeres en edad fértil que planeen concebir antes de que hayan transcurrido por lo menos 2 años después de finalizar el tratamiento.
Por medio de la transcripción y represión de determinados genes la ACI es capaz de influir en la acción de los RT intracelulares y ejercer acción principalmente reguladora de la diferenciación y proliferación de los queratinocitos y, en menor grado, como antiinflamatoria, por lo que es eficaz en la psoriasis.
La eficacia antipsoriásica de la ACI es comparativamente menor que la de los otros fármacos sistémicos disponibles (metotrexato, ciclosporina y biológicos), pero consigue blanqueamiento significativo y se puede mantener su uso a largo plazo sin riesgo de inmunosupresión.
La ACI en monoterapia obtiene respuesta terapéutica (mejoría PASI 75) entre el 40 y 50% de los pacientes. Su optimización se consigue al administrarla de forma escalonada, hasta llegar a la dosis máxima eficaz, que es variable en cada individuo.
Es un fármaco especialmente útil en la psoriasis pustulosa, o en las formas palmo-plantares. También combinado con fototerapia o en terapia secuencial con ciclosporina. Su combinación con biológicos ofrece otra ventaja estratégica en el manejo de la psoriasis a largo plazo. Al no ser inmunosupresor directo permite usarlo en situaciones donde este factor puede comprometer a otros fármacos antipsoriásicos.
El valor de la ACI no es su rapidez, sino su potencial duración como terapia antipsoriásica de mantenimiento a muy largo plazo, una vez conseguido el blanqueamiento del paciente o como fármaco de combinación.
En resumen, si bien la ACI no es habitualmente el fármaco antipsoriásico de primera línea para intentar el blanqueamiento en la psoriasis moderada y grave, sí debe tenerse en cuenta en la estrategia global del manejo de la psoriasis a largo plazo como tratamiento de mantenimiento para prevenir recidivas, ya que puede ser muy útil en casos concretos o en ciertas formas clínicas de psoriasis. El uso de ACI en psoriasis puede ser más engorroso que con otros fármacos, pero su correcto manejo hace que este fármaco tenga vigencia en la terapia antipsoriásica, incluso en la era de los tratamientos biológicos2,4. En la tabla 9 se hace un resumen del uso de la ACI en la psoriasis.
Uso de la acitretina en la psoriasis
| Indicaciones |
| Psoriasis pustulosa generalizada y palmoplantar |
| Eritrodermia psoriásica |
| Psoriasis vulgar (monoterapia, combinación, secuenciación) |
| Contraindicaciones |
| Absolutas: embarazo, alergia a componentes, insuficiencia hepática o renal grave |
| Relativas: insuficiencia renal o hepática, síndrome metabólico |
| Mecanismo de acción |
| Transducción genética mediante activación de receptores nucleares específicos |
| Acción sobre la queratinización, proliferación e inflamación celular |
| Regulación inmunológica |
| Farmacología |
| Vida media de 50h (su metabolito 13-cis-ACI 90h; etretinato 120d) |
| No se acumula en tejidos |
| Excreción renal y fecal a través de la bilis |
| Se convierte en etretinato por reesterificación (acelerado por el alcohol) |
| Eficacia |
| Respuesta lenta |
| Valorar consecución objetivo terapéutico a los 3-6 meses |
| Corto plazo (12 semanas): mejoría PASI 50 (el 80%)/mejoría PASI 75 (el 52%) |
| Largo plazo (12 meses): mejoría PASI 50 (el 89%)/mejoría PASI 75 (el 78%) |
| Dosificación |
| La dosis inicial de ACI se sitúa entre los 10 y 25mg/d |
| Aumentar la dosis escalonadamente cada 2 semanas (signo guía: aparición de quelitis/xerosis) |
| La dosis óptima se sitúa entre los 25 y 50mg/d |
| Una vez conseguida la respuesta clínica buscada, valorar reducir dosis de forma escalonada, hasta llegar a una dosis mínima eficaz, que se podrá mantener por largos periodos (10-25mg/24h; 25mg/48h) |
| Toxicidad |
| Grave: teratogenicidad, hepatotoxicidad, dislipemia (riesgo CV) |
| Leve: mucositis, xerosis, alopecia, descamación laminar, mialgias, fotosensibilidad, epistaxis, paroniquia, náuseas, dolor abdominal, piel «pegajosa» (ver tabla 3) |
| Seguridad |
| Hacer correcta elección y cribado de paciente |
| Información y educación del paciente |
| Utilizar dosis en rango terapéutico |
| Ajuste personal de dosis según aparición de efectos adversos |
| Estrategias |
| Monoterapia |
| Combinación |
| Secuenciación (ahorradora de ciclosporina) |
| Combinaciones |
| ACI+fototerapia |
| ACI+metotrexato |
| ACI+biológico |
| ACI+calcipotriol tópico |
| Cribado y seguimiento |
| Examen físico y anamnesis basal |
| Excluir embarazo (mujer fértil) |
| Despistaje contraindicaciones/comorbilidades basal y periódica |
| Chequear listado de medicamentos que tome el paciente |
| Analítica basal y secuencial protocolizada (ver ficha de seguimiento, a modo de ejemplo) |
CV:cardiovascular.
Los autores no reconocen ningún conflicto de interés en relación con la confección de la presente guía. Sin embargo, todos los participantes en la misma han tenido y/o tienen diverso grado de relación con la industria farmacéutica y han recibido remuneración económica por colaboración en conferencias, investigación en ensayos clínicos o asesoría científica a la misma en relación con otros fármacos antipsoriásicos.