El acantoma reticulado con diferenciación sebácea (RASD) es un tumor anexial benigno descrito por primera vez por Ackerman et al. en 19981-3. La frecuencia de aparición se desconoce y suele presentarse en la séptima década de la vida, con un leve predominio masculino y una localización preferente en el tronco, la cabeza y el cuello3. Clínicamente se presenta como unas pápulas o unas placas amarillentas, parduzcas o rojizas4,5. A la dermatoscopia suele observarse un patrón multicomponente con unas estructuras curvilíneas amarillentas y brillantes que se anastomosan, o unas estructuras amarillentas bien delimitadas, con o sin líneas reticulares de pigmento, líneas reticulares blanquecinas y vasos atípicos4,5. Histológicamente se observa una lesión tumoral epitelial benigna caracterizada por una proliferación de queratinocitos con un aspecto de predominio escamoso o con focos más basaloides, que hacen fusión de la red de crestas asociadas a sebocitos maduros2-4.
Es discutida la asociación de las lesiones tumorales cutáneas sebáceas con el cáncer colorrectal hereditario conocido como síndrome de Muir Torre (SMT), sin embargo, los tumores sebáceos se desarrollan en el 5% de los pacientes con un síndrome de Lynch (SL)6-8.
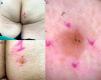
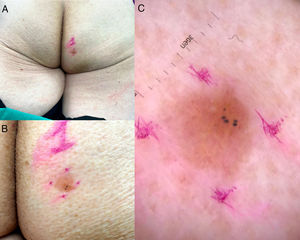
Una mujer de 83 años presentó un RASD de localización glútea y sin relación con SMT, que fue detectado durante un seguimiento rutinario por otro motivo. La lesión fue descrita como una placa eritematosa descamativa de bordes bien definidos (fig. 1 A y B), con vasos glomeruloides a la dermatoscopia y una impresión diagnóstica de enfermedad de Bowen (fig. 1C).
A y B) Placa amarillenta eritematosa levemente descamativa, con zona hiperpigmentada en su segmento inferior, bordes bien definidos, de 9×8mm en la región glútea derecha. C) Dermatoscopia. Se observa una lesión de fondo rosa, con algunos vasos puntiformes y glomeruloides, haces amarillos brillantes anastomosados, puntos blancos y amarillos y glóbulos azul-grisáceos.
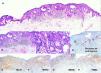
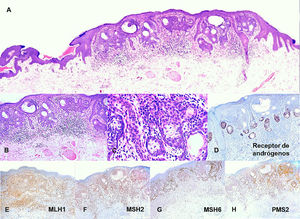
En el estudio histológico de una biopsia se observó una lesión tumoral epitelial anexial, caracterizada por una proliferación de queratinocitos eosinofílicos con algunos focos de aspecto basaloide (fig. 2A), asociados con grupos de sebocitos en la base de los cordones epiteliales anastomosados (fig. 2 B y C). Este último hallazgo se observaba mucho mejor con la tinción inmunohistoquímica para receptores de andrógenos (fig. 2D). En la dermis papilar se apreciaban algunos vasos de apariencia reactiva sin atipia, con un escaso infiltrado inflamatorio mononuclear perivascular superficial. No se observaron criterios de malignidad. Se realizaron estudios de inmunohistoquímica para las proteínas relacionadas con la reparación del ADN con una expresión nuclear intacta para MLH1, MSH2, MSH6 y PMS2 (fig. 2 E-H).
Acantoma reticulado con diferenciación sebácea. A) Microfotografía (H-E 4X). Lesión neoplásica de aspecto epitelial anexial caracterizada por una proliferación de queratinocitos eosinofílicos predominantes. B) Microfotografía (H-E 10X). Pequeños focos de aspecto más basaloides anastomosados. C) Microfotografía (H-E 40X). Presencia de grupos de sebocitos en la base de los cordones epiteliales anastomosados. D) Microfotografía (10X). Inmunohistoquímica para receptores de andrógenos en la que resalta el componente sebáceo. E) Microfotografía (10X). Inmunohistoquímica para MLH1 con patrón nuclear intacto. F) Microfotografía (10X). Inmunohistoquímica para MSH2 con patrón nuclear intacto. G) Microfotografía (10X). Inmunohistoquímica para MSH6 conpatrón nuclear intacto. H) Microfotografía (10X). Inmunohistoquímica para PMS2 con patrón nuclear intacto.
Los RASD son unos tumores benignos originados de los anejos cutáneos, de un crecimiento lento, de carácter esporádico y, en general, solitarios2,3,9.
Su sospecha es infrecuente en la clínica, por lo que el diagnóstico suele hacerse de forma tardía2. Por su manifestación clínica se asemejan a lesiones cutáneas benignas y malignas y los principales diagnósticos diferenciales clínicos incluyen la queratosis seborreica, el adenoma sebáceo, la enfermedad de Bowen y el carcinoma basocelular, entre otros2-4. Los síntomas están en relación con el tamaño aunque suelen ser asintomáticos. La correlación clínica y los hallazgos en la dermatoscopia pueden orientar el diagnóstico, sin embargo, el estudio histopatológico lo confirma5,6.
El hallazgo dermatoscópico más característico es la presencia de zonas amarillentas bien delimitadas, o de haces amarillentos anastomosados que corresponden, desde el punto de vista histológico, al acúmulo de sebocitos en la parte inferior de los lóbulos tumorales y las hiperpigmentaciones reticulares, que, también en lo histológico, son unos queratinocitos cargados de melanina4,5.
Histológicamente consiste en una lesión epitelial caracterizada por la proliferación de queratinocitos con elongación de la red de crestas epidérmicas con un patrón anastomótico, asociado con glándulas sebáceas y unas estructuras ductales sebáceas maduras en la capa basal2-4. Dentro de la dermis papilar se identificaban vasos capilares poco dilatados asociados a infiltrado mononuclear leve2-4. Dentro de los diagnósticos diferenciales histológicos se encuentran los siguientes: la queratosis seborreica, que se distingue del RASD por la ausencia de componente sebáceo en los cordones reticulares; el poroma ecrino, el cual presenta una proliferación de células poroides y cuticulares y se diferencia del RASD por la presencia ductos, además la diferenciación sebácea es focal y poco frecuente en los poromas; la verruga vulgar contrasta con el RASD por la presencia de los cambios citopáticos virales y la ausencia de componente sebáceo; por último, se ha de tener en cuenta el diagnóstico de nevus sebáceo, que difiere del RASD por la proliferación epitelial papilomatosa, además del incremento en el componente sebáceo, ecrino y apocrino, que exceden a los observados en el RASD.
Se concluyó el diagnóstico de RASD de acuerdo con los hallazgos clínicos, dermatoscópicos e histopatológicos característicos.
El primer caso publicado como RASD fue asociado a SMT, que se caracteriza por la presencia de neoplasias sebáceas y cánceres asociados a SL (colon, endometrio, urotelio, sistema nervioso central, entre otros)6-8. Son enfermedades causadas por mutaciones o, menos comúnmente, por la hipermetilación de los genes de reparación de errores de emparejamiento del ADN (MLH1, MSH2, MSH6 y PMS2)6,7. La incidencia de SL/SMT en pacientes con tumores sebáceos varía entre el 14 y el 50%, de los que el adenoma sebáceo es el asociado con más frecuencia6-8.
Los estudios de inmunohistoquímica se han implementado con el fin de abordar los casos de SL/SMT. Tienen una sensibilidad del 81-85% y una especificidad del 48%6,7 y muestran una pérdida de la expresión de al menos una de las proteínas de reparación del ADN6,7,10. Además, se ha propuesto un algoritmo de riesgo de SMT a través de la Escala de Mayo7,8.
Resulta relevante resaltar que unos resultados inmunohistoquímicos anormales no son diagnósticos del SL y deben interpretarse en asociación con los antecedentes familiares y las pruebas genéticas6,7,10.
En resumen, hemos descrito un caso de RASD sin asociación con MTS, una neoplasia sebácea relativamente rara, y sus hallazgos histopatológicos diagnósticos. Esta lesión debe diferenciarse de tumores epiteliales de morfología similar, incluyendo queratosis seborreica, poroma ecrino, nevus sebáceo y otras lesiones sebáceas o con diferenciación sebácea. Al ser asociada con MTS es importante contar siempre con la historia clínica completa, aplicar la Escala de Mayo y estudios de inmunohistoquímica con el fin de detectar factores de riesgo para tumores malignos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.