El tumor de células granulares (TCG) suele desarrollarse en la piel o en la mucosa oral, pero se ha descrito en muchos otros órganos. Suele ser único, pero puede ser múltiple y asociarse a otras enfermedades.
ObjetivosAnalizar las características clínicas de nuestros pacientes con TCG en la piel y la mucosa oral y su posible asociación con otras afecciones.
Material y métodosEstudio retrospectivo de los pacientes con TCG diagnosticados entre 1995-2019. Se revisaron las historias clínicas para obtener los siguientes datos: edad, sexo, localización, número de lesiones, diámetro, tiempo de evolución, diagnóstico clínico de sospecha, estado de los márgenes de resección, desarrollo de recidiva, tiempo de seguimiento y enfermedades asociadas.
ResultadosOchenta y un pacientes presentaron 89 TCG en la piel y la mucosa oral (43 mujeres/38 varones, edad media 40,21años). El diámetro medio fue de 1,34cm. Contabilizando los tumores extracutáneos 5 de los 81 pacientes presentaban TCG múltiple (6,2%). La edad media de los pacientes con TCG múltiple fue significativamente inferior a la de los pacientes con un único tumor (p=0,004). Solamente un paciente presentó recidiva local y ninguno desarrolló metástasis a distancia. No hemos detectado ningún caso asociado a otras enfermedades.
ConclusionesLa mayoría de TCG son benignos, y a pesar de tener los márgenes afectados no suelen presentar recidivas locales. Sin embargo, hay que tener en cuenta la posibilidad de presentar TCG múltiples, tanto en la piel y en la mucosa oral como en órganos internos, especialmente en pacientes jóvenes.
Although a granular cell tumor (GCT) usually develops on the skin or oral mucosa, it has been described in many other organs. GCT typically presents as a solitary tumor, but multiple lesions can occur. It has also been described in association with other diseases.
ObjectivesTo describe the clinical characteristics of cutaneous and oral mucosal GCTs and explore potential associations with other diseases.
Material and methodsRetrospective study of patients diagnosed with GCT at our hospital between 1995 and 2019. The following information was collected from the patients’ medical records: age, sex, number of GCTs, location, diameter, time to diagnosis, tentative clinical diagnosis, surgical margin status, recurrence, follow-up time, and associated diseases.
ResultsWe detected 89 cutaneous or oral mucosal GCTs in 81 patients (43 women, 38 men) with a mean age of 40.21 years. The mean tumor diameter was 1.34cm. Five of the 81 patients (6.2%) had multiple GCTs, including noncutaneous tumors. Patients with multiple GCTs were on average younger than those with a single tumor (P=.004). There was only a single case of local recurrence and no cases of distant metastasis. None of the patients had associated diseases.
ConclusionsMost GCTs are benign and local recurrence is uncommon, even in patients with positive margins. Nevertheless, the possibility of multiple tumors affecting the skin, oral mucosa, or internal organs should be borne in mind, especially in young patients.
El tumor de células granulares (TCG) es un tumor poco frecuente que fue descrito por Abrikossoff en 19261. La mayoría de casos se desarrollan en la mucosa oral, la piel y el tejido subcutáneo, pero se ha descrito en muchos otros órganos2. Su variante maligna es muy poco frecuente3. Suelen ser tumores únicos, pero en ocasiones pueden ser múltiples y en los últimos años se han descrito algunos casos asociados a síndrome de Noonan y neurofibromatosis4. Nuestro objetivo fue revisar las características clínicas de nuestros pacientes con TCG localizados en la piel y en la mucosa oral y su posible asociación con otras afecciones.
Material y métodosFueron incluidos en el estudio todos los casos codificados como TCG localizados en la piel, la mucosa oral en la base de datos del Servicio de Anatomía Patológica de nuestro hospital entre 1995 y 2019. Se trata de un Hospital Universitario con 800 camas que proporciona asistencia a una población de aproximadamente 1.000.000 de personas. Se revisaron retrospectivamente las historias clínicas de los pacientes para recoger los siguientes datos: la edad al diagnóstico del TCG o del primero de ellos en casos con lesiones múltiples, el sexo, la localización de las lesiones, el número de lesiones, el diámetro del tumor, el tiempo de evolución al diagnóstico y el diagnóstico clínico de sospecha. También se registró si la extirpación fue completa o con márgenes afectados, el desarrollo de recidiva, la asociación a neurofibromatosis u otras rasopatías y el tiempo de seguimiento. Asimismo se recogieron los casos codificados como TCG en la base de datos del Servicio de Anatomía Patológica localizados en cualquier otro órgano durante el mismo periodo.
Los datos obtenidos fueron analizados con el paquete estadístico SPSS 17.0 para Windows. Las variables categóricas se compararon mediante la prueba exacta de Fisher. Las variables continuas se compararon mediante la prueba «t» de Student cuando se confirmó la normalidad de la distribución de datos. De lo contrario, se realizó la prueba U de Mann-Whitney. La significación estadística se estableció para un valor de p<0,05. Se realizaron comparaciones de los parámetros evaluados según el sexo de los pacientes, y se compararon las características de los pacientes con lesiones únicas frente a los que presentaban lesiones múltiples.
ResultadosOchenta y un pacientes presentaron 89 TCG localizados en la piel y la mucosa oral (43 mujeres/38 varones). La edad de los pacientes al diagnóstico del primer TCG osciló entre los 14 y los 75 años, con una edad media de 40,21 años (DE 14,982). El tiempo de evolución del primer TCG osciló entre 1 y 120 meses (media de 19,02 meses, DE 25,527) y su diámetro medio fue de 1,34cm (DE 0,7255).
Setenta y ocho pacientes presentaron una única lesión cutaneomucosa y 3 pacientes lesiones múltiples en la piel y la mucosa oral (un paciente 2 lesiones, un paciente 4 lesiones y otro paciente 5 lesiones). La tabla 1 muestra la localización del total de los 89 tumores diagnosticados en la piel y la mucosa oral y la localización del primer TCG cutaneomucoso en cada paciente (81 tumores). Las lesiones estaban induradas al tacto en 34 casos y en 6 pacientes los tumores eran dolorosos (7,4%). Los diagnósticos clínicos más frecuentes fueron fibroma-histiocitoma (17 casos), quiste (14 casos), lipoma (4 casos) y TCG (4 casos). En el mismo periodo se diagnosticaron 43 TCG extracutaneos en el servicio de anatomía patológica (tabla 2). Uno de los pacientes con lesiones múltiples en la piel o la mucosa oral presentaba también lesiones extracutáneas en la mama y otros 2 pacientes con una única lesión en la piel o la mucosa oral presentaban también lesiones extracutáneas (laringe y mama). Contabilizando también los tumores extracutáneos 5 de los 81 pacientes presentaban TCG múltiple (6,2%) (tabla 3). La edad media de los pacientes con TCG múltiple en el momento del diagnóstico del primer TCG cutáneo-mucoso fue de 21,60 años (DE 8,532) frente a 41,43 años (DE 14,524) para los pacientes con un único TCG en la piel o la mucosa oral (p=0,004).
Localización de los tumores de células granulares (TCG) de la piel y la mucosa oral
| 89 TCG | 81 TCG (1.° de cada paciente) | |
|---|---|---|
| Mucosa oral | 32 (36%), lengua 29 (33%) | 28 (35%), lengua 26 (32%) |
| Piel de cabeza y cuello | 7 (8%) | 5 (6%) |
| Tronco | 24 (27%) | 23 (28%) |
| Extremidades sup. | 13 (15%) | 13 (16%) |
| Extremidades inf. | 8 (9%) | 8 (10%) |
| Genital-perianal | 5 (6%) | 4 (5%) |
Localización de los 43 tumores de células granulares extracutáneos (3 de ellos presentaron también tumores en la piel o la mucosa oral)
| Mujeres 25 | Varones 18 | |
|---|---|---|
| Mama 13 | 12 | 1 |
| Esófago 12 | 7 | 5 |
| Intestino 6 (5 colon, 1 duodeno) | 2 | 4 |
| Bronquio-tráquea 6 | 2 | 4 |
| Cuerda vocal 2 | 0 | 2 |
| Supraselar 2 | 1 | 1 |
| Vía biliar 1 | 1 | 0 |
| Mediastino 1 | 0 | 1 |
Aunque a uno de nuestros pacientes le habían sido extirpados 2 neurofibromas cutáneos, no hemos detectado ningún caso asociado a neurofibromatosis u otras rasopatías.
La extirpación del TCG de la piel y la mucosa oral fue completa en 39 de los 59 casos, de los cuales disponemos información sobre los márgenes de resección. El tiempo medio de seguimiento de estos 59 pacientes fue de 20,29 meses (rango 0-144 meses, DE 27,704). Solamente en un paciente se detectó una recidiva local.
El tiempo medio de seguimiento de los pacientes fue de 17,05 meses (rango 0-144, DE 27,731).
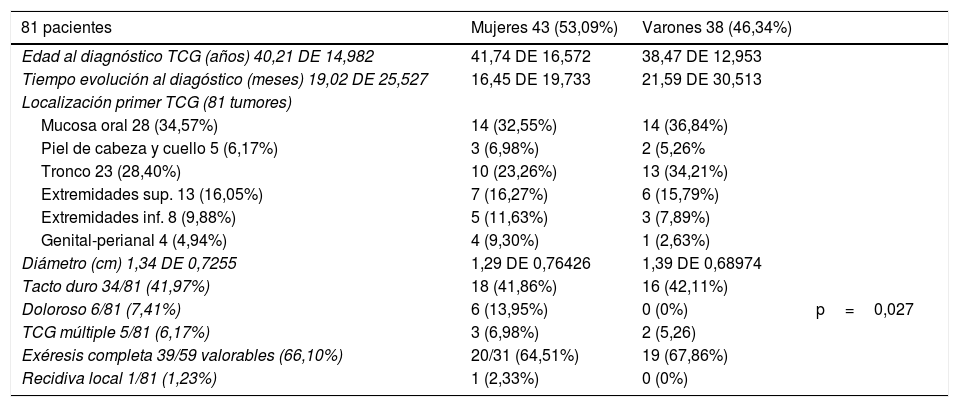
Al comparar las características clínicas de los 81 pacientes entre sexo masculino y femenino únicamente se detectaron diferencias estadísticamente significativas en la proporción de TCG dolorosos, que fueron más frecuentes en el sexo femenino (p=0,027) (tabla 4).
Características clínicas de los 81 pacientes según el sexo
| 81 pacientes | Mujeres 43 (53,09%) | Varones 38 (46,34%) | |
|---|---|---|---|
| Edad al diagnóstico TCG (años) 40,21 DE 14,982 | 41,74 DE 16,572 | 38,47 DE 12,953 | |
| Tiempo evolución al diagóstico (meses) 19,02 DE 25,527 | 16,45 DE 19,733 | 21,59 DE 30,513 | |
| Localización primer TCG (81 tumores) | |||
| Mucosa oral 28 (34,57%) | 14 (32,55%) | 14 (36,84%) | |
| Piel de cabeza y cuello 5 (6,17%) | 3 (6,98%) | 2 (5,26% | |
| Tronco 23 (28,40%) | 10 (23,26%) | 13 (34,21%) | |
| Extremidades sup. 13 (16,05%) | 7 (16,27%) | 6 (15,79%) | |
| Extremidades inf. 8 (9,88%) | 5 (11,63%) | 3 (7,89%) | |
| Genital-perianal 4 (4,94%) | 4 (9,30%) | 1 (2,63%) | |
| Diámetro (cm) 1,34 DE 0,7255 | 1,29 DE 0,76426 | 1,39 DE 0,68974 | |
| Tacto duro 34/81 (41,97%) | 18 (41,86%) | 16 (42,11%) | |
| Doloroso 6/81 (7,41%) | 6 (13,95%) | 0 (0%) | p=0,027 |
| TCG múltiple 5/81 (6,17%) | 3 (6,98%) | 2 (5,26) | |
| Exéresis completa 39/59 valorables (66,10%) | 20/31 (64,51%) | 19 (67,86%) | |
| Recidiva local 1/81 (1,23%) | 1 (2,33%) | 0 (0%) | |
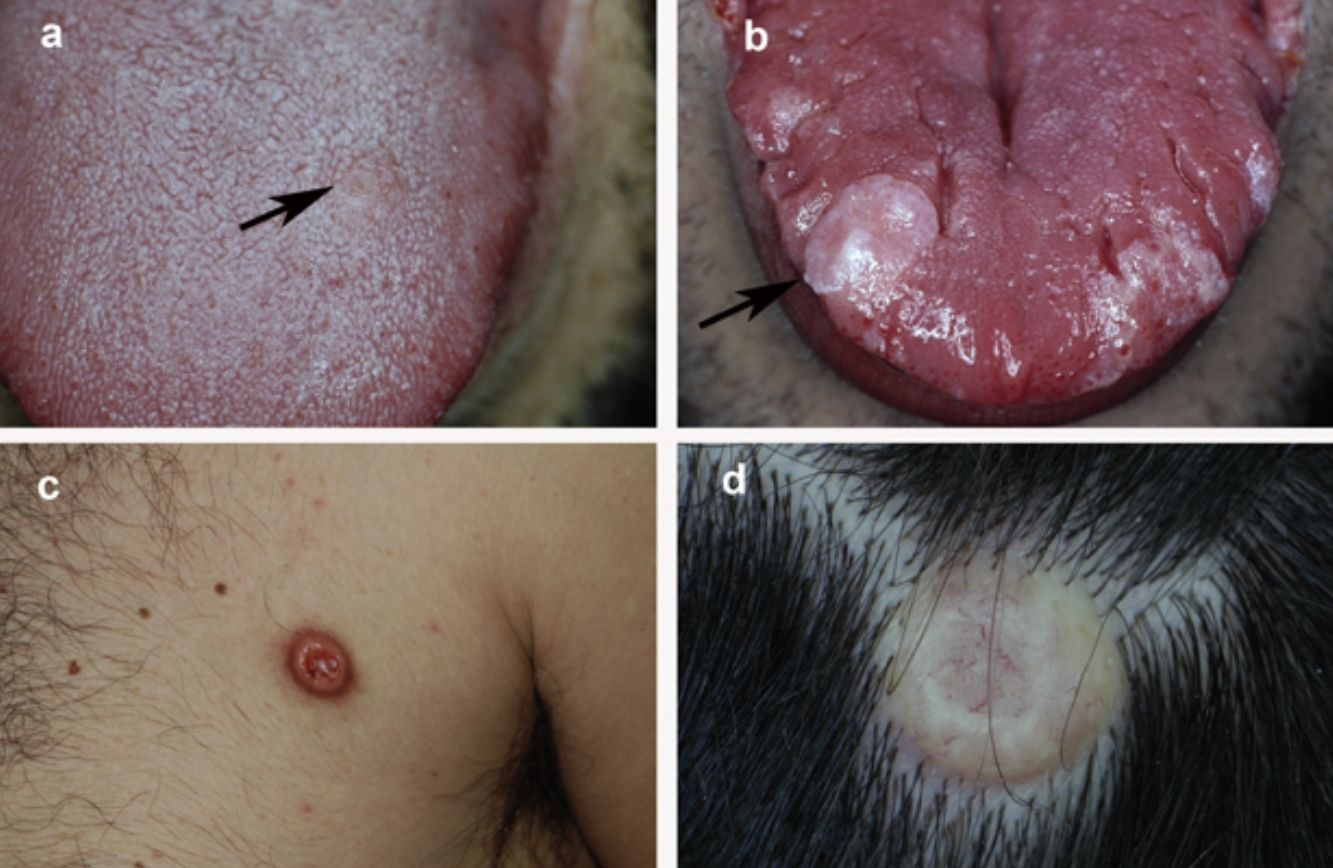
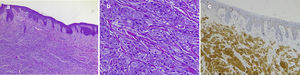
La figura 1 muestra el aspecto clínico de las lesiones en la lengua y el tronco. La figura 2 muestra la imagen histológica de un típico TCG.
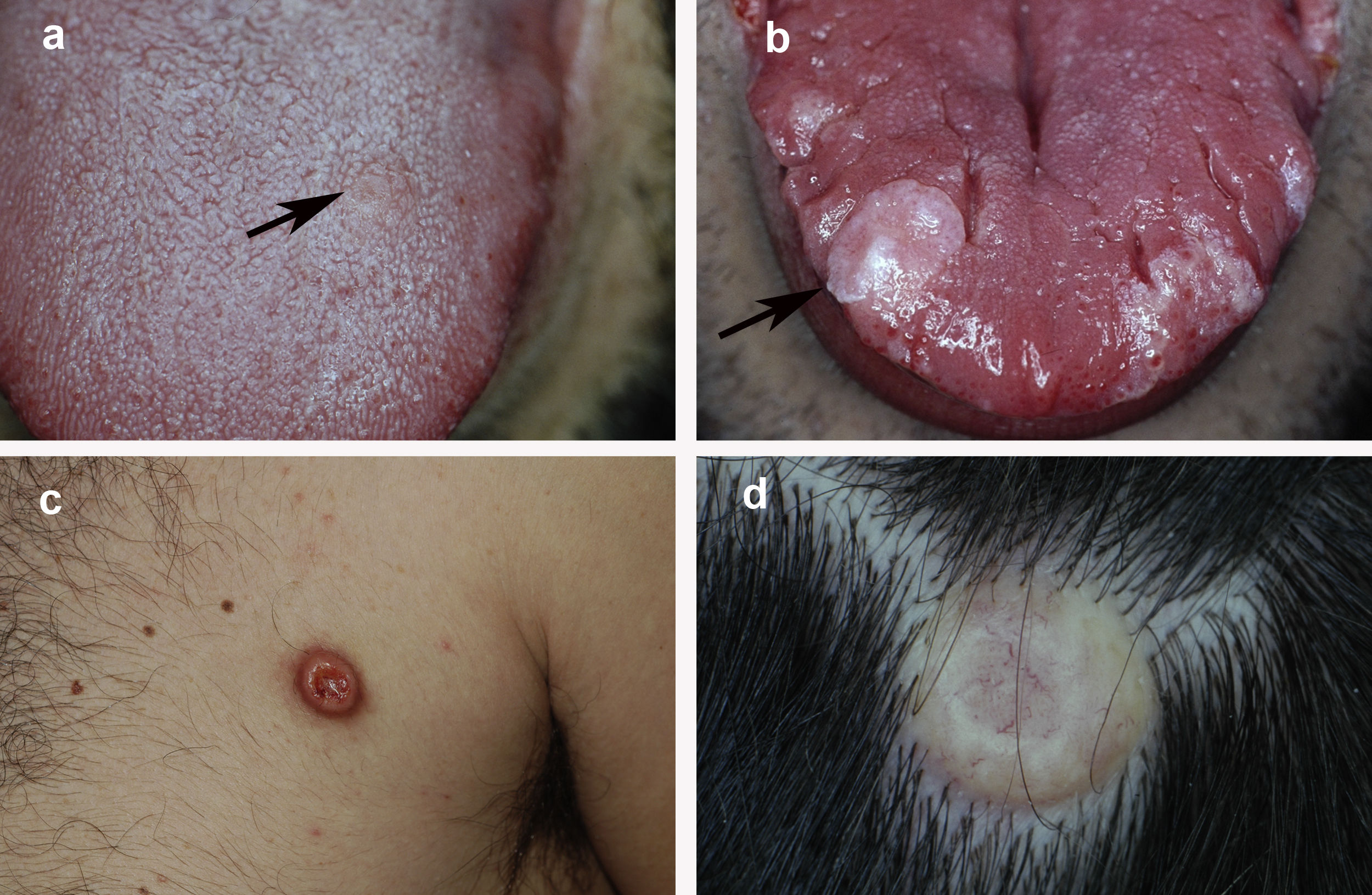
Aspecto clínico del TCG en 4 pacientes: a) lesión incipiente en la lengua de 5mm de diámetro; b) lesión nodular exofítica de mayor tamaño en la lengua, de coloración blanquecina debido a hiperplasia epitelial suprayacente; c) lesión nodular localizada en el tronco de coloración eritematosa; d) lesión nodular en el cuero cabelludo con coloración amarillenta y telangiectasias.
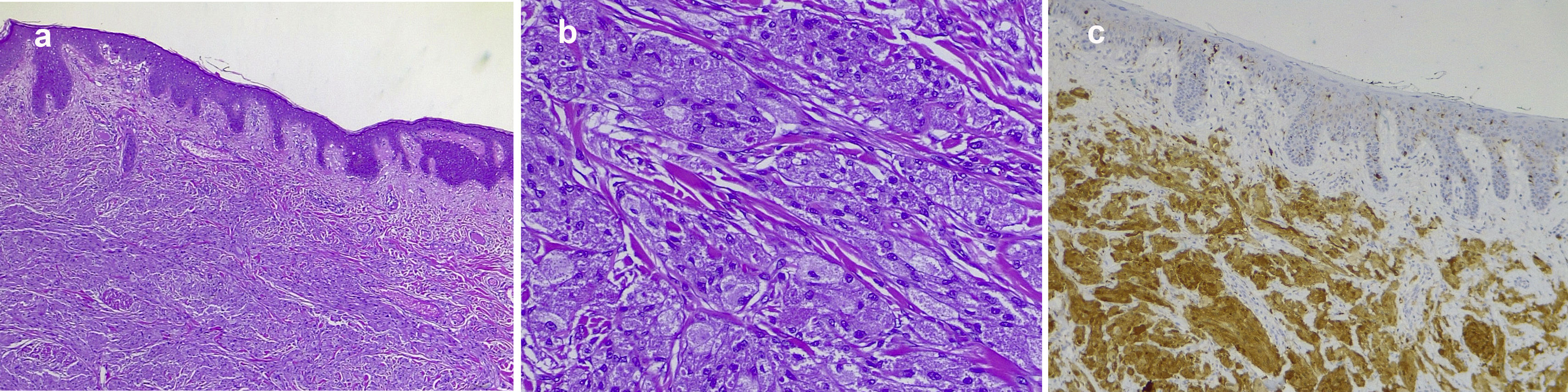
Imagen histológica típica de un TCG cutáneo: a) imagen a pequeño aumento donde se observa la proliferación dérmica de células con citoplasma granular y cierta hiperplasia epidérmica suprayacente (hematoxilina-eosina×40); b) imagen a gran aumento con un detalle de las células granulares (hematoxilina-eosina×200); c) tinción inmunohistoquímica positiva para S100 al nivel de las células granulares (tinción para proteína S100×100).
Varios linajes celulares han sido propuestos como posible origen del TCG. Inicialmente, en la época preinmunohistoquímica se consideró que las células del TCG correspondían a mioblastos, probablemente debido a que en los tumores de la lengua la infiltración entre los haces de músculo estriado dio la impresión de un origen muscular2,5. Posteriormente se propusieron otras estirpes celulares como posibles orígenes de la neoplasia, como los histiocitos, las células neuroendocrinas, los fibroblastos y las células mesenquimales indiferenciadas1. Aunque la histogénesis del TCG todavía está en debate, hoy en día existen múltiples evidencias morfológicas, inmunohistoquímicas y ultraestructurales en apoyo de un origen a partir de células de Schwann1.
Según la literatura el TCG suele desarrollarse entre la cuarta y sexta décadas de la vida, pero también puede aparecer en la edad infantil1,2. La proporción entre varones y mujeres varía según las series, y aunque algunos estudios sugieren que es más frecuente en mujeres1,4,6, otros detectan que es más común en el sexo masculino2,7,8. En una reciente revisión de casi 1.500 casos publicados, el 60,40% de casos corresponden a mujeres9. En nuestro estudio el TCG fue también algo más frecuente en mujeres (53%) y la edad media al diagnóstico del primer TCG fue de 40,21 años.
La localización más frecuente del TCG es la piel y la mucosa oral3,6. La localización en la lengua es especialmente frecuente3,4,6,7. En nuestra serie la lengua representa el 33% de tumores, seguida por el tronco y las extremidades (tabla 1). Según los libros de texto el TCG suele presentarse clínicamente como un tumor de crecimiento lento, redondeado, pero con márgenes bastante indefinidos, de entre 5 y 20mm de diámetro2,4. Puede presentar un aspecto verrugoso debido a la hiperplasia epidérmica2. En nuestros pacientes la característica clínica descrita con mayor frecuencia fue que se trataba de una lesión nodular de tacto duro (34 casos). Según la literatura, el color puede variar entre el color de la piel normal a color rosado o marrón grisáceo2. Curiosamente en 3 de nuestros pacientes se destacó en la historia clínica que presentaban una coloración amarillenta (fig. 1D), por lo que creemos que debería considerarse el TCG en el diagnóstico diferencial de lesiones nodulares amarillentas. Aunque los TCG dolorosos se consideran raros2,5, 6 de nuestros 81 pacientes presentaron tumores dolorosos (7,4%).
Como en otros estudios, el diagnóstico clínico de presunción más frecuente en nuestros pacientes fue el de fibroma-histiocitoma (17 casos)7. Otros diagnósticos propuestos con frecuencia fueron el de quiste (14 casos) y lipoma (4). El diagnóstico de TCG se sospechó en 4 de nuestros pacientes, todos ellos con lesiones localizadas en la lengua.
Aunque el TCG suele ser solitario, se han descrito pacientes con TCG múltiples en la piel y la mucosa oral y casos con TCG en la piel y la mucosa oral asociados a TCG en órganos internos2–4. La proporción de TCG múltiple varía mucho entre las series, entre el 4% y 30%3. Sin embargo, las series que detectan una mayor proporción de TCG múltiples corresponden a series antiguas con un número de casos limitado10. En el presente estudio, contabilizando los tumores en órganos internos, 5 de 81 pacientes (6,2%) presentaban lesiones múltiples (tabla 3), cifra similar a la observada en una reciente revisión de aproximadamente 1.500 casos publicados en la literatura (7,14%)9.
Los TCG múltiples se han descrito asociados a enfermedades como la neurofibromatosis y el linfoma Hodgkin3. También se han descrito TCG múltiples en la edad infantil asociados a lentiginosis, cardiopatía congénita, manchas café con leche, estenosis pulmonar y criptorquidia4. En los últimos años se han descrito varios casos de TCG múltiples en el síndrome de Noonan4,11, y curiosamente algunas de las anteriores asociaciones se encuentran actualmente clasificadas dentro de las rasopatías junto con el síndrome de Noonan, lo que puede indicar un vínculo patogénico común. Las rasopatías son un grupo de enfermedades de origen genético que se caracterizan por presentar una mutación que afecta a los genes que codifican las proteínas de la familia Ras, que desempeñan un importante papel en la proliferación y diferenciación celulares. Entre las entidades que se incluyen en este grupo se encuentran la neurofibromatosis tipo i, el síndrome de Noonan, el síndrome de Legius, el síndrome LEOPARD y el síndrome de Costello12. A uno de nuestros pacientes se le habían extirpado previamente 2 neurofibromas cutáneos, pero no tenía criterios diagnósticos de neurofibromatosis. Tampoco hemos detectado ningún caso asociado al síndrome de Noonan ni casos familiares, al igual que otro estudio en nuestro país7.
El TCG también puede localizarse con menor frecuencia en órganos internos2,4. Las localizaciones extracutáneas descritas incluyen: tejidos blandos, mama, tiroides, mediastino, tracto respiratorio (laringe, tráquea, pulmón), tracto gastrointestinal, árbol biliar y páncreas, ovario-testículo, sistema urinario, corazón y sistema nervioso central1. En nuestra serie destaca la mama como localización extracutánea más frecuente con 13 casos. En la mama el TCG típicamente se presenta como una lesión nodular palpable, indolora, que clínica y radiológicamente puede simular un carcinoma de mama13. Las pruebas de imagen pueden ser relativamente inespecíficas, pero típicamente se presenta como una masa espiculada o infiltrante en la mamografía, y como una masa irregular mal definida con sombra acústica posterior a la ecografía13. A pesar de que los TCG suelen ser benignos, es destacable por su potencial gravedad la localización en el sistema nervioso central, como en 2 de nuestros pacientes que presentaron TCG a nivel supraselar, lo cual representa el 4,7% de tumores extracutáneos en nuestra serie.
Histológicamente el TCG es un tumor no encapsulado formado por grandes células poliédricas con un pequeño núcleo central hipercromático y un citoplasma lleno de gránulos eosinofílicos debido a la acumulación citoplasmática de lisosomas secundarios2,3. Los gránulos citoplasmáticos son PAS positivos diastasa resistentes3. Los tumores dérmicos con frecuencia se extienden a la parte superficial de la hipodermis3. Las células tumorales a menudo muestran grandes gránulos eosinofílicos rodeados por un halo transparente, conocidos como cuerpos pústulo-ovoides de Milian2,3. En un estudio estos se observaron en el 47% de los tumores y sus autores consideran que su número se incrementa conforme aumenta la edad del tumor7. El epitelio suprayacente con frecuencia muestra hiperplasia pseudoepiteliomatosa prominente que puede ser confundida con un carcinoma escamoso si la biopsia es superficial2,3. Se detectó hiperplasia epidérmica suprayacente en el 58% de tumores de una serie7. La inmunohistoquímica es positiva para la proteína S100, el antígeno CD68, y la enolasa neuronal específica3. Algunos tumores pueden ser S100 negativos y se denominan TCG no neurales1,3. Recientemente se ha descrito que estos tumores sobreexpresan ALK y ciclina D1 y probablemente constituyan una entidad distinta14.
El TCG maligno es extremadamente raro. De hecho, algunos autores solamente aceptan un caso como maligno si ha producido metástasis3, y según este criterio comprenden menos del 2-2,5% de los TCG1,9,15. Fanburg-Smith et al.16 propusieron 6 criterios para clasificar los TCG en benigno, atípico o maligno: la presencia de necrosis, morfología fusocelular, núcleo vesiculoso con nucléolo prominente, más de 2 mitosis por 10 campos de gran aumento, índice núcleo-citoplasmático elevado y pleomorfismo celular. Los tumores que no presentan ningún criterio se consideran benignos, los que presentan uno o 2 criterios se consideran atípicos y los que presentan 3 o más se clasifican como malignos. Los tumores malignos crecen más rápidamente y tienen potencial para producir metástasis, especialmente a los ganglios linfáticos regionales, pulmones, hígado y huesos1. En un reciente estudio sobre 113 casos de TCG maligno la edad media de los pacientes fue de 49,2 años y la supervivencia a los 5 años fue del 62,8%17. En nuestro estudio no hemos detectado ningún caso de TCG maligno.
La extirpación simple es el tratamiento de elección del TCG benigno2. A pesar de ello, pueden producirse recidivas locales. Como es de esperar, las recidivas son más frecuentes en casos con márgenes quirúrgicos afectados, pero algunos estudios han detectado también recidivas locales en tumores extirpados con márgenes libres6. En nuestra serie en 20/59 casos de TCG en la piel y la mucosa oral de los que tenemos información sobre los márgenes quirúrgicos, la extirpación fue incompleta, y a pesar de ello solo hemos detectado una recidiva local.
ConclusionesComo en estudios previos, la localización más frecuente del TCG en nuestra serie es la mucosa oral (especialmente la lengua) y la piel, aunque puede producirse en órganos internos. Contabilizando también los TCG localizados en órganos internos, 5 de nuestros pacientes presentaron TCG múltiples (6,2%). Aunque se han descrito casos asociados a neurofibromatosis, síndrome de Noonan y otras rasopatías, consideramos que es una asociación poco frecuente en nuestra población, puesto que no la hemos observado en ninguno de nuestros pacientes. La mayoría de TCG son benignos, y a pesar de tener márgenes afectados no suelen presentar recidivas locales. Sin embargo, hay que tener en cuenta la posibilidad de presentar TCG múltiples tanto en la piel y la mucosa oral como en órganos internos. Los pacientes con tumores múltiples tienen menor edad en el momento del diagnóstico del primer TCG respecto a los pacientes con una única lesión, por lo que hay que tener en cuenta que en pacientes jóvenes la probabilidad de desarrollar lesiones múltiples es más elevada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.