La escabiosis es una parasitosis de elevada prevalencia en el mundo, con cerca de 200 millones de personas afectadas, y que puede ocasionar un gran impacto socioeconómico1,2. El diagnóstico clínico suele ser sencillo, pero en algunos casos la confirmación diagnóstica puede ser difícil. La dermatoscopia puede ser útil al identificar los surcos y el signo del ala delta (estructura triangular marronácea en el extremo de líneas blanquecinas onduladas) y guiar la obtención de la muestra para la citología (test de Muller). Recientemente se ha descrito la utilidad de la microscopia confocal de reflectancia in vivo (MCR) en el diagnóstico de la escabiosis y de diversas parasitosis3. A continuación presentamos un caso de escabiosis politratada en el cual la MCR confirmó la persistencia de la infestación.
Se trata de un varón de 26 años, heterosexual, con antecedente de infección por VIH en tratamiento antiviral de gran actividad con un buen control inmunológico (carga viral indetectable y 503 linfocitos CD4/μl), que consultó en el Servicio de Urgencias por un prurito de 4 meses de evolución. Con la sospecha clínica de escabiosis, basada en el predominio nocturno del prurito y la presencia de múltiples lesiones excoriadas en las muñecas, se indicó crema de permetrina al 5% y antihistamínicos orales, y posteriormente corticoides tópicos. El paciente aplicó el escabicida en 2 ocasiones, pese a lo cual persistió el prurito, por lo que fue remitido a Dermatología. En la exploración física se observaron múltiples surcos acarinos en las muñecas y manos. En la dermatoscopia se observó el signo del ala delta. Se realizó un raspado para citología en 2 surcos de la mano izquierda, que fue informada como negativa, sin evidencia del ácaro. Dada la alta sospecha clínica se realizó MCR (VivaScope® 3000) de los surcos de la mano derecha, observándose claramente el parásito (fig. 1), junto a escíbalos y ninfas; incluso se apreciaba en tiempo real el peristaltismo intestinal del parásito. Se indicaron baños de permanganato potásico 3/10.000/día debido a la presencia de lesiones exudativas, ivermectina 200μg/kg/dosis (18mg)×2 veces (día 0 y 10) y una nueva aplicación de permetrina crema al 5%. El prurito disminuyó paulatinamente a partir de la segunda semana, con una resolución completa del cuadro clínico en el control a las 3 semanas.
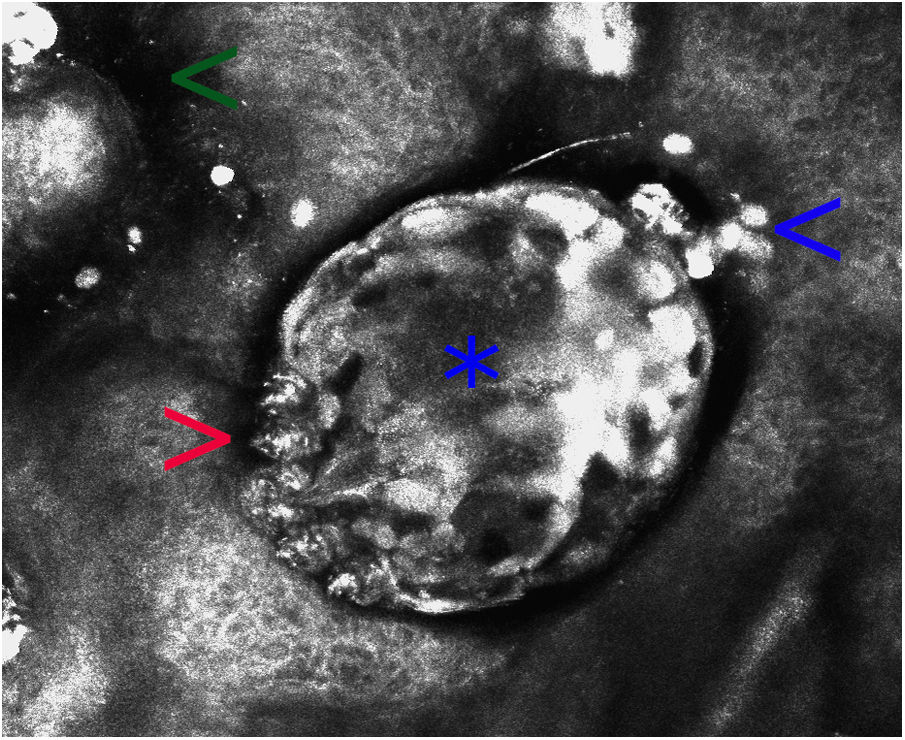
Microscopia confocal de reflectancia en escabiosis (campo de visión de 500×500μ). Estructura ovalada de refractabilidad heterogénea, que corresponde al cuerpo del Sarcoptes scabiei (asterisco). Se observan sus patas (flecha roja), estructuras ovoideas hiperrefráctiles de menor tamaño correspondientes a sus heces (flecha azul) y zonas hiporrefráctiles mal delimitadas que son parte del surco acarino (flecha verde). En esta imagen no se observan huevos ni ninfas.
El diagnóstico de escabiosis se basa en la clínica y en la demostración del parásito, escíbalos o huevos en la observación microscópica del raspado del surco acarino1. Sin embargo, la sensibilidad del test de Muller es baja. Los falsos negativos, como el caso presentado, no son infrecuentes y el procedimiento requiere experiencia y tiempo4. Recientemente, se han desarrollado diversas pruebas moleculares como la ELISA o la reacción de la polimerasa en cadena para la detección del Sarcoptes scabiei, con buenos resultados iniciales, pero aún no están disponibles comercialmente4,5. La MCR es una técnica diagnóstica novedosa en dermatología que permite el diagnóstico de afección tumoral, inflamatoria e infecciosa, con una alta sensibilidad y especificidad3. Es rápida, indolora y no requiere contraste, y permite una visión horizontal de las diversas capas de la piel, con resolución celular, sin dañar el tejido. Sus limitaciones son su restringida disponibilidad (elevado coste), la necesidad de especialización para su interpretación y la escasa penetración en la piel de alrededor de 200-300μ, que solo permite la observación hasta la dermis superficial. El S. scabiei se observa en la MCR como una imagen ovoide de refractabilidad heterogénea, en la que se pueden distinguir sus patas e incluso su tubo digestivo. Las heces (escíbalos) son hiperrefráctiles y los huevos y el surco acarino, hiporrefráctiles3. La MCR no solo permite confirmar la presencia del ácaro, también puede evaluar su viabilidad in vivo al observar su movilidad y el peristaltismo de su tubo digestivo, por lo que es útil en la monitorización de la respuesta terapéutica3,6. En estudios con MCR se ha estimado que en la sarna noruega el número de ácaros en la piel del huésped puede ascender a 15,8 millones, y el de huevos a 7,2 millones7. Otros parásitos fácilmente visualizables son el Demodex folliculorum, así como diversas micosis3.
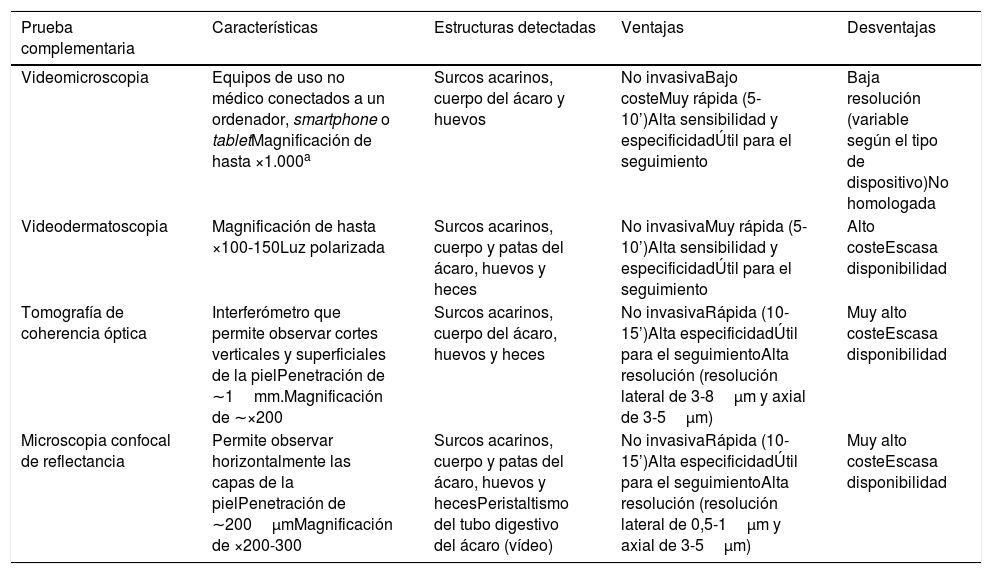
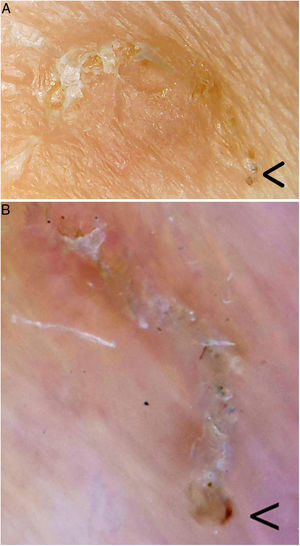
Otras técnicas de imagen de alta especificidad que han sido utilizadas recientemente en el diagnóstico de la escabiosis son la videodermatoscopia, la videomicroscopia y la tomografía de coherencia óptica (tabla 1). Son pruebas diagnósticas rápidas en las que tampoco se requiere una manipulación del tejido, con lo que disminuye el riesgo de contagio al personal sanitario. Entre sus limitaciones se encuentran su escasa disponibilidad en la actualidad y el alto coste de alguno de estos aparatos8. Una excepción es la videomicroscopia que se realiza con dispositivos de uso no médico, no homologados y utilizados en joyería, electrónica, bricolaje y entomología, entre otras. Utilizan en general luz no polarizada y se conectan vía USB o wifi a un ordenador, smartphone o tablet, ampliamente distribuidos para su venta en portales de Internet, con un precio de entre 20-50$. La videomicroscopia es una alternativa coste-efectiva y podría revolucionar el diagnóstico y seguimiento de los pacientes con escabiosis, especialmente en países en vías de desarrollo9. En nuestra consulta hemos utilizado uno de estos dispositivos (con un coste menor de 20€) para identificar los surcos acarinos, pudiendo observar la gran magnificación y resolución que ofrece, y que parece ser superior a la dermatoscopia (fig. 2).
Nuevas pruebas de imagen para el diagnóstico de la escabiosis
| Prueba complementaria | Características | Estructuras detectadas | Ventajas | Desventajas |
|---|---|---|---|---|
| Videomicroscopia | Equipos de uso no médico conectados a un ordenador, smartphone o tabletMagnificación de hasta ×1.000a | Surcos acarinos, cuerpo del ácaro y huevos | No invasivaBajo costeMuy rápida (5-10’)Alta sensibilidad y especificidadÚtil para el seguimiento | Baja resolución (variable según el tipo de dispositivo)No homologada |
| Videodermatoscopia | Magnificación de hasta ×100-150Luz polarizada | Surcos acarinos, cuerpo y patas del ácaro, huevos y heces | No invasivaMuy rápida (5-10’)Alta sensibilidad y especificidadÚtil para el seguimiento | Alto costeEscasa disponibilidad |
| Tomografía de coherencia óptica | Interferómetro que permite observar cortes verticales y superficiales de la pielPenetración de ∼1mm.Magnificación de ∼×200 | Surcos acarinos, cuerpo del ácaro, huevos y heces | No invasivaRápida (10-15’)Alta especificidadÚtil para el seguimientoAlta resolución (resolución lateral de 3-8μm y axial de 3-5μm) | Muy alto costeEscasa disponibilidad |
| Microscopia confocal de reflectancia | Permite observar horizontalmente las capas de la pielPenetración de ∼200μmMagnificación de ×200-300 | Surcos acarinos, cuerpo y patas del ácaro, huevos y hecesPeristaltismo del tubo digestivo del ácaro (vídeo) | No invasivaRápida (10-15’)Alta especificidadÚtil para el seguimientoAlta resolución (resolución lateral de 0,5-1μm y axial de 3-5μm) | Muy alto costeEscasa disponibilidad |
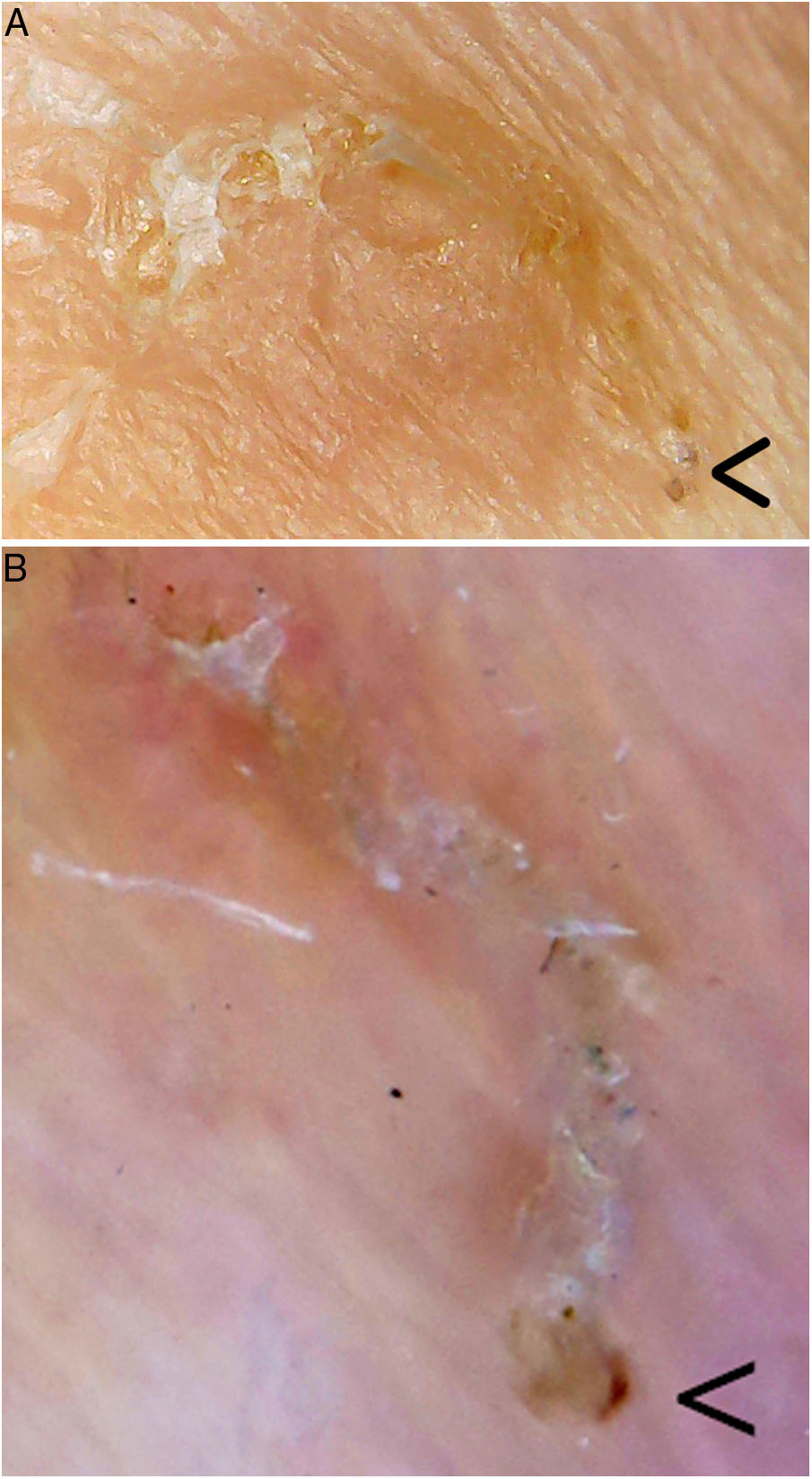
Surco acarino. En el extremo inferior derecho (flecha) se encontraría el parásito. A. Videomicroscopia (aproximadamente ×60-100 ?es difícil establecer la magnificación real, dado que es un dispositivo no homologado?, Jiusion 40-1000X). B. Dermatoscopia (×8, DermLite DL200, 3Gen). Se puede observar una mayor magnificación y resolución con la videomicroscopia.
Recientemente se han introducido diferentes herramientas de imagen que facilitan el diagnóstico de la escabiosis. La MCR es una técnica complementaria rápida, indolora, altamente sensible y específica que puede ayudar en el diagnóstico de casos atípicos o dudosos de esta parasitosis.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.