Esta es la segunda parte de una serie dedicada a la patología granulomatosa en la biopsia cutánea. Mientras que en la primera parte hablamos, entre otras, de algunas condiciones metabólicas y tumorales, esta segunda parte abordará fundamentalmente patología infecciosa de diversos tipos, junto con otras condiciones relativamente frecuentes en las consultas de dermatología.
Part 2 of this series on granulomatous diseases focuses on skin biopsy findings. Whereas the first part treated noninfectious conditions (metabolic disorders and tumors, among other conditions), this part mainly deals with various types of infectious disease along with other conditions seen fairly often by clinical dermatologists.
Los granulomas son uno de los hallazgos más frecuentes y variados en las biopsias de Dermatopatología, no solo por su morfología, sino también por su etiología y su significado clínico y pronóstico.
En esta revisión, conformada por dos artículos, hemos repasado las principales entidades asociadas a la presencia de granulomas en las biopsias cutáneas. En la primera parte se abordaron los distintos tipos de granulomas y células gigantes, así como algunas de las enfermedades más emblemáticas, tales como los granulomas por cuerpos extraños, algunas entidades de origen metabólico, neoplásico o autoinmune.
En el presente artículo se abordará un grupo adicional de entidades, entre las que se incluyen las de causa infecciosa.
Granuloma anularDefinición. El granuloma anular (GA) es una enfermedad cutánea granulomatosa relativamente frecuente, de etiología multifactorial y de naturaleza inmune, localizada o generalizada, que afecta a cualquier edad y que se asocia a enfermedades sistémicas. El GA cursa como un proceso inflamatorio crónico con tendencia lenta a la curación.
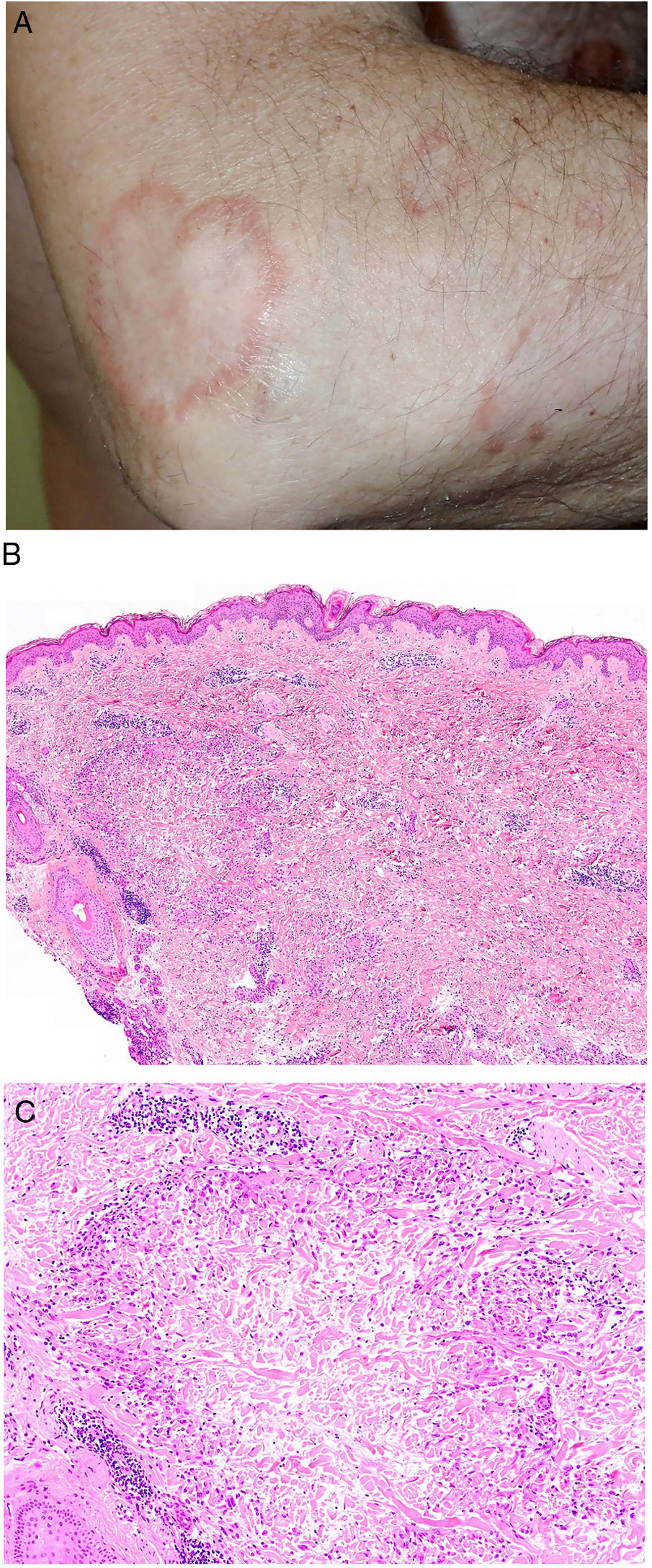
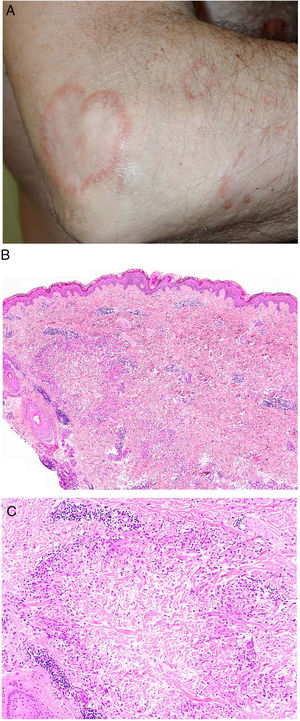
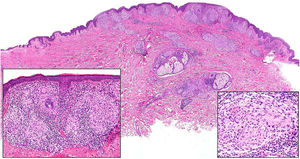
Clínica. El GA se presenta habitualmente como pápulas, placas eritematosas o nódulos de patrón anular, que surgen especialmente en las extremidades, de manera localizada o generalizada (fig. 1A)1. En ocasiones las lesiones adoptan un aspecto úlcero-perforante, de nódulos subcutáneos o lineal. La presentación localizada, y de manera especial la papulosa y la subcutánea, son más frecuentes en niños y jóvenes; en cambio, la presentación cutánea generalizada es más propia de adultos y ancianos. El GA generalizado puede asociarse a diversas enfermedades, entre las que cabe destacar la diabetes mellitus, la hiperlipemia, las enfermedades autoinmunes, la inmunodeficiencia, los procesos hematológicos y, en ocasiones, las neoplasias. No es inusual que en un mismo paciente afecto de GA las lesiones tengan diferente morfología.
A)Granuloma anular. Paciente que presenta en el brazo varias placas eritematosas anulares de borde ligeramente sobreelevado y aclaramiento central. B)Piel que muestra en la dermis reticular dos áreas de degeneración colagénica y de alteración del intersticio, delimitadas por una reacción inflamatoria dispuesta a modo de banda. La dermis superficial y la epidermis están preservadas. También se observan coronas linfocitarias perivasculares y un incremento difuso de la densidad fibroblástica (H&E ×40). C)Se aprecia una zona central de colágeno desorganizado acompañada de depósito de mucina ácida, que se halla rodeada por un infiltrado de macrófagos, células epitelioides dispuestas en empalizada, fibroblastos, linfocitos y ocasionales eosinófilos. Se reconocen densas coronas linfocitarias perivasculares sin fenómenos de vasculitis (H&E ×200).
Histopatología. El GA se caracteriza por el desarrollo, habitualmente en la dermis, de una o varias áreas de degeneración del colágeno, de contorno irregular, delimitadas por una reacción inflamatoria granulomatosa (fig. 1B)2. El infiltrado celular se compone de macrófagos dispuestos en empalizada, células epitelioides, fibroblastos, linfocitos y ocasionales eosinófilos, pero sin presencia de células plasmáticas. En la porción central de los granulomas se aprecia una matriz intersticial basófila, por depósito de mucina ácida, y/o colágeno hipereosinófilo. El depósito de mucina ácida puede ser escaso, por lo que es de utilidad la tinción de hierro coloidal para ponerlo de manifiesto. Además, se observan densas coronas linfocitarias perivasculares (fig. 1C). No se produce elastolisis ni, consecuentemente, granulomas elastolíticos. En la forma perforante, la intensa degeneración del colágeno da lugar a un tejido necrótico que es eliminado por los folículos pilosos. En los casos de disposición subcutánea, el GA puede simular el nódulo reumatoideo, del que se diferencia por la mucina. En raras ocasiones el GA puede adoptar un carácter sarcoideo. El GA es la consecuencia de una reacción inflamatoria autoinmunitaria, mediada por linfocitos CD4 de tipo Th1 y Th17, con la consiguiente activación macrofágica (tipo M2) y fibroblástica, lo que origina la síntesis de mucina ácida, metaloproteasas y citoquinas proinflamatorias, que alteran el intersticio y producen la degeneración descrita del colágeno. En ocasiones el GA se asocia a alteración de la inmunidad innata3.
Granuloma actínico y granuloma anular elastolítico de células gigantesDefinición. Los términos «granuloma actínico»4 y «granuloma anular elastolítico de células gigantes» (GAECG)5-7 se refieren a lesiones granulomatosas elastolíticas equivalentes, si no idénticas. El primer término se suele usar para las lesiones presentes en áreas fotoexpuestas con daño actínico importante, mientras que el segundo se emplea de dos formas: una restringida para lesiones similares al granuloma actínico pero localizadas en zonas no fotoexpuestas, y otra como un término genérico que engloba tanto al granuloma actínico como a las lesiones de áreas no fotoexpuestas. Además, dado que no siempre aparecen lesiones anulares, se ha recomendado la denominación de «granuloma elastolítico de células gigantes»5,8. No hay acuerdo sobre la propuesta de algunos autores de que el GAECG sea una variante fotoinducida del GA7.
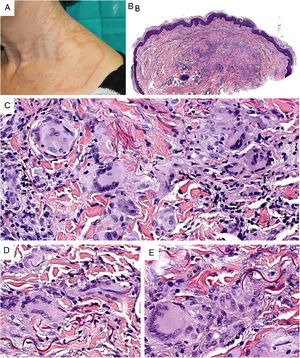
Clínica. Clínicamente aparecen en adultos de mediana edad, sin una clara preferencia de género5. El granuloma actínico comienza con pápulas que evolucionan generalmente hacia la confluencia, configurando lesiones anulares (fig. 2A). El GAECG se caracteriza por grandes placas anulares de bordes sobreelevados y centro atrófico, localizadas (según su aplicación restrictiva) en áreas no fotoexpuestas. Se han descrito variantes papulares (que no evolucionan a anulares), reticulares y generalizadas8. La evolución clínica es variable, ya que hay casos que se resuelven de forma espontánea, mientras que otros son resistentes al tratamiento (corticoides tópicos; pimecrolimus; crioterapia; UVA con psoraleno; cloroquina o hidroxicloroquina oral; corticoides, ciclosporina o clofazimina sistémicas; ácido fumárico; dapsona; tranilast o isotretinoína)8.
A)Granuloma actínico: grandes placas anulares de bordes sobreelevados eritematosos en área fotoexpuesta. B)La visión panorámica histológica muestra un infiltrado inflamatorio en dermis reticular. C-E)A mayor aumento se aprecia una lesión granulomatosa con numerosas células gigantes multinucleadas y elastofagocitosis, sin empalizada, aumento de mucina ni necrobiosis (B: H&E ×40; C y D: H&E ×400; E: H&E ×600).
Histopatología. Ambas entidades se caracterizan por lesiones granulomatosas dérmicas con presencia de células gigantes multinucleadas (mayoritariamente de tipo cuerpo extraño con gran cantidad de núcleos) y evidencia de elastofagocitosis multifocal (fig. 2B-E), sin que se observe generalmente depósito significativo de mucina, empalizadas o necrobiosis8. En algunos casos puede haber un predominio de histiocitos no multinucleados o incluso granulomas de tipo sarcoideo. Se ha descrito un patrón trizonal4,5, de forma que el componente de células gigantes se localiza típicamente en el borde sobreelevado eritematoso, alrededor del cual solo se observa elastosis sin componente inflamatorio, y la zona central atrófica se caracteriza por una marcada reducción o ausencia de fibras elásticas. Puede haber un componente linfocitario variable7.
Enfermedad de MorbihanDefinición. La enfermedad de Morbihan es una entidad rara de etiopatogenia desconocida descrita por el dermatólogo francés Robert Degos en 1957 en un granjero del departamento de Morbihan, en la región de Bretaña9. Entre otros hallazgos morfológicos puede exhibir granulomas perilinfáticos e intralinfáticos.
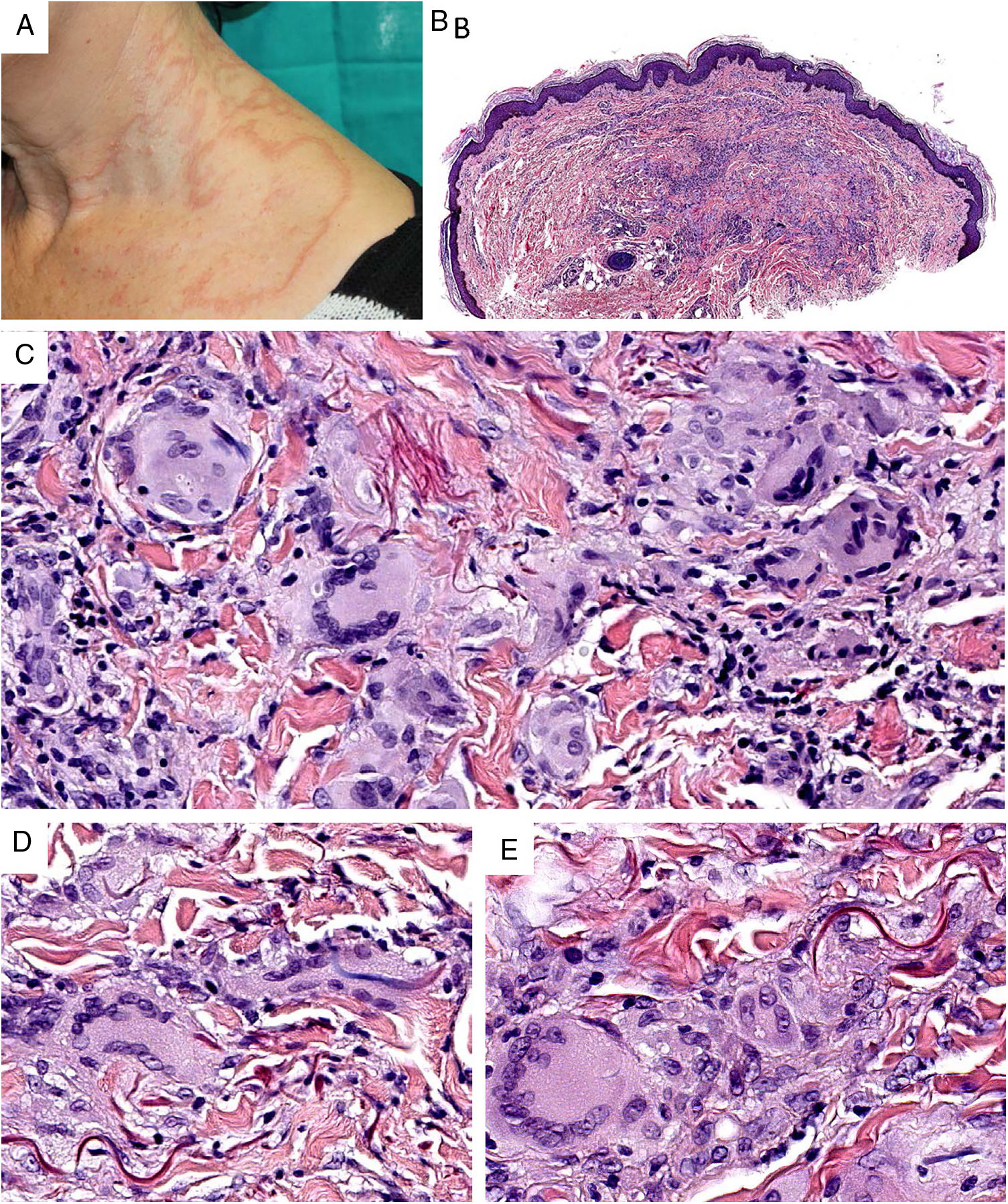
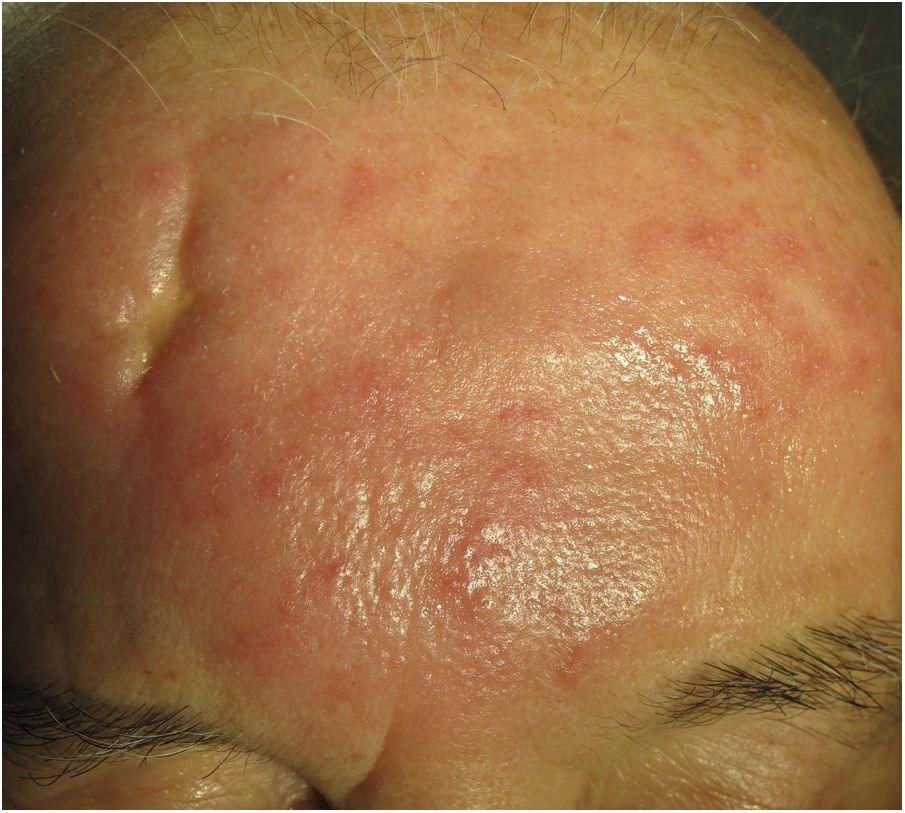
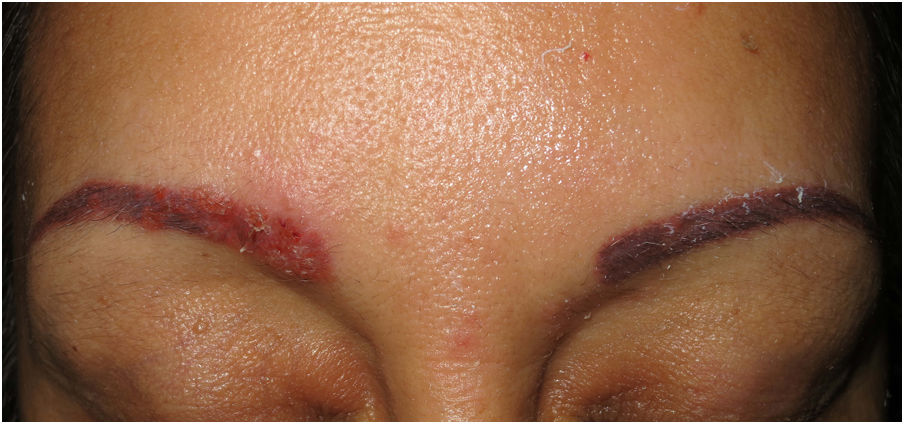
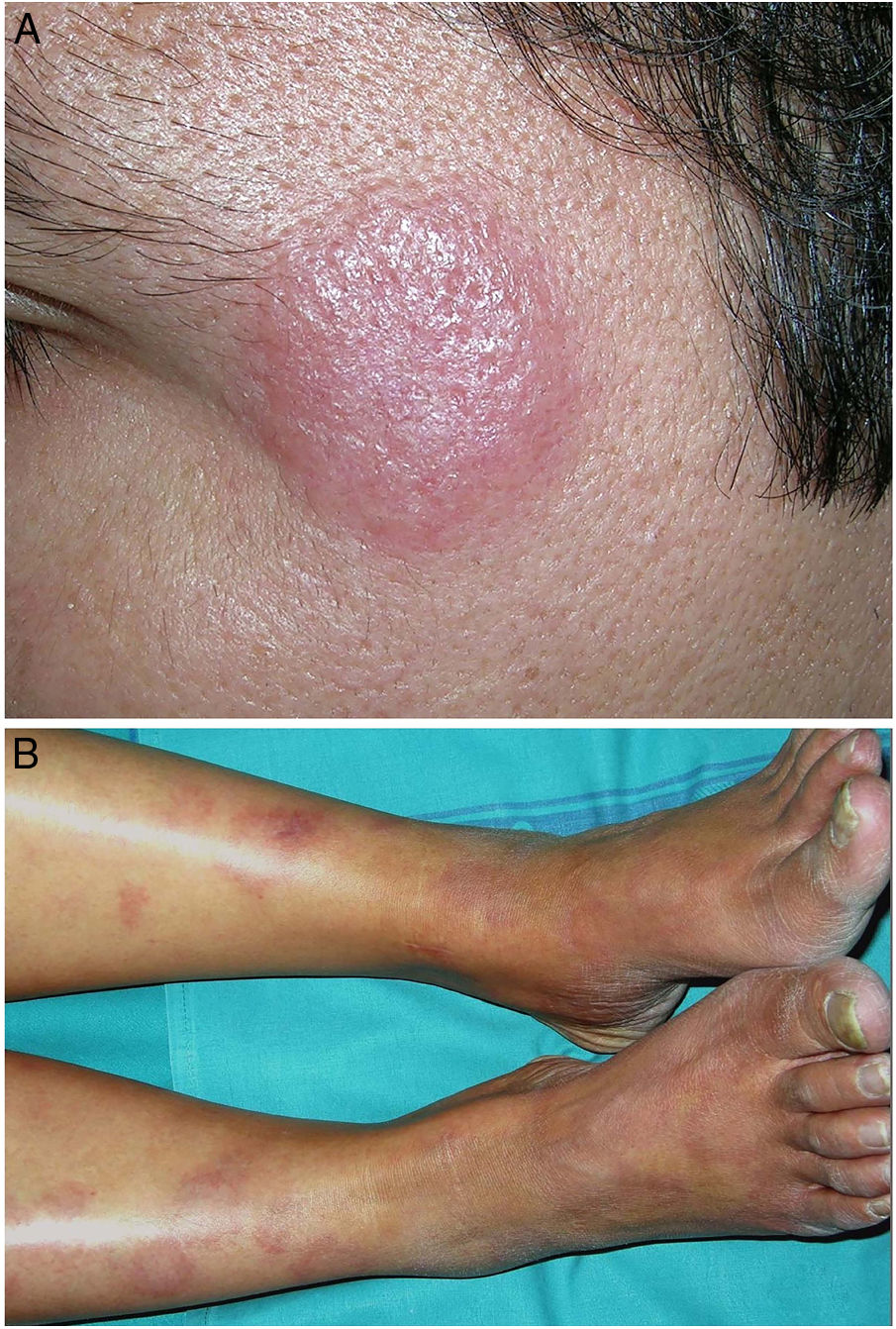
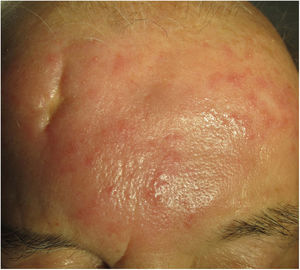
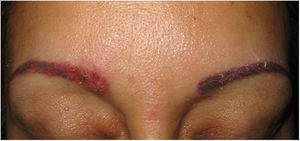
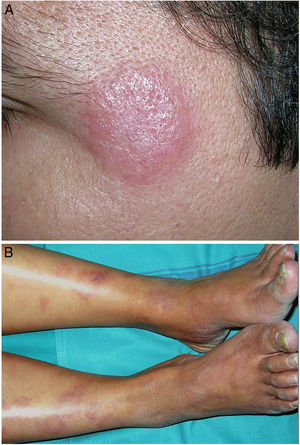
Clínica. Es más frecuente en varones entre 40 y 60años. Se asocia a rosácea en el 26% de los casos10, y excepcionalmente al lupus miliar diseminado de la cara11. Presenta un curso crónico y recurrente. Los pacientes exhiben eritema y edema sólido simétrico de los dos tercios superiores del rostro (frente, glabela, párpados, nariz y mentón) (fig. 3). Aunque generalmente es asintomática, puede producir trastornos derivados de aspectos estéticos, y en algunos casos alteraciones campimétricas en pacientes con edema periorbitario severo. Teniendo en cuenta que el diagnóstico de esta enfermedad es por exclusión, deben descartarse otras entidades, como lupus eritematoso, dermatomiositis o dermatitis actínica crónica.
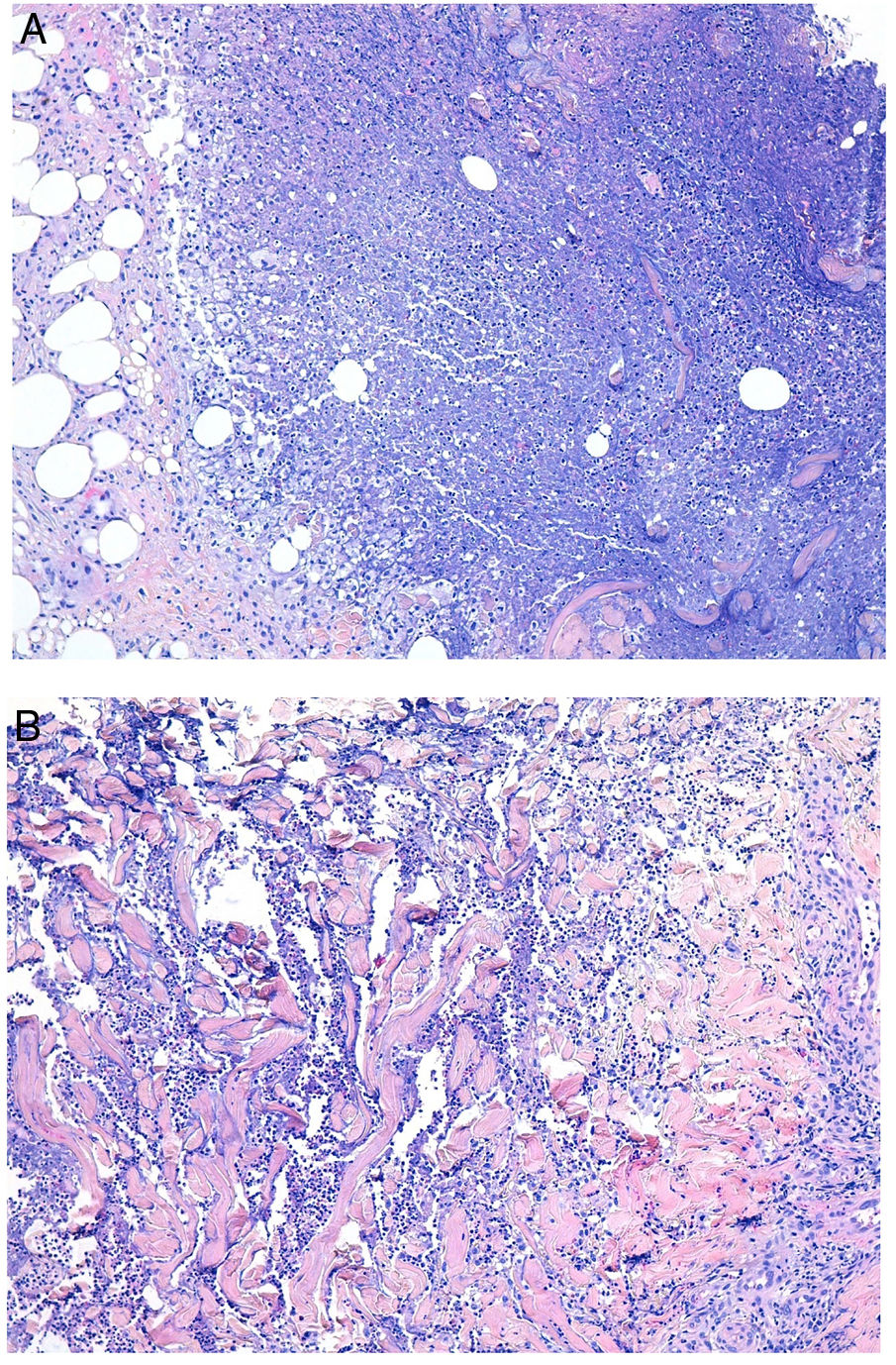
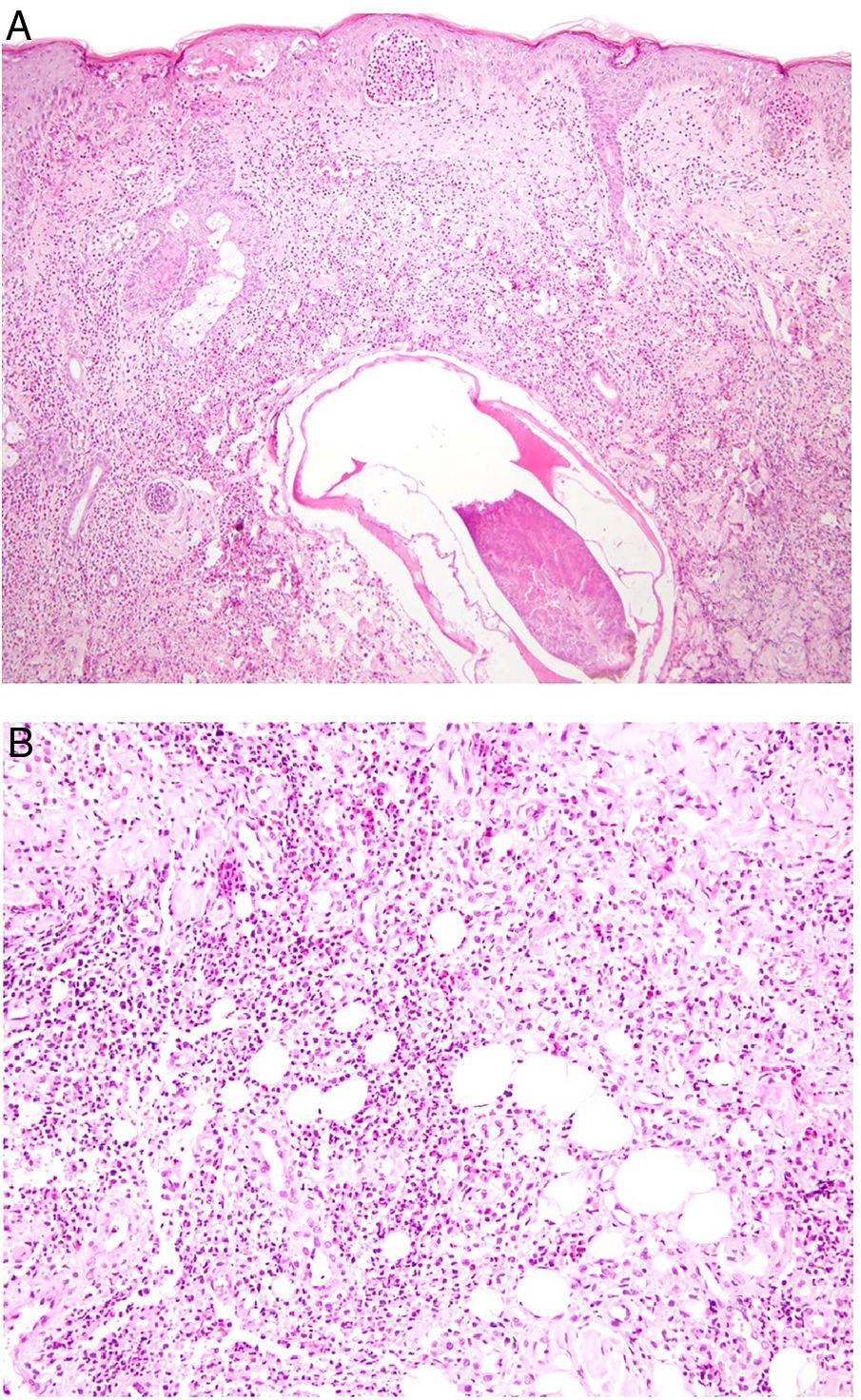
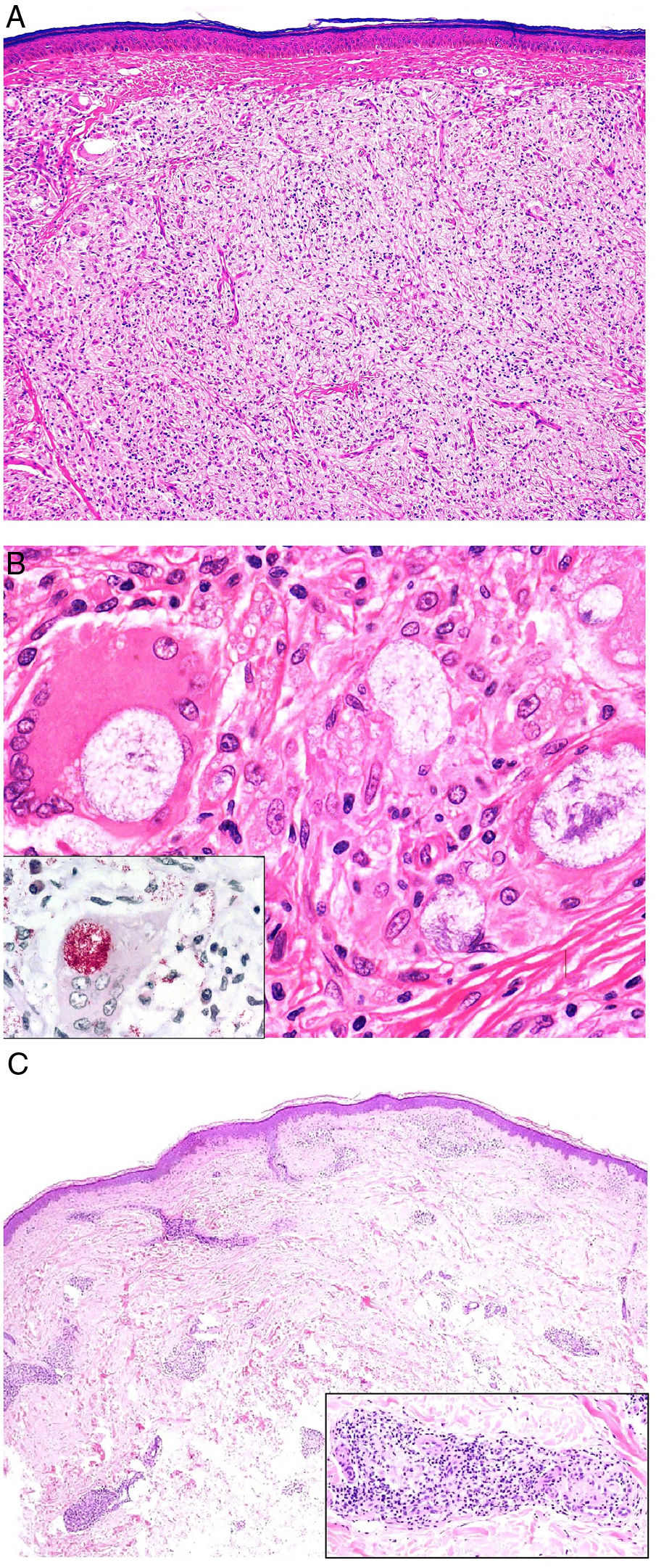
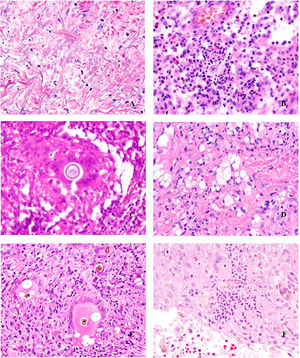
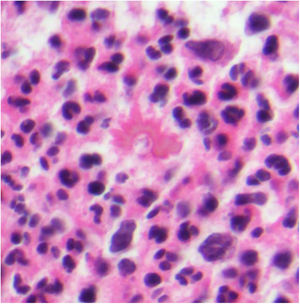
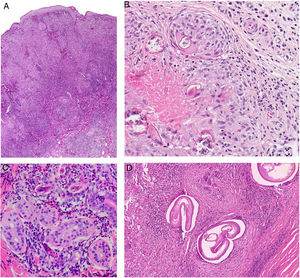
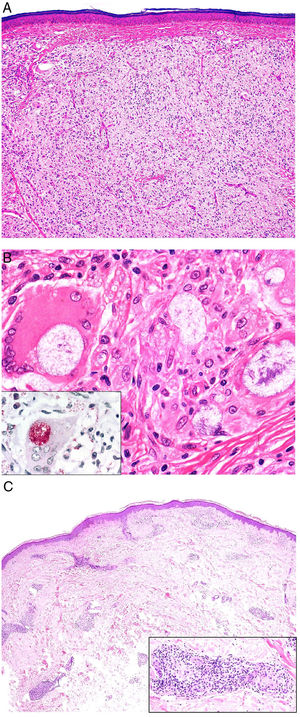
Histopatología. Los hallazgos morfológicos son bastante inespecíficos (fig. 4A), e incluyen: edema intersticial dérmico (fig. 4B), ectasia vascular, fibrosis perifolicular, infiltrado inflamatorio linfohistiocitario perivascular y perifolicular (fig. 4C) con presencia de neutrófilos (fig. 4D) y en algunos casos de mastocitos, hiperplasia de glándulas sebáceas y granulomas epitelioides mayoritariamente perilinfáticos e intralinfáticos12-14 y ocasionalmente perifoliculares. Esto obliga a establecer el diagnóstico diferencial con otros procesos granulomatosos más comunes: rosácea granulomatosa, lupus miliar diseminado de la cara, dermatitis perioral granulomatosa, granulomatosis anogenital, sarcoidosis y síndrome de Melkersson-Rosenthal. La mayor parte de ellos pueden ser descartados por la clínica y por criterios histológicos adicionales. Finalmente, aunque la etiopatogenia de la enfermedad de Morbihan no está dilucidada, se han apuntado algunas posibles causas: desequilibrio entre la producción y el drenaje linfático, alteración en la integridad de las paredes vasculares (capilares y linfáticos) asociada a la inflamación crónica o el impacto de los granulomas epitelioides perilinfáticos sobre la pared de los linfáticos dérmicos.
Enfermedad de Morbihan. A)Imagen panorámica en la que se observa edema dérmico con infiltrado inflamatorio perifolicular e intersticial (H&E ×20). B)Detalle del edema dérmico marcado junto con dilataciones vasculares (H&E ×100). C)Infiltrados linfohistiocitarios perivasculares (H&E ×200). D)Detalle de algunos polimorfonucleares neutrófilos en el infiltrado (H&E ×400).
Definición. La sarcoidosis es una enfermedad multisistémica de etiología desconocida caracterizada histológicamente por la presencia de granulomas sarcoideos no caseificantes en diversos órganos tales como pulmón, ganglios linfáticos, piel y bazo.
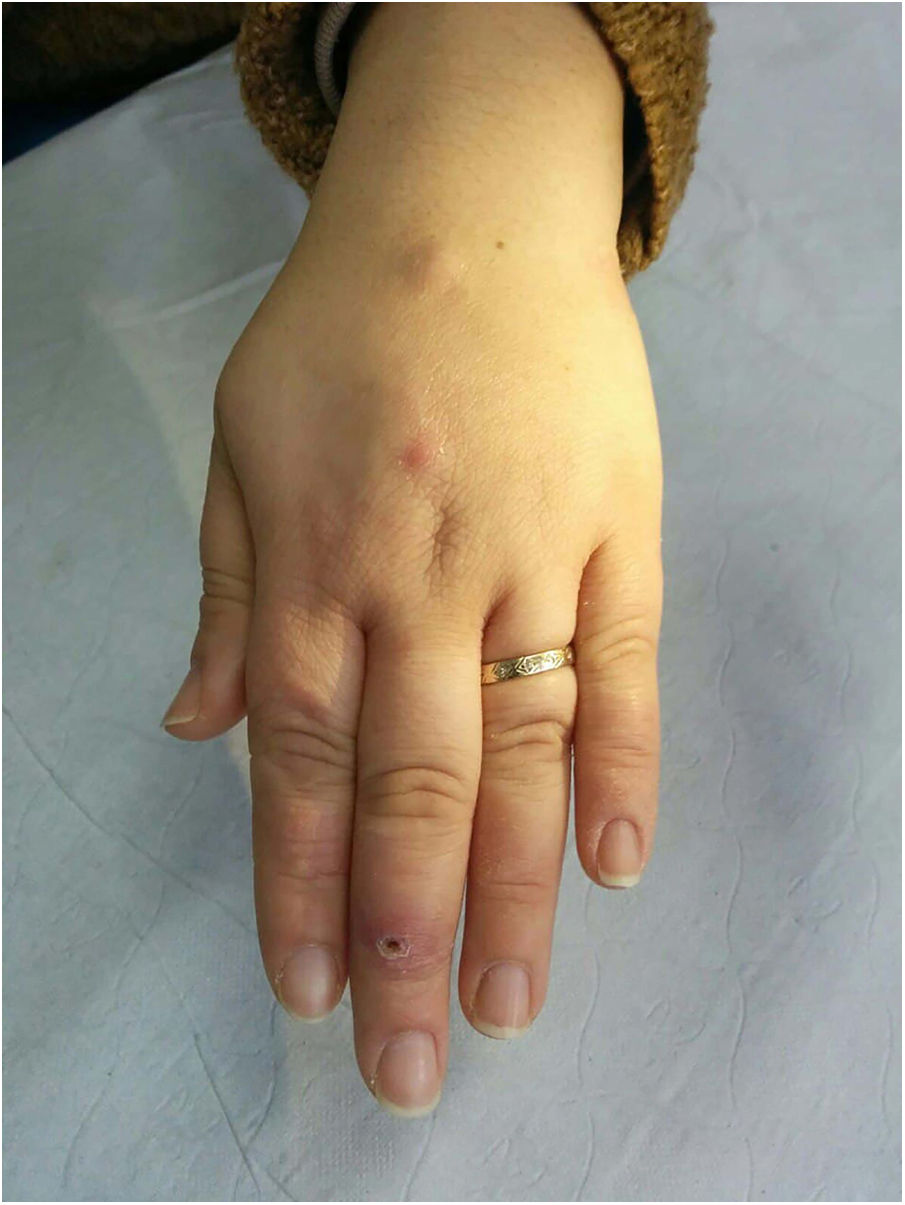
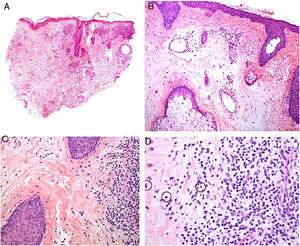
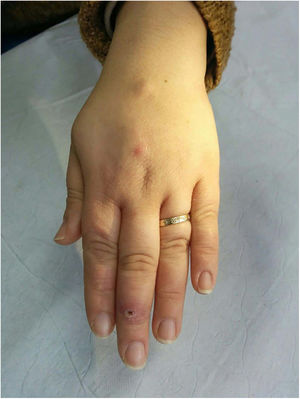
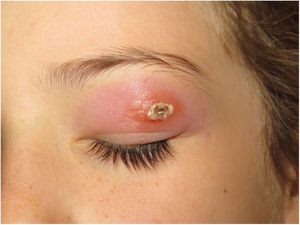
Clínica. Las lesiones cutáneas se clasifican en específicas e inespecíficas. Las específicas son las compuestas por granulomas; se caracterizan por una clínica muy variable y es muy frecuente la presencia de maculo-pápulas y placas de diversos tamaños y formas15. Ocasionalmente, las lesiones aparecen sobre cicatrices o zonas de trauma tales como tatuajes, cirugía, láser o venopunciones15 (fig. 5). La presencia de placas rojo-violáceas en la región centro facial se considera característica y se ha denominado lupus pernio. Las lesiones inespecíficas carecen de granulomas e incluyen el eritema nudoso, calcificaciones, prurigo y eritema multiforme, entre otras.
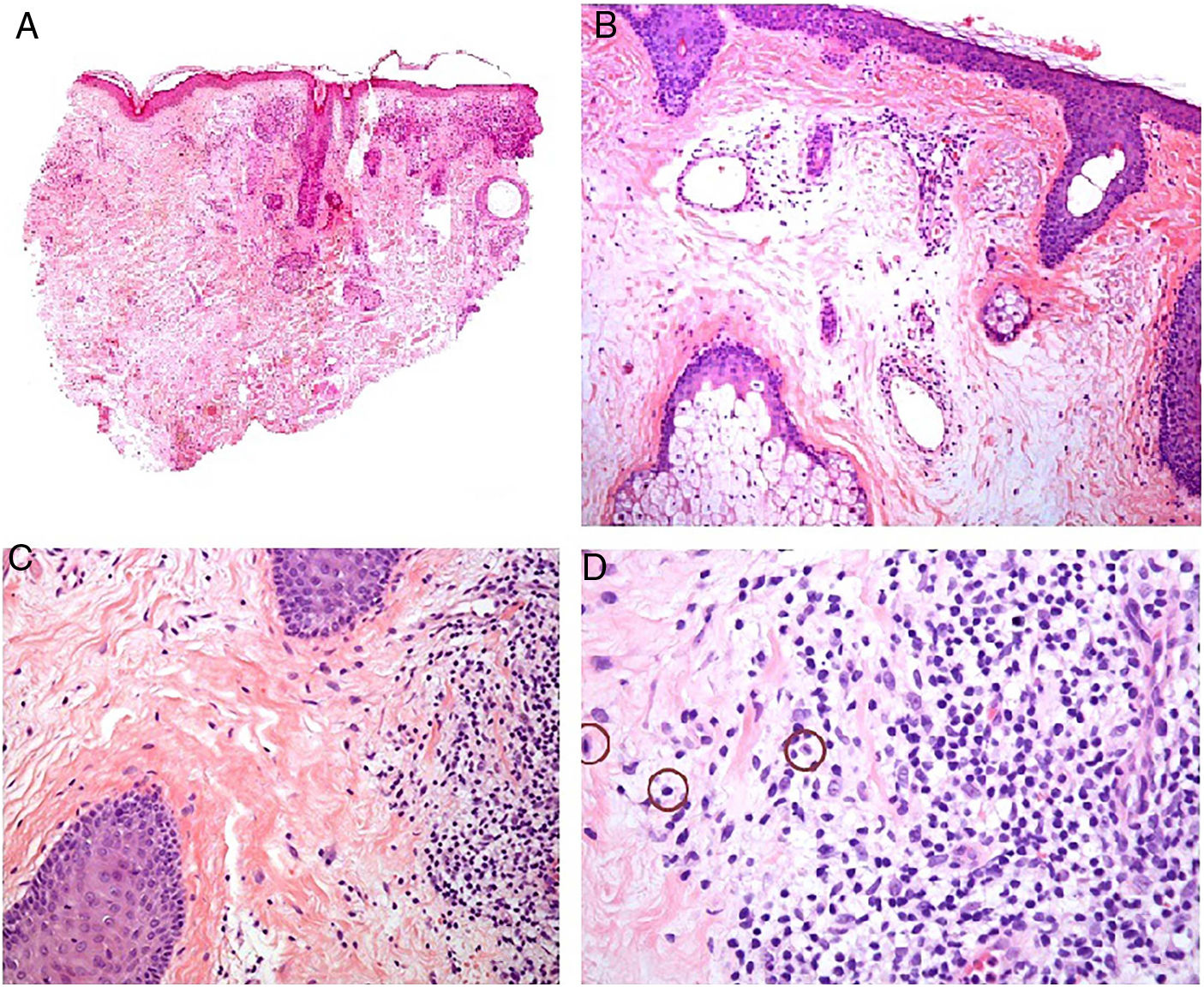
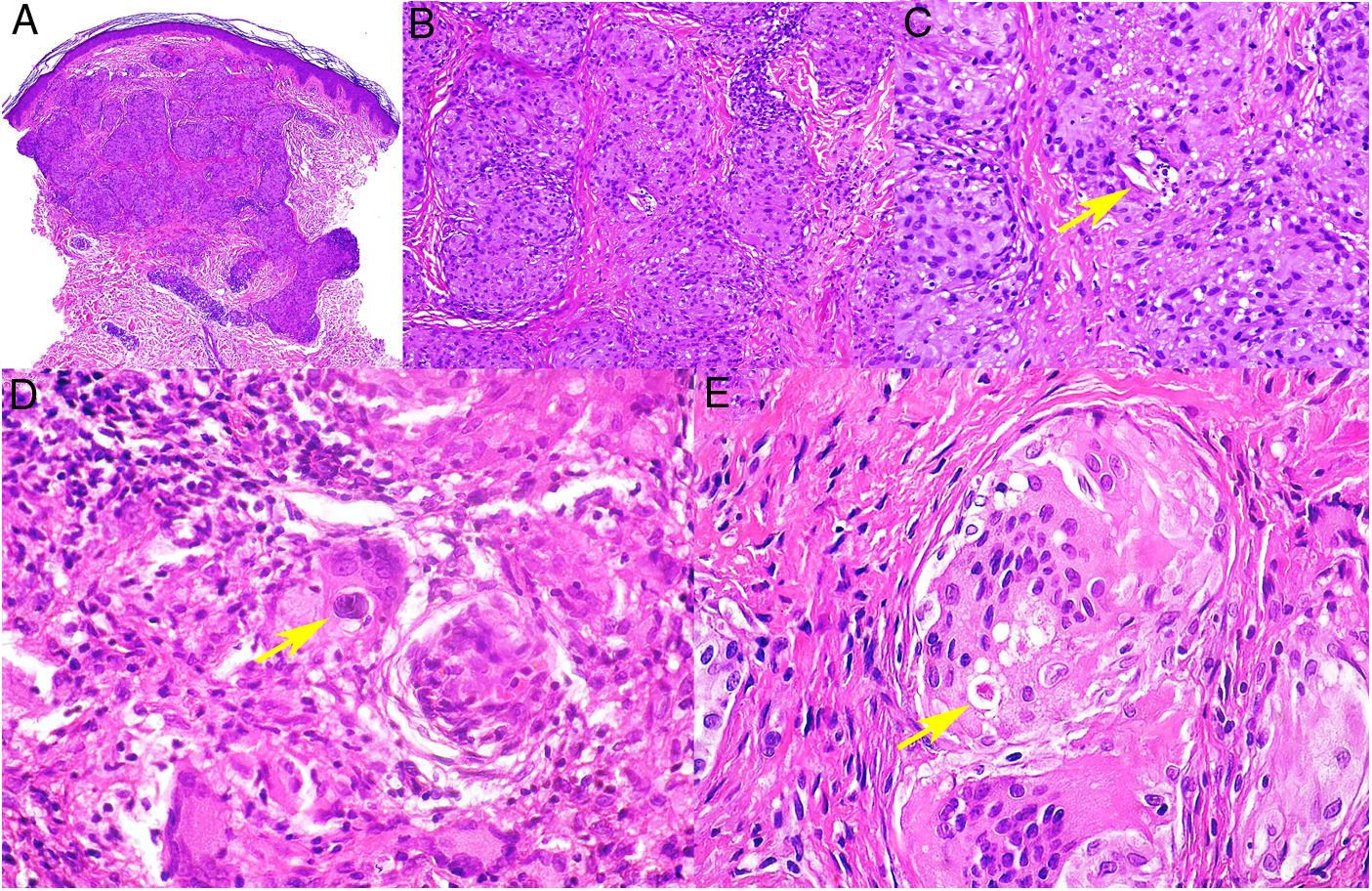
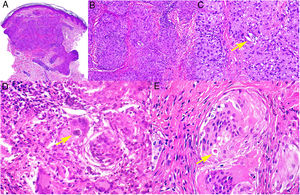
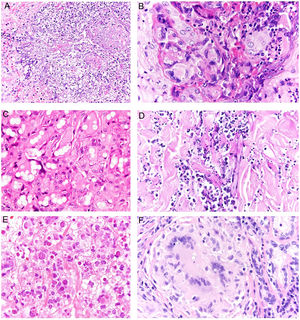
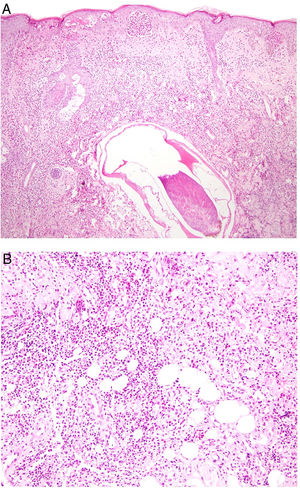
Histopatología. El hallazgo histológico más característico es la presencia de granulomas sarcoideos «desnudos», es decir, granulomas epitelioides no caseificantes rodeados de una escasa cantidad de linfocitos en la periferia (fig. 6A,B). Los granulomas suelen localizarse en la dermis reticular, con ocasional extensión al tejido celular subcutáneo. La epidermis puede ser normal o, menos frecuentemente, mostrar atrofia, hiperplasia o ulceración15-18. Otros hallazgos menos característicos son la presencia de granulomas perifoliculares y perineurales, granulomas tuberculoides, necrosis fibrinoide focal, mucina dérmica, daño liquenoide y vasculitis, entre otros16,17. Ocasionalmente se pueden observar inclusiones intracitoplasmáticas (cuerpos de Schaumann y cuerpos asteroides), que aunque características, no son específicas17,18. Los cuerpos de Schaumann son estructuras laminares concéntricas, basófilas, constituidas por calcio y proteínas (fig. 6D), y los cuerpos asteroides son estructuras radiales eosinófilas con forma de espícula que parecen estar formadas por filamentos del citoesqueleto (fig. 6E). No es infrecuente, además, encontrar cuerpos extraños, tales como partículas de sílice, en el interior de los granulomas16,18 (fig. 6E). Esto último ha dado lugar al concepto de granuloma por sílice, que se cree es fruto de una predisposición de los pacientes con sarcoidosis a formar granulomas en respuesta a partículas de sílice introducidas accidentalmente en la dermis19-21.
Sarcoidosis cutánea. A)Granulomas epitelioides que ocupan dermis superficial y media con escasos linfocitos en periferia (H&E ×20). B)Granulomas epitelioides compuestos por células con abundante citoplasma eosinófilo (H&E ×100). C)Partícula de sílice (flecha) en un granuloma sarcoideo (H&E ×200). D)Cuerpo de Schaumann (flecha) (H&E ×400). E)Cuerpo asteroide (H&E ×2.400).
Definición. La dermatitis granulomatosa intersticial y neutrofílica en empalizada es una entidad, o más bien un patrón histológico reactivo, asociada generalmente a procesos sistémicos, mayoritariamente autoinmunes.
Clínica. Con un curso autolimitado, comienza con lesiones eritematosas de patrón anular y pápulo-nodular o en placas3,22,23, con distribución simétrica, principalmente en la superficie extensora de extremidades y tronco3,24. Asocia comorbilidades como artralgias y prurito3. Cursa dentro de cuadros autoinmunes3,22,25, como lupus eritematoso, enfermedad inflamatoria intestinal, artritis reumatoide26, granulomatosis con poliangeítis27 y algunas neoplasias hematológicas, como leucemia, mieloma múltiple y linfoma de Hodgkin25,28. Su relación con los fármacos está en discusión3,22
Histopatología. Bajo una epidermis normal se observa un infiltrado inflamatorio dérmico difuso, superficial y/o profundo23, con neutrófilos centrales e histiocitos dispuestos en empalizada en torno a colágeno degenerado con escasa mucina (fig. 7A,B). Presencia de cariorrexis con variable vasculitis leucocitoclástica22 y algún eosinófilo ocasional23,26.
Granulomas por micosis profundasDefinición. Infecciones cutáneas profundas causadas por hongos. La infección cutánea puede producirse por inoculación directa (traumatismos, infección de heridas…) o bien por diseminación interna desde otros órganos afectos, como el pulmón o el sistema nervioso central.
Clínica. Las lesiones cutáneas pueden ser muy variables dependiendo de la especie causante. Pueden evidenciarse máculas, pápulas, placas, pústulas, nódulos, cicatrices, áreas de paniculitis, intertrigo o tumores, con o sin ulceración. Algunas lesiones pueden adoptar un aspecto «verrucoso», a veces incluso exagerado. En ocasiones el hongo puede eliminarse por la lesión en forma de partículas visibles al ojo humano (p.ej., los gránulos «de azufre» de los eumycetomas)29. Algunas infecciones (no solamente la esporotricosis) producen un claro patrón de diseminación linfática con distribución lineal de las lesiones a lo largo del trayecto linfático (patrón «esporotricoide»; fig. 8). Adicionalmente, algunas especies pueden cursar con ciertos tipos de lesiones un poco más características, como las lesiones queloideas de la lobomicosis o las molluscum-like de la coccidioidomicosis. En general, las presentaciones clínicas pueden llegar a ser tan variadas que algunas entidades (como la histoplasmosis) han sido llamadas la «sífilis fúngica».
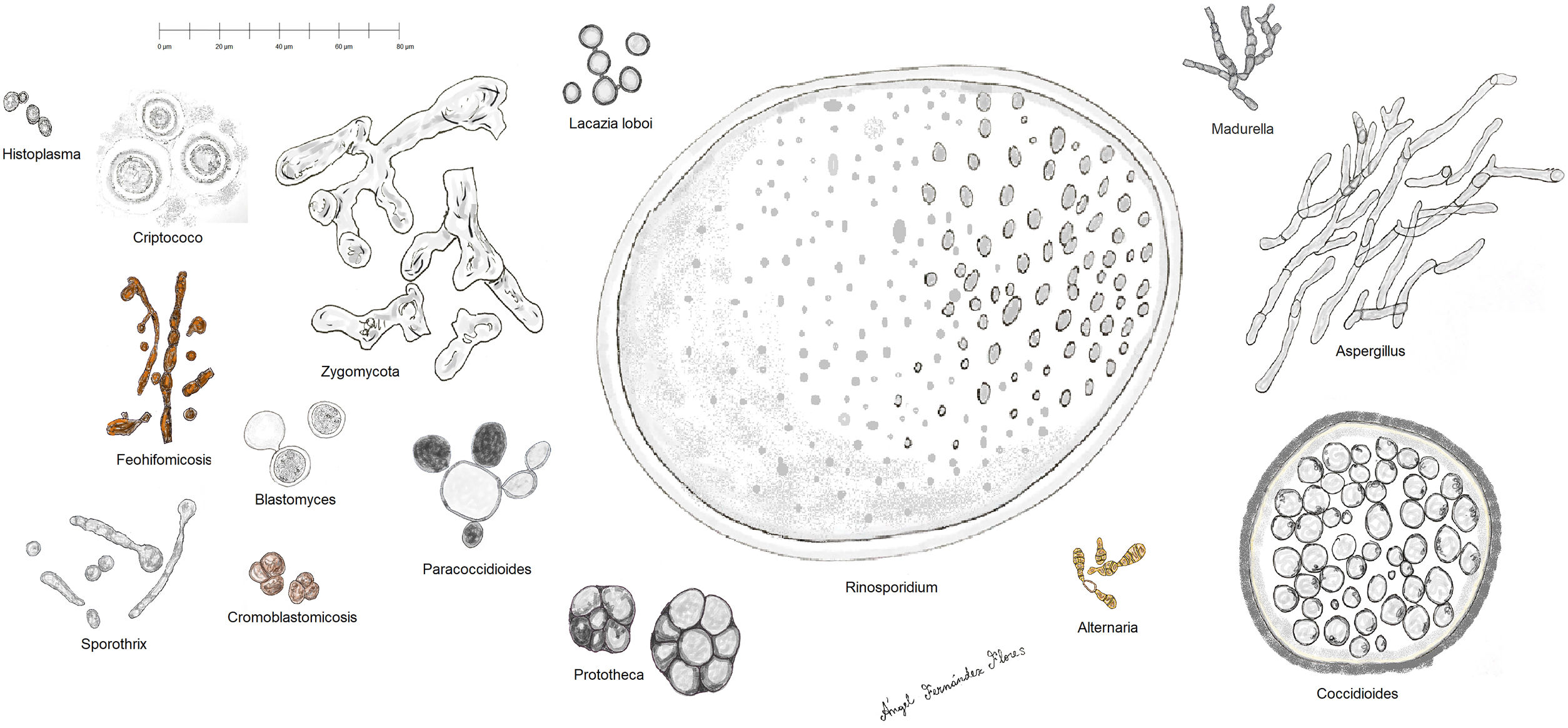
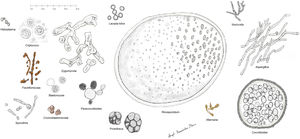
Histopatología. Los distintos microorganismos causantes de las micosis profundas se distinguen por su morfología y por su tamaño (fig. 9)30. En la figura 9 se han representado las principales formas causantes de las micosis profundas humanas en dermatología. Se ha incluido también a Prototeca, a pesar de ser un alga y no un hongo, por comparación. Algunos hongos son fácilmente identificables por su pigmentación (cromoblastomicosis, feohifomicosis y alternariosis). La mayoría de estos hongos, dada su vistosidad, tamaño y forma, son fácilmente identificables en las preparaciones de hematoxilina y eosina (figs. 10-12), pero en ocasiones será necesario realizar técnicas especiales para su mejor visualización; las más usadas son el ácido periódico de Schiff (PAS) y el Grocott. Algunos hongos (como Lacazia) son birrefringentes con luz polarizada.
Algunos hongos estimulan un intenso depósito de anticuerpos en torno a ellos. El fenómeno se conoce como Splendore-Hoeppli y se ve como una corona eosinofílica radiada entorno al hongo (fig. 13).
La infección cutánea profunda por hongos suele ir acompañada de una respuesta granulomatosa supurativa (abscesificada), encontrándose los microorganismos normalmente en el centro del granuloma (área supurativa). Naturalmente, el granuloma supurativo no es patognomónico y puede verse también en otros tipos de infecciones, como micobacterias atípicas o Tularemia, por ejemplo. En ocasiones se observan otros tipos de granulomas, como el sarcoideo o el necrosante caseificante, lo cual dificulta la sospecha de una micosis. Algunos hongos (como Coccidioides) pueden inducir una respuesta mucinosa de fondo.
No es nada raro que se produzca una hiperplasia de la epidermis suprayacente, a veces «verrucosa». Puede a veces producirse la eliminación transepidérmica del hongo. En individuos inmunocomprometidos los granulomas pueden no formarse a veces, predominando la respuesta neutrofílica, y diseminándose la enfermedad con mucha facilidad en ocasiones.
Infecciones por micobacteriasDefinición. Infecciones por organismos del género Mycobacterium. Tradicionalmente se distingue entre M.tuberculosis, causante de la tuberculosis, y micobaterias no tuberculosas, englobadas como atípicas. La lepra, causada por M.leprae, será considerada aparte en este texto.
La tuberculosis cutánea es infrecuente y supone menos del 2% de las formas extrapulmonares, pero su incidencia ha aumentado en paralelo a las otras modalidades de tuberculosis, ligada a la infección por el virus de la inmunodeficiencia humana (VIH) y al incremento de cepas multirresistentes. Las micobacterias no tuberculosas son un grupo amplio y heterogéneo de microorganismos ubicuos, patógenos oportunistas, cuya incidencia es difícil de estimar, aunque parece estar en aumento tanto en pacientes inmunodeprimidos como en inmunocompetentes31-34. Las especies que producen infección cutánea más habitualmente son M.marinum (granuloma de las piscinas), el complejo M.fortuitum-chelonae y M.ulcerans (úlcera de Buruli), extraordinariamente raro en nuestro medio34.
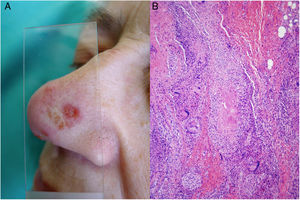
Clínica. Con respecto a la tuberculosis cutánea, se distinguen dos tipos de lesiones35-39: las tuberculosis verdaderas (vinculadas a la presencia de bacilos en las lesiones y consecuencia directa de la infección) y las tubercúlides (una manifestación de hipersensibilidad ante antígenos del microorganismo). La clasificación habitual se basa en la forma de adquisición: a partir de una fuente exógena (tuberculosis por inoculación o chancro tuberculoso y tuberculosis verrucosa cutis) o de una fuente endógena, bien por contigüidad (escrofuloderma, tuberculosis cutis orificialis y algunos casos de lupus vulgar) o a diseminación hematógena (lupus vulgar [fig. 14A], tuberculosis miliar y goma tuberculoso). Las tubercúlides comprenden el eritema indurado, la tubercúlide pápulo-necrótica y el liquen escrofuloso36-39.
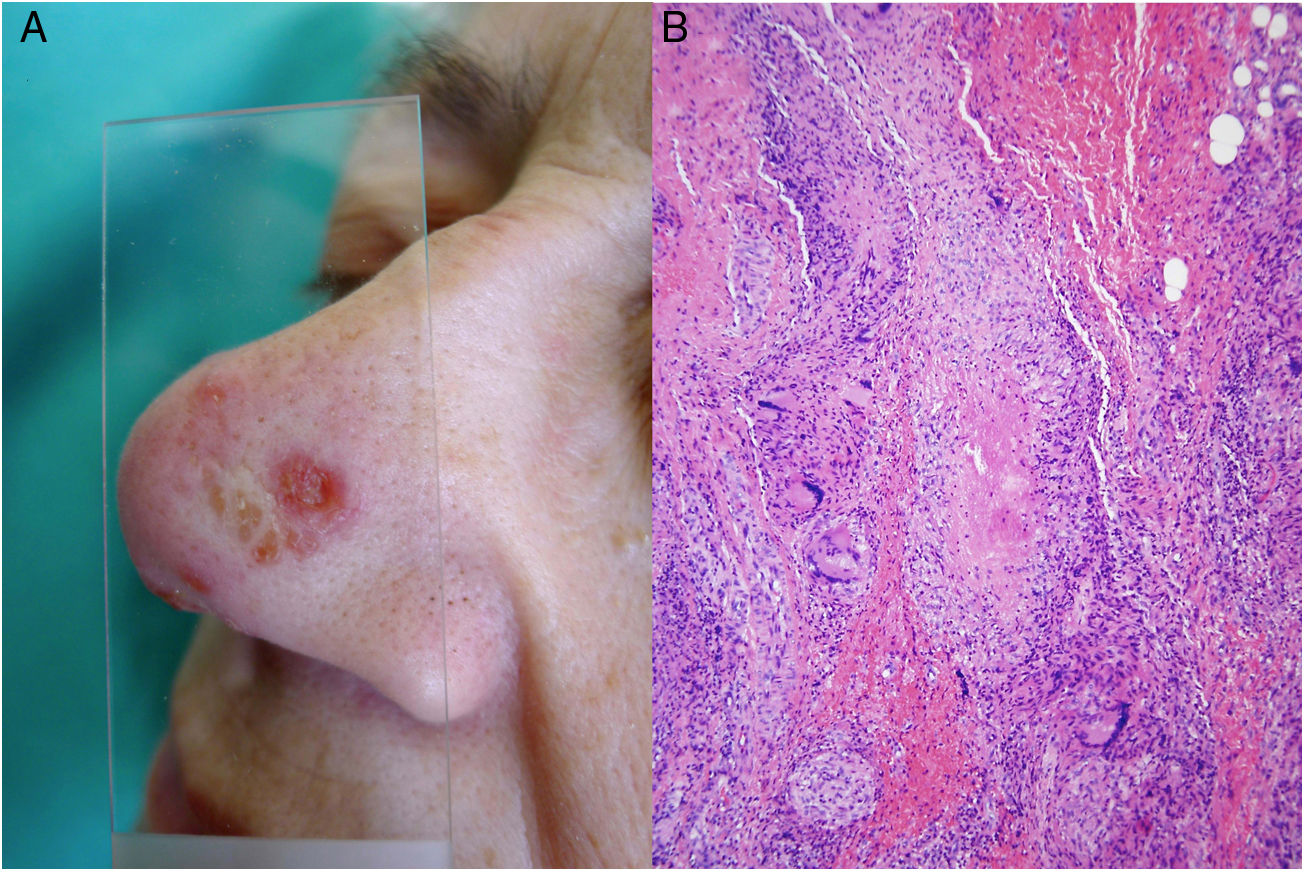
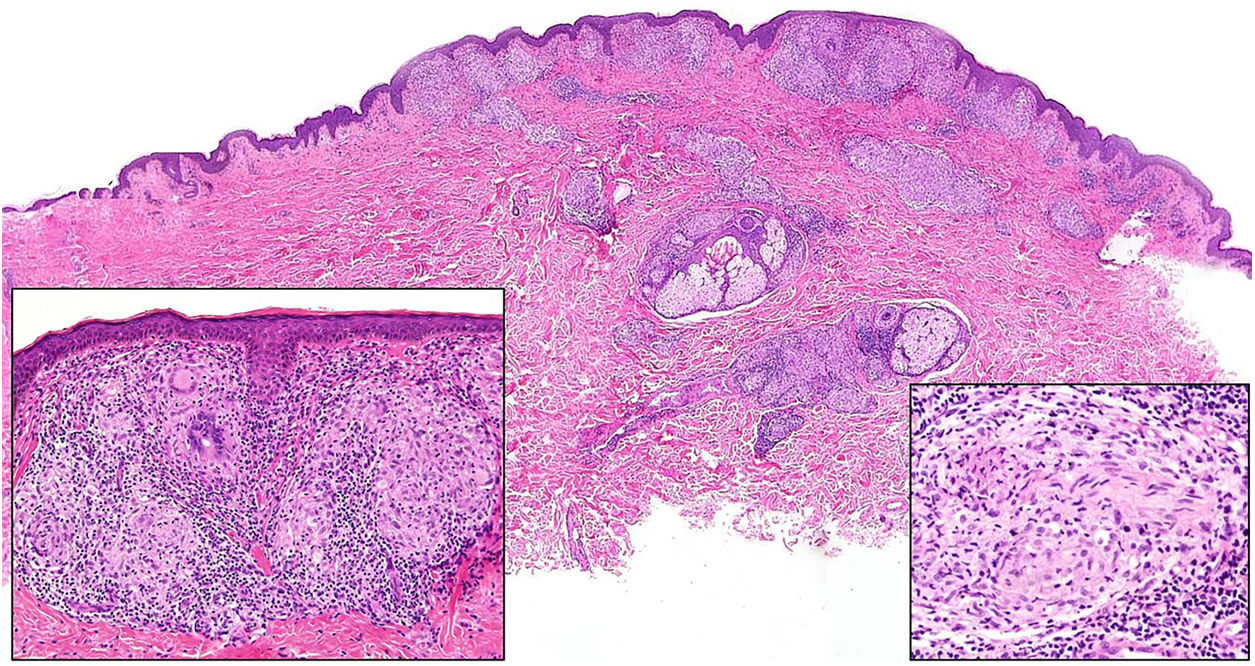
Infección por M.tuberculosis. A)Lesión de lupus vulgar en el dorso nasal (la localización más frecuente) en una paciente con tuberculosis pulmonar. Se aprecia una placa eritematosa formada por varias pápulas, así como el aspecto característico en «jalea de manzana» con la diascopia (Cortesía de la Dra. Sánchez-Aguilar). B)Ejemplo del aspecto histológico de una lesión típica de la tuberculosis: granulomas con necrosis caseosa central y abundantes linfocitos en la periferia (H&E ×40).
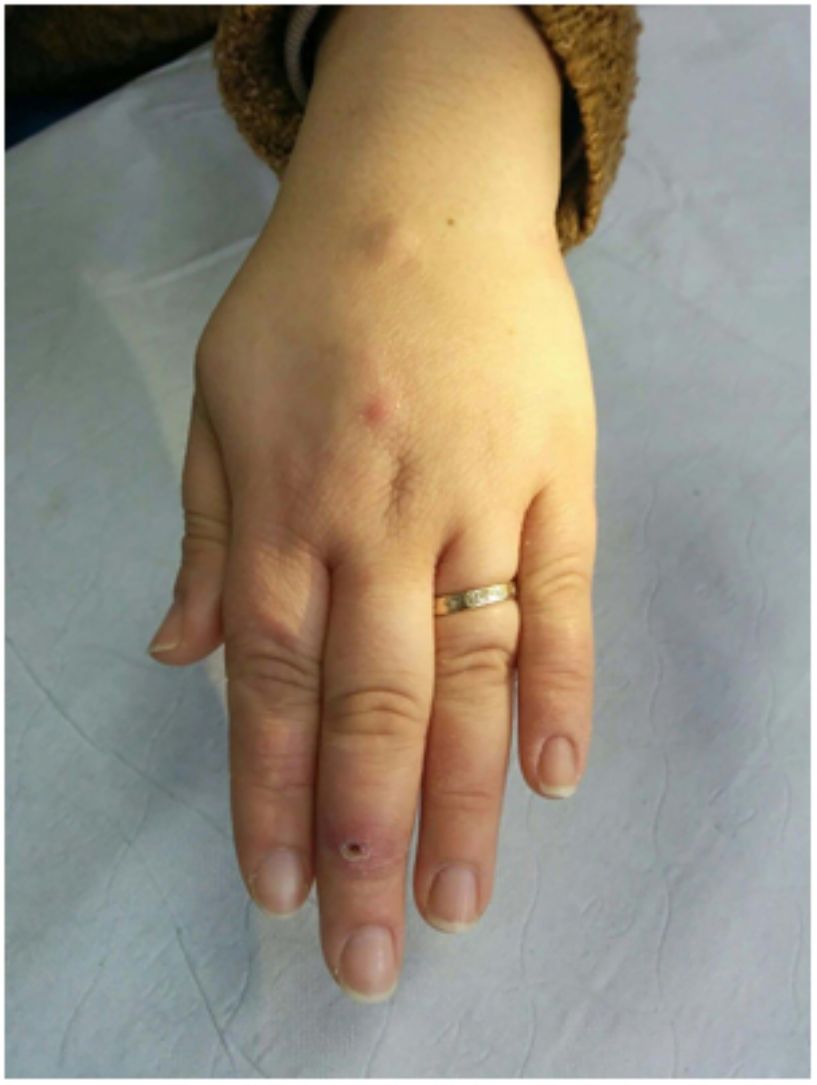
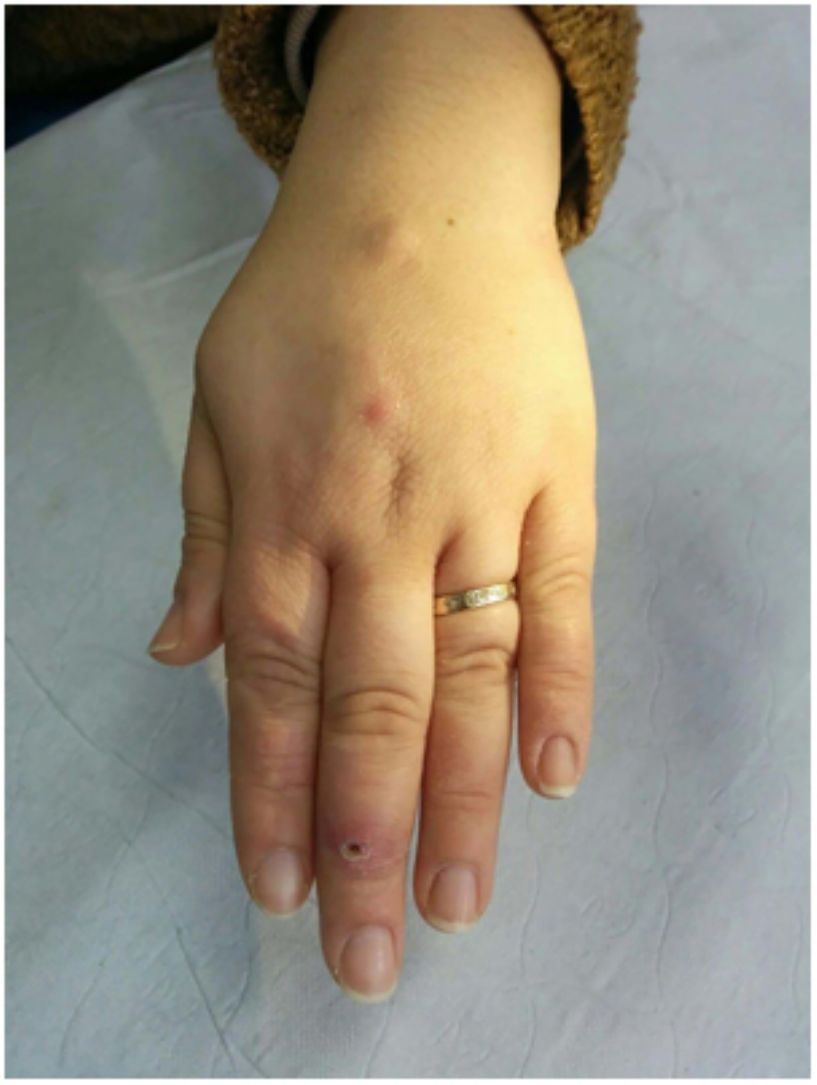
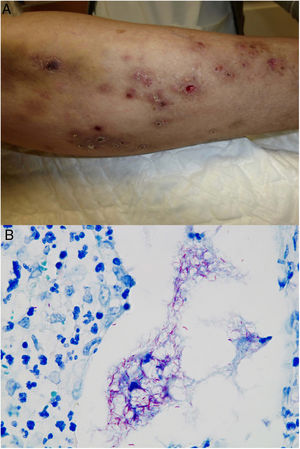
En cuanto a las infecciones por micobacterias atípicas, el aspecto clínico de las lesiones es muy amplio y en muchas ocasiones no resulta diagnóstico (fig. 15A). La infección por M.marinum se desarrolla una o dos semanas después de una herida producida en un entorno acuático y con frecuencia muestra diseminación esporotricoide34,35,40. Las infecciones por M.fortuitum-chelonae son consecuencia de la contaminación de una herida, incluyendo las relacionadas con intervenciones quirúrgicas, inyecciones, mesoterapia o acupuntura35,40. Se han descrito brotes en relación con la contaminación de pigmentos empleados en tatuajes decorativos41.
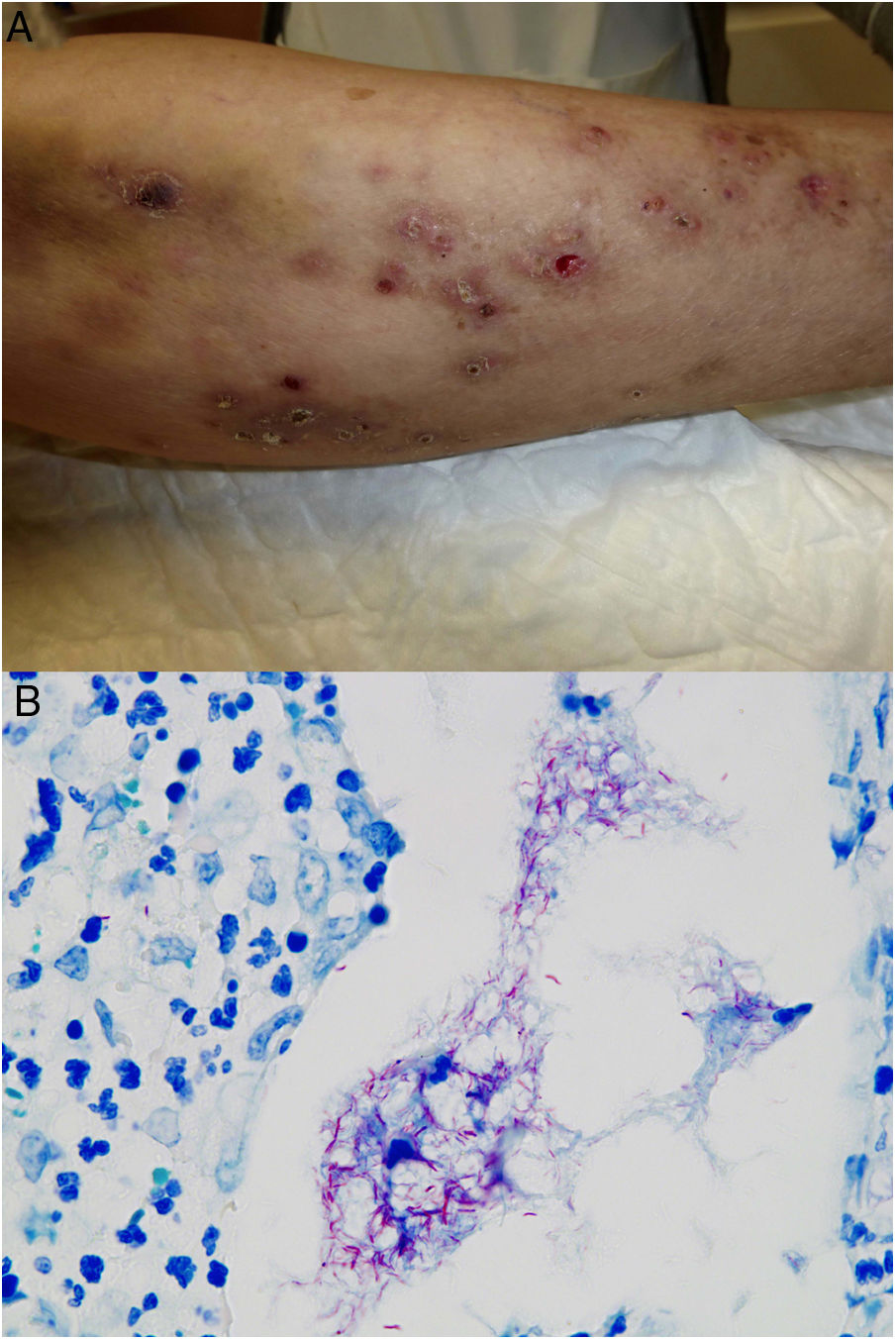
Ejemplo de infección por M.chelonae. A)Lesiones nodulares, dolorosas y supurativas, con ulceración superficial y formación de costra (Cortesía de la Dra. Rodríguez Blanco). B)Infección por M.chelonae. En ocasiones, los microorganismos tienden a agruparse en las áreas de supuración, donde pueden demostrarse con la tinción de Ziehl-Neelsen (Ziehl-Neelsen, ×1.000).
Histología. En cuanto a las formas cutáneas de infección por M.tuberculosis, todas ellas se caracterizan por la presencia de granulomas tuberculoides (fig. 14B): acúmulos de macrófagos epitelioides y células gigantes tipo Langhans, con grados variables de necrosis caseosa central, y abundantes linfocitos en la periferia. En ocasiones los granulomas pueden no mostrar necrosis o ser de tipo supurativo e incluso predominar la necrosis sin apenas respuesta granulomatosa, dependiendo del estado inmunitario del huésped36,39,42. La morfología no es diagnóstica de por sí y es necesario la demostración de los microorganismos. Se puede hacer mediante técnicas histopatológicas, como el Ziehl-Neelsen, pero es positiva en menos del 5% de los casos, ya que la carga bacteriana en las lesiones cutáneas suele ser baja y son necesarias un mínimo de entre 1.000 y 10.000 unidades formadoras de colonias/ml para su detección43,44. Alternativamente se emplearán técnicas microbiológicas como extensiones, cultivo o reacción en cadena de la polimerasa (PCR), y esta última puede realizarse a partir de material de biopsia incluido en parafina. El diagnóstico diferencial principal, además de otras infecciones granulomatosas, es la sarcoidosis, en la que los granulomas no muestran necrosis ni linfocitos en la periferia.
El eritema indurado es el prototipo de paniculitis lobulillar y muestra inflamación granulomatosa acompañada de vasculitis de pequeños vasos en el interior del lobulillo. La tubercúlide pápulo-necrótica se caracteriza por la extensa necrosis de la dermis, con áreas de inflamación granulomatosa y vasculitis acompañante36,37.
En cuanto a las micobacterias atípicas, el aspecto histológico de la infección por M.marinum es el de un proceso inflamatorio granulomatoso generalmente limitado a la dermis, con frecuente abscesificación central y cambios secundarios en la epidermis32,33. El estudio histológico de las lesiones producidas por M.fortuitum-chelonae revela grados variables de inflamación aguda con formación más tardía de granulomas, generalmente mal definidos. En algunos casos se aprecian agregados de bacilos en las áreas de supuración (fig. 15B). Estos cambios no son específicos, sino que son compartidos con otras especies de micobacterias que más raramente son causa de infección cutánea33,44.
LeishmaniasisDefinición. Enfermedad causada por un parásito flagelado perteneciente al género Leishmania, transmitida habitualmente por la picadura de flebótomo y cuyo reservorio suelen ser mamíferos salvajes o domésticos, en particular perros.
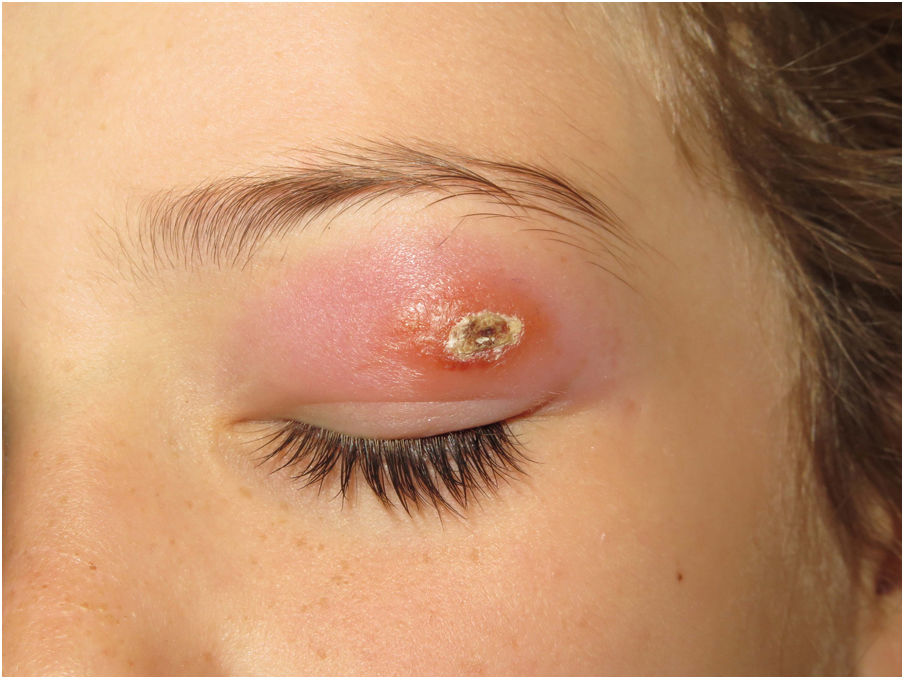
Clínica. Existen formas clínicas cutáneas, mucocutáneas o sistémicas, con una presentación muy variable, que depende de características del parásito, del vector, de la respuesta inmune individual y de la localización de las lesiones45. La forma puramente cutánea (generalmente restringida a la cara, cuero cabelludo, brazos u otras áreas expuestas) se presenta como una pápula indurada con costra que se agranda lentamente y es autolimitada (fig. 16). En situaciones de inmunosupresión se producen formas cutáneas diseminadas. También existen formas recurrentes y post kala-azar. La forma mucocutánea, causada principalmente por L.braziliensis, produce lesiones de la mucosa oral y nasofaríngea. En la forma visceral (kala-azar) (en la que los parásitos se distribuyen por todo el sistema reticuloendotelial causando fiebre, hepatoesplenomegalia y síntomas sistémicos graves), la afectación cutánea es infrecuente (5%), excepto por una pigmentación irregular oscura.
De las más de 20 especies potencialmente patógenas para el ser humano, algunas, como L.donovani y L.infantum, tienden a mostrar tropismo visceral, y otras (la mayoría), cutáneo o mucocutáneo. Sin embargo, L.infantum, la especie predominante en España y en la cuenca mediterránea occidental, puede tener afectación exclusivamente cutánea46.
Histopatología. Los hallazgos histológicos se correlacionan con la forma de presentación clínica y la respuesta inmune del huésped. En caso de mala respuesta inmunitaria suelen encontrarse innumerables amastigotes y abundantes histiocitos sin otras células inflamatorias. En pacientes no inmunodeprimidos suele haber un número escaso o moderado de amastigotes con formación de granulomas y, en ocasiones, necrosis.
En las formas agudas se observa un denso infiltrado dérmico difuso de predominio histiocitario, acompañado de abundantes linfocitos y células plasmáticas. La epidermis puede mostrar hiperplasia marcada, con hiperqueratosis o cambio pseudoepiteliomatoso, y en otros casos atrofia o ulceración.
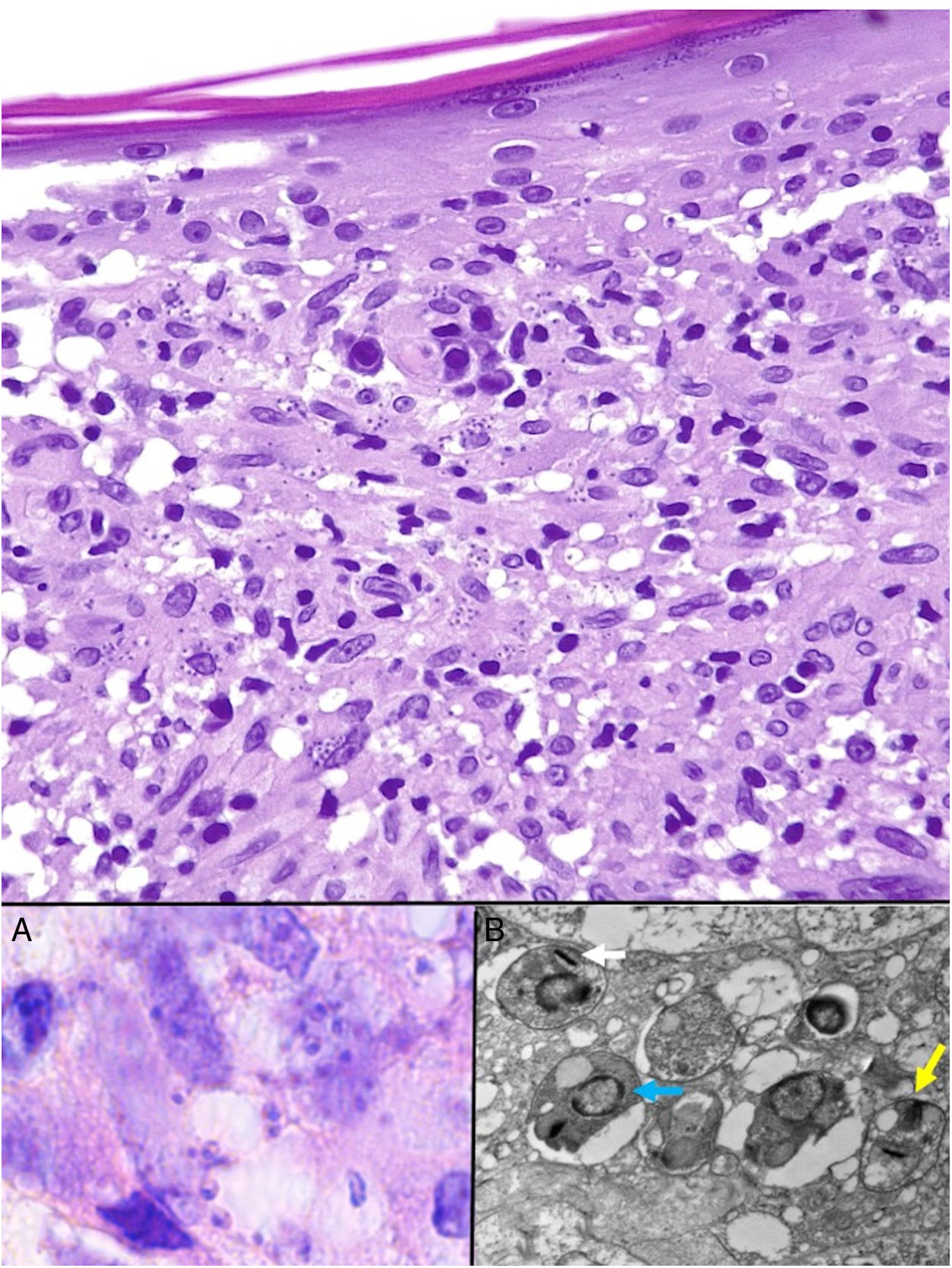
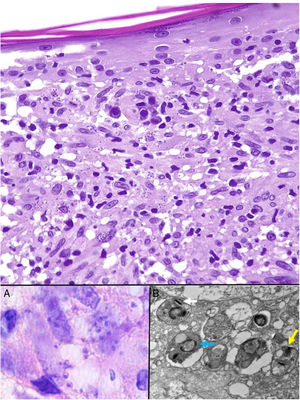
Las Leishmania en su forma de amastigote (forma intracelular del parásito) se observan predominantemente a nivel intracitoplásmico. Se visualizan bien con hematoxilina eosina y con técnica de Giemsa en el interior de los macrófagos. También pueden ser observados en una extensión citológica por raspado, impronta o punción aspiración con aguja fina (PAAF). Tienen forma de cuerpos redondeados u ovalados de 2-5μm de diámetro con un refuerzo periférico correspondiente al quinetoplasto y tienden a disponerse en la periferia del citoplasma (fig. 17, recuadro a). Con microscopia electrónica se distingue núcleo, quinetoplasto y flagelo interno (fig. 17, recuadro b)47. No poseen cápsula y, por lo tanto, son PAS y Grocott negativos, lo que los distingue de Histoplasma capsulatum. La forma de promastigote (alargada, de mayor tamaño y con flagelo externo) no la vamos a observar en las lesiones, ya que se localiza únicamente en el intestino del vector.
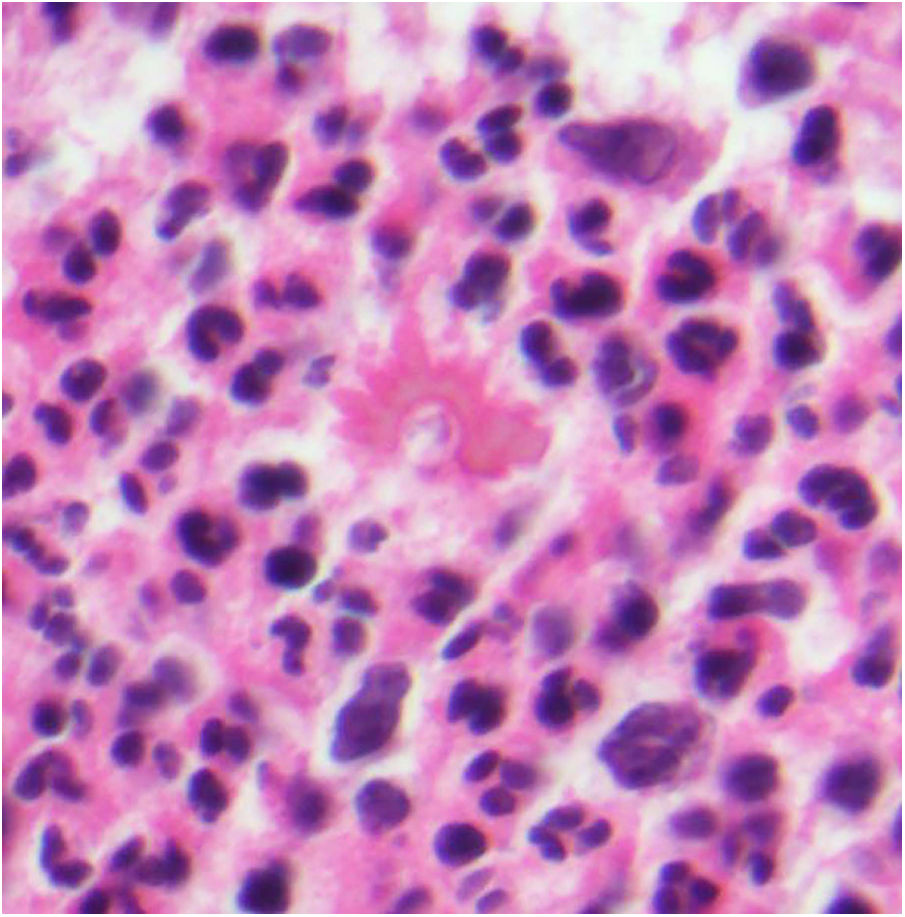
Leishmaniasis. Infiltrado granulomatoso subepidérmico con epidermis atrófica. Presencia de abundantes amastigotes de Leishmania en dermis superior (H&E ×200). Recuadro a: amastigotes intracelulares de 2μm con refuerzo periférico, que tienden a disponerse en la periferia del citoplasma («marquee sign») (HE ×1.000). Recuadro b: microscopia electrónica de transmisión (×8.000), que permite apreciar el núcleo (flecha azul), el quinetoplasto (flecha blanca) y el flagelo interno (flecha amarilla).
En las formas más crónicas aparecen granulomas epitelioides confluyentes, mal delimitados, de aspecto desordenado («messy granulomas»)48 que suelen ocupar todo el espesor de la dermis (fig. 18A). Pueden observarse células gigantes de tipo Langhans y el número de células plasmáticas aumenta, mientras que el número de amastigotes disminuye y su presencia puede ser muy difícil de apreciar. Los amastigotes tienden a localizarse en las zonas más superiores de la dermis, a nivel subepidérmico (fig. 17).
A)Forma crónica de leishmaniasis. Aparecen granulomas epitelioides confluyentes, mal delimitados, de aspecto desordenado («messy granulomas»)48 que suelen ocupar todo el espesor de la dermis (H&E ×20). B)Bilharziosis cutánea tarda vulvar. Zona de dermis reticular en la que se aprecia un granuloma epitelioide con necrosis central alrededor de siete estructuras con morfología redondeada u oval. Una de ellas, más íntegra, muestra una espícula lateral, característica de S.hematobium. C)Prurito del nadador por cercarias. No es una reacción granulomatosa. Se aprecian tres fragmentos longitudinales de Cercaria, sin que se llegara a identificar especie, cercana a glándulas ecrinas y rodeadas de infiltrado linfohistiocitario con numerosos eosinófilos. D)Oncocercoma. Se aprecia infiltrado granulomatoso con presencia de neutrófilos y esclerosis, así como algunas células gigantes de cuerpo extraño alrededor de la sección transversal en tres áreas, con artefacto de retracción característico alrededor de la gruesa cutícula eosinofílica de las tres filarias.
La leishmaniosis recidivante muestra granulomas epitelioides no necrosantes confluyentes, en los que resulta muy difícil o imposible identificar amastigotes. Los granulomas se acompañan de linfocitos, células plasmáticas y eosinófilos.
En caso de existir pocos parásitos, pueden ser útiles las técnicas de inmunohistoquímica. Existen anticuerpos monoclonales anti-Leishmania49, aunque su uso está poco extendido y poco estandarizado. También puede ser de ayuda la inmunohistoquímica para CD1a con el clon MTB1, ya que presenta positividad en los amastigotes, posiblemente por transferencia desde las células de Langerhans. El CD1a marca preferentemente los amastigotes localizados en la dermis superior, perdiendo intensidad en profundidad50. Sin embargo, no todas las especies de Leishmania son positivas. Además, otros clones del mismo anticuerpo resultan también negativos. El método más sensible para la detección de Leishmania es la PCR, cuya sensibilidad puede ser cercana al 100%51.
En la leishmaniosis cutánea difusa la dermis está ocupada de forma difusa por macrófagos que no forman granulomas y de citoplasma claro que contiene innumerables amastigotes (fig. 18A). No se observan apenas linfocitos ni células plasmáticas. Los cambios epidérmicos son variables.
El diagnóstico diferencial histológico es amplio y depende de la forma de presentación. Debe hacerse con otras enfermedades granulomatosas y depende de la correcta identificación de los amastigotes. En ocasiones la densidad del infiltrado inflamatorio puede plantear diagnóstico diferencial con linfoma. En el rinoscleroma, la histoplasmosis, el granuloma inguinal y la blastomicosis se observan también parásitos intracelulares, con características morfológicas y tintoriales distintas. Las lesiones evolucionadas o crónicas de Leishmania presentan abundantes células plasmáticas, lo que puede plantear diagnóstico diferencial con sífilis secundaria o terciaria. En ocasiones la hiperplasia epidérmica puede simular un carcinoma escamoso. También plantean diagnóstico diferencial histológico con otras enfermedades granulomatosas, como lupus vulgar, lepra o sarcoidosis52.
Enfermedades por parásitosLos granulomas secundarios a infestaciones parasitarias suponen hasta el 16,7% de los casos e incluyen, entre otros, esquistosomiasis o granulomas secundarios a quistes hidatídicos53. Dentro de las infecciones por helmintos incluimos las producidas por trematodos (esquistosomiasis, paragonimiasis y fasciolaliasis), nematodos (larva cutánea migrans, oncocercosis, filariasis, gnatostomiasis, loiasis, dracunculiasis, estrongiloidosis, ascariasis, streptocercosis, dirofilariasis y triquinosis) y cestodos (esparganosis, cisticercosis y equinococosis). Nos centraremos en aquellas en las que la histopatología suele acompañarse de granulomas.
Esquistosomiasis cutáneaDefinición. Infección endémica en áreas tropicales y subtropicales causada por el género Schistosoma, que habitualmente se encuentra en los caracoles. La infección se adquiere tras el contacto con aguas contaminadas. Dentro de las cinco especies que pueden afectar al hombre, las tres más comunes son S.hematobium (localizado en África y Oriente medio y que infecta el sistema urinario), S.japonicum (localizado en Japón y Sudeste asiático) y S.mansoni (más propio de África, Sudamérica y Caribe).
Las lesiones cutáneas están relacionadas con los Schistosoma antropófilo, es decir, aquellos en que la cercaria puede penetrar la piel, produciendo gusanos adultos que se aparean y liberan huevos al exterior a través del intestino o de la vejiga. Dichas lesiones cutáneas pueden ser: 1)granulomatosas (en reacción a los gusanos adultos y huevos), también conocidas como bilharziosis cutánea tarda; 2)relacionadas con hipersensibilidad (dermatitis cercarial o prurito del nadador), y 3)bilharzides (respuestas cutáneas transitorias sin parásito en las lesiones, y secundarias a la liberación de huevos a la circulación, acompañadas de fiebre, urticaria y, a veces, púrpura) (fig. 18B)54. El prurito del nadador puede deberse también a esquistosomas antropofílicos que no pueden madurar y completar su ciclo en los humanos, por lo que mueren en la piel, produciendo solo una reacción local inflamatoria (fig. 18C). Nos centraremos fundamentalmente en el primer cuadro clínico, la bilharziosis cutánea, que es típicamente granulomatosa.
Clínica. Pápulas o placas papilomatosas que pueden simular verrugas genitales asociadas a virus del papiloma humano55. Ante su detección, es importante descartar la presencia de parásitos vesicales o intestinales.
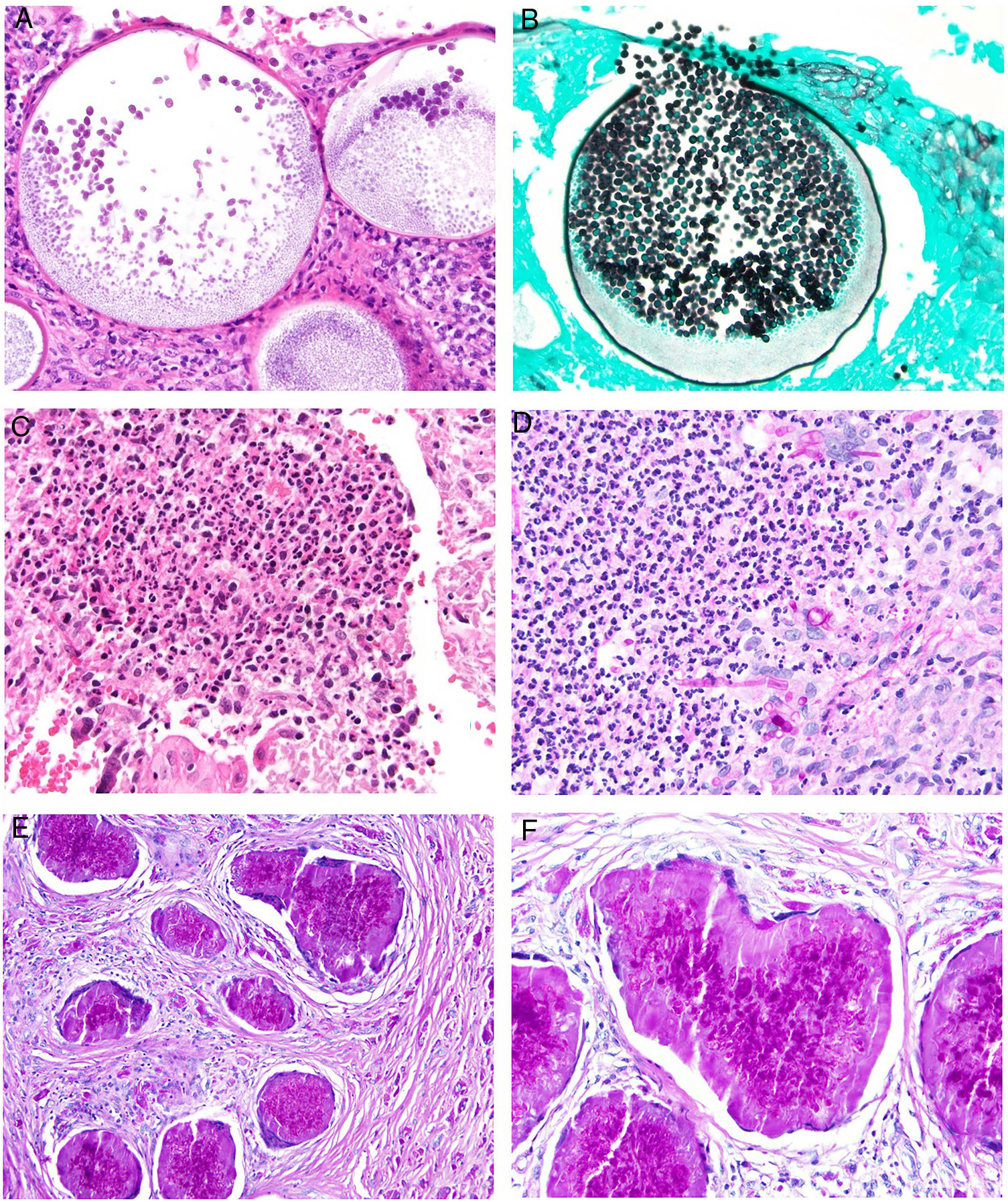
Histopatología. Aunque puede existir papilomatosis y paraqueratosis, lo más característico es la presencia de un infiltrado inflamatorio granulomatoso con presencia de eosinófilos y plasmáticas alrededor de los huevos de Schistosoma. Los huevos de S.hematobium tienen una espícula terminal, los de S.mansoni tienen una espícula lateral y los de S.japonicum no tienen espículas. En el caso del prurito del nadador, la presencia de metacercarias no patogénicas que no pueden sobrevivir da una reacción más intensa, produciendo mayor espongiosis y densidad del infiltrado de eosinófilos y neutrófilos (fig. 18C).
OncocercosisDefinición. Grupo de infecciones producidas por nematodos (gusanos redondos) del género Filaroidea que tienen un cuerpo filiforme y una boca rodeada por papilas. Se suelen trasmitir por mosquitos. Aquí revisaremos las formas subcutáneas, que incluyen la oncocercosis y la loiasis o gusano ocular. En la oncocercosis, causada por Onchocerca volvulus y trasmitida por la mosca negra o Simulium, pueden observarse granulomas.
Clínica. La oncocercosis produce xerosis importante, así como signos de envejecimiento cutáneo prematuro, acompañados de picor intenso, pápulas aisladas de superficie lisa y máculas hiperqueratósicas, así como la presencia de piel de leopardo, con áreas depigmentadas y repigmentadas y nódulos subcutáneos denominados oncocercomas. Los oncocercomas tienden a localizarse sobre prominencias óseas.
Histopatología. La microfilaria puede identificarse en la piel, con edema, depósitos mixoides, dilatación de linfáticos e infiltrado inflamatorio con neutrófilos y con eosinófilos. Cuando se biopsian los oncocercomas, están rodeados de una respuesta granulomatosa frente a numerosos organismos (fig. 18D). La respuesta inflamatoria suele estar separada de la gruesa cutícula de las filarias por un artefacto de retracción causado por la imposibilidad de las células fagocíticas de pegarse a dicha cutícula.
GnatostomiasisDefinición. Parasitosis emergente producida por el tercer estadio larvario (L3) de nematodos del género Gnathostoma (orden Spirurida), cuyo complejo ciclo vital requiere un primer hospedador intermedio, el copépodo, que servirá de alimento a peces o anfibios de agua dulce, y en el que el parásito evolucionará de L2 a L3, siendo ya capaz de moverse, y desde el que alcanzará a cánidos, felinos o cerdos, en los que formará granulomas en la mucosa digestiva, desde la que se eliminarán por las deposiciones las larvas acuáticas L1, que, de nuevo, se hospedarán e iniciarán su maduración en los copépodos. Dado el ciclo vital del Gnathostoma, sucede con más frecuencia en zonas en que se tiende a consumir pescado o anfibios sin cocinar, por ejemplo, sushi o ceviche.
Clínica. En la especie humana el parasito no puede completar su ciclo vital y, tras ser ingerido, viaja a través del plexo mesentérico, alcanza la hipodermis y produce una paniculitis migratoria. El antecedente de ingesta de pescado crudo más la eosinofilia tisular o en sangre periférica serán muy sugestivos56. Una paniculitis migratoria puede verse también en la toxocariasis subcutánea, en la loaiasis o incluso en el Strongyloides stercolaris, la larva migrans cutánea y, raramente, en los trematodos con migración ectópica como Fasciola hepatica o Paragonimus spp.
Histopatología. Aunque pueden encontrarse granulomas alrededor de la larva de Gnathostoma (fig. 19A), lo más frecuente es encontrar infiltrados eosinofílicos de diferente cuantía, mezclados con linfocitos, neutrófilos, histiocitos e incluso plasmáticas (fig. 19B). En ocasiones se puede encontrar al gusano en dermis profunda o en panículo adiposo, con un diámetro de unos 200 a 300μm.
Diagnóstico diferencial. De tamaño similar es Spirometra, agente causal de la esparganosis, que produce la infección tras ingesta de carne, pero también pescado crudo o aplicación de agua o productos contaminados tópicos. La larva, blanca, plana y festoneada, puede vivir en los estómagos de mamíferos carnívoros y migrar a la piel, produciendo también nódulos de entre 0,5-5cm, similares a lipomas o fibromas y con incubaciones de 6-11días57. Estos nódulos pueden abrirse al exterior y permitir la salida de la larva. Histopatológicamente es frecuente que haya una reacción granulomatosa alrededor de la larva, que, al carecer de estructuras genitales e intestinales y tener un estroma central laxo con cuerpos calcáneos y músculo liso discontinuo, es fácilmente distinguible de la larva de Gnathostoma57. Se ha descrito reacción granulomatosa en empalizada con mucina, simulando a la habitual en GA en relación con la esparganosis. A diferencia de otras parasitosis, la extirpación quirúrgica es tratamiento habitual, y encontrar la larva conduce al diagnóstico58.
DirofilariasisDefinición. Producidas por nematodos del género Dirofilaria que se trasmiten por picaduras de mosquito en su estado larvario. Pueden afectar al pulmón (D.immitis) o a otros órganos, incluyendo la piel (D.repens)59.
Clínica. Las manifestaciones cutáneas de D.repens son nódulos únicos o múltiples, eritematosos y de consistencia blanda, por la degeneración de la larva inmadura que produce una respuesta inmune granulomatosa de cuerpo extraño, con granulomas en empalizada, colágeno necrobiótico y un infiltrado inflamatorio mixto con eosinófilos, plasmáticas, linfocitos e histiocitos.
Histopatología. Se parece a la necrobiosis lipoídica, aunque es habitual en cortes seriados encontrar espacios en la zona superior del tejido subcutáneo con espinas cuticulares estriadas y una zona central con las vísceras de la filaria59.
EstrongiloidosisDefinición. Enfermedad parasitaria primariamente gastrointestinal pero que puede presentarse con una afectación cutánea, más frecuente en pacientes inmunosuprimidos y clínicamente relevante por ser las formas clínicamente purpúricas más habituales en hiperinfestaciones y estar asociadas a un mal pronóstico60.
Clínica. Puede presentarse como una larva currens de movilidad rápida, de hasta 5-15cm a la hora, o como máculas purpúricas que confluyen en lesiones más grandes, centrífugamente, en zona abdominal y de muslos.
Histopatología. La larva puede ser detectada en la dermis reticular dentro de capilares o entre las fibras de colágeno y puede haber inflamación granulomatosa alrededor de la misma, aunque es rara y se atribuye a la muerte de la larva61.
Diagnóstico diferencial. La larva migrans cutánea, causada por la penetración cutánea del Ancylostoma brasiliense, produce una lesión clínicamente característica, lineal y sinuosa, siguiendo el trayecto de la larva que avanza varios centímetros al día; histopatológicamente no suele mostrar granulomas sino espongiosis e infiltrado inflamatorio linfocitario rico en eosinófilos. El tamaño de la L3 de Strongyloides es similar al de Ancylostoma (unos 3 queratinocitos), aunque la primera suele encontrarse en la dermis y la segunda, rara de observar, en la epidermis62. El tamaño sí es útil para diferenciar la estrongiloidosis de la larva L3 de Gnathostoma (diámetro 200-300μm), notablemente más grande.
CisticercosisDefinición. Infección de la forma larvaria de la Taenia solium. Tiene especial importancia cuando afecta el sistema nervioso central. Se estima que el 2% de las urgencias por convulsiones en países subdesarrollados se deben a cisticercosis.
Clínica. Cuando afecta la piel, lo hace en forma de nódulos subcutáneos únicos o en pequeño número (<10) en el 88% de los casos63. Los nódulos están localizados principalmente en el tronco y muestran un contenido líquido amarillento.
Histopatología. Cuando está presente la larva, hay un espacio quístico rodeado por una pared vesicular. La luz, que es festoneada, contiene estructuras nodulares redondeadas que son los escólex invaginados63. La presencia de granulomas es más habitual cuando se ha roto el parásito.
Equinococosis o enfermedad hidatídicaDefinición. Infección por las formas larvarias, tipo metacestoda, del género Echinococcus.
Clínica. Al igual que la cisticercosis, clínicamente puede simular un quiste infundibular o un lipoma64, con una tendencia a crecer entre 1mm y 5cm al año.
Histopatología. Las lesiones de quiste hidatídico tienen tres capas principales: una más externa o periquística, del hospedador; una intermedia; y una interna germinal, que es delgada y translúcida y de la que se desarrollan los escólices64. Dado que las lesiones carecen de un recubrimiento epitelial, pero contienen histiocitos epitelioides elongados en múltiples capas, son, por tanto, pseudoquistes. Los histiocitos pueden marcarse con CD68 y suele haber linfocitos y eosinófilos. Ante la rotura de un quiste se produce inflamación granulomatosa con fibrosis e histiocitos multinucleados, neutrófilos, eosinófilos, e incluso, en ocasiones, vasculitis leucocitoclástica .
LepraDefinición. La lepra es una infección crónica causada por los bacilos intracelulares obligatorios Mycobacterium leprae o lepromatosis. Afecta predominantemente a la piel, al tracto respiratorio alto y a los nervios periféricos. Actualmente sigue siendo endémica en muchos países, como India, Indonesia o Brasil. En Europa la mayoría de los casos son importados65,66.
Clínica. La clínica es un espectro entre la lepra tuberculoide o paucibacilar (con escasas lesiones y sistema inmune competente) en un extremo, y la lepra lepromatosa o multibacilar (con numerosas lesiones y sistema inmune deficiente) en el otro67. En el centro del espectro estaría la lepra indeterminada, que, dependiendo de la inmunidad del paciente, podría derivar a tuberculoide o lepromatosa.
La lepra indeterminada se manifiesta por una o más máculas hipopigmentadas o eritematosas. En la lepra tuberculoide hay una o varias placas insensibles eritematoparduzcas bien delimitadas (fig. 20A) La lepra lepromatosa es una enfermedad sistémica con clínica principal en la piel, donde las lesiones son abundantes y mal delimitadas; se manifiesta por placas o nódulos que pueden llegar a producir una marcada infiltración difusa, con progresiva pérdida de la sensibilidad. En el medio hay distintas formas dimorfas (o borderline), con manifestaciones intermedias, y lesiones con frecuencia anulares (fig. 20B)68. La lepra histioide es una variante nodular infrecuente. Por último, hay una serie de reacciones lepromatosas que representan episodios agudos dentro del curso lento de la enfermedad. La leprorreacción tipoI corresponde a una reacción de hipersensibilidad de tipoIV. La leprorreacción tipoII corresponde a una vasculitis por complejos inmunes.
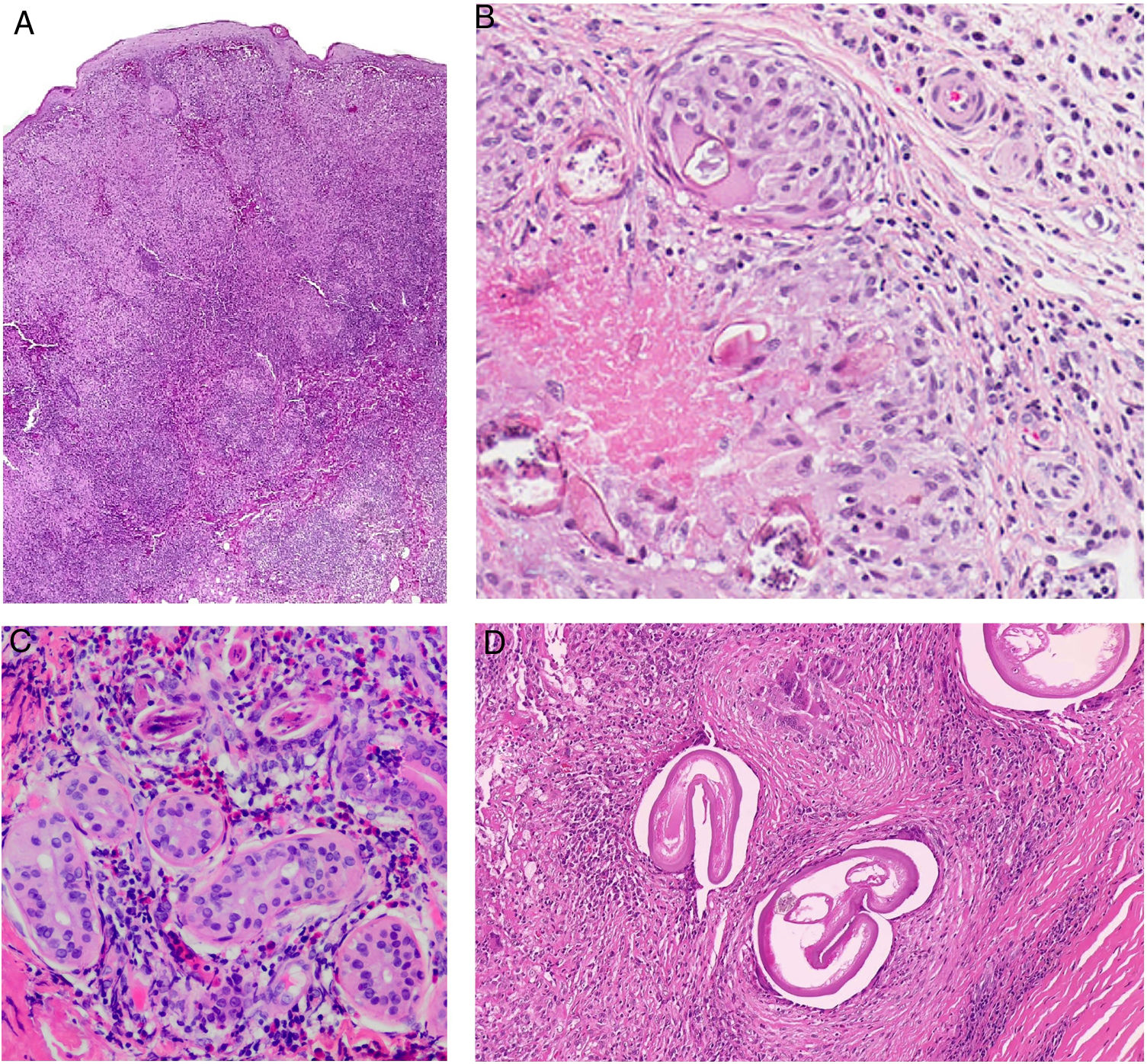
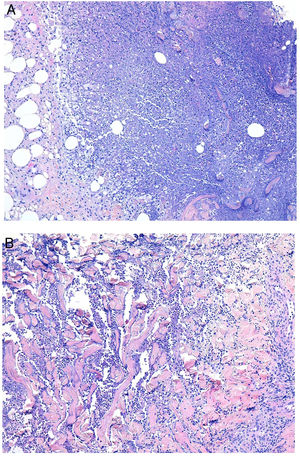
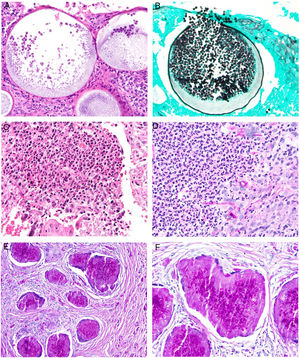
Histopatología. La lepra indeterminada muestra un ligero infiltrado linfohistiocitario alrededor de vasos, anejos y nervios. La lepra tuberculoide se caracteriza por granulomas epitelioides no necrosantes con células gigantes multinucleadas y numerosos linfocitos; es frecuente que el infiltrado tenga forma «de salchicha», porque se distribuye a lo largo de nervios y anejos; normalmente no contiene bacilos (fig. 21). La lepra lepromatosa consta de algunos linfocitos, pero sobre todo de un infiltrado histiocitario dérmico, nodular o difuso, bajo una zona Grenz (fig. 22A); los histiocitos, que son S-100 positivos, presentan un citoplasma amplio y granular, que en las lesiones más avanzadas es espumoso; los nervios suelen hallarse intactos en las lesiones iniciales, pero más adelante pueden mostrar una fibrosis concéntrica; los anejos desaparecen; en estas lesiones se observa una gran cantidad de bacilos, y es frecuente que estos formen masas anfófilas denominadas globi (fig. 22B)65,67,68. Las formas borderline presentan rasgos intermedios entre las dos anteriores (fig. 22C). La lepra histioide se caracteriza por nódulos de histiocitos predominantemente fusiformes en los que se identifican numerosos bacilos67.
Lepra tuberculoide. Esta muestra de lepra tuberculoide, correspondiente al paciente de la figura 20A, muestra un infiltrado linfohistiocitario con una distribución «en salchicha» que sigue los haces neurovasculares (H&E, ×20). En el recuadro inferior izquierdo se aprecian granulomas epitelioides rodeados por linfocitos (H&E, ×100). En el recuadro inferior derecho se reconoce un nervio en el centro del granuloma (H&E, ×100).
A)Lepra lepromatosa. Bajo una zona Grenz, se aprecia un infiltrado histiocitario en sábana (H&E, ×40). B)A mayor aumento, se observan numerosos histiocitos espumosos y células gigantes multinucleadas en cuyos citoplasmas se observan globi (HE, ×200). En el recuadro inferior izquierdo pueden apreciarse numerosos bacilos teñidos con la técnica de Job-Fite, algunos agrupados en globi dentro de los macrófagos (Job-Fite, ×200). C)Lepra dimorfa. Caso procedente de la biopsia de la paciente de la figura 19B, con un infiltrado inflamatorio perivascular y perianexial superficial y profundo (H&E, ×20), compuesto por linfocitos e histiocitos, tal y como se reconoce en el recuadro inferior derecho (H&E, ×100).
La reacción de tipoI (reversa) es visible por una inflamación linfogranulomatosa alrededor de los haces neurovasculares. La reacción de tipoII (eritema nudoso leproso) consiste en una vasculitis leucocitoclástica añadida a los hallazgos de lepra existentes, con globi. Una variante de la anterior es el fenómeno de Lucio, donde hay una importante inflamación con trombos arteriales, infartos y abundantes microorganismos68.
Las bacterias del complejo Mycobacterium leprae son bacilos grampositivos y ácido-alcohol resistentes que se pueden poner de manifiesto con técnicas de Fite o Ziehl-Neelsen, así como mediante PCR65.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este artículo es una iniciativa del Grupo Español de Dermatopatología de la Academia Española de Dermatología y Venereología y de la Sociedad Española de Anatomía Patológica. Todos los autores firmantes han contribuido por igual en la elaboración del manuscrito, independientemente del orden de apellidos.