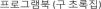La sífilis maligna (SM) es una manifestación poco común de la sífilis secundaria. Esta se presentará principalmente en individuos inmunodeprimidos, como es el caso de los pacientes con una coinfección por el virus de la inmunodeficiencia humana (VIH). Sin embargo, recientemente se han descrito casos de SM también en personas inmunocompetentes. Se realizó una revisión de los casos publicados entre el año 2014 y el 2018 para recoger las características de los pacientes con SM, así como los factores de riesgo asociados. De los 45 casos publicados, 33 (73%) ocurrieron en personas VIH positivas, la mayoría con recuentos de CD4 < 500 células/mm3. De los 12 casos (27%) en pacientes VIH-negativo, la mitad tenía comorbilidades como diabetes mellitus, alcoholismo, abuso de drogas, psoriasis y hepatitis. La manifestación más frecuente de la SM fueron las lesiones cutáneas ulcero-nodulares, las que presentaban una costra central adherente, y que afectaban la cara, el tronco y las extremidades. Dado el creciente número de SM, independientemente del estado inmunológico, los dermatólogos y médicos generales deben tener en cuenta la existencia de esta entidad para así poder realizar un diagnóstico y tratamiento oportuno, reduciendo de esta manera la morbilidad asociada.
Malignant syphilis (MS) is a rare manifestation of secondary syphilis which mainly occurs in immunocompromised individuals such as those coinfected with human immunodeficiency virus (HIV). However, recent reports have described MS in immunocompetent individuals. To describe the characteristics of individuals with MS and associated risk factors, a review of case reports published from 2014 to 2018 was conducted. Out of 45 published case reports, 33 cases (73%) occurred in HIV-positive individuals with majority having CD4 counts < 500 cells/mm3. Of the 12 cases (27%) in HIV-negative individuals, half had comorbidities such as diabetes mellitus, alcoholism, drug abuse, psoriasis, and hepatitis. The most frequent manifestation of MS was ulceronodular cutaneous lesions with central adherent crust, which affected the face, trunk, and limbs. Given the increasing number of MS regardless of the immune status, dermatologists and general practitioners should be vigilant to allow early diagnosis and treatment, hence reducing their morbidity.
La sífilis es una infección causada por el Treponema pallidum, una espiroqueta que infecta exclusivamente al ser humano1. La sífilis maligna (SM), también conocida como lues maligna o sífilis rupioide, es una forma agresiva poco frecuente de sífilis secundaria1. El término «rupioide» proviene de la rupia, debido a la apariencia «como de ostra» de estas lesiones, haciendo referencia a las placas bien delimitadas con presencia de costras gruesas, laminadas y adherentes en la superficie, que se asemejan a la concha de una ostra2. En 1859, el dermatólogo francés Pierre Bazin utilizó por primera vez el término «maligno» para describir un caso de sífilis secundaria, y en 1896, en el Tercer Congreso Internacional de Dermatología en Londres, el dermatólogo danés Haslund y el especialista alemán Neisser, clasificaron a la SM de forma independiente como una forma rara, agresiva y ulcerativa de sífilis secundaria y no una forma temprana de sífilis terciaria, como se creía hasta ese momento1,3. Esta patología se distinguirá de la sífilis secundaria clásica por presentar un cuadro clínico más grave y por la presencia de lesiones cutáneas pleomórficas y ulcero- necróticas4.
La SM se presenta como pápulas y placas costrosas o descamativas que pueden ulcerarse o hacerse necróticas5. El exantema afecta principalmente al tronco y a las extremidades, aunque también puede dañar la cara, el cuero cabelludo, las mucosas, las palmas y las plantas de los pies. En pacientes con esta enfermedad, se observa con frecuencia la presencia de una linfadenopatía periférica palpable, fiebre y síntomas constitucionales. Existe un número limitado de casos de SM publicados en la literatura médica, y la mayoría de los que han sido notificados han sido en individuos inmunodeprimidos, particularmente en aquellos infectados con el virus de la inmunodeficiencia humana (VIH)6. La sífilis y la coinfección por VIH pueden conducir a un aumento de la carga viral del VIH, concomitantemente con una disminución del recuento de células CD4 +, lo que aumenta, en gran medida, el riesgo de SM, especialmente si no se trata7,8. Antes de la pandemia por el VIH, la SM era extremadamente rara. Entre 1900 y 1988, solo se habían publicado 14 casos en idioma inglés. En la actualidad, se estima que hasta el 7% de todos los casos de sífilis en pacientes inmunodeprimidos cumplen los criterios de SM, presentándose a menudo como la primera manifestación clínica de la infección por VIH4. Sin embargo, recientemente han sido publicados algunos casos de pacientes con incompetente que han presentado una SM9,10. Por este motivo, se decidió realizar una revisión sistemática de los casos de SM publicados entre el 2014 y el 2018, con la finalidad de analizar los factores demográficos y de riesgo relacionados con esta entidad.
MétodosPara poder revisar los datos clínicos, laboratoriales y de los tratamientos en los pacientes con el diagnóstico de SM, se realizó una búsqueda de la literatura publicada entre los años 2014 y 2018, utilizando dos bases de datos diferentes (PubMed y Google Académico). Los términos usados para la búsqueda fueron: sífilis maligna o sífilis rupioide o sífilis ulcero nodular (fig. 1). Dicha búsqueda bibliográfica arrojó 39 artículos, los que fueron revisados de manera independiente por dos investigadores. Cuando existía algún desacuerdo, este se resolvía en consenso por ambos. Se incluyeron todos los artículos en los que el diagnóstico se confirmaba mediante una serología o cualquier combinación de serología, hallazgos patológicos e inmunotinción. No se incluyeron trabajos que carecían de pruebas serológicas positivas. Los criterios de inclusión de los trabajos fueron: (1) relato de caso con alguna de las expresiones mencionadas en el título; (2) artículo en inglés; (3) artículos publicados entre el año 2014 y el 2018; y (4) contener toda la información necesaria (género, edad, comportamiento sexual [heterosexual, bisexual u homosexual], ubicación y descripción de las lesiones, forma de aparición, resultados serológicos e histopatológicos, estado de VIH, inmunotinción, tratamiento, reacciones postratamiento y resultados). En total, 36 de los 39 artículos se consideraron relevantes y cumplieron con los criterios de inclusión. De los documentos seleccionados, se recopilaron un total de 45 casos de SM2,3,9–39. Se recogieron los datos de cada caso y estos fueron registrados en una hoja de cálculo de Microsoft Excel 2016. Para realizar el análisis estadístico descriptivo básico de los datos recogidos, se utilizó Microsoft Excel 2016 (frecuencias, porcentajes y medianas). No se hizo ninguna prueba de hipótesis.
ResultadosCaracterísticas demográficasLa mayoría (84%) de los pacientes eran varones, con una mediana de edad de 41 años (rango de 20 a 86 años). La mayor incidencia se registró en el grupo de entre los 40 a los 44 años (tabla 1). En los casos revisados, se disponía de la información mínima acerca de las conductas de alto riesgo (posiblemente relacionadas con la adquisición de sífilis).
Características demográficas y los factores de riesgo de sífilis en pacientes con sífilis maligna
| Características | Pacientes (n) | (%) |
|---|---|---|
| Sexo | ||
| Masculino | 38 | 84,4 |
| Femenino | 7 | 15,6 |
| Grupo etario | ||
| 20-24 | 3 | 6,7 |
| 25-29 | 7 | 15,6 |
| 30-34 | 1 | 2,2 |
| 35-39 | 9 | 20 |
| 40-44 | 13 | 28,9 |
| 45-54 | 8 | 17,8 |
| 55-64 | 2 | 4,4 |
| >65 | 2 | 4,4 |
| Serología positiva | ||
| No-treponémicas (VDRL, RPR) | 41† | - |
| Treponémicas (FTA-ABS,TPHA, TPPA) | 35† | - |
| Estatus de VIH | ||
| Positivo | 33 | 73,3 |
| Negativo | 12 | 26,7 |
| CD4 VIH (+) (cels/mm3) | ||
| < 200 | 8 | 24,2 |
| 200-499 | 17 | 51,5 |
| >500 | 5 | 15,2 |
| No informado | 3 | 9,1 |
| Tratamiento | ||
| BPG | 29 | 64,4 |
| Penicilina G | 7 | 15,6 |
| Doxiciclina | 6 | 13,3 |
| Ceftriaxona | 3 | 6,7 |
| JHR | ||
| Positiva | 9 | 20 |
| Negativa | 36 | 80 |
BPG: Penicilina benzatínica G; FTA-ABS: Fluorescent Treponemal Antibody Absorption; JHR: Reacción de Jarisch-Herxheimer; RPR: Rapid Plasma Reagin; TPHA: Treponema Pallidum Hemagglutination Assay; TPPA: Treponema pallidumpartcle agglutination; VDRL: Venereal Disease Research Laboratory, VIH: Virus de la inmunodeficiencia humana.
Las manifestaciones clínicas se describen en la tabla 2. Las más frecuentes fueron las lesiones cutáneas ulcero-nodulares con una costra superficial central adherente localizadas predominantemente en la cara, el tronco y/o las extremidades (tabla 2). Se contó con los datos serológicos de 44 de los 45 casos. El diagnóstico de sífilis se confirmó mediante pruebas no treponémicas y treponémicas, que se reportaron como positivas en 41 y 35 casos, respectivamente. La mayoría (73%) de los pacientes eran VIH positivos; entre ellos, el 51% tenía un rango de recuento de células CD4 de 200 a 499 células/mm3. En particular, de los 12 pacientes inmunocompetentes, seis (50%) tenían una comorbilidad, como diabetes mellitus, alcoholismo, abuso de drogas, psoriasis y hepatitis.
Estudios sobre sífilis maligna publicados entre el año 2014-2018
| Núm. | Referencias | Raza,sexo,edad (años),orientación sexual | Estado de VIHValor de CD4(cels/mm3)/otros | Localización de las lesiones | Inicio (antes del ingreso) | Resultado de prueba serológica | Histopatología | Inmunotinción/ tinción de microorganismo | Tratamiento | JHR | Tiempo de Resolución/ mejoría |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1. | Dos Santos et al., 201411 | Africana, 27, HSH | VIH +340 | Frente, espalda, miembros inferiores | 3 meses | VDRL 1:128 | Infiltrado inflamatorio perivascular mixto y granuloma en la dermis | ND | Doxiciclina 100 mg/12 horas/VO por 3 semanas | −Hidrocortisona profiláctica 200 mg IV | 3 semanas |
| 2. | Maldonado et al., 201412 | Masculino, 42 | VIH +442 | Cara, cuero cabelludo, tronco, extremidades | 8 días | RPR 1:64IgG +TPPA + | Histiocitos abundantes, células gigantes y células plasmáticas en la dermis | + | Penicilina Benzatínica G 2,4 mU/sem/IM por 3 semanas | − | 3 semanas |
| 3. | Maldonado et al., 201412 | Masculino, 33 | VIH +1.294 | Cuero cabelludo, mejilla, miembros superiores, tronco | 5 meses | RPR 1:16TPPA + | Linfocitos y células plasmáticas en la dermis | + | Penicilina Benzatínica G 2,4 mU/sem/IM por 3 semanas | − | 10 días |
| 4. | Maldonado et al., 201412 | Masculino, 25 | VIH +210 | Tronco, cuero cabelludo | 1 mes | RPR 1:64TPPA + | Infiltrado denso liquenoide, linfocitos, histiocitos, y numerosas células plasmáticas en la epidermis | + | Penicilina Benzatínica G 2,4 mU/sem/ IM por 3 semanas | − | 2 semanas |
| 5. | Bustos et al., 201413 | Masculino, 46 | VIH −Hepatitis B | Tronco, extremidades, genitales, cuero cabelludo | 2 meses | VDRL 1:32, FTA-ABS + | Infiltrado linfocitos e histiocitos intenso, células plasmáticas abundantes en la dermis | ND | Penicilina Benzatínica G 2,4 mU/sem/IM por 3 semanas | − | 3 semanas |
| 6. | Bueno et al., 20144 | Femenino, 29 | VIH −Psoriasis | Rostro, tronco, extremidades | 2 semanas | VDRL 1:256Pruebas treponémicas + | Infiltrado denso linfohistocitario rico en células plasmáticas, con extensión de la dermis profunda | + | Penicilina Benzatínica G 2,4 mU/sem/IM por 3 semanas | + | 3 meses |
| 7. | Kong et al., 201414 | Masculino, 36, HSH | VIH + | Rostro, tronco | 3 semanas | VDRL 1:128 | Granulomas, linfocitos, y células plasmáticas en las dermis | ND | Penicilina Benzatínica G | − | Mejorado |
| 8. | Andino et al., 20158 | Blanca, masculino, 25 | VIH +236 | Rostro, tronco, extremidades, pene | 3 meses | RPR 1:512MHA-TP + | Infiltrado denso de células plasmáticos, linfocitos, e histiocitos | + | Penicilina Benzatínica G 2,4 mU/sem/IM por 3 semanas | − | 1 semana |
| 9. | Devkota et al., 201515 | Afroamericana, masculino, 20, HSH | VIH +276 | Tronco, rostro, y extremidades superiores | 1 mes | RPR 1:128,FTA-ABS + | Infiltrado liquenoide linfohistiocitario con células plasmáticas | + | Doxiciclina 100 mg/ 12 horas/ VO por 3 semanas | + | 3 semanas |
| 10. | Jalili et al., 201516 | Blanca, femenino, 47 | VIH +155 | Extremidades superiores, inferiores, tronco, cabeza | 1 mes | IgM +TPPA +TPHA 1:1280VDRL 1:32 | Infiltrado perivascular y perifolicular de linfocitos, histiocitos y numerosas células plasmáticas en la dermis | − | Penicilina Benzatínica G 2,4 mU/sem/IM por 3 semanas | −Metilprednisolona profiláctica 40 mg VO 1 hora antes de las inyecciones con penicilina | 4 semanas |
| 11. | Li et al., 201517 | Asiática, masculino, 38, heterosexual | VIH − | Rostro, tronco, extremidades | 1 mes | TPPA +RPR 1:128 | Infiltrado perivascular mixto con neutrófilos, linfocitos, células plasmáticas, e histiocitos en la dermis | ND | Penicilina Benzatínica G 2,4 mU/sem/IM por 3 semanas | − | Mejorado |
| 12. | Li et al., 201518 | Asiática, masculino, 35 | VIH −DM | Rostro, tronco, extremidades | 1 meses | TPHA +RPR 1:256 | Infiltrado perivascular denso de neutrófilos, linfocitos, células plasmáticas e histiocitos | ND | Penicilina Benzatínica G 2,4 mU/sem/IM por 3 semanas | −Prednisona profiláctica 40 mg 1 día antes de iniciar con la penicilina | 4 semanas |
| 13. | Chang et al., 201519 | Asiática, masculino, 22 | VIH +360 | Rostro, tronco, extremidades | 1 semana | RPR 1:4TPHA 1:320 | Infiltrado de neutrófilos, linfocitos, histiocitosperivascular e intersticial, y algunas células plasmáticas de la dermis | ND | Penicilina G acuosa 24 mU/día/IV por 2 semanas | − | Varios días |
| 14. | Chang et al., 201519 | Asiática, masculino, 26, HSH | VIH +88 | Rostro, tronco, extremidades, genitales | 3 semanas | RPR 1:512TPHA 1:20.480 | Infiltrado linfohistiocitario denso en la dermis superior y media, abundantes células plasmáticas | + | Penicilina G acuosa 12 mU/día/IV por 18 días y ciprofloxacino por 7 días | − | 21 días |
| 15. | Hanson et al., 201520 | Masculino, 45 | VIH +441 | Espalda, ingle | 5 semanas | RPR 1:256 | Dermatitis perivascular granulomatosa con escasas células plasmáticas | + | Penicilina Benzatínica G 2,4 mU/sem/IM por 3 semanas | + | ND |
| 16. | Alves et al., 201521 | Masculino, 57, HSH | VIH − | Cabeza, cuello, tronco, extremidades | 4 meses | RPR 1:128TPHA 1:5120 | Infiltrado dérmico inflamatorio difuso compuesto por células plasmáticas, histiocitos, y linfocitos formando granulomas en la dermis profunda | ND | Penicilina Benzatínica G 2,4 mU/sem/IM por 3 semanas | − | Mejorado, curación completa en 6 semanas |
| 17. | Braue et al., 20153 | Afroamericana, masculino, 36 | VIH +450 | Cabeza, rostro, cuello, extremidades | 1 mes | FTA-ABS +RPR 1:1024 | Infiltrado dérmico prominente de histiocitos epitelioides, con granulomas poco formados con células gigantes, infiltrado perifolicular linfohistiocitario | + | Penicilina G acuosa 24 mU/día/IV por 2 semanas con una dosis descendente (debido a JHR). Posteriormente, la penicilina Benzatínica G 2,4 mU/sem/IM por 3 semanas | + | 1 semana |
| 18. | Yamashita et al., 201522 | Asiática, masculino, 40, heterosexual | VIH +110 | Tronco, extremidades | 4 semanas | RPR + (5,4 RU, método card x4)TP Ag + (2.713,6 U) | Vasos dérmicos con venulitis y extravasación de glóbulos rojos, neutrófilos abundantes, histiocitos, un pequeño número de células plasmáticas, y eosinófilos | + | Penicilina G | - | ND |
| 19. | Martinez et al., 201623 | Masculino, 54, bisexual | VIH +497 | Rostro, tronco, extremidades, escroto, palmas, y plantas | 2 semanas | RPR 1:8TPHA 1:2560 | No mencionado | + | Penicilina Benzatínica G 2,4 mU/sem/IM por 3 semanas | + | ND |
| 20. | Muylaert et al., 201624 | Femenino, 50 | VIH −Alcohólica usuaria de drogas | Rostro, tronco, extremidades | 4 meses | VDRL 1:512FTA-ABS +IgG +IgM + | Sífilis secundaria confirmada | ND | Penicilina Benzatínica G 2,4 mU posteriormente Ceftriaxona por 14 días | + | 2 semanas |
| 21. | Martins et al., 201625 | Blanca, femenino, 53 | VIH −DM | Cabeza, pecho, extremidades | 20 días | VDRL 1:8FTA-ABS + | Un clúster de granulomas no caseificantes, células plasmáticas, escasos eosinófilos, tumefacción endotelial en la dermis | ND | Penicilina Benzatínica G 2,4 mU/ semana/IM por 3 semanas y prednisona 60 mg VO diariamente | – | ND |
| 22. | Borges, 201626 | Blanca, masculino, 42, heterosexual | VIH +435 | Tronco, extremidades superiores | 2 semanas | TPHA y VDRL >1:256 | ND | ND | Penicilina Benzatínica G 2,4 mU/IM | – | Mejorado |
| 23. | Borges, 201626 | Blanca, masculino, 42, heterosexual | VIH +435 | Tronco, extremidades superiores | 2-8 semanas | TPHA y VDRL >1:256 | ND | ND | Penicilina Benzatínica G 2,4 mU/IM | – | Mejorado |
| 24. | Borges, 201626 | Blanca, masculino, 42, heterosexual | VIH +435 | Cabeza, tronco, extremidades superiores | 2 meses | TPHA y VDRL >1:256 | ND | ND | Penicilina Benzatínica G 2,4 mU/IM | – | Mejorado |
| 25. | Sammet y Draenert, 201627 | Masculino, 40, bisexual | VIH +360 | Tronco, generalizado | 3 episodios previos | TPPA320,000 (2010)1,28 mill (2012)320,000 (2014)RPR | ND | ND | Ceftriaxona 2 g/día/IV por 3 semanas | −Prednisolona profiláctica 1 mg/kg PO en dosis única | 1 semana |
| 26. | Krase et al., 201628 | Asiática, masculino, 43 | VIH−CKDDM | Tronco, extremidades | Varios meses | FTA-ABS +RPR 1:4 | Infiltrado perivascular de linfocitos, numerosas células plasmáticas, y eosinófilos dispersos | ND | Penicilina Benzatínica G 2,4 mU/ semana/IM por 3 semanas | − | Completamente curado en 3 meses |
| 27. | Delgado y Caceres, 201729 | Masculino, 25 | VIH +108 | Rostro, pecho, extremidades | 1 mes | RPR 1:128, FTA-ABS + | Infiltrado granulomatoso no caseificante crónico con presencia de células plasmáticas en la dermis | ND | Penicilina Benzatínica G | − | Mejorado |
| 28. | Mohan et al., 201730 | Masculino, 36 | VIH +57 | Rostro, tronco, extremidades | 6 semanas | RPR 1:64 | Dermatits liquenoide, psoriasiforme, granulomatosa | + | Doxiciclina 100 mg VO | − | 1 semana |
| 29. | Rao et al., 201731 | Asiática, masculino, 35, heterosexual | VIH− | Rostro, tronco, extremidades | 1 mes | VDRL 1:32TPHA 1:60 | Colección densa de neutrófilos linfocitos, escasas células plasmáticas en la dermis, células PMN en la pared de los vasos (endarteritis obliterante) | ND | Penicilina Benzatínica G 2,4 mU/ semana IM | − | Mejorado |
| 30. | Johnson y Spivak, 201732 | Masculino, 41 | VIH +629 | Pie derecho, pectoral izquierdo | 9 meses | RPR 1:1024 | Células plasmáticas abundantes e hiperplasia endotelial | − | Penicilina Benzatínica G 2,4 mU/ semana/IM por 3 semanas | − | 72 horas |
| 31. | Mena et al., 201733 | Masculino, 58, HSH | VIH +463 | Tronco, extremidades, testículos | 2 semanas | RPR 1:256 | Denso infiltrado dérmico de células plasmáticas con presencia de una costra seropurulenta y cambios de hiperplasia epidérmica reactiva | − | Penicilina Benzatínica G 2,4 mU/ semana/IM en dosis única | − | 1 semana |
| 32. | Faraone y Portini, 201734 | Blanca, femenino, 86, heterosexual | VIH− | Lengua, rostro, tronco, extremidades | 4 meses | TPHA 1:10.240VDRL + | Ulceración epitelial y un infiltrado perivascular intenso de la lámina propia, rico en células plasmáticas | ND | Ceftriaxona por 2 semanas | − | Rápido (completamente curado en 1 mes) |
| 33. | Gevorgyan et al., 201735 | Masculino, 41 | VIH +101Usuario de drogas | Rostro, tronco, extremidades, cuero cabelludo, plantas | 4 meses | TP Ab +RPR 1:64 | NA | ND | Penicilina Benzatínica G 2,4 mU/ semana/IM por 3 semanas | + | 2 días (completamente curado en 1 mes) |
| 34. | Zanella et al., 20172 | Masculino, 42 | VIH +140 | Rostro, tronco, extremidades, palmo plantar, mucosa oral y genital | 2 meses | VDRL 1:128TPHA + | Infiltrado linfohistiocitario con eosinófilos y leucocitos, y células epitelioides con células gigantes multinucleadas | ND | Penicilina Benzatínica G 2,4 mU/ semana/IM por 3 semanas | + | Mejorado tras tratamiento |
| 35. | Zanella et al., 20172 | Femenino, 42 | VIH +586 | Rostro, lengua, espalda | 2 meses | VDRL 1:64TPHA + | Dermatitis perivascular profunda | ND | Ceftriaxona 2 g/día por 2 semanas | −Corticosteroides profilácticos | Mejorado tras tratamiento |
| 36. | Yap et al., 201836 | Masculino, 71 | VIH +252 | Tronco, extremidad, palmas, y plantas | 2 semanas | RPR 1:256TPPA + | Ulceración epidérmica con la presencia de un infiltrado dérmico conformado predominantemente por células mononucleares, histiocitos abundantes, y células plasmáticas | ND | Penicilina G Acuosa 12 mU/día/IV por 15 días | −Prednisolona profiláctica 60 mg/día por 5 días | 2 semanas |
| 37. | Sun et al., 201837 | Asiática, masculino, 23 | VIH +CD4 disminuidos | Rostro, tronco, extremidades | 2 meses | Prueba treponémica + | ND | + | Doxiciclina 100 mg/12 horas/VO por 2 semanas | − | 2 semanas |
| 38. | Yang et al., 201838 | Asiática, masculino, 52 | VIH + | Rostro | 6 meses | Prueba treponémica + | ND | + | Penicilina Benzatínica G 2,4 mU/ semana/IM por 3 semanas | − | 1 semana |
| 39. | Fustà et al., 201839 | Hispana, masculino, 39, HSH | VIH +171 | Palmo plantar, rostro, tronco, cuero cabelludo | 2 semanas | VDRL 1:128 | Dermatitis liquenoide (linfocitos, histiocitos, células plasmáticas). | + | Penicilina Benzatínica G 2,4 mU/ semana/IM por 3 semanas | + | Mejorado |
| 40. | Fustà et al., 201839 | Hispana, masculino, 36, HSH | VIH +250 | Palmoplantar, uñas, cuero cabelludo, rostro | 3 semanas | VDRL 1:250 | Dermatitis espongiótica (histiocitos, células plasmáticas). | + | Penicilina G acuosa 24 mU/día/ IV por 15 días | + | Mejorado |
| 41. | Fustà et al., 201839 | Hispana, masculino, 54, HSH | VIH +697 | Palmoplantar, extremidades | 1 mes | VDRL 1:512 | Dermatitis liquenoide(linfocitos, histiocitos, células plasmáticas). | − | Penicilina Benzatínica G 2,4 mU/ semana/IM por 3 semanas | − | Mejorado |
| 42. | Fustà et al., 201839 | Hispana, masculino, 26, HSH | VIH +790 | Palmoplantar, cuero cabelludo, extremidades | 1 mes | VDRL 1:256 | Dermatitis absecificada (linfocitos, histiocitos, células plasmáticas). | − | Penicilina Benzatínica G 2,4 mU/ IM dosis única | − | Mejorado |
| 43. | Mitteldorf et al., 20187 | Caucásica, masculino, 42 | VIH +312 | Tronco | 6 semanas | ND | Infiltrado liquenoide, histiocitos. y células plasmáticas en la dermis | + | Penicilina G acuosa 30 mU/ dia/IV por 2 semanas | −Prednisona profiláctica 60 mg dosis única | Pocas semanas |
| 44. | Pradhan et al., 20189 | Femenino, 35, heterosexual | VIH− | Rostro, tronco, extremidades, genital, palmas, plantas, cuero cabelludo | 3 semanas | VDRL 1:64TPHA 1:160 | Células plasmáticas en la pared del vaso y en vasos trombosados en la dermis con una endarteritis | ND | Doxiciclina 100 mg/12 horas/VO por 3 semanas | − | 2 semanas |
| 45. | Rockwood, y Nwokolo, 201810 | Blanca, masculino, 41, heterosexual | VIH− | Rostro, tronco, extremidades, masa testicular izquierda | 2 semanas | TPPA +RPR 1:256 | Epididimo-orquitis crónica con granulomas poco formados | + | Doxiciclina 100 mg/12 horas/PO por 4 semanas | − | 4 semanas |
FTA-ABS: Fluorescent treponemal antibody absorbed; HSH: Hombre que tiene sexo con hombre; IgG: inmunoglobulina G; IgM: inmunoglobulina M; IM: Intramuscular; IV: vía intravenosa; JHR: reacción de Jarisch-Herxheimer; NA: not available; ND: No disponible; PMN: polymorphonuclear; RPR: Reagina plasmática rápida; RU: RPR unit; TP Ab: Treponema pallidum anticuerpo; TPHA: Treponema pallidum hemaglutinación test; TPPA: Treponema pallidumpartcle agglutination; VDRL: Venereal Diseases Research Laboratory; VIH: Virus de la inmunodeficiencia humana; VO: Vía oral.
Las lesiones cutáneas fueron estudiadas y confirmadas histológicamente en 37 de los 45 casos revisados (tabla 2). Las características histopatológicas reportadas con mayor frecuencia fueron el infiltrado dérmico linfohistiocítico compuesto por células plasmáticas. Se proporcionaron datos sobre la inmunotinción y la tinción de microorganismos en 23 de los casos. El T. pallidum se detectó en 17 de esos pacientes. En los seis individuos restantes, no se detectaron espiroquetas (tabla 2).
Tratamiento y resultadoAproximadamente dos tercios (64%) de los pacientes fueron tratados con penicilina G benzatínica intramuscular y los casos restantes con terapias alternativas, como la penicilina G acuosa intravenosa, doxiciclina oral o ceftriaxona intravenosa (tabla 1). Nueve pacientes (20%) experimentaron una reacción de Jarisch-Herxheimer (JHR), de ellos, siete se trataron con corticosteroides profilácticos (tabla 2).
DiscusiónSe revisaron 45 casos de pacientes con diagnóstico de SM, publicados entre el año 2014 al 2018. Se conoce ampliamente que la SM con frecuencia se presentará en sujetos inmunodeprimidos, como es el caso de los pacientes con VIH. Se desconoce la patogenia de la SM, pero en general, se cree que la inmunosupresión debida a la coinfección por VIH permite que el T. pallidum sea más agresivo. Sin embargo, cabe destacar que la mayoría de las personas con VIH tenían un recuento de células CD > 200 células/mm3 y, por lo tanto, presentaban una inmunosupresión marcada12. La pérdida de células T CD4 que se produce como resultado de la infección por VIH u otras afectaciones4 conlleva a una mayor acción de las células T citotóxicas y de los neutrófilos de la piel2 en la SM. Como resultado, la SM se diferenciará de la sífilis convencional, ya que esta se presentará en personas con sistemas inmunitarios conservados. Este razonamiento concuerda con la mayor afectación de pacientes con comorbilidades o enfermedades que alteran el sistema inmune. Nuestra revisión demostró que seis de los 12 individuos VIH negativos (50%) tenían otras comorbilidades que podrían afectar su función inmunológica, como el diagnóstico de diabetes mellitus, alcoholismo, abuso de drogas, psoriasis y hepatitis. La aparición de SM en pacientes VIH negativos con comorbilidades plantea la posibilidad de una respuesta inmune aberrante causada por estas condiciones sistémicas que desencadenan una manifestación cutánea más grave y la posible existencia de cepas de Treponema más virulentas, hipótesis que ya se había considerado previamente por otros autores4,32,38,39.
La SM se encuentra con frecuencia en asociación con títulos no treponémicos altos y síntomas sistémicos5. Para guiar el diagnóstico clínico, en 1969, Fisher et al. propusieron cuatro criterios que ayudaban a identificar esta variante poco recurrente de sífilis: una morfología macroscópica y microscópica similar; una prueba serológica de sífilis con títulos elevados; JHR; y una respuesta espectacular a la terapia antibiótica40.
El diagnóstico por biopsia de la piel en pacientes afectados es un desafío, ya que la presencia de espiroquetas en las lesiones cutáneas generalmente es escasa. Sin embargo, la biopsia de piel se recomienda para poder excluir otras infecciones bacterianas, fúngicas y micobacterianas. Los datos obtenidos con tinciones especiales y microscopía de campo oscuro pueden ser insuficientes para hacer un diagnóstico histológico33,40, sin embargo, el examen microscópico puede revelar hallazgos inflamatorios inespecíficos, como patrones histológicos de infiltrado dérmico con células plasmáticas y linfocitos, a veces daño granulomatoso y vascular. Nuestra revisión demostró que el infiltrado dérmico linfohistiocítico con células plasmáticas fue la característica histológica reportada con mayor frecuencia12. La utilización de la inmunohistoquímica será superior a las tinciones con plata para detectar espiroquetas, sin embargo, no siempre estará disponible como una técnica de rutina33.
Se ha descrito un aumento en la incidencia de la JHR tanto en pacientes con SM como en pacientes con VIH en general. Yang et al. describieron una tasa de incidencia de la JHR del 34,6% en pacientes infectados por el VIH41. En nuestra revisión, la JHR se notificó en solo nueve pacientes (20%), y de estos, siete recibieron corticosteroides profilácticos. La JHR es un fenómeno inmunológico transitorio que se observa comúnmente en pacientes durante el tratamiento de la sífilis secundaria. Se manifestará con síntomas constitucionales como fiebre, escalofríos, cefalea y mialgias, además de exacerbación de las lesiones cutáneas existentes. La reacción generalmente ocurre horas después de la administración de un antibiótico apropiado y normalmente se resuelve sin ninguna intervención dentro de las primeras 24 horas. La JHR será más grave cuando el número de patógenos es abundante, lo que concuerda con una prueba serológica de títulos altos como parte de los criterios de la SM. Debe tratarse sintomáticamente y no requiere la interrupción del tratamiento antimicrobiano apropiado. Se han utilizado corticosteroides para prevenir la reacción, pero no hay evidencia concluyente sobre su beneficio35,42.
Actualmente, no existen recomendaciones específicas para el tratamiento de la SM. El régimen de terapia más utilizado es el mismo que se emplea para la sífilis latente tardía (tres inyecciones intramusculares semanales consecutivas de penicilina benzatínica, 2,4 millones de unidades/dosis). En caso de alergia a la penicilina, se puede usar un tratamiento con ceftriaxona. En casos resistentes o de recaídas, se sugiere terapia prolongada con altas dosis de penicilina12,25. Aproximadamente el 80% de los pacientes de nuestra revisión fueron tratados con penicilina, ya sea por vía intramuscular o por vía intravenosa como solución acuosa y todos los sujetos tuvieron una rápida mejoría de su condición después del tratamiento con antibióticos.
ConclusionesLa presente revisión incluyó 45 casos de SM publicados entre el año 2014 y el 2018, disponibles en las bases de datos de PubMed y/o Google Académico. De todos los pacientes, el 74% eran seropositivos. De los individuos VIH negativos, la mitad tenía una comorbilidad como diabetes mellitus, alcoholismo, abuso de drogas, psoriasis o hepatitis. La mayoría de los casos se dieron en hombres (84%), la mediana de edad de presentación fue de 41 años, siendo el grupo de edad de entre 40 a 44 años el más afectado. Las manifestaciones cutáneas más frecuentes fueron la presencia de lesiones ulcero-nodulares con una costra adherente superficial central, localizadas en la cara, el tronco y las extremidades. La mitad de los pacientes con infección por VIH tienen un recuento de células CD4 en el rango de 200 a 499 células/mm3. La mayoría de las personas fueron tratadas con penicilina G benzatínica o penicilina G acuosa, y todas experimentaron una rápida mejoría clínica después de la terapia con antibióticos. Se notificó una JHR en el 20% de los pacientes, a pesar de que la mayoría de ellos habían recibido corticosteroides profilácticos. Debido al incremento del número de casos de esta forma poco frecuente de sífilis, independientemente del estado inmunológico, tanto los dermatólogos como los médicos generales deben de estar pendientes ante la sospecha diagnóstica de una SM, lo que permitirá realizar un diagnóstico y un tratamiento oportuno, reduciendo así su morbilidad.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nos gustaría agradecer a Hindawi Editage (http://hindawi.editage.com/) por la edición en inglés.