La vasculopatía livedoide (VL) es una enfermedad cutánea trombótica oclusiva infrecuente, que afecta principalmente a los pequeños vasos sanguíneos de las extremidades inferiores. Se trata de una situación recurrente y dolorosa, caracterizada por livedo persistente asociado a ulceraciones dolorosas recurrentes, principalmente alrededor de los maléolos, que evoluciona a lesiones cicatriciales atróficas (atrofia blanca)1–3. El diagnóstico se confirma mediante biopsia cutánea2,3, que muestra anomalías vasculares, incluyendo trombosis intraluminal, proliferación endotelial y degeneración hialina de la subíntima (fig. 1)1,2,4. Esta situación es más común en mujeres de mediana edad1–3. Su patogenia es incierta, aunque puede estar asociada a diversas coagulopatías y síndromes afines2,4,5. El inhibidor del activador de plasminógeno tipo 1 (PAI-1) es un importante inhibidor del sistema fibrinolítico, habiéndose descrito niveles elevados de PAI-1 en los pacientes con VL4,6. El tratamiento para VL es difícil, y no está bien establecido, siendo su objetivo la mejora de las lesiones cutáneas, el alivio del dolor y la prevención de la recidiva. La terapia más ampliamente prescrita es la administración de anticoagulantes (más frecuentemente como monoterapia, lográndose una respuesta favorable en el 98% de los pacientes), esteroides anabólicos (para controlar los síntomas agudos debido a su efecto antiinflamatorio, aunque también pueden aumentar la fibrinólisis y la inhibición de la coagulación), inmunoglobulinas intravenosas y antiplaquetarios, entre una serie de terapias que incluyen dipiridamol, pentoxifilina y nifedipina1,7,8. Recientemente se han utilizado, también, los nuevos anticoagulantes orales antagonistas no vitamina K (NOAC), especialmente rivaroxabán, con éxito considerable5,7–9.
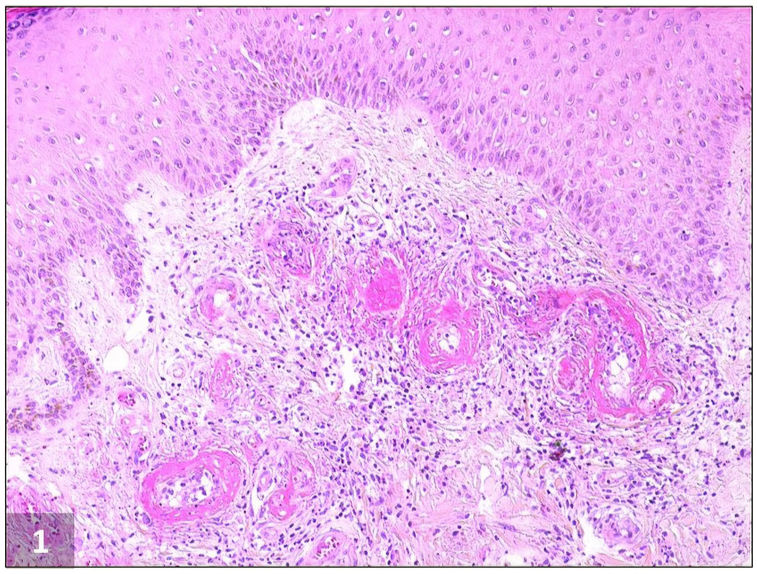
Imagen histopatológica de vasculopatía livedoide. Depósito de fibrina dentro de la pared y luz de los vasos sanguíneos dérmicos que origina engrosamiento de las paredes de los vasos y oclusión vascular debido a la trombosis. También se observan fibrosis dérmica e infiltrado linfocítico perivascular (H&E, ×100).
Reportamos 2 casos de VL en mujeres de mediana edad con enfermedad recalcitrante, que albergaron polimorfismos de riesgo incrementado del promotor de PAI-1, y que fueron exitosamente tratadas con NOAC.
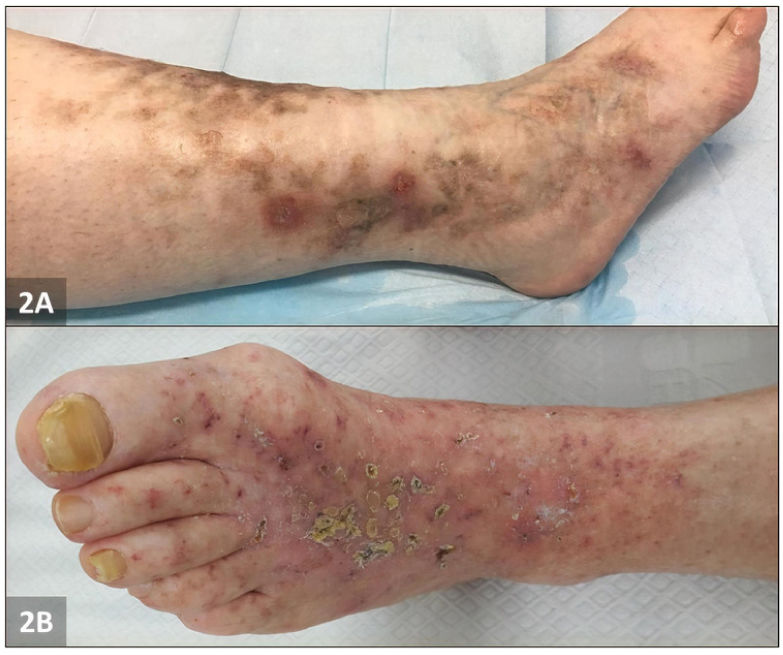
El paciente número 1 fue una mujer de 42 años, que acudió a nuestra clínica con historia de pápulas purpúricas colaescentes y blandas de 14 meses de evolución en la parte baja de las piernas, que habían evolucionado a ulceraciones profundas y dolorosas, no teniendo historia clínica pasada relevante. La exploración física reveló piel moteada y úlceras perforadas rodeadas de eritema purpúrico e hiperpigmentación en ambas regiones maleolares, con eritema reticular y lívido en las piernas. Diversas úlceras habían sanado, evolucionando a cicatrices esteladas atróficas (fig. 2A). La biopsia cutánea fue compatible con VL (fig. 1). Se detectó homocigosidad 4G/4G del promotor PAI-1 en la secuenciación de ADN. Se prescribieron aspirina y prednisolona oral, observándose una mejoría leve. Se rebajó gradualmente la dosis de prednisolona (hasta 5mg/día), manteniéndose la dosis estándar de aspirina como terapia de mantenimiento. Sin embargo, se documentó una nueva recidiva en 4 meses. Se introdujo una dosis de edoxabán (15mg/día), con resolución clínica completa en 5 meses. A los 7 meses de seguimiento su situación era buena.
El paciente número 2 fue una mujer de 72 años con historia de pápulas dolorosas y pruríticas de 6 años de evolución en ambas piernas, piel moteada y ulceraciones dolorosas. Al acudir al centro se observaron múltiples ulceraciones y costras localizadas de tipo livedoide en ambos tobillos y pies (fig. 2B). La gravedad del dolor y las úlceras empeoraron durante el verano, remitiendo durante el invierno. La biopsia cutánea confirmó el diagnóstico de VL. Se detectó polimorfismo de inserción (5G)/deleción (4G) en la posición −675 del gen PAI-1 mediante análisis PCR-RFLP. Se intentó monoterapia y terapia combinada con aspirina, prednisolona oral y pentoxifilina durante 4 meses, sin mejoría clínica. Seguidamente se inició monoterapia con rivaroxabán (20mg/día/durante 12 semanas y seguidamente 10mg/día) con resolución clínica completa en 6 meses, y ausencia de recidiva de la enfermedad documentada a los 6 meses de seguimiento.
En ambas pacientes se realizaron pruebas médicas completas, incluyendo recuento sanguíneo total, análisis de orina, estudios de coagulación, factor reumatoide, niveles del complemento en sangre, pruebas de anticuerpos antipéptido citrulinado cíclico, anticuerpos antinucleares y anticuerpos antineutrófilos citoplasmáticos, crioglobulinas séricas, electroforesis de proteínas séricas, inmunofijación y ecografía doppler de las piernas. No se observó evidencia de otras coagulopatías ni enfermedades sistémicas asociadas a VL, además de los polimorfismos del promotor de PAI-1.
El alelo 4G es ligeramente más transcripcionalmente activo que 5G, por lo que la homocigosidad del alelo 4G y algunos polimorfismos 4G/5G del promotor de PAI-1 están asociados a un incremento de los niveles de la proteína PAI-1, alteraciones fibrinolíticas, e incremento del riesgo de trombosis, reconociéndose de manera creciente como un factor de riesgo de enfermedades tales como infarto de miocardio juvenil e ictus4,6. En los últimos años, una serie de estudios han propuesto un vínculo entre las mutaciones del promotor de PAI-1 y VL2,6. Este descubrimiento ha impulsado el uso de agentes trombolíticos, tales como el activador de plasminógeno tisular, como opción terapéutica, con algunos resultados prometedores2,6,10. Sin embargo, su seguridad es motivo de preocupación, y no se recomienda como tratamiento de primera línea4,7.
Debemos tener en cuenta que, aunque muchos pacientes afectados tienen una situación protrombótica, ninguna alteración individual caracteriza a VL, pudiendo contemplarse como patrón de expresión cutánea del incremento de coagulación que compromete los vasos dérmicos o fibrinólisis anómala3. Por tanto, el uso de anticoagulantes es la terapia más utilizada para VL7, siendo los NOAC como rivaroxabán y edoxabán, más fáciles de utilizar que warfarina. Se trata de inhibidores directos del factor Xa actuando, por tanto, en el factor final de ambas vías de coagulación intrínseca y extrínseca, lo cual origina a su vez la producción de trombina5,8,9. Como tal, el factor Xa es un objetivo deseable y seguro de las terapias de anticoagulación. Nuestras pacientes tenían VL refractaria, habiendo albergado ambos polimorfismos del promotor de PAI-1 relacionados con un incremento del riesgo protrombótico. Estas pacientes experimentaron un buen resultado clínico con los NOAC. Los casos presentados subrayan que el cribado de los factores de riesgo protrombótico debería incluir polimorfismos genéticos en el promotor de PAI-1 en los pacientes de VL, y que los NOAC pueden ser una opción válida como terapia de primera línea en estos pacientes.