Los anticoagulantes orales directos (ACOD) emergen como una alternativa más cómoda y segura que los clásicos antagonistas de la vitamina K (AVK); no precisan monitorización, poseen una ventana terapéutica más amplia y tienen menos interacciones farmacológicas. Sin embargo, a pesar de que su uso está cada vez más extendido, existe poco consenso sobre cuál es su manejo perioperatorio óptimo en cirugía dermatológica. En este artículo se describen las características de los ACOD y se revisa la evidencia disponible sobre su uso perioperatorio en la cirugía de la piel.
Direct-acting oral anticoagulants (DOACs) have emerged as safer, easier-to-manage alternatives to traditional vitamin K antagonists and are used increasingly because they require no monitoring, have a wider therapeutic window, and react less with other drugs. However, there is little consensus on optimal perioperative management when these drugs are used in dermatologic surgery. This article describes the characteristics of DOACs and reviews current evidence on their use in this setting.
Se estima que en España el 1,3% de la población toma tratamiento anticoagulante. El manejo perioperatorio de los pacientes tratados con anticoagulantes cumarínicos clásicos o antagonistas de la vitamina K (AVK) es bien conocido. Sin embargo, cada vez son más frecuentes los pacientes sometidos a procedimientos quirúrgicos que toman anticoagulantes orales directos (ACOD) o nuevos anticoagulantes orales, cuyo manejo perioperatorio está menos estandarizado1,2. Estos emergen como una alternativa más cómoda y segura que los AVK, dado que no requieren una monitorización rutinaria, presentan una ventana terapéutica más amplia, un efecto anticoagulante más predecible, un número menor de interacciones farmacológicas, un riesgo menor de hemorragia intracraneal y una eficacia similar a la de los anticoagulantes clásicos3,4. Entre sus indicaciones aprobadas se encuentran la prevención y el tratamiento de las complicaciones tromboembólicas en la fibrilación auricular no valvular, la profilaxis y el tratamiento de la trombosis venosa profunda, del tromboembolismo pulmonar y, en el caso del rivaroxabán, la prevención aterotrombótica tras el síndrome coronario agudo5–7.
La escasa experiencia clínica sobre su uso en cirugía cutánea y la publicación de opiniones dispares ha conducido a un manejo perioperatorio desigual entre dermatólogos8. Hay autores que abogan por retrasar la intervención hasta la finalización del tratamiento; otros proponen un manejo análogo al de los AVK9. Sin embargo, su perfil farmacológico, monitorización, riesgo hemorrágico y mecanismo para revertir la hemorragia difieren sustancialmente del de los AVK.
Un cuestionario realizado a dermatólogos del Reino Unido sobre el manejo de los ACOD reflejó que los puntos con un consenso menor eran la actuación previa a la realización de intervenciones quirúrgicas complejas y el tiempo de interrupción necesario10.
Debido a que su uso está cada vez más extendido, es esencial conocer sus características, así como las medidas disponibles para revertir sus efectos.
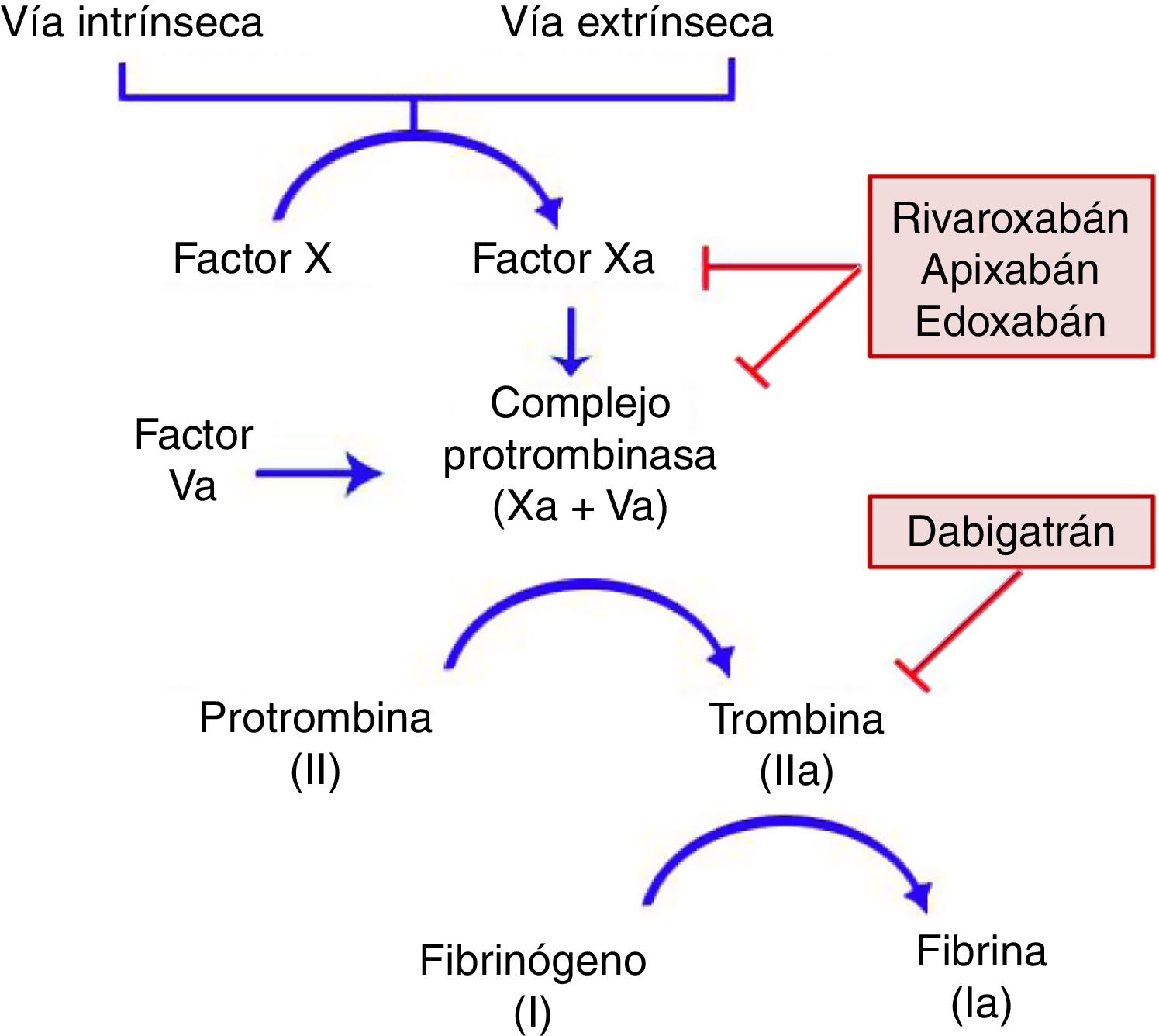
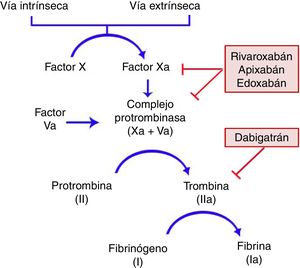
Características generalesMecanismo de acciónTodos los ACOD actúan en algún punto de la vía común de la coagulación, tras la convergencia de las vías intrínseca y extrínseca que se produce con la activación del factor X. Este se unirá al factor V activado para formar el complejo de la protrombinasa, que dará lugar al factor II activado (IIa) o trombina. Finalmente, el factor IIa será el responsable de activar el fibrinógeno (fig. 1)11,12. Dabigatrán (Pradaxa®) es el único inhibidor oral directo y reversible de la trombina, mientras que rivaroxabán (Xarelto®), apixabán (Eliquis®) y edoxabán (Lixiana®) son inhibidores del factor X activado (Xa), tanto libre como unido a la protrombinasa.
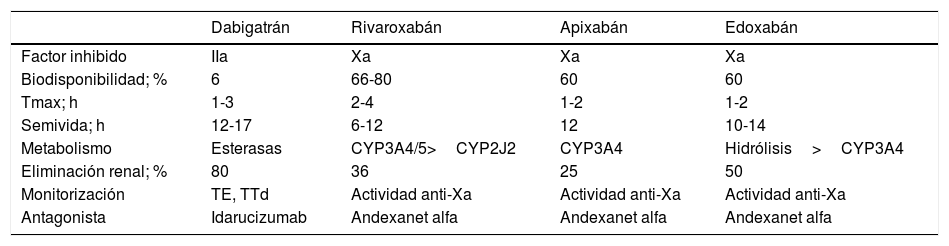
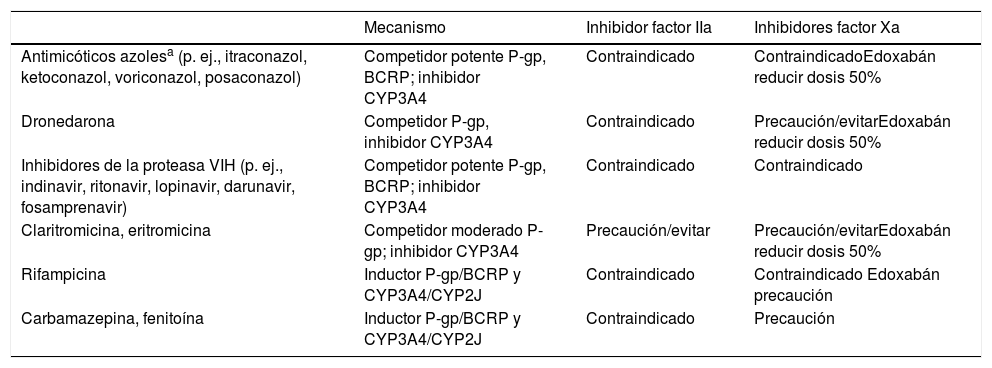
Los ACOD actúan más rápidamente que los AVK y sus efectos son de menor duración. El pico máximo de actividad se produce a las 2-4h tras su administración y tienen una semivida de entre 8 y 18h en pacientes con una función renal normal (tabla 1)4,11,13. Las principales interacciones de los ACOD se producen con fármacos inhibidores o inductores del sistema de transporte de la glicoproteína-P (P-gp) o del sistema CYP3A4 (tabla 2)6,14.
Propiedades farmacocinéticas y antagonistas de los ACOD
| Dabigatrán | Rivaroxabán | Apixabán | Edoxabán | |
|---|---|---|---|---|
| Factor inhibido | IIa | Xa | Xa | Xa |
| Biodisponibilidad; % | 6 | 66-80 | 60 | 60 |
| Tmax; h | 1-3 | 2-4 | 1-2 | 1-2 |
| Semivida; h | 12-17 | 6-12 | 12 | 10-14 |
| Metabolismo | Esterasas | CYP3A4/5>CYP2J2 | CYP3A4 | Hidrólisis>CYP3A4 |
| Eliminación renal; % | 80 | 36 | 25 | 50 |
| Monitorización | TE, TTd | Actividad anti-Xa | Actividad anti-Xa | Actividad anti-Xa |
| Antagonista | Idarucizumab | Andexanet alfa | Andexanet alfa | Andexanet alfa |
ACOD: anticoagulantes orales directos; CYP: cytochrome P450; TE: tiempo de ecarina; Tmax: Time to maximum plasma concentration (tiempo requerido para alcanzar la concentración máxima del fármaco en sangre); TTd: tiempo de trombina diluida con plasma; IIa: II activado; Xa: X activado.
Principales interacciones de los ACOD. Los fármacos inductores del metabolismo incrementan el riesgo tromboembólico, mientras que los inhibidores/competidores incrementan el riesgo hemorrágico
| Mecanismo | Inhibidor factor IIa | Inhibidores factor Xa | |
|---|---|---|---|
| Antimicóticos azolesa (p. ej., itraconazol, ketoconazol, voriconazol, posaconazol) | Competidor potente P-gp, BCRP; inhibidor CYP3A4 | Contraindicado | ContraindicadoEdoxabán reducir dosis 50% |
| Dronedarona | Competidor P-gp, inhibidor CYP3A4 | Contraindicado | Precaución/evitarEdoxabán reducir dosis 50% |
| Inhibidores de la proteasa VIH (p. ej., indinavir, ritonavir, lopinavir, darunavir, fosamprenavir) | Competidor potente P-gp, BCRP; inhibidor CYP3A4 | Contraindicado | Contraindicado |
| Claritromicina, eritromicina | Competidor moderado P-gp; inhibidor CYP3A4 | Precaución/evitar | Precaución/evitarEdoxabán reducir dosis 50% |
| Rifampicina | Inductor P-gp/BCRP y CYP3A4/CYP2J | Contraindicado | Contraindicado Edoxabán precaución |
| Carbamazepina, fenitoína | Inductor P-gp/BCRP y CYP3A4/CYP2J | Contraindicado | Precaución |
ACOD: anticoagulantes orales directos; BCRP: breast cancer resistance protein; CYP: cytochrome P450; P-gp: glicoproteína P; IIa: II activado; Xa: X activado.
Los ACOD no precisan una monitorización rutinaria de la coagulación debido a que su farmacocinética y farmacodinámica son predecibles y tienen pocas interacciones farmacológicas. Además, las pruebas que permiten una monitorización precisa de los mismos, son costosas y no están disponibles en todos los centros (tabla 1). En general, estas se reservan para las intervenciones cruentas y de carácter urgente, que resultan excepcionales dentro del ámbito dermatológico15,16.
El tiempo de protrombina y el international normalized ratio (INR), empleados para la monitorización de los AVK, no se correlacionan de forma lineal con el efecto anticoagulante de los ACOD17.
Evaluación del riesgo de hemorragia perioperatoriaEl riesgo de hemorragia perioperatoria está condicionado por las comorbilidades del paciente y por las características del procedimiento quirúrgico.
Para la valoración adecuada del riesgo que condicionan las comorbilidades del paciente, existen índices como el HAS-BLED (tabla 3) que permiten al cirujano dermatológico caracterizarlo de forma adecuada18. Un ejemplo es que la presencia de una elevada tensión arterial sistólica perioperatoria entraña una mayor tasa de hemorragia intraoperatoria durante la cirugía de Mohs19.
Índice HAS-BLED. Una puntuación de 3 o más puntos es altamente predictiva de presentar un proceso hemorrágico
| HAS-BLED | Puntuación |
|---|---|
| Hipertensión sistólica >160mmHg | 1 |
| Función renal o hepática anormal | 1 cada una |
| Ictus previo | 1 |
| Historia de hemorragia mayor/predisposición | 1 |
| INR lábil o inestable | 1 |
| Edad>65 años | 1 |
| Fármacos antiplaquetarios, AINE o historia de alcoholismo | 1 cada una |
AINE: antiinflamatorio no esteroideo; HAS-BLED: hypertension, abnormal liver/renal function, stroke history, bleeding history or predisposition, labile INR, elderly, drug/alcohol usage; INR: international normalized ratio.
Fuente: Adaptación de Doherty et al.18.
El riesgo de hemorragias relevantes —aquellas que no se autolimitan y/o ceden con medidas compresivas— en la cirugía dermatológica es bajo20–23.
Si se analiza específicamente el riesgo en pacientes con ACOD, existe un cierto incremento de las hemorragias relevantes tras realizar intervenciones quirúrgicas grandes, pero no se incrementa en las pequeñas24–27. Algunos estudios han analizado por regiones anatómicas el riesgo hemorrágico, independientemente del tamaño de la intervención, obteniendo resultados dispares y poco concordantes. Por ello, actualmente la localización anatómica no se considera un factor determinante21,28. Respecto la cirugía de Mohs, ha demostrado no entrañar un riesgo mayor de hemorragia per se29.
El cirujano dermatológico debe conocer y valorar los factores que determinan un incremento significativo del riesgo hemorrágico (tabla 4), prestando especial atención a aquellos procedimientos que conlleven un mayor riesgo de aparición de hematomas subcutáneos, que puedan disecar el tejido formando una cavidad virtual. Son ejemplos de estas intervenciones la biopsia selectiva de ganglio centinela, las que precisan de un cierre con grandes colgajos como el tipo avance de mejilla completo o las que se realizan sobre la cavidad oral30.
Procedimientos quirúrgicos cutáneos que entrañan un mayor riesgo hemorrágico postoperatorio
| Intervenciones que implican múltiples capas (fascia, músculo, cartílago, hueso) |
| Defecto quirúrgico grande (>4cm) o cierre con injerto/colgajo de gran tamaño |
| Intervenciones con un acceso visual restringido del campo quirúrgico (liposucción, intervenciones ganglionares, anorrectales, o de cavidad oral) |
Fuente: Adaptación de Sporbeck et al.30.
Hay factores que condicionan un incremento en el riesgo de presentar un fenómeno tromboembólico tras la suspensión del anticoagulante. La presencia de alguna de estas características condiciona un riesgo tromboembólico de al menos un 10% en ausencia de anticoagulación (tabla 5)31–33.
Situaciones clínicas con alto riesgo de episodios tromboembólicos
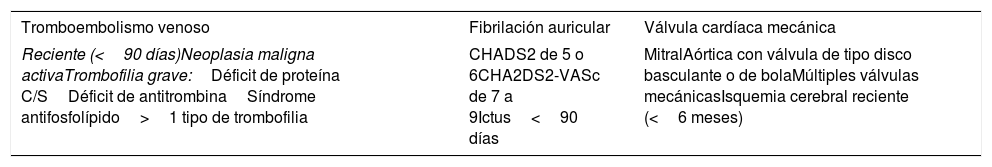
| Tromboembolismo venoso | Fibrilación auricular | Válvula cardíaca mecánica |
|---|---|---|
| Reciente (<90 días)Neoplasia maligna activaTrombofilia grave:Déficit de proteína C/SDéficit de antitrombinaSíndrome antifosfolípido>1 tipo de trombofilia | CHADS2 de 5 o 6CHA2DS2-VASc de 7 a 9Ictus<90 días | MitralAórtica con válvula de tipo disco basculante o de bolaMúltiples válvulas mecánicasIsquemia cerebral reciente (<6 meses) |
CHA2DS2: congestive heart failure, hypertension, age≥75 years, diabetes mellitus, stroke or transient ischemic attack (TIA); VASc: vascular disease, age 65 to 74 years, sex category.
Entre las complicaciones tromboembólicas secundarias a la suspensión de la anticoagulación perioperatoria en las intervenciones quirúrgicas de la piel se han descrito accidentes vasculares cerebrales, infartos de miocardio, embolismos pulmonares, trombosis venosas profundas y oclusión de la arteria retiniana con ceguera secundaria34.
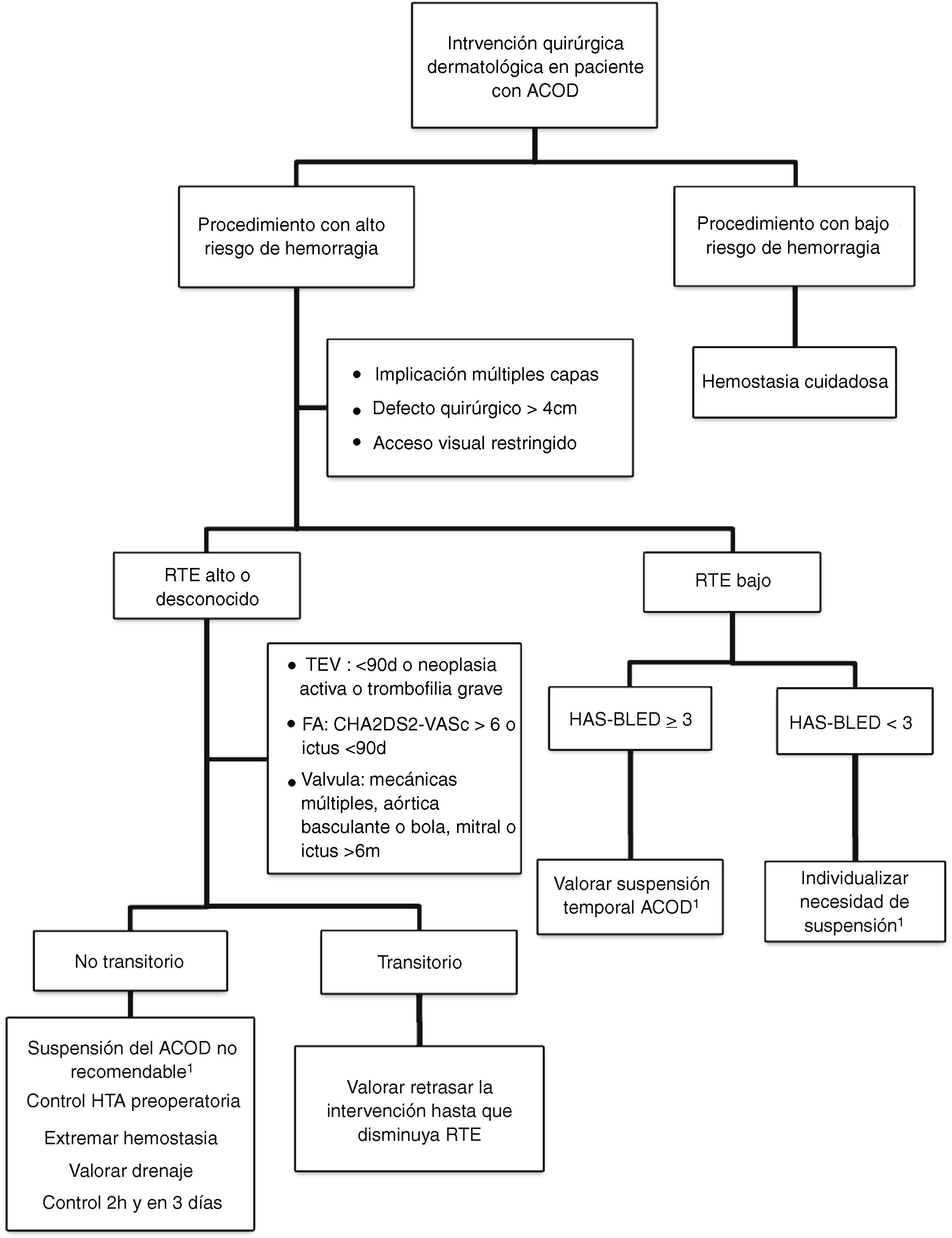
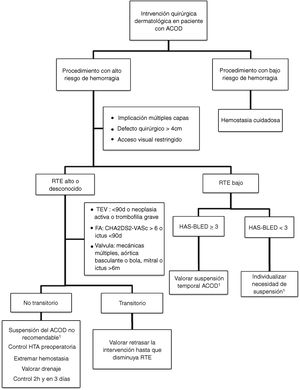
Actitud en la cirugía dermatológicaLa evidencia sobre el manejo perioperatorio de los ACOD todavía es limitada, puesto que no se disponen aún de ensayos clínicos aleatorizados ni de grandes estudios observacionales. Actualmente se acepta no suspender la anticoagulación ante procedimientos que impliquen un riesgo bajo de hemorragia. En la práctica clínica, algunos cirujanos abogan por retrasar la toma del ACOD hasta después de la intervención35. Si se considera que el riesgo quirúrgico de hemorragia es elevado (por el tipo de intervención y/o las comorbilidades del paciente), y el riesgo tromboembólico es bajo, la estrategia más aceptada sería la de valorar la suspensión temporal del fármaco (fig. 2)18,32. Si desconocemos el riesgo tromboembólico o este es elevado, no se debería interrumpir la anticoagulación de forma rutinaria e, idealmente se debería consensuar la actitud con el equipo médico de hemostasia y coagulación32,33. Conviene recordar que el riesgo vital inherente a una complicación tromboembólica y el manejo de la misma supera el riesgo vital de la hemorragia perioperatoria dermatológica, que suele ser de fácil tratamiento36,37. Una opción en aquellos pacientes que tengan de forma transitoria un estado de alto riesgo tromboembólico (p. ej., ictus o un tromboembolismo venoso <90 días), sería retrasar la intervención hasta que el riesgo se haya normalizado.
La hemostasia cuidadosa forma parte del manejo básico de toda intervención quirúrgica. Para ello se debe realizar una cirugía cuidadosa que respete al máximo los tejidos y un uso habitual de bisturís eléctricos, bipolares o monopolares, u otros dispositivos electrocauterizadores para lograr una hemostasia adecuada de los vasos pequeños. Para los vasos de mayor tamaño (>2mm), la electrocoagulación puede no ser suficiente, por lo que se prefiere la ligadura por sutura por su acción más prolongada. Si la hemorragia ocurre en el borde de la incisión de forma difusa, los puntos colchoneros horizontales y la sutura continua bloqueante han demostrado un efecto hemostásico mayor38.
Medidas adicionalesConviene tomar medidas hemostáticas adicionales en los pacientes que no han suspendido los ACOD. Se recomendaría el empleo de forma sistemática en estos pacientes de vendajes compresivos no isquémicos y, en intervenciones grandes, valorar la colocación de drenajes. La optimización preoperatoria de la tensión arterial contribuye a disminuir el riesgo de hemorragia intraoperatoria. Es aconsejable realizar una revisión inicial de la herida a las 2h de la intervención si se han utilizado anestésicos con vasoconstrictores y, en intervenciones complejas, reevaluar la herida a los 3 días. Además, el paciente deberá ser debidamente informado del potencial riesgo de hemorragia y de las medidas que deberá tomar si esta se produce38,39.
Interrupción perioperatoriaHay evidencia que avala que el riesgo hemorrágico se asocia con la concentración mínima de fármaco y no con la máxima (picos plasmáticos)40.
Por ello, previamente a la intervención se recomienda un intervalo de suspensión del fármaco de al menos 2 semividas de eliminación, lo que deja un efecto residual variable de entre el 12-25%35. En pacientes con función renal normal se aconseja suspender el ACOD 24h antes del procedimiento. En pacientes con función renal disminuida se debe calcular su aclaramiento de creatinina y ajustar el tiempo de suspensión (tabla 6) en función del ACOD empleado (nivel de evidencia 2D)15,18.
Si la hemostasia ha sido eficaz, el ACOD puede reintroducirse entre 6 y 12h después del procedimiento (nivel de evidencia 2C)15,18,41.
Dado que estos fármacos tienen una semivida corta y su inicio de acción es rápido, no es preciso realizar una terapia puente perioperatoria. De hecho, hay estudios que la desaconsejan dado que aumentaría la tasa de hemorragia postoperatoria, sin disminuir el riesgo tromboembólico42,43.
Hemostasia postoperatoriaLa mayoría de complicaciones hemorrágicas tras los procedimientos quirúrgicos dermatológicos se pueden controlar con medidas locales debido a la accesibilidad a la herida quirúrgica. Estas medidas incluyen el frío local, la elevación de la zona intervenida, el recambio de los apósitos compresivos, el uso de agentes hemostáticos tópicos y, en casos persistentes o de hemorragia abundante, la revisión quirúrgica de la herida y el uso de electrocoagulación44.
En función de la gravedad y el fracaso de las medidas anteriores se pueden añadir otras medidas generales de soporte, que incluyen la administración de sueros, la transfusión de hemoderivados y la interrupción temporal del ACOD13. Debido a su semivida corta y al pico plasmático rápido, su efecto se reduce rápidamente tras la última toma.
Solo de forma excepcional y en situaciones de hemorragia abundante, no controlable y que ponga en peligro la vida del paciente, habría que emplear otras medidas que van dirigidas a disminuir los niveles plasmáticos del ACOD o a revertir su efecto.
Entre estas medidas está el uso de carbón activado, siempre que se ingiera entre la primera y la sexta horas tras la ingesta del ACOD. También se pueden emplear agentes de reversión no específica (complejos de concentrados de protrombina que contienen hasta 4 factores de la coagulación activados) y ácido tranexámico (antifibrinolítico de administración subcutánea o endovenosa). Antes de administrarlos conviene descartar antecedentes tromboembólicos, historia familiar de trombofilia o el uso concomitante de anticonceptivos hormonales. La hemodiálisis ha resultado eficaz para revertir los efectos de dabigatrán45–49.
Por último, existen antídotos específicos para los ACOD que se encuentran en diferentes fases de desarrollo. Solo idarucizumab (Praxbind®), que es un inhibidor no competitivo de dabigatrán, está aprobado por la EMA para revertir sus efectos en intervenciones quirúrgicas urgentes con complicaciones hemorrágicas con riesgo vital50.
ConclusionesLa escasa evidencia disponible sugiere que existe un cierto incremento del riesgo de hemorragia en los pacientes sometidos a intervenciones quirúrgicas dermatológicas que están en tratamiento con ACOD. Sin embargo, su interrupción podría incrementar el riesgo tromboembólico y debe ser una decisión consensuada e individualizada. El candidato ideal para interrumpir el ACOD es aquel paciente con un riesgo tromboembólico bajo, pero con una tendencia hemorrágica elevada que va a someterse a una cirugía que entraña un riesgo alto de hemorragia. El tiempo de interrupción dependerá del fármaco y de la función renal, y se debe prestar una atención especial a posibles interacciones farmacológicas. Por otra parte, los procedimientos con un riesgo hemorrágico bajo se pueden llevar a cabo sin suspender la anticoagulación. En cualquier caso, es aconsejable extremar las medidas de hemostasia con vendajes compresivos y, en situaciones con defectos quirúrgicos grandes, realizar controles postoperatorios estrechos. Cuando aparece una complicación hemorrágica que no se controla con medidas locales se debe considerar la suspensión del ACOD. En caso de hemorragia con riesgo vital, situación excepcional en cirugía dermatológica, se puede emplear idarucizumab, un antídoto específico aprobado que revierte el efecto de dabigatrán.