El documento de consenso respecto al manejo del melanoma primario de la piel, que detallamos a continuación, nace de la puesta en común, aceptación, revisión y confrontación con la literatura reciente (incluyendo guías clínicas nacionales e internacionales), así como de los protocolos de diagnóstico, seguimiento y tratamiento consensuados en los diferentes centros hospitalarios de toda Cataluña y Balerares pertenencientes a la Xarxa de Centres de Melanoma de Catalunya i Balears. El objetivo principal de este documento es exponer de forma conjunta el manejo habitual del paciente con melanoma que actualmente se realiza en nuestro medio. Sin embargo, este documento no pretende, ni puede, por lo que tampoco debiera ser usado como un protocolo de obligado cumplimiento por los profesionales que atendemos a este grupo de enfermos. En este sentido, cabe mencionar que la consulta de este documento por parte del profesional no es vinculante para su acción, y en ningún caso este texto podrá ser utilizado para garantizar o buscar responsabilidades del juicio médico concreto. El grupo de dermatólogos que firman dicho documento se formó hace ahora tres años, con la intención de dar a conocer a nuestras autoridades la importancia de este complejo tumor, que en nuestro país creemos que se encuentra erróneamente infravalorada con respecto a otros tipo de cáncer. Además, fruto de las reuniones periódicas del grupo, han surgido también interesantes propuestas de colaboración en distintos proyectos de investigación epidemiológica, clínica y básica aplicada en torno al melanoma maligno en nuestra sociedad.
The consensus statement on the management of primary cutaneous melanoma that we present here was based on selection, discussion, review, and comparison of recent literature (including national and international guidelines). The protocols for the diagnosis, treatment, and follow-up used in the hospital centers throughout Catalonia and the Balearic Isles belonging to the Network of Catalan and Balearic Melanoma Centers were also considered. The main objective of this statement was to present the overall management of melanoma patients typically used in our region at the present time. As such, the statement was not designed to be an obligatory protocol for health professionals caring for this group of patients, and neither can it nor should it be used for this purpose. Professionals reading the statement should not therefore consider it binding on their practice, and in no case can this text be used to guarantee or seek responsibility for a given medical opinion. The group of dermatologists who have signed this statement was created 3 years ago with the aim of making our authorities aware of the importance of this complex tumor, which, in comparison with other types of cancer, we believe does not receive sufficient attention in Spain. In addition, the regular meetings of the group have produced interesting proposals for collaboration in various epidemiological, clinical, and basic applied research projects on the subject of malignant melanoma in our society.
En términos generales, y a pesar de que no está bien establecida la utilidad de las medidas de cribaje poblacional, se recomienda un seguimiento periódico por el dermatólogo con ayuda de la dermatoscopia en personas con un mayor riesgo de desarrollar un melanoma maligno (MM), como son las que presentan nevos clínicamente atípicos múltiples o antecedentes personales o familiares de MM1–3. En este grupo de población, y con la finalidad de identificar precozmente aquellas lesiones malignas o con riesgo de desarrollar un MM (lesiones que cumplen la regla del ABCDE por asimetría, bordes irregulares, color abigarrado, diámetro >6mm o lesiones que evolucionan de forma rápida), se determinará el tipo y la frecuencia del control pertinente en cada caso —visitas semestrales frente a anuales, dermatoscopia manual frente a digital (mapa corporal)4, estudio a familiares de riesgo— en función de la presencia de una o más variables de riesgo conocidas para desarrollar un MM5–10:
- 1.
Fenotipo: ojos claros, fototipo bajo (I, II), cabello rubio o pelirrojo, múltiples efélides o lentigos solares, numerosos nevos típicos (no >50), numerosos nevos clínicamente atípicos (regla ABCDE), síndrome de nevo displásico (no de nevos >100 con uno o más de un tamaño superior a 6mm y 1 o más con histología de nevo displásico).
- 2.
Antecedentes en familiares de primer grado de MM o múltiples neoplasias.
- 3.
Antecedentes personales de MM.
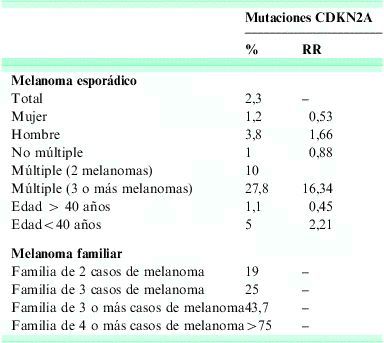
El antecedente personal de MM aumenta el riesgo de desarrollar un segundo primario por un factor de 10, siendo el riesgo máximo en los dos años siguientes al diagnóstico. Los pacientes con antecedentes familiares de MM y nevos atípicos múltiples son los que presentan un riesgo mayor de desarrollar un MM; en algunas familias en nuestro ámbito con MM familiar11–15 se han identificado mutaciones de los genes CDKN2a y CDK4 que confieren un riesgo vital de desarrollar un MM del 60 al 90% (tabla 1). El diagnóstico genético en estos probandos de alta sospecha y de pacientes con melanoma múltiple debería efectuarse en el contexto de programas de asesoramiento genético. Actualmente existe un programa específico de asesoramiento genético en melanoma familiar en el Hospital Clínic de Barcelona16. En el ámbito nacional existen también otros servicios que ofrecen la posibilidad de realizar estos estudios genéticos en melanoma familiar, entre los que destacan el Instituto Valenciano de Oncología (Comunidad Valenciana), el Hospital Virgen de la Arrixaca (Murcia), así como otros centros en la Comunidad de Madrid, en Galicia o en el País Vasco.
Incidencia de mutaciones en el gen CDKN2A detectadas en sangre de pacientes con melanoma
| Mutaciones CDKN2A | ||
| % | RR | |
| Melanoma esporádico | ||
| Total | 2,3 | – |
| Mujer | 1,2 | 0,53 |
| Hombre | 3,8 | 1,66 |
| No múltiple | 1 | 0,88 |
| Múltiple (2 melanomas) | 10 | |
| Múltiple (3 o más melanomas) | 27,8 | 16,34 |
| Edad > 40 años | 1,1 | 0,45 |
| Edad<40 años | 5 | 2,21 |
| Melanoma familiar | ||
| Familia de 2 casos de melanoma | 19 | – |
| Familia de 3 casos de melanoma | 25 | – |
| Familia de 3 o más casos de melanoma | 43,7 | – |
| Familia de 4 o más casos de melanoma | >75 | – |
Datos obtenidos a partir del estudio de más de 700 casos de melanoma esporádico, más de 150 casos de melanoma múltiple y más de 50 familias con melanoma familiar estudiadas en nuestro ámbito16.
Ante una lesión melanocítica con sospecha clínica de MM se recomienda recoger en la historia clínica del paciente las siguientes características:
- 1.
Evolución de la lesión (cronología y síntomas o signos que motivan la consulta: sangrado, prurito, dolor, cambio del color o de la forma o del tamaño de la lesión, presencia de lesión precursora, existencia de manipulación o tratamiento previo de la lesión, etc.).
- 2.
Estudio macroscópico del tumor (localización, palpación, presencia de pápulas o nódulos, tamaño, pigmentación, tipo clínico, ulceración, áreas de regresión, nevo adyacente, etc.).
- 3.
Descripción del estudio de microscopía de epiluminiscencia (dermatoscopia)17.
- 4.
Documentación iconográfica que objetive la sospecha clínica de MM.
Toda lesión clínicamente sospechosa de MM será biopsiada y remitida al Servicio de Anatomía Patológica para la confirmación histológica del diagnóstico. La biopsia será escisional (incluyendo toda la lesión), siempre que sea posible, con un margen quirúrgico entre 2 y 5mm, para no alterar el drenaje linfático de la zona. Se recomienda evitar manipular la lesión sospechosa con punciones, curetajes, legrados, afeitados ni tampoco su tratamiento con electrocoagulación, láser, crioterapia u otros métodos que dificulten el correcto estudio histopatológico de la pieza. Ocasionalmente (en casos de sospecha clínica baja, localización de la lesión en la cara o en un área donde la exéresis resulte mutilante) se puede optar por realizar una biopsia incisional (biopsia en sacabocados) profunda que se hará de la zona que se sospeche más gruesa (zona palpable o según criterios dermatoscópicos).
Diagnóstico anatomopatológicoEl informe anatomopatológico de una lesión melanocítica maligna debería seguir las recomendaciones consensuadas y publicadas recientemente por diferentes grupos de trabajo nacionales18,19. Según dichas recomendaciones las características enumeradas en la tabla 2 se harán constar de forma explícita en el informe anatomopatológico definitivo, incluyendo los datos negativos. En aquellos casos en que la pieza histológica no permita la identificación de algún valor se hará referencia también de forma explícita en el informe. Cuando el diagnóstico de MM se realice en otro centro, y el paciente sea remitido para el control o la realización de la técnica de la biopsia del ganglio centinela (BGC) a un hospital de referencia, es recomendable que el centro de referencia solicite una laminilla o el bloque de parafina para su valoración previa.
Características histopatológicas que deberían aparecer en el informe anatomopatológico de un melanoma18
| Descripción macroscópica de la pieza y localización anatómica |
| Tipo de escisión (biopsia incisional o escisional, afeitado, curetaje, etc,) |
| Tipo clínico-histológico de melanoma |
| Medición micrométrica de la profundidad (Breslow) |
| Nivel de Clark |
| Índice mitótico (no mitosis por mm2) |
| Fase de crecimiento vertical presente (sí/no) |
| Ulceración (sí/no) |
| Regresión (sí/no) |
| Infiltración linfocitaria (sí/no) |
| Invasión vascular (sí /no) |
| Invasión perineural (sí/no) |
| Satelitosis histológica (sí/no) |
| Márgenes libres de resección (en mm) laterales y profundos |
| Lesión precursora (nevus melanocítico) (sí/ no) |
| Características opcionales |
| Infiltrado plasmocitario |
| Valoración semicuantitativa de la regresión y del infiltrado inflamatorio |
| Celularidad y variantes de melanoma (nevoide, células balonizantes, célula pequeña, foliculotropo, spitzoide, etc.) |
La evaluación clínica inicial de todo paciente diagnosticado de melanoma debe incluir una historia clínica dirigida al MM en la que se especifiquen, entre otras características clínicas, las siguientes:
- 1.
Antecedentes familiares y personales de MM o síndrome del nevo displásico.
- 2.
Historia oncológica personal y familiar.
- 3.
Fototipo cutáneo.
- 4.
Hábito de exposición solar (patrón de exposición solar [intermitente, crónico, etc.]), tiempo de trabajo y/o de actividades de ocio al aire libre, número de quemaduras solares graves, uso de lámparas de rayos UVA, etc.).
- 5.
Síntomas que motivan la consulta (prurito, dolor, sangrado, cambio de color o de tamaño, etc.).
- 6.
Localización y diámetro de la lesión.
- 7.
Presencia de zonas sugestivas de regresión.
- 8.
Presencia de nevos clínicamente atípicos.
- 9.
Presencia de lesión precursora previa.
Además, deberemos también realizar una anamnesis general dirigida en la que figuren los siguientes datos: síntomas sugestivos de la presencia de metástasis (síndrome tóxico, dolor localizado, tos, síntomas neurológicos, sangrado digestivo, etc.); enfermedades concomitantes, especialmente aquellas que puedan representar dificultades en el tratamiento quirúrgico y/o médico a realizar.
Exploración físicaLa exploración dermatológica deberá ser completa, incluyendo el cuero cabelludo, el área genital y la mucosa oral, con especial atención en la detección de posibles lesiones precursoras (nevos clínicamente atípicos), de otras lesiones pigmentadas sospechosas o de posibles metástasis cutáneas del MM primario. También deberemos realizar un examen físico general prestando especial atención a la exploración de los ganglios linfáticos regionales y a la presencia de masas o nódulos subcutáneos.
Exploraciones complementarias en el estudio de extensión inicialEn la actualidad la clasificación clinicopatológica recomendada para estadificar a los pacientes con MM es la clasificación pronóstica de la American Joint Committee on Cancer (AJCC), publicada en el año 2009 (septima clasificación) (tabla 3)20,21. Para su aplicación es preciso realizar el estudio anatomopatológico del tumor primario y la BGC, en los casos en los que esta esté indicada.
Clasificación clínicohistológica actual de la American Joint Committee on Cancer (AJCC) para el MM20
| Clasificación T | Grosor micrométrico de Breslow (mm) | Ulceración |
| T0 | Sin evidencia de tumor primario | Cualquiera |
| Tis | In situ | Cualquiera |
| T1 | ≤1 | a- sin ulceración y mitosis < 1/mm2 |
| b-con ulceración o mitosis igual o > a 1/mm2 | ||
| T2 | 1,01–2,0 | a-sin ulceración |
| b-con ulceración | ||
| T3 | 2,01–4,0 | a-sin ulceración |
| b-con ulceración | ||
| T4 | >4,0 | a-sin ulceración |
| b-con ulceración | ||
| Clasificación N | No de ganglios | Tamaño del ganglio metastástico |
| N1 | 1 ganglio | a-micrometástasis¿ |
| b-macrometástasis¿¿ | ||
| N2 | 2–3 ganglios | a-micrometástasis¿ |
| b-macrometástasis¿¿ | ||
| c-metástasis satélites/en tránsito sin metástasis nodal | ||
| N3 | 4 o más ganglios, mazacote adenopático, o metástasis satélites/en tránsito con cualquier metástasis ganglionar | |
| Clasificación M | Localización | Valor sérico de LDH |
| M1a | Piel distante, subcutáneo, metástasis nodal | Normal |
| M1b | Metástasis pulmonar | Normal |
| M1c | Todas las demás localizaciones | Normal |
| Cualquier localización | Elevado |
| Estadificación clínica | Estadificación histológica | ||||||
| T | N | M | T | N | M | ||
| 0 | Tis | N0 | M0 | 0 | Tis | N0 | M0 |
| IA | T1a | N0 | M0 | IA | T1a | N0 | M0 |
| IB | T1b | N0 | M0 | IB | T1b | N0 | M0 |
| T2a | N0 | M0 | T2a | N0 | M0 | ||
| IIA | T2b | N0 | M0 | IIA | T2b | N0 | M0 |
| T3a | N0 | M0 | T3a | N0 | M0 | ||
| IIB | T3b | N0 | M0 | IIB | T3b | N0 | M0 |
| T4a | N0 | M0 | T4a | N0 | M0 | ||
| IIC | T4b | N0 | M0 | IIC | T4b | N0 | M0 |
| III | Tx | N > N0 | M0 | IIIA | T1-4a | N1a | M0 |
| T1-4a | N2a | M0 | |||||
| IIIB | T1-4b | N1a | M0 | ||||
| T1-4b | N2a | M0 | |||||
| T1-4a | N1b | M0 | |||||
| T1-4a | N2b | M0 | |||||
| T1-4a | N2c | M0 | |||||
| T1-4b | N2c | M0 | |||||
| IIIC | T1-4b | N1b | M0 | ||||
| T1-4b | N2b | M0 | |||||
| Tx | N3 | M0 | |||||
| IV | Tx | Nx | M1 | Tx | Nx | M1 | |
La BGC permite estudiar de forma selectiva los ganglios linfáticos de la cadena ganglionar regional con más riesgo de recibir las metástasis por vía linfática, limitando la realización de tratamientos quirúrgicos adicionales (linfadenectomías) o tratamientos adyuvantes a aquellos pacientes en los que se detecten metástasis en el ganglio centinela (GC)22. Por ello, la principal utilidad de la BGC para los pacientes con MM, aceptada casi globalmente por la comunidad científica, es su papel como herramienta de estadificación precisa, siendo imprescindible su utilización en aquellos pacientes incluidos en estudios clínicos6–10,22–24. Sin embargo, algunos autores consideran controvertido el uso rutinario de la BGC debido a que no ha podido demostrarse, por el momento, un impacto beneficioso en la supervivencia global de los pacientes25–30.
Criterios de indicación de la biopsia del ganglio centinelaEn la tabla 4 se resumen los criterios de selección actuales globalmente aceptados para la indicación de la BGC en los pacientes con MM31.
Criterios de selección recomendados para la indicación de la biopsia del ganglio centinela en pacientes con melanoma maligno31
| Indicaciones |
| Melanoma cutáneo primario estadio ≥IB (AJCC) 2009 ausencia de ganglios regionales clínicamente palpables¿ |
| Contraindicaciones relativas¿¿ |
| Enfermedad metastásica |
| Alteración del drenaje linfático de la zona: |
| Extirpación amplia del tumor primario (márgenes >1cm) |
| Cobertura mediante injerto/colgajo |
| Infección activa |
| Cirugía radical o radioterapia sobre el territorio ganglionar a estudio |
| Estado general y patología de base del paciente |
| Embarazo¿¿¿ |
La ecografía de los territorios ganglionares en el estudio de extensión inicial en pacientes sin adenopatías clínicamente evidentes no debería sustituir en la práctica clínica habitual a la BGC, si bien es útil realizarla de forma previa a la indicación de la BGC en casos en los que la palpación clínica puede resultar dificultosa (pacientes obesos o con antecedentes quirúrgicos en el territorio a explorar [por ejemplo intervenidos de herniorrafia inguinal]) o en aquellos centros en los que no se considere ni la realización de la BGC ni la derivación del paciente a un centro donde se la practiquen32–34.En los pacientes con un MM de riesgo bajo (estadio 0 o IA) y sin una sospecha clínica de afectación ganglionar no se recomienda realizar la BGC. A criterio del centro se puede indicar el procedimiento en aquellos tumores primarios invasivos de riesgo mínimo (Breslow<1mm, no ulcerados) que presenten signos importantes de regresión histológica, u otras características de mal pronóstico35–40. Se recomienda que la realización de la BGC coincida con el momento de la ampliación de los márgenes del tumor primario (o bien con la extirpación amplia del mismo cuando la biopsia haya sido incisional). El estudio anatomopatológico del/los GC debe ser exhaustivo, y precisa un abordaje que difiere sustancialmente del estudio histológico convencional de otras muestras ganglionares41,42. Los diferentes protocolos para el estudio del GC incluyen la valoración de múltiples niveles de cada bloque de la muestra y el uso combinado de tinciones de hematoxilina-eosina e inmunohistoquímica. Se desaconseja la congelación de muestras del GC para obtener informes peroperatorios36,43.
Exploraciones complementarias para la estadificación visceralAdemás de la historia clínica dirigida, ya detallada en el manejo inicial del paciente, y de la correspondiente exploración física minuciosa, a todos los sujetos diagnosticados de MM invasivo (excluyendo el MM in situ, estadio O) se les realizarán las siguientes exploraciones dentro del estudio de extensión inicial6–10,22,44–47:
- 1.
Analítica general, incluyendo un hemograma y un estudio bioquímico, especialmente fosfatasa alcalina, gamma-GT y lactato deshidrogenasa (LDH). La determinación de otros marcadores (beta S100, MIA, RT-PCR mARN de tirosinasa en sangre periférica, etc.) se considerará de forma adicional36,48.
- 2.
Radiografía simple de tórax posteroanterior y lateral.
- 3.
Electrocardiograma (en aquellos casos en que esté indicada la BGC como parte del preoperatorio o candidatos a tratamiento adyuvante [interferón]).
En los pacientes con MM de riesgo bajo o intermedio (estadios IA, IB y IIA) no se practicarán exploraciones complementarias adicionales de forma rutinaria, aunque en estadios IB y IIA algunos centros recomiendan practicar también una ecografía abdominal. En cualquier caso, ante la sospecha clínica de metástasis se solicitarán las exploraciones necesarias en cada caso (tomografía computarizada [TC], ecografía, resonancia magnética nuclear [RMN], gammagrafía, etc.) para confirmar y delimitar la extensión de la enfermedad. En los pacientes con melanoma invasivo de alto riesgo (estadios IIB, IIC y III) se recomienda realizar exploraciones complementarias, a pesar de una exploración física anodina debido a la probabilidad de que existan metástasis a distancia ocultas en el momento del diagnóstico. Se recomienda realizar una TC toraco-abdominopélvica (o TC torácica+ecografía abdominal), RMN o TC craneal (opcional), TC cervical (en el caso de tumores localizados en la cabeza o el cuello) y gammagrafía ósea (opcional) en la visita inicial de forma previa a la realización del tratamiento quirúrgico definitivo (BGC o linfadenectomía)6–10,44–47,49–54. La solicitud de una tomografía por emisión de positrones (PET) en los pacientes con MM es una opción que actualmente queda reservada en nuestro entorno para los pacientes con MM y metástasis a distancia, en la estadificación primaria o con sospecha de recidiva, siempre que se plantee una actitud terapéutica curativa según el resultado de la prueba (especialmente indicado en casos de planteamiento quirúrgico de metástasis única o en imágenes dudosas con otras exploraciones complementarias)55–59.
Sin embargo, la mayor difusión de esta técnica, así como el uso combinado de la misma con otras pruebas de imagen (PET-TC), permite valorar de forma individualizada la utilidad de esta prueba en el estudio inicial del melanoma de alto riesgo (estadios AJCC IIB, IIC o III) o en los casos de melanoma de origen desconocido (ver más adelante)57–59.
Notificación a los registros local y nacionalUna vez completado el estudio de extensión inicial es muy aconsejable notificar el diagnóstico de MM a los pertinentes registros de cáncer o de melanoma locales y nacionales.
Tratamiento del paciente con melanoma maligno localizadoEl MM invasivo es un tumor complejo cuyo manejo requiere de la participación de múltiples especialistas, a ser posible organizados y coordinados en comités monográficos.
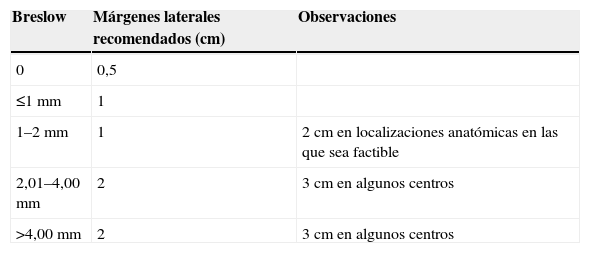
Tratamiento del tumor primarioEl tratamiento del melanoma cutáneo primario es su extirpación quirúrgica local amplia. La radioterapia u otras terapéuticas (imiquimod, crioterapia, etc.) como tratamiento del tumor primario quedan reservadas a aquellas indicaciones en que la cirugía no se puede realizar (pacientes inoperables), o en aquellos en los que la extirpación completa de la lesión sea altamente desfigurante (grandes lentigos malignos de la región facial). De forma ideal la exéresis se realizará “en bloque” en el momento de la biopsia de la lesión sospechosa (exéresis-biopsia) con unos márgenes que no excederán los 0,5cm. Este margen es suficiente en los tumores más delgados (in situ) y no alteraría el drenaje linfático de la zona en el caso que el paciente deba ser sometido a procedimientos tales como la linfogammagrafía o la BGC. El periodo de tiempo entre la biopsia diagnóstica y el tratamiento quirúrgico definitivo será siempre el mínimo posible. Una vez realizada la exéresis de la lesión y confirmado el diagnóstico del MM se programará la ampliación de los márgenes de resección. La amplitud lateral de dichos márgenes se medirá desde la cicatriz de la exéresis simple, descontando los milímetros (de 2 a 5mm) que se extirparon con la inicial resección del tumor, y se calculará en función del grosor micrométrico del tumor (índice de Breslow). La extirpación se extenderá en profundidad hasta la fascia muscular (sin incluirla)6–10,22,23. Los resultados de diversos ensayos aleatorizados y controlados han demostrado que el margen lateral idóneo en cada caso depende de la profundidad de la lesión (grosor micrométrico de Breslow), no evidenciándose ningún beneficio con las ampliaciones laterales de más de 3 cm60–68. Todo ello ha conducido a una reducción de los márgenes recomendados en el pasado (tabla 5). La estratificación de los pacientes en dichos estudios se realizó siempre en función de las clasificaciones vigentes en aquel momento, que ignoraban la importancia de la ulceración del tumor primario en la estadificación. Se debería conocer el resultado de estudios similares realizados en función del estadio TNM del tumor, que hasta la fecha no han sido publicados. En aquellos casos en que la BGC esté indicada (como ya se ha visto con anterioridad), la ampliación deberá efectuarse idealmente de forma simultánea o, si no es posible, posteriormente a la BGC. En ocasiones el tratamiento quirúrgico del tumor primario se debe adaptar a las peculiaridades anatómicas de algunas localizaciones, de algunos tumores de gran tamaño, o a la situación médica del paciente. En el caso de los tumores subungueales se recomienda la amputación por debajo de la articulación interfalángica distal. No obstante, en los tumores subungueales en estadio 0 (in situ) se debería plantear una cirugía conservadora (exéresis+injerto o plastia). De igual forma, en aquellos MM situados en otras localizaciones de los dedos o localizados en la palma, la planta u otras zonas de los pies o las manos se considerará realizar un tratamiento conservador del miembro, siempre y cuando se consiga una extirpación completa y con margen suficiente del tumor, aceptándose las reconstrucciones con injertos o plicaturas de aproximación y granulación por segunda intención. En el caso de los tumores de los dedos puede realizarse también una desarticulación proximal al tumor69. Por otro lado, la cirugía micrográfica de Mohs ha demostrado ser una opción válida en tumores de difícil delimitación y en localizaciones anatómicas en las que la obtención de un margen adecuado pueda resultar difícil y/o mutilante70–72.
Recomendaciones para la ampliación de márgenes laterales tras la exéresis simple según el valor del grosor micrométrico Breslow del melanoma primario
| Breslow | Márgenes laterales recomendados (cm) | Observaciones |
| 0 | 0,5 | |
| ≤1mm | 1 | |
| 1–2mm | 1 | 2cm en localizaciones anatómicas en las que sea factible |
| 2,01–4,00mm | 2 | 3cm en algunos centros |
| >4,00mm | 2 | 3cm en algunos centros |
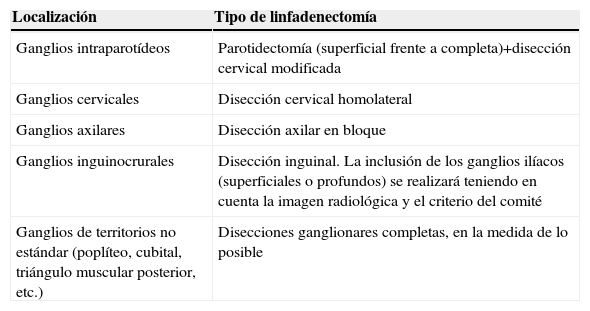
El tratamiento de la enfermedad ganglionar regional es la cirugía (linfadenectomía), que en determinadas situaciones puede ir seguida de algún tratamiento adyuvante (radioterapia, inmunoterapia, etc.). Los diferentes tipos de linfadenectomías según el territorio de drenaje quedan recogidos en la tabla 6. Se realizará una linfadenectomía selectiva del territorio ganglionar en aquellos casos sin evidencia clínica de enfermedad regional en que el estudio histopatológico del/los ganglio/s centinela/s muestren la presencia de micrometástasis ganglionares. La linfadenectomía terapéutica está indicada en aquellos pacientes con afectación ganglionar evidente (por sospecha clínica —palpación— o por técnicas de imagen [ECO, TC, PET]), confirmada histológicamente (punción-aspiración con aguja fina [PAAF] o ecografía-PAAF, según la localización)6–10,22,23. Se consideran como contraindicaciones relativas a tener en cuenta antes de indicar la linfadenectomía las siguientes: a) metástasis a distancia conocida; b) supervivencia a largo plazo, por otras causas, poco probable; y c) estado general y patología de base del paciente (a valorar de forma individualizada por un comité).
Tipos de linfadenectomías recomendados según la localización de las metástasis ganglionares
| Localización | Tipo de linfadenectomía |
| Ganglios intraparotídeos | Parotidectomía (superficial frente a completa)+disección cervical modificada |
| Ganglios cervicales | Disección cervical homolateral |
| Ganglios axilares | Disección axilar en bloque |
| Ganglios inguinocrurales | Disección inguinal. La inclusión de los ganglios ilíacos (superficiales o profundos) se realizará teniendo en cuenta la imagen radiológica y el criterio del comité |
| Ganglios de territorios no estándar (poplíteo, cubital, triángulo muscular posterior, etc.) | Disecciones ganglionares completas, en la medida de lo posible |
El tratamiento radioterapéutico del territorio o territorios ganglionares (después de la linfadenectomía) disminuye la probabilidad de una recidiva ganglionar en un 50–20% en algunos grupos de pacientes en estadio III, considerados de alto riesgo73–75. Por ello se valorará su indicación en los siguientes casos:
- 1.
Recidiva ganglionar (sea cual sea el estadio clínico-patológico previo del paciente).
- 2.
Metástasis ganglionares con afectación extracapsular en el estudio histopatológico.
- 3.
Metástasis en más de tres ganglios en la misma cadena ganglionar.
- 4.
Macrometástasis ganglionares (adenopatía/s >3cm de diámetro)75.
Si el enfermo es tributario de tratamiento con interferón, la radioterapia se completará un mes antes del inicio del tratamiento con este, para evitar el riesgo de desmielinización76.
Interferón alfa en dosis altasEn la actualidad, la terapia adyuvante con interferón (IFN) alfa 2b a altas dosis ha demostrado tener un beneficio en términos de supervivencia libre de enfermedad y, sólo en algún trabajo, también respecto a la supervivencia global77–88. Las indicaciones aprobadas en nuestro país para la terapia con IFN en altas dosis son todas aquellas situaciones de melanoma de alto riesgo de recidiva. Por ello se contemplará en los siguientes casos:
- 1.
Pacientes con metástasis en los ganglios regionales, metástasis en tránsito o -satelitosis que queden libres de enfermedad después de la cirugía (estadio III).
- 2.
Pacientes con un tumor primario (o recidiva local) de más de 2mm y ulcerado (estadio IIB) o más de 4mm (estadio IIB-IIC).
Sin embargo, el elevado índice de toxicidad de esta pauta de tratamiento (ver ficha técnica) obliga siempre a valorar de forma individualizada la edad y la patología de base del paciente y a excluir aquellos sujetos con enfermedad concomitante grave, gestación, segunda neoplasia o evidencia de metástasis a distancia88. Se recomienda iniciar el tratamiento de forma precoz tras el diagnóstico del melanoma (primeras 8 semanas desde el diagnóstico o la cirugía definitiva del tumor). La pauta de tratamiento aprobada para el uso de IFN en altas dosis se basa en un esquema bifásico, con una primera fase (fase de inducción) en la que se administra en dosis más elevadas (20MU/m2) por vía endovenosa, 5 días a la semana durante 4 semanas, seguida de una fase de mantenimiento en dosis inferiores (10MU/m2), por vía subcutánea, tres días a la semana durante 48 semanas (denominado esquema de Kirkwood). El objetivo del tratamiento es mantener las dosis más elevadas toleradas por el paciente, realizando los ajustes de dosis necesarios en función de la toxicidad (ver ficha técnica).Antes de iniciar el tratamiento se debe solicitar una analítica general con hormonas tiroideas, funciones hepática y lipídica completas, serología para los virus de la hepatitis B y C y un electrocardiograma (en algunos centros también se recomienda realizar un fondo de ojo). Para la monitorización de la toxicidad es necesario realizar controles analíticos de forma semanal durante la fase de inducción y después mensuales y bimensuales, según la tolerancia.
Interferón alfa 2b pegiladoEl IFN alfa 2b pegilado ha demostrado tener una eficacia similar al IFN alfa 2b convencional en el tratamiento de las diferentes patologías en las que este está indicado (hepatitis crónica por virus de la hepatitis C, melanoma) con una pauta posológica más cómoda y una menor toxicidad. Ello permitiría plantear tratamientos más prolongados que los actuales, con el objetivo de prolongar también el beneficio del mismo (período libre de enfermedad). Aunque en la actualidad su uso está aprobado sólo en la hepatitis crónica por el virus de la hepatitis C, se espera que las administraciones sanitarias tramiten su aprobación en pacientes con melanoma87.
Otros tratamientos adyuvantesLa administración de tratamientos diferentes del IFN alfa-2b en régimen de adyuvancia se debe realizar sólo en el contexto de ensayos clínicos. En el momento actual estos tratamientos se basan fundamentalmente en inmunoterapia celular o la utilización de moléculas diana (por ejemplo anti CTLA-4).
Tratamiento del paciente con melanoma maligno metastáticoSiempre que sea posible se debe intentar incluir al paciente con enfermedad metastásica dentro de ensayos clínicos. Los mejores candidatos para ofrecer un tratamiento sistémico paliativo serán aquellos pacientes con baja carga tumoral y con un buen estado general. Si el paciente no cumple criterios para ser tratado en un ensayo clínico, podrán plantearse diferentes alternativas, entre las que figura la abstención terapéutica y el tratamiento sintomático, dada la escasa efectividad de los tratamientos paliativos en el melanoma en estadio IV.
Cirugía de las metástasisLa resección quirúrgica completa es la única forma de tratamiento para la enfermedad metastásica por MM que se ha mantenido asociada, de forma consistente, con una mejora en la tasa de supervivencia a los 5 años. No se considera como un tratamiento curativo, pero la resección quirúrgica de las metástasis prolonga la supervivencia del paciente89. Se valorará la exéresis quirúrgica de las metástasis en caso de lesiones únicas localizadas en las partes blandas, los ganglios linfáticos no regionales89, el pulmón90 o en casos seleccionados de afectación del sistema nervioso central (SNC) (véase más adelante) o del tracto digestivo (sobre todo en caso de metástasis sangrantes)91. La cirugía se realizará únicamente a pacientes con un buen estado general, un intervalo libre de la enfermedad previsiblemente largo, y en ausencia de un crecimiento rápido de las lesiones.
Radioterapia paliativaLas indicaciones para realizar tratamiento radioterápico en el MM metastásico comprenden74,75:
- 1.
Metástasis subcutáneas múltiples no operables.
- 2.
Metástasis única después de la exéresis.
- 3.
Recidiva local del tumor primario, metástasis visceral (óseas con compresión medular, cerebrales múltiples) o ganglionar no operable.
Las dosis y fraccionamiento de la radioterapia oscilarán fundamentalmente en función de la localización tumoral, del riesgo de complicaciones previsibles y del objetivo del tratamiento (radical, complementario o paliativo). Siempre que sea posible se utilizará un esquema de dosis hipofraccionadas. En el caso de las metástasis cerebrales se considerará la radioterapia holocraneal, cirugía o radiocirugía, dependiendo de la situación clínica. Ante un paciente con una metástasis única, mayor de 3cm, con un importante efecto masa y con enfermedad controlada a otros niveles se indicará resección quirúrgica, seguida de radioterapia holocraneal. En el caso de una metástasis única menor de 3cm puede considerarse la radiocirugía. En el caso de metástasis múltiples el tratamiento estándar es la radioterapia asociada o no a quimioterapia92, sin descartar el beneficio de la radiocirugía inicial en pacientes seleccionados con dos o tres metástasis.
Perfusión regional con citostáticos en hipertermia en el tratamiento del melanoma maligno de las extremidadesEste tratamiento está indicado en los pacientes con MM localizado en una extremidad y que, una vez extirpada la lesión en una ocasión como mínimo, presenta recidivas locales o en tránsito diseminadas por toda la extremidad. Los fármacos usados en la perfusión que parecen más efectivos es la asociación de melfalán y TNF alfa93.
QuimioterapiaEn este contexto (paciente con MM en estadio IV) y ante los resultados mediocres obtenidos con la quimioterapia (ningún régimen de quimioterapia ha conseguido incrementar de forma significativa la supervivencia de estos enfermos), está justificado investigar nuevos fármacos en fase II, incluso como tratamiento de primera línea94. Los esquemas de quimioterapia más recomendados actualmente son con dacarbacina (DTIC). Excepto en el contexto de protocolos experimentales el quimioterápico considerado como estándar y aprobado por las autoridades sanitarias es la dacarbacina94. Ha demostrado un 10,2–20% de respuestas en estudios de fase III.
TemozolamidaHa demostrado una eficacia similar a dacarbacina en estudios en fase III (tasa de respuestas del 13%)95. Se utilizará especialmente en aquellos pacientes donde el esquema oral sea preferible, como uso compasivo, ya que no dispone de la aprobación de las agencias reguladoras. Tiene la ventaja de que penetra en el SNC, por lo que podría contribuir a disminuir el riesgo de recidiva a este nivel96.
FotomustinaEs un fármaco aprobado para el melanoma que en estudios aleatorizados ante dacarbacina muestra un discreto beneficio, y que puede ser utilizado en metástasis cerebrales97. Puede ser considerado en primera o segunda línea, dependiendo de la presencia de metástasis cerebrales. El principal efecto secundario es la mielotoxicidad.
PoliquimioterapiaLos esquemas de combinaciones de quimioterapia (CVD: cisplatino [CDDP]+vinblastina+DTIC, CBVD: CDDP+carmustina [BCNU]+vinblastina+DTIC o CDDP/DTIC) han demostrado, en general, tasas de respuestas superiores al DTIC en estudios fase II, pero no han podido demostrar superioridad respecto a la monoterapia con DTIC en estudios de fase III98. Además, se asocian a un incremento de la toxicidad, por lo que no se recomiendan de forma rutinaria. La combinación que, por el momento, ha demostrado una mayor tasa de respuestas completas en diversos trabajos es la de: DTIC+BCNU+CDDP+tamoxifeno (TMX), aunque también ha fallado en demostrar una mejor supervivencia en estudios de fase III.
InmunoterapiaInterleucina 2 en monoterapiaEn infusión endovenosa y a dosis altas se asocia a un 15% de respuestas, un tercio de las cuales son respuestas completas99. De estas, el 70% son duraderas y, en algún caso, curativas. Sin embargo, su elevada toxicidad (con muertes tóxicas en torno al 0,5–2% de los pacientes) obliga a un manejo intensivo (en la Unidad de Cuidados Iintensivos), reservado únicamente para centros altamente especializados y con un número elevado de pacientes. Debido precisamente a esta gran toxicidad y a la falta de estudios comparativos con DTIC o con regímenes de poliquimioterapia, no ha recibido aún la aprobación por las agencias reguladoras europeas.
Interferón-alfaNo está aprobado en monoterapia para el tratamiento del MM metastásico. Ha demostrado un 10–15% de respuestas en estudios de fase I–II100, pero no se ha comparado, en monoterapia, con DTIC o poliquimioterapia. Su adición a esquemas de quimioterapia (DTIC, o DTIC-CDDP-TMX o CBVD, o a interleucina 2 [IL2]) tampoco ha supuesto un beneficio significativo en diversos estudios de fase III, por lo que no se recomienda fuera del contexto de algún ensayo clínico.
VacunasEn nuestro medio existen ensayos de fase II con vacunas de células heterólogas101 y de células dendríticas autólogas pulsadas con tumor heterólogo o autólogo102, que pueden beneficiar a algunos pacientes con poco volumen tumoral o enfermedad lentamente evolutiva.
BioquimioterapiaEl término hace referencia a las combinaciones de DTIC y/o poliquimioterapia con INFα (subcutáneo) o Il-2 (endovenosa o subcutánea) a dosis variables. Estos esquemas se han asociado a una elevada tasa de respuestas (33–64%), así como a una toxicidad considerable en estudios de fase II103,104. No obstante, no se ha publicado de momento ningún estudio fase III (frente a quimioterapia) que haya demostrado un beneficio significativo en tiempo hasta la progresión o en supervivencia105, por lo que no puede recomendarse de forma estándar.
Otros tratamientosActualmente existen múltiples estudios de fase II y algunos fase III para intentar establecer el papel de nuevos tratamientos en el melanoma metastásico94. Estos ensayos incluyen desde aproximaciones con inmunoterapia a terapéuticas diana como sorafenib, oblimersen, paclitaxel y anticuerpos anti-CTLA-4, entre otros. Por el momento, no está justificada la utilización de estos tratamientos fuera de ensayos clínicos.
Manejo en el seguimiento del paciente con melanoma malignoEl seguimiento del paciente diagnosticado de MM, como en otras neoplasias, tiene un doble objetivo: en primer lugar el diagnóstico de la recidiva (local, regional y/o a distancia) realizando las exploraciones y pruebas complementarias adaptadas a la historia natural del proceso y, en segundo lugar, el diagnóstico precoz de un segundo melanoma. Se utilizarán los métodos más sencillos y ágiles, que pueden variar según el centro. Este diagnóstico precoz se justifica esencialmente si existen posibilidades terapéuticas de rescate eficaces. Sin embargo, ningún estudio ha demostrado que realizar seguimientos periódicos al paciente incremente su supervivencia6–10,106.
A pesar de que no existe un acuerdo unánime de cuáles son las exploraciones complementarias que deberían ser consideradas de rutina, sí que hay un consenso general para adaptar estas exploraciones en función de los factores pronósticos y, en especial, según el estadio clínico-histopatológico6–10,22. En cada visita del paciente se deberá realizar una anamnesis dirigida a detectar la presencia de síntomas o signos sospechosos de una recidiva, la exploración detallada de toda la piel del enfermo y la palpación de los territorios de drenaje linfático o, según la disponibilidad del centro y las características del enfermo (por ejemplo en pacientes obesos), se considera más precisa la valoración de dichos territorios mediante ecografía22,33,34,107. Además, todos los pacientes serán instruidos para realizarse una auto-vigilancia una vez al mes y una fotoprotección eficaz. El paciente buscará la presencia de un cambio en las máculas pigmentadas y la aparición o modificación de los ganglios superficiales. Se facilitará también un circuito de consulta rápida para que el paciente pueda consultar si aparecen síntomas o signos inexplicables, sin esperar a una visita de rutina108.
En referencia a la duración del periodo de seguimiento los controles deberían realizarse durante un mínimo de 5 años en los estadios 0 o IA y un mínimo de 10 años para el resto de los estadios. Los pacientes diagnosticados de MM (independientemente del estadio) y con antecedentes familiares de melanoma, o que presenten otras lesiones névicas sospechosas (nevos clínicamente atípicos) se deberían controlar toda la vida, por el riesgo de aparición de un segundo melanoma22,109. Existen diferentes pautas clínicas de seguimiento según los diferentes hospitales que quedarían englobadas y resumidas en el siguiente esquema:
- 1.
MM in situ. Seguimiento anual durante 3 a 5 años, sin exploraciones complementarias.
- 2.
MM de bajo riesgo (estadio IA). Seguimiento durante 5 a 10 años. Calendario de visitas: primeros dos años cada 3–6 meses; siguientes tres años semestral. Si se realiza más seguimiento, anual; analítica convencional+LDH*: primeros dos años semestral-anual, siguientes tres años anual; radiografía de tórax±ecografía abdominal anual los primeros 5 años.
- 3.
MM de riesgo intermedio (estadio IB y IIA). Seguimiento durante 10 años: calendario de visitas los primeros tres años cada 3–6 meses, los siguientes dos años semestral, los siguientes 5 años anual; analítica convencional+LDH* los primeros tres años trimestral-semestral, los siguientes dos años semestral, los siguientes 5 años anual; radiografía de tórax±ecografía abdominal los primeros tres años semestral, los siguientes dos años anual y los 5 años restantes sin ecografía.
- 4.
MM riesgo elevado (estadio IIB-IIC-III). Seguimiento durante 10 años: calendario de visitas los primeros tres años cada 3–4 meses, los siguientes dos años semestral, los siguientes 5 años anual; analítica convencional+LDH*: primeros tres años trimestral-semestral, los siguientes dos años semestral, los siguientes 5 años anual; TC toracoabdominal (o radiografía de tórax+ecografía abdominal en estadios IIB-IIC): los primeros tres años semestral-anual, los siguientes dos años anual, los 5 años restantes no es necesaria. Algunos centros realizan también RMN craneal (más sensible) o TC craneal y gammagrafía ósea de forma anual en los estadios de riesgo elevado.
¿Otros marcadores opcionales son tirosinasa, beta s100 (el incremento constatado en la determinación de la beta s100 de un 50% es altamente indicativo de enfermedad diseminada, aunque por el momento sólo está incluido en protocolos de estudio)48,110–112. El resto de las exploraciones complementarias se llevarán a cabo en función de los hallazgos clínicos o analíticos.
Melanoma de origen desconocidoEl melanoma de origen desconocido (MOD) se define como la presencia de metástasis de melanoma (confirmadas mediante estudio histológico) en los ganglios linfáticos, localizaciones subcutáneas o viscerales sin evidencia de una lesión primaria, y supondría un 2–6% del total de pacientes con melanoma113–116. El pronóstico de estos pacientes no difiere sustancialmente del de los sujetos con melanomas primarios que en el momento del diagnóstico presentan un estadio AJCC similar114. Aunque las definiciones más estrictas excluyen aquellos casos en los que se recoge el antecedente de excisión previa de una probable lesión melanocítica sin estudio histológico, el abordaje clínico de estos pacientes no difiere del de los pacientes con MOD en sentido estricto. Ante todo paciente diagnosticado de metástasis de melanoma sin primario conocido se debe iniciar una serie de exploraciones para descartar la presencia de un melanoma no cutáneo, que en muchas ocasiones no es clínicamente evidente: exploración cutánea y mucosa completa, con especial énfasis en las áreas que drenan en el territorio ganglionar afecto (si procede) y en las localizaciones poco accesibles (genitales, cuero cabelludo, etc.); exploración otorrinolaringológica, oftalmológica, ginecológica y del tracto digestivo (gastroscopia, colonoscopia)117. La estadificación de este grupo de pacientes se realiza siguiendo la clasificación de la AJCC20, considerándose estadio III si hay afectación de la piel, tejido celularsubcutaneo o ganglionar y estadio IV cuando hay afectación visceral. Las exploraciones complementarias necesarias para la estadificación inicial se indican en función del estadio AJCC y de la semiología del paciente, y no difieren de las de los pacientes con melanoma de primario conocido117,118. El tratamiento de los pacientes con MOD se debe decidir según los mismos criterios utilizados para determinar el tratamiento del melanoma cutáneo primario conocido. La cirugía radical de la lesión o lesiones iniciales, cuando es factible, es el tratamiento de elección119.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.