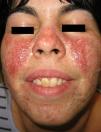
Presentamos el caso de una paciente mujer de 27 años de edad, diagnosticada desde hace más de 10 años de esclerosis tuberosa (ET). En el momento de su primera consulta en dermatología se objetivaron varias de las manifestaciones cutáneas características de la enfermedad: angiofibromas faciales diseminados (fig. 1), múltiples tumores de Koenen periungueales en ambos pies, máculas hipopigmentadas en el tronco así como una lesión de placa de chagrín en la espalda. La presencia de epilepsia y de retraso mental completaba el cuadro clínico. La paciente no presentaba lesiones hamartomatosas internas conocidas.
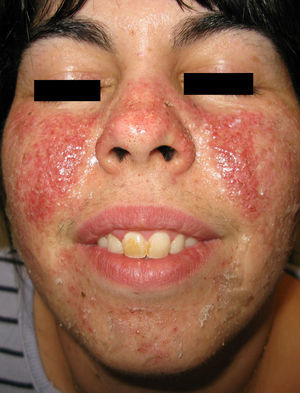
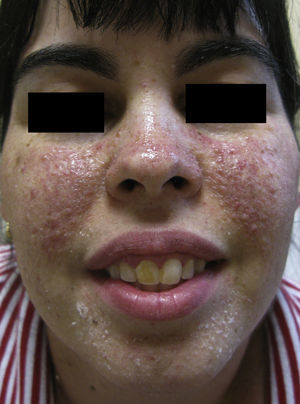
Con el objetivo de mejorar la apariencia facial y disminuir el número de angiofibromas se habían realizado en el pasado varios procedimientos que incluyeron afeitados múltiples, láser de colorante pulsado, electrodesecación y aplicación de pomada de tacrolimus al 0,1%. La respuesta a los tratamientos fue pobre, sin disminución evidente del número de lesiones y persistencia del eritema. En ese momento se decidió un intento terapéutico con una solución de rapamicina tópica 1 mg/ml formulada en farmacia, aplicada dos veces al día en las zonas afectas de ambas mejillas. Después de 3 meses de tratamiento la mejoría clínica de las lesiones era evidente, con disminución en su número así como en el eritema subyacente (fig. 2).
La ET es una genodermatosis de herencia autosómica dominante caracterizada por la aparición de hamartomas en múltiples órganos, incluyendo la piel y el sistema nervioso central. Su patogénesis se fundamenta en la alteración de las proteínas hamartina o tuberina, codificadas en los locus 9q34 y 16p13.3 respectivamente1. La clínica típica consiste en la triada clásica de múltiples angiofibromas, epilepsia y retraso mental, aunque esta asociación sólo es evidente en el 26% de los pacientes2.
A pesar de la gran variabilidad clínica de la enfermedad y su penetrancia variable3, los angiofibromas faciales se encuentran presentes en el 83 al 90% de los casos3,4. Se consideran patognomónicos y se localizan de forma preferente en los surcos nasolabiales, las mejillas, el mentón, el cuero cabelludo, la frente y las orejas4. Suelen aparecer a lo largo de la primera década de la vida y se estabilizan en la adolescencia, persistiendo de por vida. No tienen características de malignidad, pero representan un motivo de consulta muy frecuente en estos pacientes por su apariencia estética.
En su tratamiento se han empleado diversas opciones terapéuticas, incluyendo escisión simple, criocirugía, curetaje, dermoabrasión, láser de CO2 y terapia fotodinámica, entre otras. Ningún tratamiento se ha mostrado efectivo para controlar su aparición y/o evitar las recidivas5–7.
Rapamicina o sirolimus es un fármaco inmunosupresor utilizado por vía oral principalmente en el contexto de trasplantes renales. Su mecanismo de acción no ha sido completamente definido, pero se sabe que interfiere en la vía de la proteína mTOR, responsable de la proliferación celular y de la inhibición de la apoptosis en los pacientes con ET8. Hamartina y tuberina, las proteínas que se encuentran modificadas en la ET, suprimen también la actividad de la vía mTOR, de tal manera que la alteración en su funcionamiento provoca la activación permanente de esta vía provocando la aparición de tumores hamartomatosos a múltiples niveles9. Se ha sugerido que las vías por las que la rapamicina disminuye el número y el tamaño de los tumores en ET sean la inhibición de la angiogénesis9,10 y de factores de crecimiento aberrantes10, aunque estos fenómenos sólo se han comprobado en lesiones hamartomatosas extracutáneas (cerebro, riñón y pulmón).
Después de comprobar el fracaso de las terapias empleadas en nuestra paciente para el control de los angiofibromas faciales, decidimos ensayar un tratamiento tópico con rapamicina, una alternativa que ha sido descrita recientemente en dos trabajos anteriores9,10. El nuestro constituye el cuarto caso descrito en el que esta terapia es empleada para el control de angiofibromas faciales. En todos los pacientes se ha descrito franca mejoría del cuadro, con disminución marcada o incluso desaparición completa de las lesiones, así como mejoría en el eritema facial después de pocos meses de tratamiento. De los tres casos anteriormente descritos, dos fueron tratados con una solución de rapamicina 1mg/ml, y el paciente restante con rapamicina en pomada al 0,1%. La posología varió entre una y dos aplicaciones diarias. Al igual que en nuestra paciente, el tratamiento pareció ser bien tolerado, sin aparición de efectos adversos locales o sistémicos en ningún caso. Las vías farmacológicas responsables de la eficacia de rapamicina en los angiofibromas de la ET deben ser esclarecidas en futuros trabajos.
En el momento actual no existe en el mercado americano o europeo ningún preparado tópico de rapamicina comercial, por lo que ésta debe ser formulada en farmacia. Por su vía de administración, la aplicación tópica debería asociarse a un mejor perfil de seguridad en comparación con la vía oral, aunque es necesario un seguimiento más prolongado de los pacientes para confirmar estas observaciones. Dado el pequeño número de casos descritos hasta el momento, la presentación mas adecuada del producto no ha sido todavía determinada.
En conclusión, aportamos un nuevo caso de múltiples angiofibromas faciales en el contexto de ET tratados con rapamicina tópica. Su utilización puede representar una alternativa válida para este contexto, pero son necesarios más casos para verificar la eficacia y seguridad de la terapia a largo plazo.