El diagnóstico del lentigo maligno melanoma facial constituye un reto en la práctica clínica habitual debido al solapamiento de ciertas características clínicas y morfológicas con lesiones como lentigos solares o queratosis actínicas pigmentadas. La microscopia confocal es una técnica no invasiva que permite obtener imágenes en tiempo real de la epidermis y la dermis superficial con resolución a nivel celular. En esta serie se describen 3 casos de lesiones faciales sospechosas de lentigo maligno, evaluadas por dermatoscopia y microscopia confocal antes de realizar el análisis histopatológico. En el primer caso, con diagnóstico de lentigo maligno melanoma, se realizó un mapeo prequirúrgico mediante microscopia confocal, para delimitar los márgenes con mayor precisión, y en el segundo y el tercer caso con sospecha clínica y dermatoscópica de lentigo maligno melanoma se identificó la zona óptima para realizar la biopsia.
Facial lentigo maligna melanoma can be a diagnostic challenge in daily clinical practice as it has similar clinical and morphological features to other lesions such as solar lentigines and pigmented actinic keratoses. Confocal microscopy is a noninvasive technique that provides real-time images of the epidermis and superficial dermis with cellular-level resolution. We describe 3 cases of suspected facial lentigo maligna that were assessed using dermoscopy and confocal microscopy before histopathology study. In the first case, diagnosed as lentigo maligna melanoma, presurgical mapping by confocal microscopy was performed to define the margins more accurately. In the second and third cases, with a clinical and dermoscopic suspicion of lentigo maligna melanoma, confocal microscopy was used to identify the optimal site for biopsy.
La microscopia confocal de reflectancia (MCR) es una técnica no invasiva que permite, mediante el uso de un sistema de láser de baja potencia, la obtención de imágenes in vivo con una penetración que alcanza la dermis papilar y una resolución a nivel celular1,2. Su utilidad ha sido reportada, demostrando mejorar la precisión en el diagnóstico del melanoma y del cáncer de piel no melanoma, sobre todo en lesiones de difícil valoración3–7.
La piel facial presenta características histológicas particulares como resultado de la prominencia de los anejos cutáneos, el borramiento de las crestas epidérmicas y un grado variable de elastosis en la dermis. En la exploración dermatoscópica de las lesiones pigmentadas faciales, a diferencia de la piel del resto del cuerpo, rara vez se observa retículo pigmentado; en su lugar se encuentra un pseudorretículo de celdas amplias formado por los numerosos folículos pilosos y aperturas glandulares presentes8. Todas las lesiones faciales pigmentadas, tanto melanocíticas como no melanocíticas, pueden presentar este pseudorretículo8–10; por este motivo el diagnóstico del lentigo maligno (LM) y del lentigo maligno melanoma (LMM) facial frecuentemente constituye un reto, debido a que existe un solapamiento de las características clínicas y dermatoscópicas con lesiones tales como lentigos solares, queratosis actínicas pigmentadas y otras11. Del mismo modo, no es infrecuente encontrar un diagnóstico de LM/LMM en lesiones clínica y dermatoscópicamente inciertas o incluso banales. Por todo ello es necesario tener a nuestro alcance herramientas que nos permitan incrementar la precisión diagnóstica, detectando lesiones malignas en fases tempranas, así como evitando extirpaciones innecesarias de lesiones benignas12.
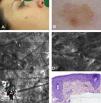
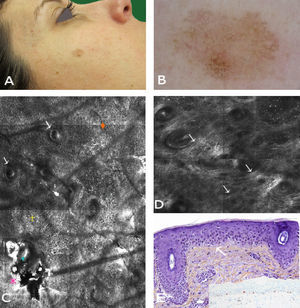
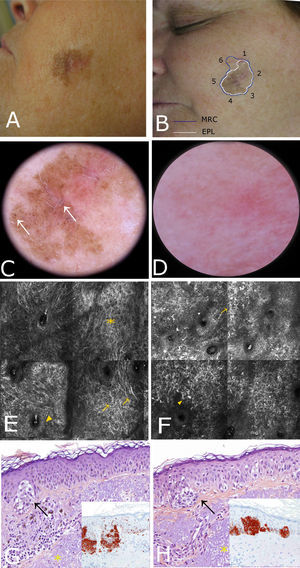
Caso 1Mujer de 37 años, con antecedentes de melanoma múltiple y melanoma familiar. Portadora de la mutación de alto riesgo 358 del G en CDKN2A. En una exploración de control se apreció lesión pigmentada de 7×5mm en la mejilla derecha de menos de 6 meses de evolución. En la dermatoscopia se observó una lesión policroma (marrón claro, marrón oscuro y gris), con distribución asimétrica de la pigmentación, patrón granular anular gris y pseudorretículo pigmentado. La lesión presentaba por tanto criterios dermatoscópicos que comparten tanto el LM/LMM, como las queratosis actínicas pigmentadas. La lesión fue examinada bajo MCR, donde se evidenció disrupción del estrato córneo, alteración de la arquitectura epidérmica (panal de abejas atípico) y atipia queratinocítica suprabasal con presencia de algunas células dendríticas pequeñas (<20μm) sin distribución perifolicular ni infiltración pagetoide. La dermis superficial mostraba un estroma con fibras engrosadas, moderadamente refráctil característico de elastosis solar (fig. 1). Estos hallazgos fueron altamente sugestivos de queratosis actínica y mediante MCR se pudo localizar el sitio más adecuado para obtener la biopsia que confirmó el diagnóstico. Finalmente la lesión fue tratada con adapaleno 0,1% diario durante un mes, con buenos resultados durante el seguimiento.
Caso 1. A. Imagen clínica. B. Imagen dermatoscópica donde se observa pseudorretículo con puntos grises y un área excéntrica más pigmentada con refuerzo perifolicular focal. C. Submosaico de MCR (1300×800μm) que muestra un material amorfo de refractilidad heterogénea (
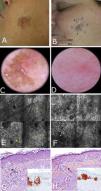
Mujer de 56 años, sin antecedentes patológicos de interés, remitida a nuestro centro para valoración quirúrgica de una lesión en la mejilla izquierda, con biopsia previa informada por otro centro como melanoma in situ tipo LM. En el examen se observaba placa marrón de 21×17mm, con cicatriz central de 6mm, de bordes mal delimitados, con áreas de pigmento marrón y oclusión folicular, en la periferia áreas de escaso pigmento sin signos dermatoscópicos claros de LMM (fig. 2 A). Sabiendo que la identificación de márgenes adecuados es crucial en la evaluación prequirúrgica del LMM, y debido a que no era posible visualizar adecuadamente los límites de la lesión con dermatoscopia, se procedió a realizar un mapeo de las zonas adyacentes mediante MCR (fig. 2 E). Los hallazgos mostraron que un área acrómica adyacente a la lesión mostraba signos compatibles con LMM, al igual que el área pigmentada. Basándonos en esta información se procedió a determinar los márgenes prequirúrgicos y posteriormente a extirpar la lesión, que finalmente llegó a medir 28×20mm. El examen histopatológico reportó márgenes libres y el defecto quirúrgico fue reparado con un colgajo de rotación. A los 6 meses la lesión presentó recurrencia focal que se sometió a extirpación simple. No hubo evidencia de recurrencia a los 2 años de seguimiento.
Caso 2. A. Imagen clínica que muestra lesión pigmentada de bordes irregulares de 21×17mm en la mejilla izquierda con cicatriz central. B. Mapeo del área periférica en sentido horario, que muestra los límites de la lesión por epiluminiscencia (línea blanca) y por MCR (línea azul), ubicando una zona acrómica con signos de compromiso en MCR. C. Dermatoscopia mostrando pigmento perifolicular y oclusión de la salida folicular (
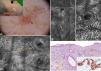
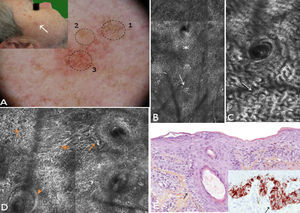
Un varón de 62 años, sin antecedentes patológicos de interés, acudió a nuestra consulta por presentar una lesión eritematosa en la región malar derecha de 10mm×7mm. En la dermatoscopia se distinguían 3 zonas: una superior con pigmentación granular anular gris, una pápula central y una zona inferior con pigmento escaso y estructuras romboidales rojas, un nuevo criterio dermatóscopico de LM recientemente descrito10. Dichos hallazgos dermatoscópicos no resultaban concluyentes, entrando en el diagnóstico diferencial el LM/LMM, la queratosis actínica pigmentada y el lentigo solar. Por este motivo se practicó MCR con los hallazgos que se describen en la figura 3. Mediante esta técnica se descartó malignidad en la zona 1; la zona 2 presentaba características de queratosis seborreica y la zona 3 signos compatibles con LM. Se realizó biopsia punch de la zona 3 de la lesión, y el análisis histopatológico, corroborado con inmunohistoquímica, confirmó el diagnóstico. Se realizó exéresis completa de la lesión con diagnóstico histológico de presencia de focos de hiperplasia melanocítica, sin datos de LM. Este diagnóstico también fue corroborado por inmunohistoquímica.
Caso 3. A. Imagen clínica y dermatoscópica donde se observa en la zona 1 pigmentación granular anular gris, en la zona 2 una pápula central y estructuras romboidales rojas incipientes en zona la 3 inferior. B. Submosaico de MCR (1000×500μm) correspondiente a la zona 1 al nivel de la epidermis, donde se aprecia un patrón en panal de abejas típico con células hiperrefráctiles aisladas sin signos de atipia. C. Submosaico de MCR (350×600μm) correspondiente a la zona 2 al nivel de la epidermis que muestra cordones epiteliales compatibles con queratosis seborreica. D. Submosaico de MCR (800×900μm) correspondiente a la zona 3 al nivel de la epidermis que muestra panal de abejas desestructurado, (
La microscopia confocal es una técnica emergente dentro del campo de investigación clínica de la dermato-oncología. La mayor ventaja de esta técnica es la oportunidad única que ofrece para evaluar in vivo la morfología cutánea; esta «biopsia virtual» ahorra la necesidad de extirpar una lesión, y aunque una biopsia o una extirpación no son procedimientos complejos, los costes asociados a su análisis histopatológico y la morbilidad derivada son aspectos que resultan importantes desde la perspectiva de los servicios de salud y del paciente.
Si se compara con la dermatoscopia, método que alcanza una sensibilidad del 83,2% y una especificidad de 85,5%13, la MCR alcanza una sensibilidad mayor y una especificidad similar logrando un 97,3 y 83% respectivamente14. A pesar de ello, al ser una técnica que requiere un entrenamiento especial y mayor tiempo para su ejecución, no puede ser utilizada para una primera aproximación al diagnóstico, sino para lesiones que resulten equívocas a la dermatoscopia. Una limitación técnica del equipo de MCR es la profundidad que alcanza el láser, entre 350μ y 500μ, correspondientes a la dermis papilar, por lo que ni la profundidad de invasión de un tumor ni los procesos de la dermis reticular se pueden evaluar de manera fiable. Asimismo, como en cualquier técnica de imagen, la interpretación depende del entrenamiento del observador; a este respecto, actualmente se encuentran bajo desarrollo sistemas automatizados de diagnóstico de imagen.
Existen múltiples trabajos que muestran cómo el empleo de la MCR incrementa la precisión en el diagnóstico de lesiones melanocíticas de difícil diagnóstico y manejo4,7,12–15, aportando evidencia que soporta la iniciativa de implementar la MCR dentro de la práctica clínica con el objetivo de evitar biopsias innecesarias, entre otras aplicaciones.
Sin desestimar las limitaciones propias de la presente serie, este estudio nos ilustra sobre cómo la MCR puede ser una herramienta útil en el abordaje de lesiones equívocas, incluso con dermatoscopia; en los 3 casos la MCR no solo ayudó a alcanzar y confirmar el diagnóstico, sino que además modificó la actitud terapéutica final.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.