Los dermatólogos que trabajan fundamentalmente en el ámbito pediátrico conocen bien las consecuencias de padecer una enfermedad cutánea genética rara. El diagnóstico puede ser más o menos sencillo, pero en todos los casos antecede a serias dificultades en la vida cotidiana del paciente y su familia, derivadas no solo de la propia enfermedad, sino también del desconocimiento de la misma por parte del sistema asistencial. Entre estas genodermatosis raras se encuentran las epidermólisis ampollosas (EB) y las ictiosis. Sin duda, la EB es una de las genodermatosis más graves con las que nos enfrentamos los dermatólogos, particularmente en el caso de las formas distróficas generalizadas. Los pacientes con formas graves de EB distrófica (EBD) presentarán a lo largo de la vida una serie de manifestaciones extracutáneas severas que deteriorarán extraordinariamente su calidad de vida y condicionarán, en muchos casos, su fallecimiento prematuro1,2. Por fortuna, la mayoría de las ictiosis no ponen en peligro la vida del individuo, pero también repercuten negativamente en su calidad de vida y requieren la colaboración asistencial multidisciplinar3. Por suerte, tanto la EB como las ictiosis más graves son enfermedades raras, es decir, su prevalencia es menor de un afectado por cada 2.000 individuos. Dos estudios recientes han estimado que en España tenemos una prevalencia aproximada de EBD de 6,0 casos por millón de habitantes4 y de ictiosis congénitas autosómicas recesivas (ICAR) de 7,2 casos por millón de habitantes5. Estos trabajos han puesto de manifiesto, además, que la mayoría de los pacientes con estas enfermedades carecen de diagnóstico genético y no son atendidos en una consulta especializada, es decir, no disponen de un hospital accesible con profesionales expertos y medios materiales y humanos suficientes, datos que indican que su atención sanitaria es francamente mejorable. Como en España no disponemos de centros de referencia de estas enfermedades raras oficialmente reconocidos, los pacientes no pueden ser derivados a los hospitales con los mejores medios para abordar su enfermedad.
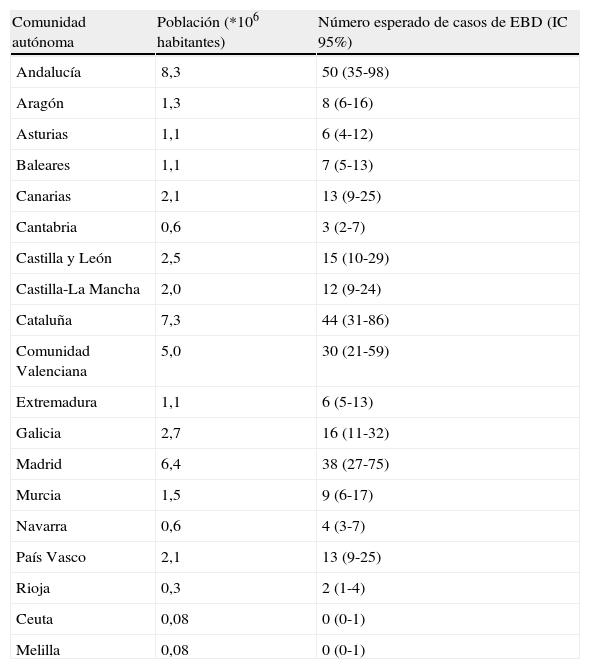
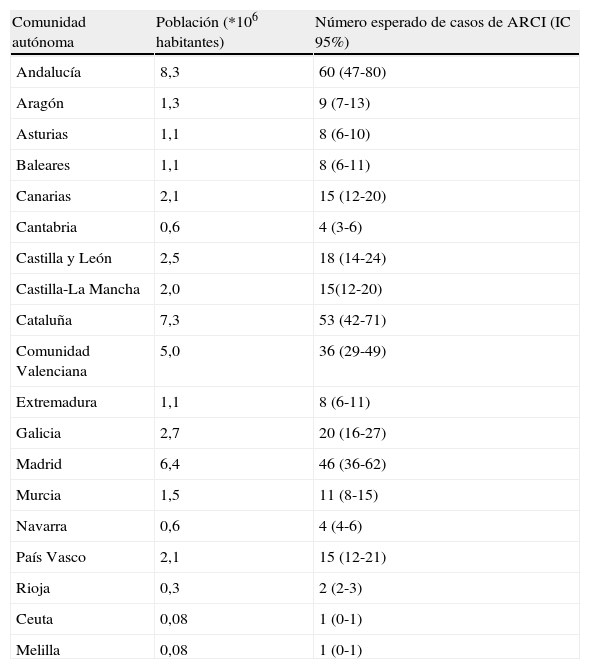
Según la prevalencia estimada, en España hay aproximadamente 276 pacientes con EBD5. Si tenemos en cuenta el número de habitantes por comunidad autónoma, el número esperado de casos oscila entre un máximo de 46 en Andalucía y un mínimo de 2 en La Rioja, excepción hecha de las ciudades autónomas de Ceuta y Melilla, donde la población es proporcionalmente tan escasa que la estimación es cercana a 0 (tabla 1). En el caso de las ICAR el número global de afectados sería de aproximadamente 288 en todo el país, y los casos esperados por comunidad autónoma variarían entre los 60 de Andalucía y un único paciente en las ciudades autónomas de Ceuta y Melilla (tabla 2). Evidentemente, la distribución teórica de afectados varía en función de la densidad poblacional y, por tanto, de la comunidad autónoma, lo cual es un dato fundamental a la hora de asignar recursos sanitarios, y más particularmente a la hora de crear centros de referencia.
Número de casos esperados de EBD por comunidad autónoma
| Comunidad autónoma | Población (*106 habitantes) | Número esperado de casos de EBD (IC 95%) |
| Andalucía | 8,3 | 50 (35-98) |
| Aragón | 1,3 | 8 (6-16) |
| Asturias | 1,1 | 6 (4-12) |
| Baleares | 1,1 | 7 (5-13) |
| Canarias | 2,1 | 13 (9-25) |
| Cantabria | 0,6 | 3 (2-7) |
| Castilla y León | 2,5 | 15 (10-29) |
| Castilla-La Mancha | 2,0 | 12 (9-24) |
| Cataluña | 7,3 | 44 (31-86) |
| Comunidad Valenciana | 5,0 | 30 (21-59) |
| Extremadura | 1,1 | 6 (5-13) |
| Galicia | 2,7 | 16 (11-32) |
| Madrid | 6,4 | 38 (27-75) |
| Murcia | 1,5 | 9 (6-17) |
| Navarra | 0,6 | 4 (3-7) |
| País Vasco | 2,1 | 13 (9-25) |
| Rioja | 0,3 | 2 (1-4) |
| Ceuta | 0,08 | 0 (0-1) |
| Melilla | 0,08 | 0 (0-1) |
Número de casos esperados de ICAR por comunidad autónoma
| Comunidad autónoma | Población (*106 habitantes) | Número esperado de casos de ARCI (IC 95%) |
| Andalucía | 8,3 | 60 (47-80) |
| Aragón | 1,3 | 9 (7-13) |
| Asturias | 1,1 | 8 (6-10) |
| Baleares | 1,1 | 8 (6-11) |
| Canarias | 2,1 | 15 (12-20) |
| Cantabria | 0,6 | 4 (3-6) |
| Castilla y León | 2,5 | 18 (14-24) |
| Castilla-La Mancha | 2,0 | 15(12-20) |
| Cataluña | 7,3 | 53 (42-71) |
| Comunidad Valenciana | 5,0 | 36 (29-49) |
| Extremadura | 1,1 | 8 (6-11) |
| Galicia | 2,7 | 20 (16-27) |
| Madrid | 6,4 | 46 (36-62) |
| Murcia | 1,5 | 11 (8-15) |
| Navarra | 0,6 | 4 (4-6) |
| País Vasco | 2,1 | 15 (12-21) |
| Rioja | 0,3 | 2 (2-3) |
| Ceuta | 0,08 | 1 (0-1) |
| Melilla | 0,08 | 1 (0-1) |
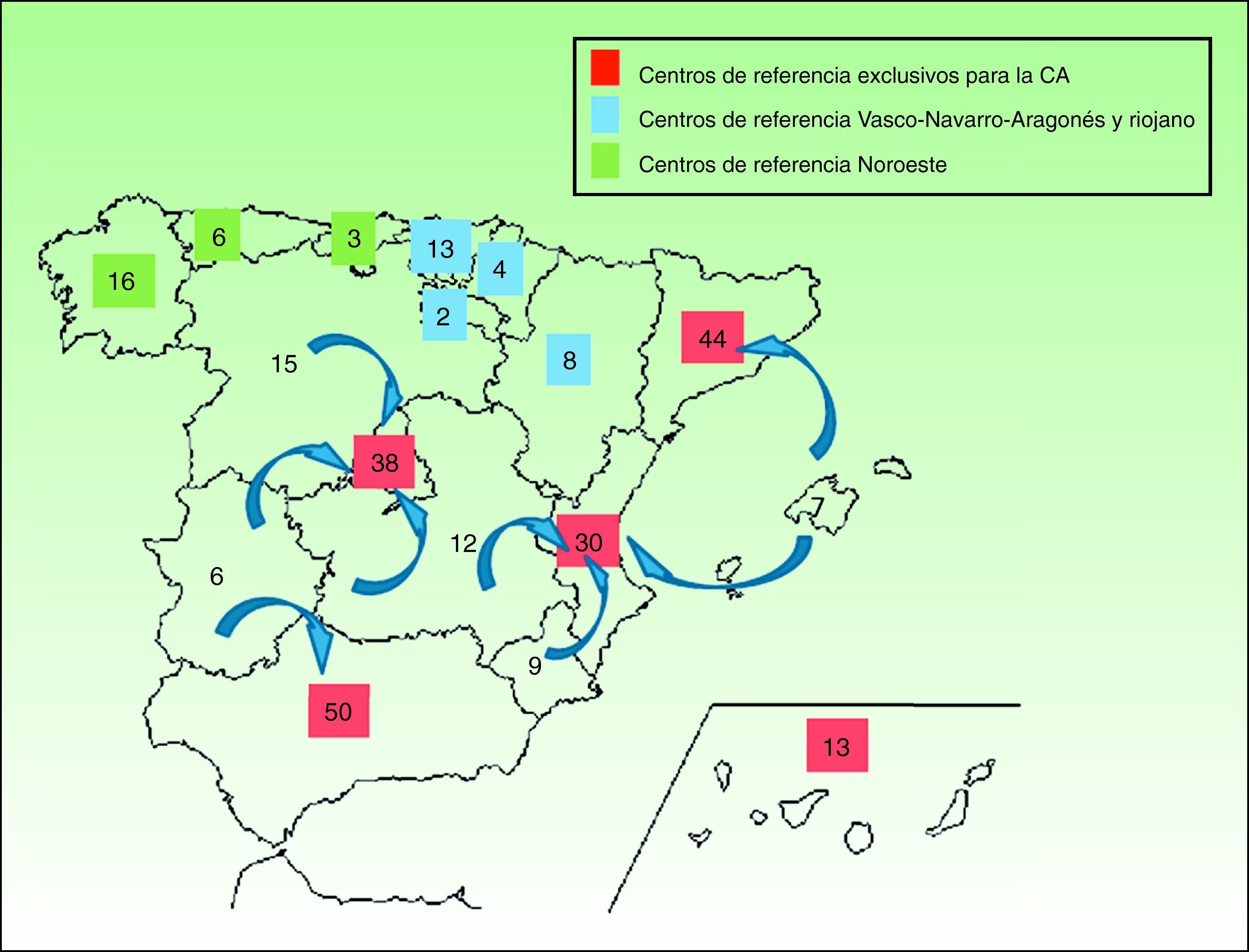
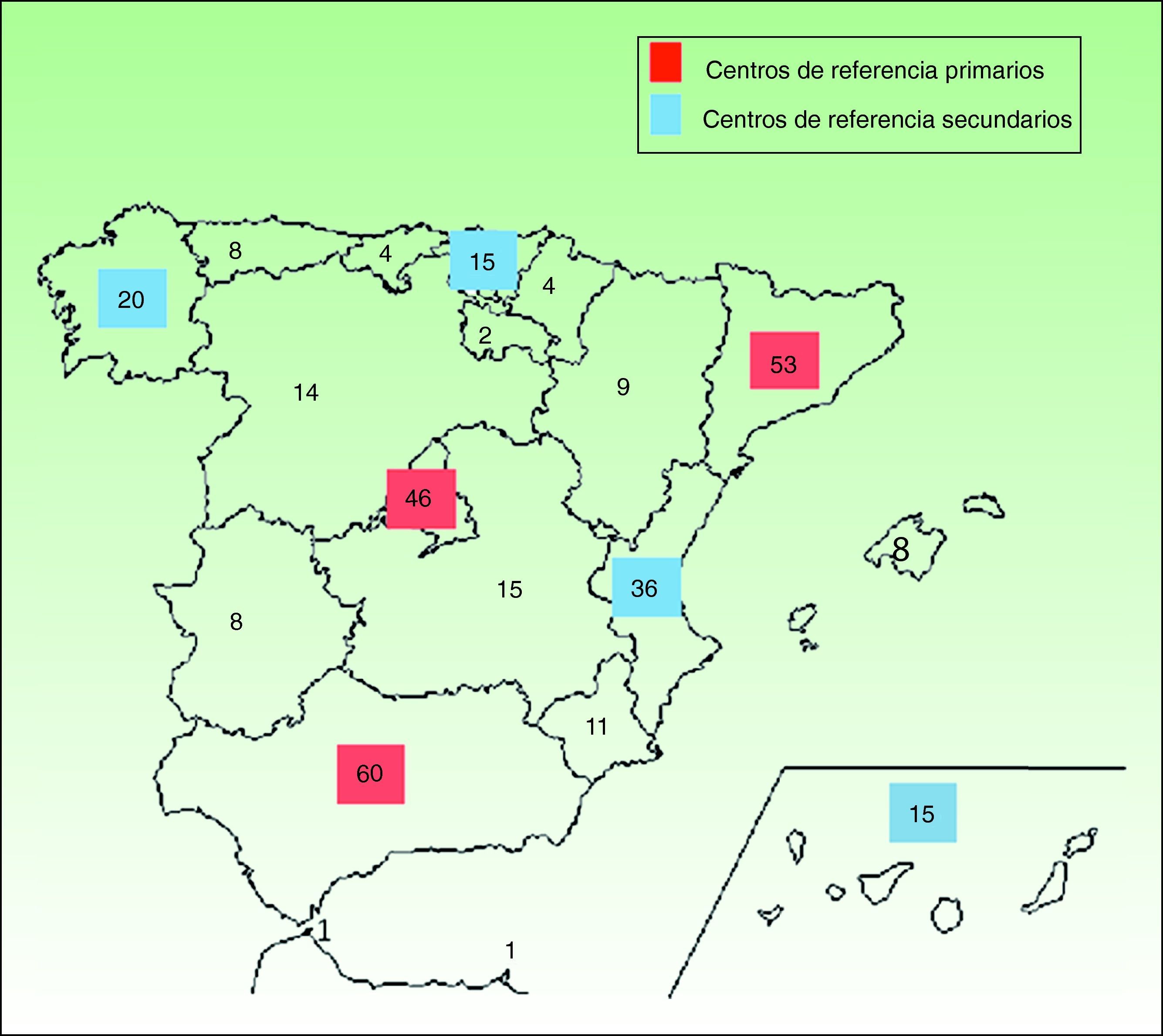
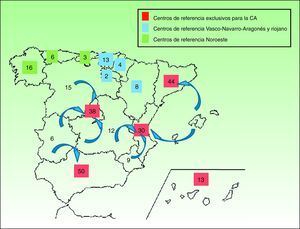
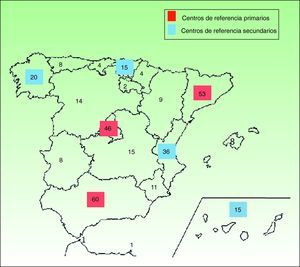
En las enfermedades de prevalencia tan baja como la EBD y las ICAR es esencial contar con unidades de referencia donde profesionales expertos se encarguen de confirmar el diagnóstico de laboratorio, informar sobre el pronóstico, ofrecer consejo genético y, de modo general, manejar las complicaciones en colaboración con equipos multidisciplinares. A la inversa, para que los centros de referencia adquieran esa experiencia, deben recibir un número suficiente de pacientes, ya que de poco sirve crear infinidad de centros de referencia donde, en la práctica, apenas se vean enfermos. Además, estas unidades de referencia deben ser accesibles y ubicarse a una distancia prudencial del domicilio del enfermo, para que el acceso a la asistencia no ocasione un excesivo trastorno personal, laboral y/o económico. Según nuestros cálculos sería razonable disponer de centros de referencia nacionales de EBD e ICAR en comunidades autónomas como Andalucía, Madrid y Cataluña, y se podrían agrupar allí los afectados de áreas limítrofes sin un volumen autonómico mínimo de pacientes. En algunas áreas geográficas como la zona noroeste de España, donde las comunidades de Galicia, Cantabria y Asturias suman una prevalencia estimada global similar a la de cada una de las comunidades autónomas más pobladas por separado, podría crearse un centro de referencia común para la zona. En las figuras 1 y 2 se proponen varios ejemplos de una posible organización de centros de referencia para EBD e ICAR respectivamente. La fragmentación del sistema sanitario español debería, en estos casos, soslayar intereses políticos y entender la necesidad de unificación de la atención sanitaria en beneficio del paciente.
Ejemplo de una posible distribución de centros de referencia de EBD. En las comunidades de mayor tamaño podría haber un centro por comunidad autónoma (en rojo). Las de menor tamaño podrían agruparse para crear un centro de referencia común (en azul y verde respectivamente). En determinados casos los pacientes podrían acudir a centros de referencia de autonomías limítrofes con buena comunicación o históricamente relacionadas en el ámbito sanitario.
Ejemplo de una posible distribución de centros de referencia de ICAR en función de la prevalencia por CC. AA. Los centros de referencia más importantes o primarios, de ámbito nacional, se ubicarían en las CC. AA. más pobladas (cuadrado rojo) y centros de referencia secundarios (cuadrado azul) se localizarían en CC. AA. más pequeñas que atienden a una cantidad considerable de afectados. El resto de las CC. AA. podrían acudir a centros de referencia primarios o secundarios en función de la distancia geográfica o los condicionantes individuales.
¿Y cómo ha de ser un centro de referencia de EBD o ICAR? Además de la prevalencia estimada (volumen de pacientes esperado en cada comunidad autónoma) es importante que los centros de referencia dispongan de medios materiales y humanos capaces de resolver las potenciales complicaciones que tengan que afrontar los pacientes. Por ejemplo, aunque en la EBD puede verse afectado prácticamente cualquier órgano corporal y son necesarias casi todas las especialidades, hay algunas completamente imprescindibles, como por ejemplo la Estomatología, la Gastroenterología, la Oftalmología, o los especialistas en Nutrición y cirugía de la mano. En cuanto a las ICAR es esencial que el dermatólogo responsable sea experto en este grupo de enfermedades, conozca los cuidados dermatológicos que requieren los pacientes y coordine eficientemente la atención de otros órganos comúnmente afectados como los ojos y los oídos. En uno y otro caso los especialistas involucrados deben procurarse la mejor formación sobre la enfermedad, ya que no se trata de procesos patológicos parecidos a ningún otro. Es evidente que la experiencia termina, a la larga, siendo formativa, pero puesto que el número de pacientes es pequeño una forma alternativa de adquirir formación sería concertando estancias en centros con experiencia acreditada, acudiendo a jornadas específicas de formación o, simplemente, consultando las opciones terapéuticas con otros médicos ya expertos. En este sentido hay que destacar que DEBRA España facilita (y financia) la formación a todos los profesionales interesados, tanto en España como en el extranjero, y que para la Asociación Española de Ictiosis (ASIC) también es uno de los objetivos de su recientemente abierto Fondo de Investigación. Los propios afectados reclaman este conocimiento por parte del médico que les atiende, ya que muchas veces ellos conocen mejor su enfermedad que su especialista.
Otro aspecto fundamental de las unidades de referencia es la comunicación entre profesionales, ya que es imprescindible el abordaje multidisciplinar, el establecimiento de una red protocolizada de trabajo y la continuidad asistencial. Especialmente importante es la colaboración con los centros de diagnóstico de laboratorio. En España disponemos al menos de 2 centros para EB, uno localizado en Madrid (CIEMAT) y otro en Barcelona (Hospital Clínic), y al menos 2 para el diagnóstico molecular de los distintos tipos de ICAR, en el Departamento de Biología Molecular de la Universidad de Salamanca (que también facilita diagnóstico genético del resto de los tipos de ictiosis) y la Fundación de Medicina Xenómica de la Universidad de Santiago de Compostela. La necesidad de esta colaboración es imprescindible en el caso de la EB, donde el aspecto clínico del recién nacido no permite determinar el tipo de EB que padece; una buena coordinación entre el dermatólogo y el laboratorio permitiría definir el tipo de EB en menos de una semana y avanzar el pronóstico a los padres certera e inmediatamente.No se trata de poner nombre a una enfermedad, sino de avanzar el pronóstico y predecir las complicaciones. Por otra parte, los centros de referencia deben articular el paso de la atención pediátrica a la asistencia en la edad adulta. En los hospitales generales podría ser más fácil, porque la comunicación es a priori más viable, pero tampoco es imposible en los hospitales exclusivamente pediátricos, y de hecho hay algunas enfermedades como la fibrosis quística que tienen bien organizada la continuidad asistencial. Del mismo modo, hay que intentar que la comunicación con los hospitales periféricos sea fluida, y que los pacientes puedan acceder sin problemas a los centros de referencia. Incluso sería deseable que los especialistas expertos en EBD o ICAR impartieran formación básica a los profesionales que solo ven esporádicamente a pacientes con estas enfermedades, para que estos conocieran los protocolos de actuación y los utilizaran en consecuencia.
No podemos olvidar que el objetivo último de los centros de referencia es procurar el mejor cuidado a los pacientes desde su nacimiento. No se trata de prestigio profesional ni de etiquetar la enfermedad, sino de informar a los padres sobre el pronóstico, anticipar y tratar las complicaciones, facilitar el eventual acceso al consejo genético y apoyar al afectado y a su familia de manera continuada en el tiempo. Y para conseguirlo, sería necesario establecer centros de referencia para EB e ictiosis ya.
Al Dr. Ignacio García Doval por su colaboración en la definición de la prevalencia de EBD e ICAR por comunidad autónoma.