El tumor benigno cutáneo plexiforme híbrido de perineuroma y neurotecoma celular (TBCPHPNC) es una entidad descrita recientemente (2013) por Requena et al.1. Clínicamente se suele presentar como una pápula solitaria pequeña en la región peribucal1, aunque otros autores han descrito un caso de localización nasal2 y otro en el tobillo izquierdo3. Histológicamente tiene hallazgos anatomopatológicos mixtos, de perineuroma y de neurotecoma celular, adoptando un patrón arquitectural plexiforme1,3. Desde el punto de vista inmunohistoquímico, los casos estudiados han mostrado inmunorreactividad para: S100A6, MiTF, NKI/C3, PGP9.5, EMA y enolasa. CD34, claudina-1 y GLUT1 se expresan de forma más variable, débil y focal. Además de los 9 pacientes del estudio original, se han publicado 2 casos adicionales. Presentamos un nuevo caso de esta recientemente reconocida lesión, que exhibe positividad para CD68 y CD163 en abundantes células, situadas entre los plexos de células neoplásicas, hallazgo que solo ha sido descrito a modo de pocos histiocitos estromales, en 2 de los casos de la serie original1.
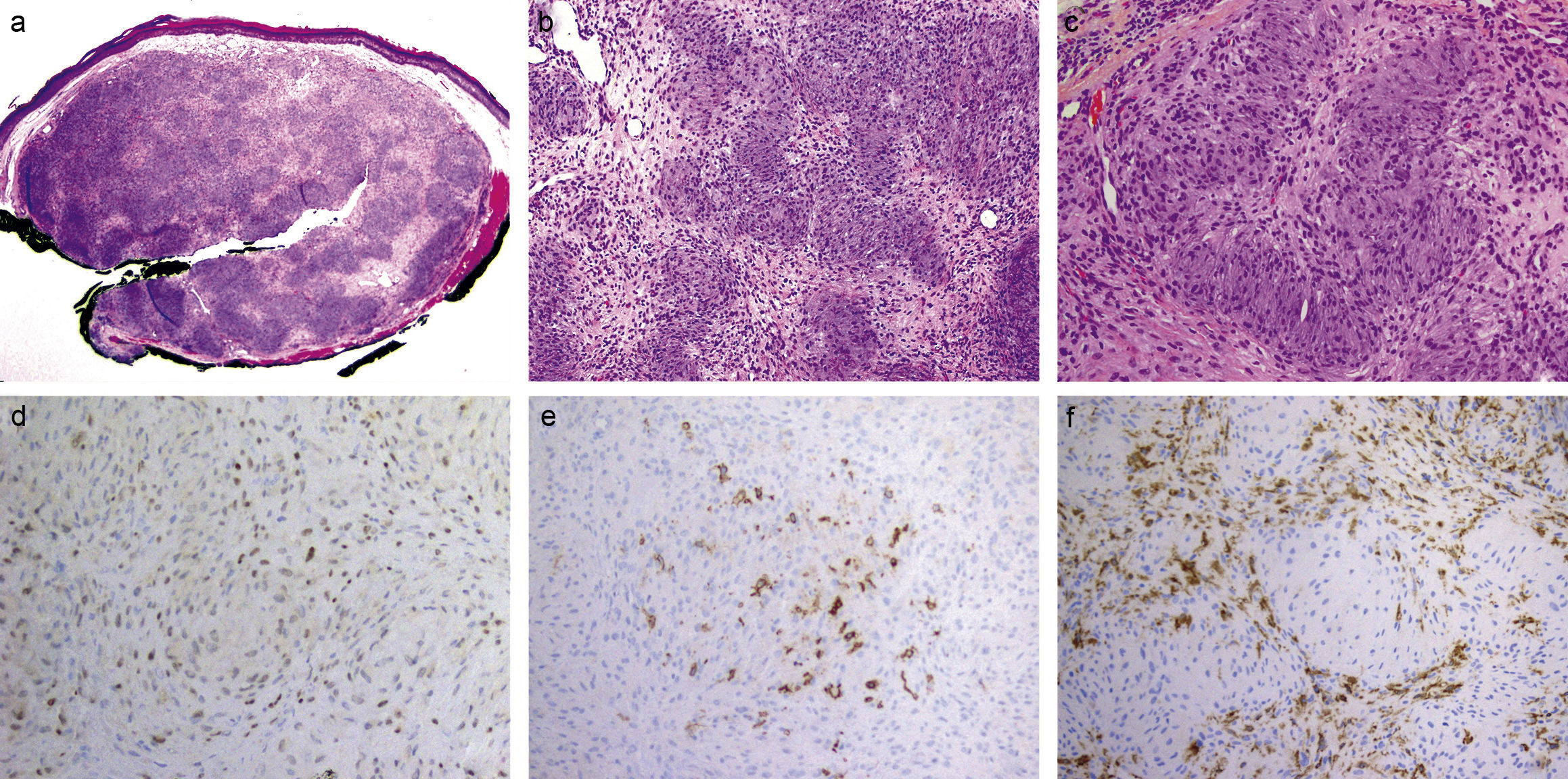
Un varón de 58 años presenta desde hace 2 años una lesión de crecimiento lento, redondeada, sobreelevada, bien definida, eritematosa, de consistencia dura y superficie brillante, en la región peri-labial inferior, que mide 5mm, sin otros síntomas. Se realiza curetaje. Histológicamente se observa un nódulo en dermis superficial, circunscrito, no encapsulado, sin contacto con la epidermis (fig. 1a), con patrón arquitectural plexiforme (fig. 1b). Algunas células son de aspecto epitelioide con citoplasma eosinofílico amplio, límites celulares imprecisos, núcleos vesiculosos y nucléolos inconspicuos. Otras son fusiformes, delicadas, con núcleos hipercromáticos. No se observa pleomorfismo, mitosis, ni necrosis. El estroma es mixoide con áreas de aspecto colágeno (fig. 1c). La epidermis exhibe leve hiperpigmentación de la capa basal, hiperqueratosis y disqueratosis pagetoide.
a) Nódulo circunscrito, no encapsulado, en dermis superficial, sin contacto con la epidermis (H&E ×2); b) Patrón arquitectural plexiforme. Las células neoplásicas se disponen formando nidos redondeados e irregulares sobre un estroma predominantemente mixoide. Dichos nidos están desprovistos de estructuras neurales o vasculares en su porción central (H&E ×10); c) La mayoría de las células neoplásicas tienen núcleos ovoides con nucléolos inconspicuos y citoplasma eosinofílico con bordes mal definidos. Estas células están íntimamente entremezcladas con otras fusiformes de núcleos delicados, elongados e hipercromáticos; d) MiTF positivo de forma difusa en los núcleos de las células neoplásicas (×10); e) Claudina-1 positivo focalmente en las células neoplásicas (×10); f) CD163 positivo en numerosas células intersticiales entre los «plexos» (×10).
Con inmunohistoquímica se observó positividad difusa para vimentina y MiTF (fig. 1d) y, positividad focal para claudina-1 (fig. 1e). Las células tumorales resultaron negativas para S100, Melan-A, enolasa, EMA, GLUT1, actina y CD34. Se observaron, además, numerosas células entre los plexos CD68 y CD163 positivas (fig. 1f). Se realizó el diagnóstico de TBCPHPNC.
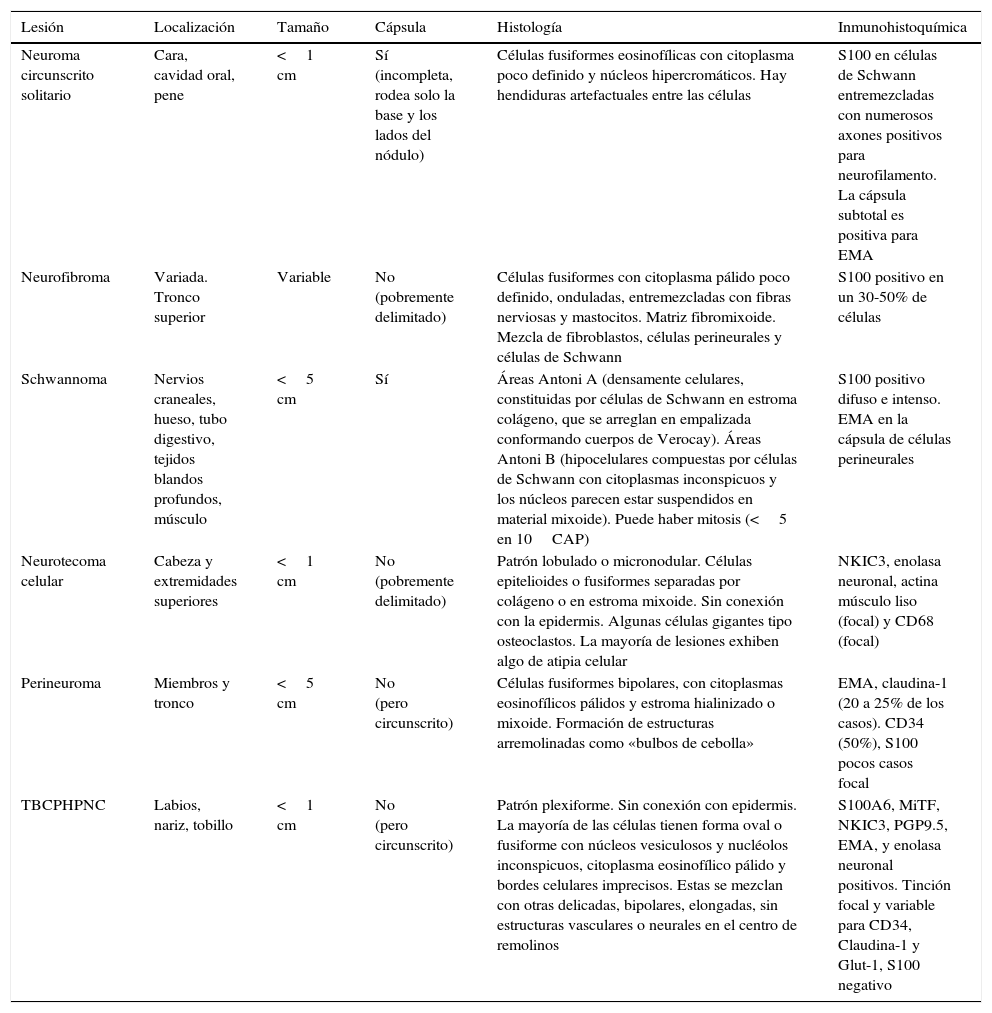
El perineuroma es un tumor compuesto por células perineurales que se disponen en un patrón «arremolinado», sobre un estroma colágeno hialinizado o mixoide. Mientras que es característica la inmunoexpresión de EMA, son frecuentemente positivos claudina-1, GLUT1 y CD34, y casi siempre es negativa la proteína S1003. Por otra parte, el neurotecoma celular es un tumor de histogénesis incierta, con patrón arquitectural lobulado, compuesto por células epitelioides y/o fusiformes sobre un estroma predominantemente mixoide. Suele ser positivo para vimentina, NKI-C3, enolasa, MiTF1, PGP9.5 y, de forma variable, para actina y CD684,5 (tabla 1). En el año 2013, Requena et al. describieron el TBCPHPNC, el cual presenta hallazgos mixtos entre perineuroma y neurotecoma celular, con patrón arquitectural plexiforme. La serie original consta de 9 casos localizados en la región peribucal1, al igual que nuestro caso. Sin embargo, Yamada et al. describieron posteriormente un caso localizado en la nariz2, y Linos et al. describieron otro en el tobillo izquierdo3. Todos los pacientes documentados, hasta el momento, son adultos entre los 30 y 76 años, con relación F/M de 1:1. Clínicamente consisten en una pápula o nódulo solitario revestido por piel aparentemente normal1–3 y, presentan también hallazgos histopatológicos similares, a excepción del caso presentado por Linos et al., que carecía de arquitectura plexiforme3.
Resumen de los principales diagnósticos diferenciales
| Lesión | Localización | Tamaño | Cápsula | Histología | Inmunohistoquímica |
|---|---|---|---|---|---|
| Neuroma circunscrito solitario | Cara, cavidad oral, pene | <1 cm | Sí (incompleta, rodea solo la base y los lados del nódulo) | Células fusiformes eosinofílicas con citoplasma poco definido y núcleos hipercromáticos. Hay hendiduras artefactuales entre las células | S100 en células de Schwann entremezcladas con numerosos axones positivos para neurofilamento. La cápsula subtotal es positiva para EMA |
| Neurofibroma | Variada. Tronco superior | Variable | No (pobremente delimitado) | Células fusiformes con citoplasma pálido poco definido, onduladas, entremezcladas con fibras nerviosas y mastocitos. Matriz fibromixoide. Mezcla de fibroblastos, células perineurales y células de Schwann | S100 positivo en un 30-50% de células |
| Schwannoma | Nervios craneales, hueso, tubo digestivo, tejidos blandos profundos, músculo | <5 cm | Sí | Áreas Antoni A (densamente celulares, constituidas por células de Schwann en estroma colágeno, que se arreglan en empalizada conformando cuerpos de Verocay). Áreas Antoni B (hipocelulares compuestas por células de Schwann con citoplasmas inconspicuos y los núcleos parecen estar suspendidos en material mixoide). Puede haber mitosis (<5 en 10CAP) | S100 positivo difuso e intenso. EMA en la cápsula de células perineurales |
| Neurotecoma celular | Cabeza y extremidades superiores | <1 cm | No (pobremente delimitado) | Patrón lobulado o micronodular. Células epitelioides o fusiformes separadas por colágeno o en estroma mixoide. Sin conexión con la epidermis. Algunas células gigantes tipo osteoclastos. La mayoría de lesiones exhiben algo de atipia celular | NKIC3, enolasa neuronal, actina músculo liso (focal) y CD68 (focal) |
| Perineuroma | Miembros y tronco | <5 cm | No (pero circunscrito) | Células fusiformes bipolares, con citoplasmas eosinofílicos pálidos y estroma hialinizado o mixoide. Formación de estructuras arremolinadas como «bulbos de cebolla» | EMA, claudina-1 (20 a 25% de los casos). CD34 (50%), S100 pocos casos focal |
| TBCPHPNC | Labios, nariz, tobillo | <1 cm | No (pero circunscrito) | Patrón plexiforme. Sin conexión con epidermis. La mayoría de las células tienen forma oval o fusiforme con núcleos vesiculosos y nucléolos inconspicuos, citoplasma eosinofílico pálido y bordes celulares imprecisos. Estas se mezclan con otras delicadas, bipolares, elongadas, sin estructuras vasculares o neurales en el centro de remolinos | S100A6, MiTF, NKIC3, PGP9.5, EMA, y enolasa neuronal positivos. Tinción focal y variable para CD34, Claudina-1 y Glut-1, S100 negativo |
EMA: antígeno de membrana epitelial; Glut-1: transportador de glucosa 1; MiTF: factor de transcripción microftalmia; NKIC3: glicoproteína 3 asociada a membrana lisosomal; S100: proteína S100; TBCPHPNC: tumor benigno cutáneo plexiforme híbrido de perineuroma y neurotecoma celular.
Nuestro caso comparte todas las características morfológicas típicas y mostró positividad difusa para MiTF1 (propio del neurotecoma) y focal para claudina-1 (que suele observarse en el perineuroma). Sin embargo, otros marcadores de uso frecuente para el diagnóstico de esas neoplasias, tales como enolasa, S100, EMA, GLUT1, actina y CD34, resultaron negativos. CD68 y CD163 destacaron numerosas células distribuidas entre los «plexos» del tumor. Este hallazgo fue descrito en 2 de los casos del trabajo de Requena et al., pero solamente en forma de pocos histiocitos en el estroma1. En todos los casos de TBCPHPNC publicados hasta el momento (incluyendo el nuestro), la proteína S100, los marcadores melánicos (HMB45, Melan-A, SOX10) y los marcadores de músculo liso (actina, desmina) han resultado negativos. MiTF1, S100A6 y PGP9.5 han sido intensamente positivos, pero solo se han realizado en algunos de los casos. Sin embargo, con NKI/C3, EMA, enolasa, CD34, claudina-1, GLUT1 y CD68 se ha observado mayor variabilidad en el inmunoperfil del TBCPHPNC.
En conclusión, el TBCPHPNC es un tumor de reciente descripción que tiene preferencia por la región peribucal, y cuyos hallazgos anatomopatológicos son híbridos entre perineuroma y neurotecoma celular. La inmunohistoquímica es variable, destacándose la positividad para S100A6, MiTF, NKI/C3, PGP9.5, EMA y enolasa. En nuestro caso, destacamos la presencia de abundantes células entre los «plexos» que expresan CD68 y CD163. Este rasgo peculiar se ha descrito previamente en 2 pacientes, pero en menor cuantía1. Dada la heterogeneidad inmunohistoquímica y, en general, la baja expresión de marcadores típicos neurales que exhibe esta neoplasia, consideramos la clínica y la morfología como elementos claves para el diagnóstico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores manifestamos nuestro agradecimiento al Servicio de Dermatología y al personal técnico del Servicio de Anatomía Patológica del Complejo Hospitalario de Navarra.