El tratamiento estándar del lentigo maligno (LM) es la escisión quirúrgica con márgenes de 0,5 cm. Sin embargo, dada la mala delimitación de muchos tumores, es frecuente que esta exéresis sea incompleta.
Objetivoidentificar parámetros clínicos que puedan predecir qué LM localizados en la cabeza, extirpados de forma primaria o tras recidivar, se extienden más allá de los límites visibles y por tanto, puedan requerir márgenes quirúrgicos más amplios.
Material y métodosse revisó retrospectivamente la información clínica de los pacientes con LM localizado en la cabeza cuyo tratamiento quirúrgico definitivo, mediante cirugía convencional o cirugía de Mohs diferida, fue realizado en el Servicio de Dermatología del Instituto Valenciano de Oncología (IVO) entre enero de 1993 y abril de 2011.
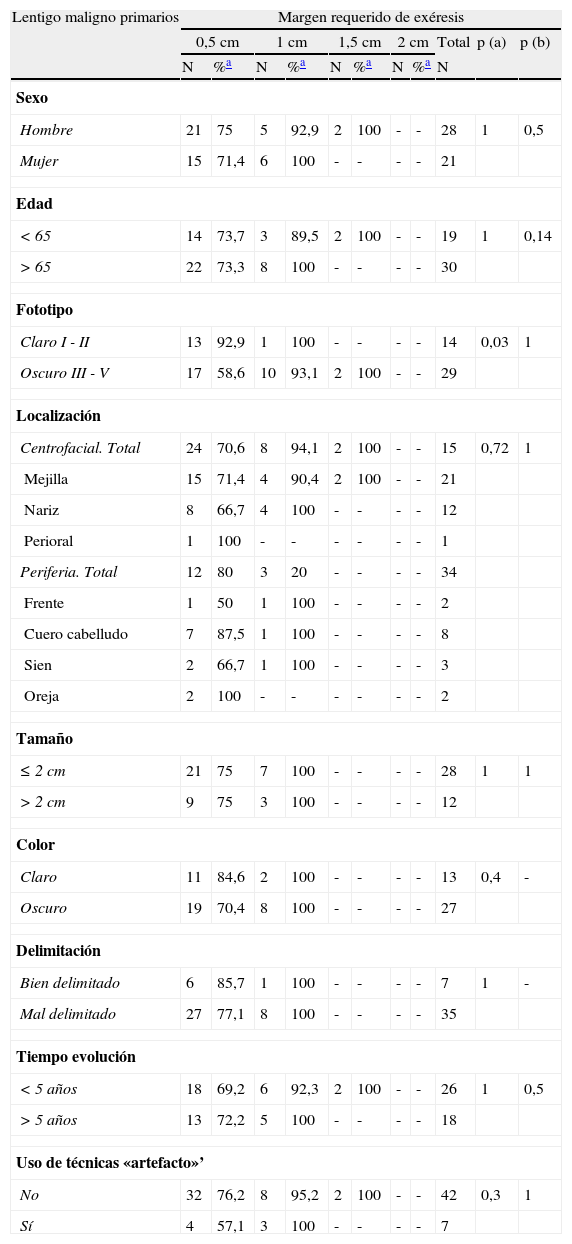
Resultadosun 69,2% de los LM recidivados y un 26,5% de los tumores primarios requirieron márgenes de más de 0,5 cm. La administración previa de tratamientos que puedan interferir en la delimitación clínica, la localización centrofacial y las lesiones que se presentan en pacientes con fototipos altos (III-V) fueron los factores asociados a la necesidad de márgenes quirúrgicos más amplios.
Conclusionesla utilización de márgenes de 0,5 cm para el tratamiento del LM es insuficiente para un número importante de casos localizados en la cabeza, especialmente los recidivados. La cirugía de Mohs diferida, con el estudio de todos los márgenes en parafina, parece el tratamiento de elección en particular para los casos recidivados o en los que la delimitación clínica pueda verse dificultada.
Surgical excision with margins of 0.5cm is the standard treatment for lentigo maligna (LM). Excision, however, is often incomplete as many of these tumors have indistinct borders.
ObjectiveTo identify clinical predictors of subclinical extension in primary and recurrent LM of the head and thereby determine which lesions might require wider surgical margins.
Material and methodsWe reviewed the clinical records of patients with LM of the head treated definitively with conventional surgical excision or slow micrographic Mohs surgery (MMS) at the dermatology department of Instituto Valenciano de Oncología between January 1993 and April 2011.
ResultsSurgical margins larger than 0.5cm were required in 69.2% of recurrent LM and 26.5% of primary LM. Factors associated with the need for wider margins were prior treatment that might have interfered with the clinical delineation of the border, lesions in the center of the face, and skin phototypes III to V.
ConclusionsSurgical margins of 0.5cm are inadequate for the treatment of a considerable number of LM lesions located on the head, particularly if these are recurrent. Slow MMS using paraffin-embedded sections appears to be the treatment of choice in such cases, particularly for recurrent lesions or lesions with poorly defined borders or possible subclinical extension.
El lentigo maligno (LM) es un subtipo de melanoma in situ que aparece en personas de edad avanzada, en zonas fotoexpuestas y con daño actínico crónico1. El tratamiento estándar es la escisión quirúrgica con márgenes de 0,5cm. Sin embargo, dada la mala delimitación de muchos tumores es frecuente que esta exéresis sea incompleta2–5. Entre un 6 y el 20% de las lesiones recidivan, lo que se atribuye a una extensión de células tumorales más a allá de los límites clínicos de la pieza de exéresis, y a que el procesamiento convencional para un estudio histológico solo evalúa un 5% de los márgenes6–8. La extensión subclínica parece estar relacionada con el tamaño del tumor, por lo que se ha sugerido que el margen requerido para garantizar una extirpación completa debería ser mayor cuanto mayor sea el diámetro del tumor9. De hecho, las últimas recomendaciones de la National Comprehensive Cancer Network apuntan que para los LM de gran tamaño podrían ser necesarios márgenes superiores a 0,5cm para obtener una extirpación completa, y que sería recomendable el uso de técnicas que garanticen el control de todos los márgenes de la pieza quirúrgica.
Existen diversas técnicas quirúrgicas —cirugía de Mohs y sus variantes— que permiten el análisis del 100% de márgenes de la pieza de exéresis, y además contribuyen a minimizar la eliminación innecesaria de tejidos sanos circundantes6,10. Diversos estudios retrospectivos han puesto de manifiesto que con estas técnicas las recurrencias del LM se reducen al 0,5-3%9,11–15. Dada la dificultad que conlleva la identificación de los melanocitos en las secciones congeladas, incluso con la ayuda de tinciones inmunohistoquímicas, la mayoría de autores prefieren las variantes de Mohs en las que el estudio histológico se realiza de forma diferida a partir del tejido procesado en parafina6,16–19. En nuestra experiencia, desde la introducción de la cirugía de Mohs para el tratamiento del LM también hemos observado un menor número de recaídas. En la mayoría de casos el tumor puede ser extirpado en un solo estadio, pero nos llama la atención que en algunos pacientes son necesarios más de dos estadios. El tamaño del LM y/o sus características clínicas podrían condicionar la medida de los márgenes adecuados para su exéresis curativa. Pensamos que puede haber alguna correlación entre ciertos parámetros clínicos del LM y su posible extensión subclínica, de modo que su identificación nos permitiría escoger a priori el tratamiento más apropiado: la exéresis quirúrgica convencional con unos márgenes preestablecidos o la cirugía de Mohs diferida.
El objetivo principal del presente estudio es identificar parámetros clínicos que puedan predecir qué LM localizados en la cabeza, extirpados de forma primaria o tras la recidiva, se extienden más allá de los límites visibles y, por tanto, puedan requerir unos márgenes quirúrgicos más amplios. El segundo objetivo es definir cuál debería ser el margen quirúrgico para obtener la curación del tumor en función de dichas variables clínicas.
MetodologíaSe seleccionaron los pacientes con LM localizado en la cabeza, cuyo tratamiento quirúrgico definitivo, mediante cirugía convencional o cirugía de Mohs diferida, fue realizado en el Servicio de Dermatología del Instituto Valenciano de Oncología (IVO) entre enero de 1993 y abril de 2011, e incluidos en la base de datos de melanoma del centro20. Se revisó retrospectivamente toda la información y la iconografía incluida en las historias clínicas acerca de las características del paciente y de la lesión.
La cirugía convencional consistió en la exéresis con 0,5cm de margen más allá de la lesión clínicamente visible y su procesamiento histológico convencional. En nuestro centro la cirugía convencional de los tumores incluye un fileteado de los márgenes quirúrgicos, con evaluación por separado de los márgenes laterales y los márgenes profundos. Con cirugía de Mohs diferida se estudió la pieza quirúrgica incluida en parafina tras su procesamiento y corte, según las pautas del Mohs convencional, es decir, con el análisis del 100% de sus márgenes, el mapeado de la pieza extirpada ayudado por imágenes impresas aportadas al patólogo y la ayuda de tinciones inmunohistoquímicas (Melan-A y HMB-45) en los casos que la pudieran requerir. Los márgenes de cada estadio de Mohs también son de 0,5cm aproximadamente, aunque a partir de la segunda etapa solo incluye la zona en la que había afectación del margen lateral en la etapa anterior y parte de las áreas adyacentes.
En primer lugar se incluyeron LM primarios confirmados histológicamente mediante biopsia incisional o excisional. Entendemos como tumores primarios aquellos que no habían recibido tratamiento curativo previo. Se consideran tratamientos curativos la cirugía convencional con márgenes de 0,5cm libres de tumor (o seguida de ampliación en los casos con márgenes afectos), la cirugía de Mohs o el imiquimod tópico seguido de la desaparición clínica de la lesión. Dentro de los tratamientos considerados no curativos se incluyeron aquellos procedimientos realizados antes del diagnóstico histológico y/o de la sospecha clínica de malignidad, por lo tanto realizados con un diagnóstico de lesión benigna y que no seguían la aplicación recomendada en caso de que se hubieran aplicado con el diagnóstico de LM. Aquí se incluyen las exéresis por afeitado, la cirugía convencional con menos de 0,5cm de margen y otros procedimientos realizados con intención terapéutica básicamente estética, implicando que la lesión pigmentada había sido considerada clínicamente benigna. La crioterapia, la electrocoagulación, diferentes tipos de láser y las cremas despigmentantes forman parte de este grupo de técnicas, que a partir de ahora denominamos «artefactuales».
Por otro lado, se incluyeron los LM que fueron operados en nuestro servicio tras presentar una recaída tumoral, es decir, que habían reaparecido después de un tratamiento considerado curativo (en nuestro centro o en otros centros).
Teniendo en cuenta que el margen de exéresis recomendado en la cirugía convencional del LM es de 0,5cm, y que en nuestro centro se analiza histológicamente el 100% de los márgenes quirúrgicos, y asumiendo que en cada estadio de cirugía de Mohs diferida extraemos el mismo tamaño de piel, se consideró que ambos procedimientos pueden englobarse bajo el concepto de etapa quirúrgica, con carácter aditivo para aquellos casos en que se requirió más de una intervención para obtener márgenes libres. Así, se estableció que la variable respuesta principal a analizar en cada lesión fue el número de etapas quirúrgicas de 0,5cm requeridas para obtener márgenes libres de tumor; esta variable fue dicotomizada en una o más de una etapa. La exéresis convencional con menos de 0,5cm y las exéresis por afeitado no se consideran tratamientos curativos, por lo tanto no se contabilizaron como etapas quirúrgicas.
Como factores demográficos se incluyeron la edad del paciente en el momento de la cirugía definitiva, el sexo y el fototipo de piel. Con respecto al tumor se anotó el tiempo de evolución desde la percepción del paciente hasta su diagnóstico, la localización, su tamaño aproximado en centímetros, su color predominante y la delimitación de los márgenes, pudiendo estar bien o mal delimitados. Por su carácter subjetivo la variable color de los LM fue categorizada como de predominio claro (marrón claro y eritematoso) u oscuro (marrón oscuro o negro). Se detallaron los tratamientos previos realizados en el grupo de LM que habían presentado recaída tumoral y, por último, se recogió la información referente a las técnicas artefactuales utilizadas en cada caso.
Se excluyeron los pacientes que presentaban focos de melanoma invasor en alguna de las biopsias o exéresis.
A efectos del estudio todas las variables cuantitativas fueron categorizadas y solo se incluyeron aquellos tumores con información disponible en cada apartado. Se realizó un análisis descriptivo de las variables demográficas y los parámetros clínicos de las lesiones, y se evaluaron las diferencias en la distribución de cada variable en función del número de etapas quirúrgicas requeridas. Se empleó la prueba de la Ji cuadrado de Pearson, excepto en aquellas situaciones en que la frecuencia mínima esperada era menor a 5, en cuyo caso se empleó el estadístico exacto de Fisher. Se estableció la significación estadística en 0,05.
ResultadosSe incluyeron 62 LM (49 primarios y 13 recaídas) que correspondían a 57 pacientes (30 varones y 27 mujeres). Un varón tuvo 2 LM en diferentes localizaciones y 4 pacientes fueron tratados en el IVO por la lesión primaria y posteriormente por la recaída tumoral. La edad mediana de los pacientes fue de 67,5 años (intervalo intercuartílico de 60-76 años). Se observó que 20/55 (36,4%) pacientes tenían un fototipo claro (Fitzpatrick I-II) y 35/55 oscuro (Fitzpatrick III-V).
Casi la mitad (48,4%) de LM estaban en la mejilla y, por orden de frecuencia decreciente, los demás tumores se localizaban en la nariz (22,6%), el cuero cabelludo (14,5%), la frente y la sien (4,8% cada una), el pabellón auricular (3,2%) y la zona perioral (1,6%).
El tiempo de evolución de las lesiones oscilaba entre unos pocos meses y años, y fue superior a 10 años en 11 de los casos. La mayoría (59,6%) fueron observados por los pacientes por primera vez en los 5 años anteriores. Con respecto a las recaídas el tiempo transcurrido desde el tratamiento curativo previo hasta el tratamiento practicado en nuestro centro oscilaba entre unos pocos meses y 6 años.
En relación con el tamaño de la lesión en 38 de 54 pacientes (70,4%) los tumores medían 2cm o menos, justo antes de recibir el tratamiento curativo y en 16 de 54 (29,6%) las lesiones eran mayores de 2cm.
Treinta (30/48; 62,5%) lesiones se catalogaron como oscuras, 18 de 48 (37,5%) claras y en 14 casos faltaba esta información.
La gran mayoría de las lesiones (47/54; 87%) estaban clínicamente mal delimitadas y tenían márgenes irregulares, y solo 7 (13%) —todos ellos LM primarios— fueron calificadas como bien definidas.
En 14 de 62 (22,6%) tumores se habían utilizado una o más de las «técnicas artefactuales» durante la evolución de la lesión, empleadas siempre bajo el diagnóstico clínico de lesión benigna.
Con respecto al tratamiento realizado en nuestro Servicio, aproximadamente una cuarta parte (13/49; 26,5%) de LM primarios, y casi un tercio (4/13; 30,7%) de las recaídas fueron tratados mediante cirugía convencional con márgenes de 0,5cm en una o más etapas, en función de la afectación de los márgenes quirúrgicos. De estos, solo 4 LM (3 recidivas y un primario) fueron intervenidos en 2 etapas de 0,5cm debido a la afectación de los márgenes quirúrgicos por el tumor. En 33 de 49 (67,3%) LM primarios y en 8 de 13 (61,5%) recidivas se utilizó una cirugía de Mohs diferida, que requirió de uno a 4 estadios para obtener márgenes libres: 29 lesiones se extirparon en una sola etapa, 10 en 2 etapas, una lesión en 3 etapas y otra en 4 etapas. Por último se empleó la cirugía de Mohs después de la exéresis convencional con márgenes afectos (en una o más etapas) en 3 de 49 LM primarios y en una de 13 recaídas. En los 3 casos fue suficiente una única etapa de cirugía de Mohs. Las exéresis convencionales de 0,5cm con márgenes afectos, realizadas a pacientes que provenían de otros centros, también contabilizaron como etapa quirúrgica. La delimitación de la lesión, su tamaño, su localización o algunas características del paciente fueron parámetros que determinaron la elección individualizada de una técnica u otra.
Nueve de los 13 LM que intervenimos tras la recaída tumoral habían sido tratados en otros centros, y 4 habían sido operados previamente en el IVO. Con respecto a los tratamientos curativos que se habían realizado 2 de 13 lesiones habían sido tratadas con imiquimod, obteniéndose la curación clínica, en 10 de 13 se había realizado una exéresis quirúrgica con márgenes informados como libres, y un LM recayó en 2 ocasiones, primero después del tratamiento con imiquimod y posteriormente a los 2 años de la exéresis quirúrgica. De los 11 tumores que habían sido tratados quirúrgicamente, en 9 se había hecho cirugía convencional y en los otros 2 cirugía de Mohs. Uno de estos últimos casos correspondía a un LM con una larga historia de tratamientos con láseres ablativos y varios ciclos de imiquimod. En 7 de 13 recaídas de LM se habían empleado «técnicas artefactuales» una o más veces durante su evolución. También se habían utilizado dichas técnicas en 3 de los 4 tumores que habían presentado recaída tumoral en más de una ocasión. Respecto a los 3 LM tratados con imiquimod, en todos ellos fueron necesarios varios ciclos de tratamiento para alcanzar la curación clínica, y cabe destacar que en los 3 casos también se habían empleado una o más «técnicas artefactuales» en algún momento de su evolución.
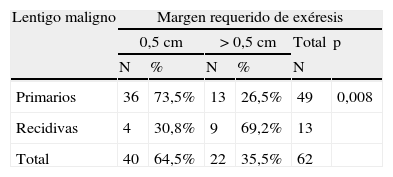
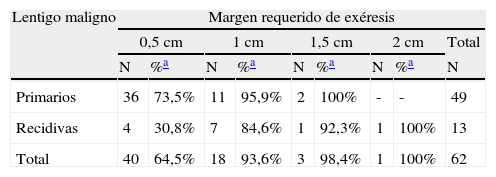
Al analizar las diferentes variables explicativas en función del margen quirúrgico requerido para su exéresis se obtuvieron los siguientes resultados: el número medio de etapas requeridas fue de 1,31 para los LM primarios y de 1,92 para los LM recidivados. Un 73,5% de los LM primarios fueron extirpados en una sola etapa quirúrgica de 0,5cm, porcentaje que se elevaba a un 95,5% de los casos si se incluían también aquellos que precisaron de 1cm de margen (2 etapas) para extirpar completamente la lesión (tablas 1 y 2). A diferencia de los LM primarios, solo el 30,8% de LM que presentaron recaída se extirparon completamente con márgenes de 0,5cm, el 84,6% al incluir los que necesitaron 1cm y el 92,3% si se incluían los extirpados con 1,5cm de margen (p<0,008) (tablas 1 y 2).
Margen quirúrgico requerido para extirpar completamente los lentigos malignos primarios y las recidivas, en una o más de una etapa de 0,5cm
| Lentigo maligno | Margen requerido de exéresis | |||||
| 0,5cm | >0,5cm | Total | p | |||
| N | % | N | % | N | ||
| Primarios | 36 | 73,5% | 13 | 26,5% | 49 | 0,008 |
| Recidivas | 4 | 30,8% | 9 | 69,2% | 13 | |
| Total | 40 | 64,5% | 22 | 35,5% | 62 | |
P: significación estadística cuando se compara el grupo que ha obtenido la curación con margen de 0,5cm vs. >0,5cm.
Margen quirúrgico total requerido para extirpar completamente los lentigos malignos primarios y las recidivas, mostrado en etapas de 0,5cm
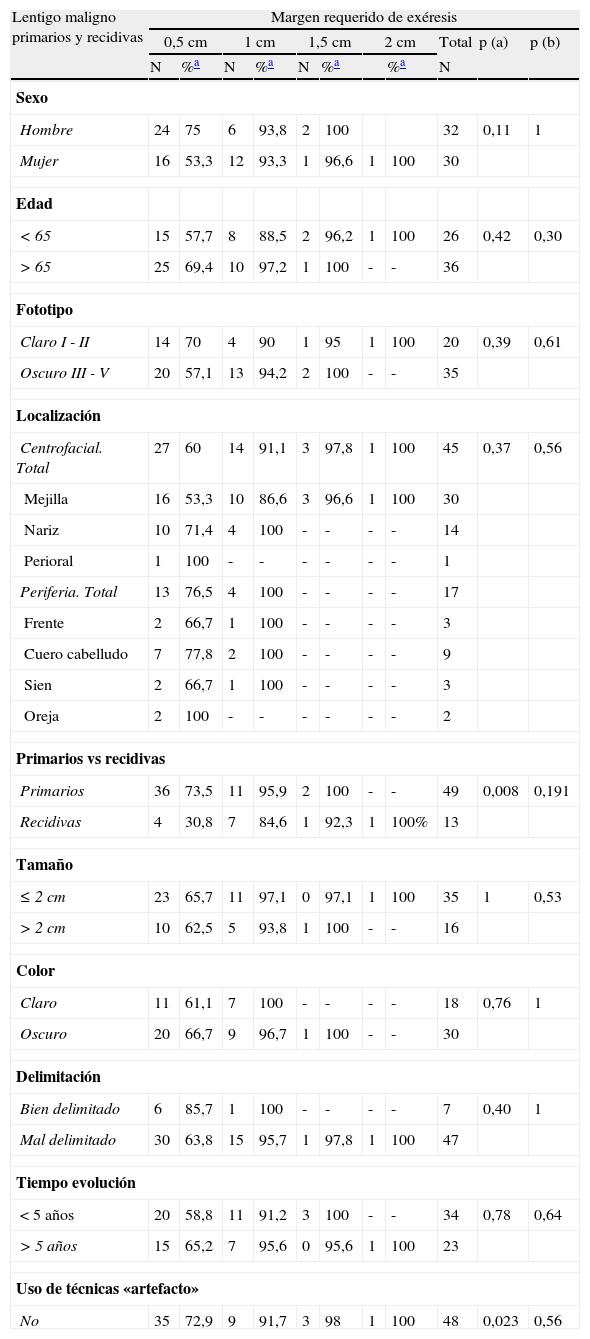
Aquellas lesiones que fueron tratadas con «técnicas artefactuales» previas al tratamiento definitivo requirieron en su mayoría 2 etapas quirúrgicas, y solo un 35,7% de los casos fueron extirpados adecuadamente con 0,5cm de margen, a diferencia de las que no recibieron dichos tratamientos (72,9% de curación con 0,5cm) (p=0,023) (tabla 3).
Margen quirúrgico total requerido en función de diferentes variables clínicas y demográficas en el grupo formado por lentigos malignos, tanto primarios como recidivados
| Lentigo maligno primarios y recidivas | Margen requerido de exéresis | ||||||||||
| 0,5cm | 1cm | 1,5cm | 2cm | Total | p (a) | p (b) | |||||
| N | %a | N | %a | N | %a | %a | N | ||||
| Sexo | |||||||||||
| Hombre | 24 | 75 | 6 | 93,8 | 2 | 100 | 32 | 0,11 | 1 | ||
| Mujer | 16 | 53,3 | 12 | 93,3 | 1 | 96,6 | 1 | 100 | 30 | ||
| Edad | |||||||||||
| <65 | 15 | 57,7 | 8 | 88,5 | 2 | 96,2 | 1 | 100 | 26 | 0,42 | 0,30 |
| >65 | 25 | 69,4 | 10 | 97,2 | 1 | 100 | - | - | 36 | ||
| Fototipo | |||||||||||
| Claro I - II | 14 | 70 | 4 | 90 | 1 | 95 | 1 | 100 | 20 | 0,39 | 0,61 |
| Oscuro III - V | 20 | 57,1 | 13 | 94,2 | 2 | 100 | - | - | 35 | ||
| Localización | |||||||||||
| Centrofacial. Total | 27 | 60 | 14 | 91,1 | 3 | 97,8 | 1 | 100 | 45 | 0,37 | 0,56 |
| Mejilla | 16 | 53,3 | 10 | 86,6 | 3 | 96,6 | 1 | 100 | 30 | ||
| Nariz | 10 | 71,4 | 4 | 100 | - | - | - | - | 14 | ||
| Perioral | 1 | 100 | - | - | - | - | - | - | 1 | ||
| Periferia. Total | 13 | 76,5 | 4 | 100 | - | - | - | - | 17 | ||
| Frente | 2 | 66,7 | 1 | 100 | - | - | - | - | 3 | ||
| Cuero cabelludo | 7 | 77,8 | 2 | 100 | - | - | - | - | 9 | ||
| Sien | 2 | 66,7 | 1 | 100 | - | - | - | - | 3 | ||
| Oreja | 2 | 100 | - | - | - | - | - | - | 2 | ||
| Primarios vs recidivas | |||||||||||
| Primarios | 36 | 73,5 | 11 | 95,9 | 2 | 100 | - | - | 49 | 0,008 | 0,191 |
| Recidivas | 4 | 30,8 | 7 | 84,6 | 1 | 92,3 | 1 | 100% | 13 | ||
| Tamaño | |||||||||||
| ≤ 2cm | 23 | 65,7 | 11 | 97,1 | 0 | 97,1 | 1 | 100 | 35 | 1 | 0,53 |
| >2cm | 10 | 62,5 | 5 | 93,8 | 1 | 100 | - | - | 16 | ||
| Color | |||||||||||
| Claro | 11 | 61,1 | 7 | 100 | - | - | - | - | 18 | 0,76 | 1 |
| Oscuro | 20 | 66,7 | 9 | 96,7 | 1 | 100 | - | - | 30 | ||
| Delimitación | |||||||||||
| Bien delimitado | 6 | 85,7 | 1 | 100 | - | - | - | - | 7 | 0,40 | 1 |
| Mal delimitado | 30 | 63,8 | 15 | 95,7 | 1 | 97,8 | 1 | 100 | 47 | ||
| Tiempo evolución | |||||||||||
| <5 años | 20 | 58,8 | 11 | 91,2 | 3 | 100 | - | - | 34 | 0,78 | 0,64 |
| >5 años | 15 | 65,2 | 7 | 95,6 | 0 | 95,6 | 1 | 100 | 23 | ||
| Uso de técnicas «artefacto» | |||||||||||
| No | 35 | 72,9 | 9 | 91,7 | 3 | 98 | 1 | 100 | 48 | 0,023 | 0,56 |
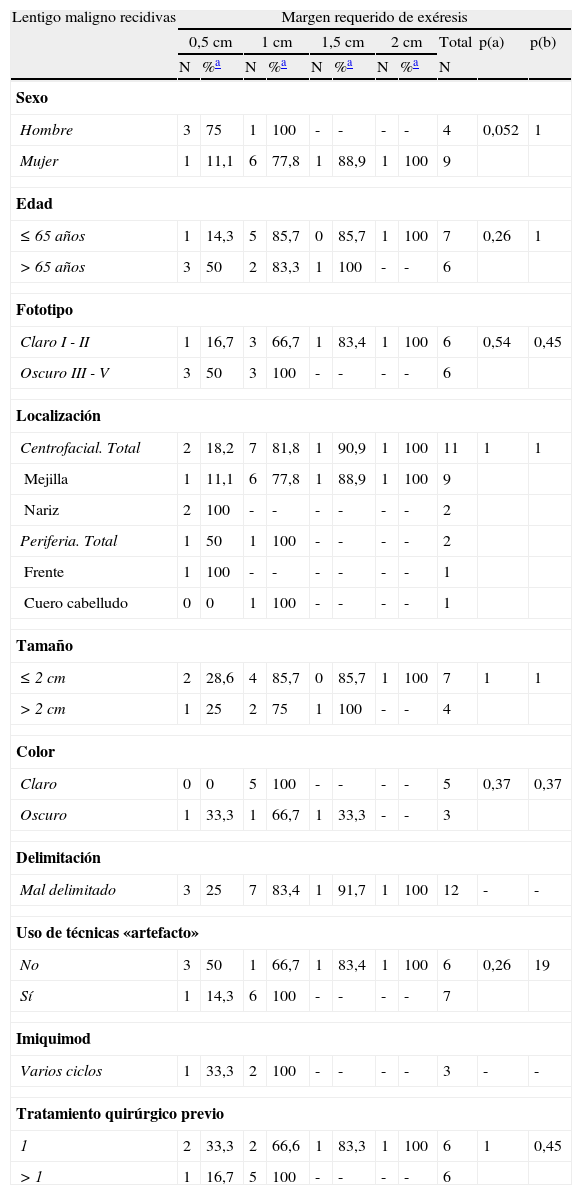
En los LM primarios de pacientes de fototipos claros se consiguió un 92,9% de curación con una sola etapa, mientras que en aquellos de fototipos oscuros fue necesario 1cm de margen quirúrgico para extirpar completamente el 93,1% de las lesiones (p=0,03) (tabla 4). Estos datos difieren de los observados en el grupo de recidivas de LM, en el que la tendencia se invierte, requiriéndose más etapas quirúrgicas en los LM de pacientes de fototipo claro (tabla 5).
Margen quirúrgico total requerido en función de diferentes variables clínicas y demográficas en los lentigos malignos primarios
| Lentigo maligno primarios | Margen requerido de exéresis | ||||||||||
| 0,5cm | 1cm | 1,5cm | 2cm | Total | p (a) | p (b) | |||||
| N | %a | N | %a | N | %a | N | %a | N | |||
| Sexo | |||||||||||
| Hombre | 21 | 75 | 5 | 92,9 | 2 | 100 | - | - | 28 | 1 | 0,5 |
| Mujer | 15 | 71,4 | 6 | 100 | - | - | - | - | 21 | ||
| Edad | |||||||||||
| <65 | 14 | 73,7 | 3 | 89,5 | 2 | 100 | - | - | 19 | 1 | 0,14 |
| >65 | 22 | 73,3 | 8 | 100 | - | - | - | - | 30 | ||
| Fototipo | |||||||||||
| Claro I - II | 13 | 92,9 | 1 | 100 | - | - | - | - | 14 | 0,03 | 1 |
| Oscuro III - V | 17 | 58,6 | 10 | 93,1 | 2 | 100 | - | - | 29 | ||
| Localización | |||||||||||
| Centrofacial. Total | 24 | 70,6 | 8 | 94,1 | 2 | 100 | - | - | 15 | 0,72 | 1 |
| Mejilla | 15 | 71,4 | 4 | 90,4 | 2 | 100 | - | - | 21 | ||
| Nariz | 8 | 66,7 | 4 | 100 | - | - | - | - | 12 | ||
| Perioral | 1 | 100 | - | - | - | - | - | - | 1 | ||
| Periferia. Total | 12 | 80 | 3 | 20 | - | - | - | - | 34 | ||
| Frente | 1 | 50 | 1 | 100 | - | - | - | - | 2 | ||
| Cuero cabelludo | 7 | 87,5 | 1 | 100 | - | - | - | - | 8 | ||
| Sien | 2 | 66,7 | 1 | 100 | - | - | - | - | 3 | ||
| Oreja | 2 | 100 | - | - | - | - | - | - | 2 | ||
| Tamaño | |||||||||||
| ≤2cm | 21 | 75 | 7 | 100 | - | - | - | - | 28 | 1 | 1 |
| >2cm | 9 | 75 | 3 | 100 | - | - | - | - | 12 | ||
| Color | |||||||||||
| Claro | 11 | 84,6 | 2 | 100 | - | - | - | - | 13 | 0,4 | - |
| Oscuro | 19 | 70,4 | 8 | 100 | - | - | - | - | 27 | ||
| Delimitación | |||||||||||
| Bien delimitado | 6 | 85,7 | 1 | 100 | - | - | - | - | 7 | 1 | - |
| Mal delimitado | 27 | 77,1 | 8 | 100 | - | - | - | - | 35 | ||
| Tiempo evolución | |||||||||||
| <5 años | 18 | 69,2 | 6 | 92,3 | 2 | 100 | - | - | 26 | 1 | 0,5 |
| >5 años | 13 | 72,2 | 5 | 100 | - | - | - | - | 18 | ||
| Uso de técnicas «artefacto»’ | |||||||||||
| No | 32 | 76,2 | 8 | 95,2 | 2 | 100 | - | - | 42 | 0,3 | 1 |
| Sí | 4 | 57,1 | 3 | 100 | - | - | - | - | 7 | ||
Margen quirúrgico total requerido en función de diferentes variables clínicas y demográficas para las recidivas de lentigo maligno
| Lentigo maligno recidivas | Margen requerido de exéresis | ||||||||||
| 0,5cm | 1cm | 1,5cm | 2cm | Total | p(a) | p(b) | |||||
| N | %a | N | %a | N | %a | N | %a | N | |||
| Sexo | |||||||||||
| Hombre | 3 | 75 | 1 | 100 | - | - | - | - | 4 | 0,052 | 1 |
| Mujer | 1 | 11,1 | 6 | 77,8 | 1 | 88,9 | 1 | 100 | 9 | ||
| Edad | |||||||||||
| ≤65 años | 1 | 14,3 | 5 | 85,7 | 0 | 85,7 | 1 | 100 | 7 | 0,26 | 1 |
| >65 años | 3 | 50 | 2 | 83,3 | 1 | 100 | - | - | 6 | ||
| Fototipo | |||||||||||
| Claro I - II | 1 | 16,7 | 3 | 66,7 | 1 | 83,4 | 1 | 100 | 6 | 0,54 | 0,45 |
| Oscuro III - V | 3 | 50 | 3 | 100 | - | - | - | - | 6 | ||
| Localización | |||||||||||
| Centrofacial. Total | 2 | 18,2 | 7 | 81,8 | 1 | 90,9 | 1 | 100 | 11 | 1 | 1 |
| Mejilla | 1 | 11,1 | 6 | 77,8 | 1 | 88,9 | 1 | 100 | 9 | ||
| Nariz | 2 | 100 | - | - | - | - | - | - | 2 | ||
| Periferia. Total | 1 | 50 | 1 | 100 | - | - | - | - | 2 | ||
| Frente | 1 | 100 | - | - | - | - | - | - | 1 | ||
| Cuero cabelludo | 0 | 0 | 1 | 100 | - | - | - | - | 1 | ||
| Tamaño | |||||||||||
| ≤2cm | 2 | 28,6 | 4 | 85,7 | 0 | 85,7 | 1 | 100 | 7 | 1 | 1 |
| >2cm | 1 | 25 | 2 | 75 | 1 | 100 | - | - | 4 | ||
| Color | |||||||||||
| Claro | 0 | 0 | 5 | 100 | - | - | - | - | 5 | 0,37 | 0,37 |
| Oscuro | 1 | 33,3 | 1 | 66,7 | 1 | 33,3 | - | - | 3 | ||
| Delimitación | |||||||||||
| Mal delimitado | 3 | 25 | 7 | 83,4 | 1 | 91,7 | 1 | 100 | 12 | - | - |
| Uso de técnicas «artefacto» | |||||||||||
| No | 3 | 50 | 1 | 66,7 | 1 | 83,4 | 1 | 100 | 6 | 0,26 | 19 |
| Sí | 1 | 14,3 | 6 | 100 | - | - | - | - | 7 | ||
| Imiquimod | |||||||||||
| Varios ciclos | 1 | 33,3 | 2 | 100 | - | - | - | - | 3 | - | - |
| Tratamiento quirúrgico previo | |||||||||||
| 1 | 2 | 33,3 | 2 | 66,6 | 1 | 83,3 | 1 | 100 | 6 | 1 | 0,45 |
| >1 | 1 | 16,7 | 5 | 100 | - | - | - | - | 6 | ||
También observaron diferencias significativas en el número de etapas quirúrgicas requeridas en los LM recidivados en función del sexo de los pacientes: las mujeres requirieron más estadios para curarse que los hombres; con 0,5cm de margen se extirparon el 11,1% de LM en mujeres frente al 75% en hombres, porcentajes de curación que subían al 77,8 y el 100% respectivamente cuando se incluían los casos que precisaban de 1cm (p=0,052) (tabla 5). El análisis conjunto de todos los LM estudiados (primarios más recidivas) mostró una tendencia a favor de lo mismo (tabla 3).
Pese a no alcanzar significación estadística se observaron algunas tendencias que merece la pena destacar (tablas 3-5). Se requirieron más etapas quirúrgicas en los pacientes menores de 65 años y en aquellas lesiones localizadas en la zona centrofacial (mejilla, nariz y zona perioral), en comparación con la periferia de la cara (frente, cuero cabelludo, sien y oreja). Los LM de color claro y aquellos que habían sido calificados como bien delimitados se extirparon completamente con menos centímetros de margen que los oscuros y los mal delimitados.
No se encontraron diferencias significativas en el número de etapas requeridas en función del tamaño de la lesión y el tiempo de evolución.
En el grupo de las recaídas tumorales ni el número de tratamientos previos realizados ni el tipo de tratamiento, ya fuera exéresis quirúrgica convencional, cirugía de Mohs o imiquimod tópico, mostró diferencias en el número de estadios requeridos (tabla 5).
DiscusiónEl tratamiento del LM sigue siendo un tema controvertido. Existen diferentes opciones terapéuticas, pero las técnicas quirúrgicas ofrecen ciertas ventajas frente a las no quirúrgicas. La primera y principal es que permite asegurar que no existe componente invasor del melanoma y, si está presente, medir el índice de Breslow, crucial para el manejo y el pronóstico de este tumor. En segundo lugar se trata el componente profundo perianexial que se observa con frecuencia cuando hay extensión subclínica del tumor7,21, y por último, a diferencia de otras técnicas ablativas, se evitan alteraciones de la pigmentación que dificulten o impidan la identificación de una posible recaída del LM.
En cuanto al imiquimod, Rajpar et al., en una revisión de LM tratados con este fármaco, comenta que pese a algunos datos llamativos de curación, el tiempo de seguimiento de todos los estudios no es lo suficientemente largo como para probar la eficacia de este tratamiento para el cáncer22,23. Además, se ha demostrado que tras una biopsia incisional con diagnóstico inicial de LM existe una probabilidad del 22% de hallar un componente invasivo en el estudio histológico de la pieza de exéresis, dato que apoya el tratamiento quirúrgico del tumor24. Por todo ello, no es un tratamiento recomendado con los datos actuales22. Los resultados de nuestra serie, a pesar del escaso número de pacientes, tampoco apoyan su uso y pensamos que su utilización podría conllevar un «efecto artefactual» sobre las características del LM. Creemos que debería restringirse su uso a aquellos casos en los que la cirugía está contraindicada y no se puedan administrar métodos alternativos, tales como la radioterapia. La cirugía convencional con 0,5cm de margen y la cirugía de Mohs constituyen los tratamientos quirúrgicos más empleados. En este estudio por primera vez hemos determinado el margen quirúrgico requerido para extirpar completamente el LM en función de diferentes características clínicas y demográficas, englobando a pacientes tratados con cirugía convencional y cirugía de Mohs diferida.
Además, es el primer estudio en que se registran los tratamientos realizados sobre los LM antes de ser diagnosticados o sospechados como patología maligna, que hemos denominado «técnicas artefactuales». A pesar de que estos tratamientos se han aplicado con éxito en algunas series de LM, creemos que es fundamental conocer la intención con la que se realizan. Collins en 1991, y posteriormente Kuflick en 1994 aplicando crioterapia en LM con intención curativa, atribuyeron su alta tasa de recurrencias al hecho de no alcanzar la temperatura o profundidad adecuadas25–29.
Es importante tener en cuenta que al tratarse de un estudio retrospectivo y observacional conlleva una serie de limitaciones: algunos parámetros no fueron registrados de forma estandarizada y prospectiva en el momento del diagnóstico, o no se han podido recuperar (color, tamaño, fototipo, etc.). También habría que remarcar el carácter subjetivo de algunas de las características clínicas, como el color o la delimitación de las lesiones. Por otro lado, creemos importante mencionar que no se utilizó la dermatoscopia ni la luz de Wood30 para optimizar la delimitación de las lesiones antes de la intervención quirúrgica. Es especialmente importante recordar que, como centro de referencia para la cirugía de Mohs, existe un inevitable sesgo de selección que hace que la población estudiada no sea necesariamente representativa de la población de pacientes que presentan un LM.
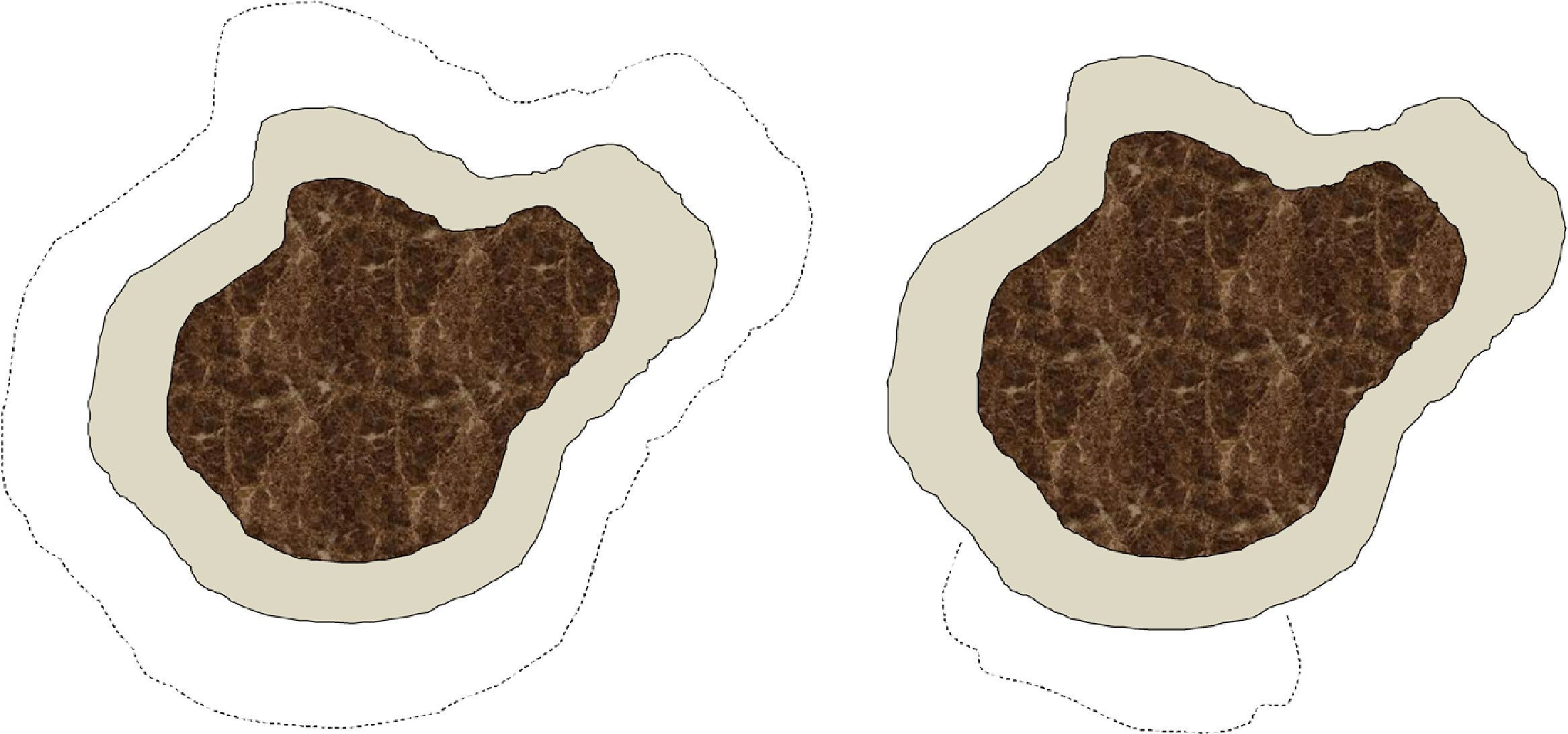
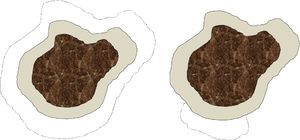
Somos conscientes de que existen notables diferencias entre la cirugía convencional y la cirugía de Mohs, tanto en la técnica de escisión (ángulo de incisión, profundidad, exactitud del tamaño de margen, etc.) y en el procesamiento de la muestra, como en el defecto final obtenido (fig. 1). No obstante, a efectos prácticos, consideramos que cada intervención de cirugía convencional o cada estadio de cirugía de Mohs forma parte del mismo concepto de «etapa quirúrgica», que sería el equivalente al tamaño del margen quirúrgico desde el límite visible de la lesión. En particular, en nuestro centro se analizan todos los márgenes laterales en las cirugías convencionales mediante el fileteado de los mismos, y la gran diferencia con la cirugía de Mohs diferida consiste en el mapeo de la lesión, que permite identificar exactamente la zona donde el margen quirúrgico ha sido insuficiente. De forma arbitraria, y posiblemente sujeto a variaciones potencialmente significativas, especialmente en localizaciones donde el cirujano se propone ahorrar el máximo tejido sano posible (por ejemplo, la zona periocular), hemos considerado que cada etapa quirúrgica, tanto en cirugía convencional como en cirugía de Mohs, correspondería a 0,5cm. Esta asunción debe considerarse también como una limitación del estudio.
Esquema sobre las diferencias en el defecto final que se obtiene tras una cirugía convencional y una cirugía de Mohs. La parte central oscura simboliza un lentigo maligno. El área grisácea corresponde al margen de exéresis estándar de piel sana alrededor del lentigo maligno, por ejemplo, 0,5cm. Las líneas de puntos indicarían el margen requerido en una segunda etapa en caso de que los márgenes de la primera intervención estuvieran invadidos. En el caso de la cirugía convencional (figura de la izquierda) el defecto final sería mayor que con una cirugía de Mohs diferida (figura de la derecha), en la que solo se extrae tejido de la zona en la que se ha observado afectación en la primera etapa.
Por otra parte, es importante resaltar que todos los pacientes fueron tratados en el mismo centro, especializado en oncología cutánea, y que probablemente muchos de ellos fueron derivados a este por presentar lesiones complejas, con mútiples recidivas o previamente tratadas sin éxito.
En nuestra serie hemos observado que las recaídas de LM requieren un margen quirúrgico más amplio que los LM primarios. También que aquellos LM, tanto primarios como recidivados, que han sido tratados con técnicas «artefactuales» requieren más etapas quirúrgicas para su curación. Estos resultados podrían indicar que los LM que presenten recaída fueran lesiones mal delimitadas desde su inicio o con una extensión subclínica amplia, y que por tanto fueran extirpadas incorrectamente o que el proceso de cicatrización dificulte el diagnóstico precoz de la recaída y permita un mayor crecimiento de la lesión. Por otro lado, los tratamientos estéticos empleados erróneamente durante la evolución de la lesión parecen haber interferido notablemente en el aspecto clínico del LM, lo que da lugar a una mala delimitación clínica al recaer. Varios estudios han mencionado con anterioridad que hay tasas altas de recurrencias tras tratamientos con crioterapia, láser de argón o electrocoagulación, destacando la dificultad para identificar clínicamente estas recurrencias13,30.
En relación con las tasas de curación con la cirugía se han descrito resultados parecidos en otras publicaciones. En la serie de Huilgol et al. un 20% de LM primarios y un 56% de las recaídas requirieron más de un estadio de 0,5cm; los resultados en nuestra serie fueron del 26,5 y del 69,2%, respectivamente. Sin embargo, Huilgol utilizó una técnica quirúrgica seriada con control de márgenes y procesamiento de la pieza igual a la cirugía convencional, por tanto analizando un porcentaje del margen periférico que dista del 100% que se obtiene con la técnica de Mohs13. Aagarwal-Antal obtenía solo un 42% de curación con 0,5cm de margen en LM de zonas fotoexpuestas3. En otro trabajo de 46 LM tratados con cirugía de Mohs convencional con tinciones inmunohistoquímicas, Zalla et al. obtenían curaciones del 50% con 0,6cm de margen31.
El hecho de que los LM primarios de pacientes de fototipos de piel más oscuros requieran más etapas quirúrgicas para ser completamente extirpados, podría tener su explicación en la dificultad que confiere delimitar una lesión melanocítica sobre un fondo pigmentado. Además cabe destacar que la delimitación histológica de estas lesiones también puede verse afectada por la elevada frecuencia en que se observan alteraciones en la densidad y distribución de melanocitos en la piel fotoexpuesta, incluso con presencia de atipia leve-moderada en algún caso, en ausencia de tumor32,33.
La tendencia a requerir más etapas quirúrgicas en los LM centrofaciales podría ser debido a que en zonas periorificiales el cirujano tiende a ser más conservador, con el objetivo de preservar las unidades estéticas de la cara. Este motivo podría justificar que también se necesiten más etapas en mujeres y en pacientes menores de 65 años.
El número medio de etapas quirúrgicas de 0,5cm en nuestro estudio es de 1,31 en los LM primarios y de 1,91 en los LM recidivados. Clayton et al.34 obtuvieron una media de 1,65 etapas quirúrgicas para un total de 77 LM extirpados mediante cirugía de Mohs diferida. En un estudio prospectivo de 116 pacientes con LM tratados mediante cirugía de Mohs convencional obtenían una media de 1,97 etapas quirúrgicas11. En este trabajo Bene demostró la necesidad del procesamiento diferido al encontrar cómo un nuevo corte parafinado tras el procesamiento con secciones congeladas revelaba persistencia de tumor en 8 de 167 casos de melanoma in situ. Siew-Yin et al. obtuvieron una media de 1,64 etapas de 0,2-0,5cm en un estudio retrospectivo de cirugía de Mohs diferida en 14 melanomas perioculares, 8 de ellos LM35.
De los 45 LM que tratamos con cirugía de Mohs diferida solo hubo 2 casos de recaída, confirmando las altas tasas de curación descritas en la literatura9,11–15.
Creemos que la decisión de emplear una técnica quirúrgica u otra debe individualizarse en función de las variables previamente descritas; la escisión quirúrgica convencional es una excelente opción para los LM primarios bien delimitados, de pequeño tamaño, en la periferia de la cara de pacientes de fototipo claro. En caso contrario deberán plantearse intervenciones con márgenes quirúrgicos más amplios (0,5-1cm), o técnicas con control de márgenes como la cirugía de Mohs, que además de ofrecer mejores tasas de curación permite minimizar la pérdida de tejido sano en localizaciones estéticamente comprometidas.
En conclusión, como ya se ha comentado en la literatura, los datos de nuestra serie apoyan que una exéresis con márgenes de 0,5cm es insuficiente para algunos casos de LM. Los tumores que han presentado recaída, los que han recibido diversos tratamientos no curativos que puedan interferir en su delimitación clínica, las lesiones que aparecen en personas de fototipos oscuros y los LM localizados en la zona centrofacial pueden requerir un margen quirúrgico inicial más amplio. Según nuestra serie características como el tamaño, el color de la lesión o el tiempo de evolución no ayudarían a predecir si la lesión puede extenderse más allá de los límites visibles. No obstante, otros trabajos sí han demostrado la influencia del tamaño de la lesión en la probabilidad de extensión subclínica30. Serían necesarios estudios prospectivos aleatorizados con un número mayor de pacientes para alcanzar mayor evidencia científica. Por otra parte, el empleo de la microscopía confocal para delimitar adecuadamente el tumor, monitorizar tratamientos no invasivos o detectar recidivas precozmente, así como el uso de tratamientos adyuvantes, como el imiquimod tópico al 0,1% en el periodo postquirúrgico en el área pericicatricial para disminuir las recurrencias podrían modificar sustancialmente las perspectivas terapéuticas para el LM36–38.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Vicente García Patos por la lectura crítica del trabajo.